专题2 研究物质的基本方法 (含解析)单元检测题 2023-2024学年高一上学期苏教版(2019)必修第一册
文档属性
| 名称 | 专题2 研究物质的基本方法 (含解析)单元检测题 2023-2024学年高一上学期苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 680.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-11 19:32:06 | ||
图片预览




文档简介
专题2《研究物质的基本方法》单元检测题
一、单选题
1.放射性同位素 I,其中数字“53”可以表示( )
A.相对原子量 B.质量数 C.原子序数 D.中子数
2.实验室中下列做法错误的是
A.金属钠着火时使用泡沫灭火器灭火
B.高锰酸钾固体保存在棕色广口瓶中
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加入水稀释
D.浓硫酸沾到皮肤上,立即用大量水冲洗,然后用3%~5%NaHCO3溶液冲洗
3.下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应,都产生H2的是( )
A.核内无中子的原子
B.价电子构型为3s23p3
C.最外层电子数等于倒数第三层上的电子数的原子
D.N层上无电子,最外层上的电子数等于电子层数的原子
4.下列装置可以分离乙醇和水的是( )
A. B.
C. D.
5.呼吸法在医学上常用于幽门螺旋杆菌的诊新,可用来测定文物年代,下列有关和的说法错误的是( )
A.和原子中均含有6个质子
B.的原子结构示意图:
C.和互为同位素
D.和原子的核外电子排布相同
6.下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 目的 分离方法 原理
A 除去KCl中的CuO 蒸发结晶 溶解度不同
B 除去碘中的NaCl 加热、升华 NaCl的熔点高,碘易升华
C 分离KNO3和NaCl 重结晶 KNO3的溶解度大于NaCl
D 分离食用油和汽油 分液 食用油和汽油的密度不同
A.A B.B C.C D.D
7.考古学常用来确定文物的历史年代,原子核内中子数是
A.6 B.8 C.14 D.20
8.把100 mL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.20 (2b-a) mol·L-1 B.20(b-2a) mol·L-1
C.10(2b-a) mol·L-1 D.10(b-2a) mol·L-1
9.如果你家里的食用菜油混有水分,你将采用下列何种方法分离( )
A.过滤 B.蒸馏 C.分液 D.萃取
10.下列关于气体摩尔体积的说法错误的是( )
A.不同的温度和压强下气体摩尔体积一定不同
B.相同物质的量的气体体积大小主要由温度和压强决定
C.在25℃和101kPa的条件下,气体摩尔体积约为24.5L·mol-1
D.标准状况下,某气体的密度为1.25g·L-1,则该气体的摩尔质量为28g·m-1
11.下列各组混合物能用分液漏斗直接分离的是( )
A.植物油与汽油 B.四氯化碳与水
C.四氯化碳和碘 D.水与乙醇
12.下列溶液中Cl-浓度最大的是( )
A.50mL 1 mol/L KCl溶液 B.20mL 3 mol/L NaCl溶液
C.25mL 2 mol/L MgCl2溶液 D.10mL 1.5 mol/L AlCl3溶液
13.关于100mL1mol/LCaCl2溶液的叙述正确的是( )
A.Cl-的物质的量浓度为2mol/L
B.CaCl2的物质的量为1mol
C.取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L
D.该溶液中水的体积为100 mL
14.某溶液中只含有四种离子,已知其中三种离子Na+、Mg2+、NO3-的物质的量浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.1 mol·L-1,则溶液中另一离子及其物质的量浓度可能( )
A.SO42-0.1 mol·L-1 B.Al3+0.2 mol·L-1
C.Cl-0.3 mol·L-1 D.K+0.4 mol·L-1
15.标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中正确的是( )
A.c= B.ω=
C.ω= D.ρ=
16.下列实验操作中,错误的( )
A.蒸发操作时,不能使混合物中的水分完全蒸干后,才停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
17.将标准状况下的 LHCl(g)溶于1000g水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是 ( )
A. mol/L B. mol/L
C. mol/L D. mo1/L
18.V mL Al2(SO4)3溶液中含有Al3+ a g,取V/4 mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是(mol/L)( )
A.125a/9V B.125a/18V C.125a/36V D.125a/54V
19.氧化铍(BeO)在航天航空等领域有着广泛的应用。一种以预处理后的硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)为原料提取BeO的流程如下图所示:
已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO
下列说法错误的是( )
A.“酸浸”步骤所得“滤渣①”的主要成分为SiO2
B.“滤液②”经处理后可获得副产品Na2SO4 10H2O
C.“碱溶”时,主要反应为Be(OH)2+2OH-=BeO +2H2O
D.“水解”时,适当增大溶液pH有利于提高BeO的提取率
二、综合题
20.分类法在化学中起着非常重要的作用:
I.由以下一些微粒:、、、、。其中:
(1)互为同位素的是
(2)中子数相等,但质子数不相等的是
(3)属于混合物的有
(4)能导电的物质有
(5)属于电解质的有
21.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为 g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
L。
(3)在臭氧发生装置中装入氧气100
mL,经反应最后气体体积变为95 mL(体积均在标准状况下测定),则混合气体的密度是 g·L-1(保留一位小数)
(4)实验室将氧气和臭氧的混合气体0.896 L(标准状况),通入盛有20.0 g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6
g。则原混合气中臭氧的体积分数
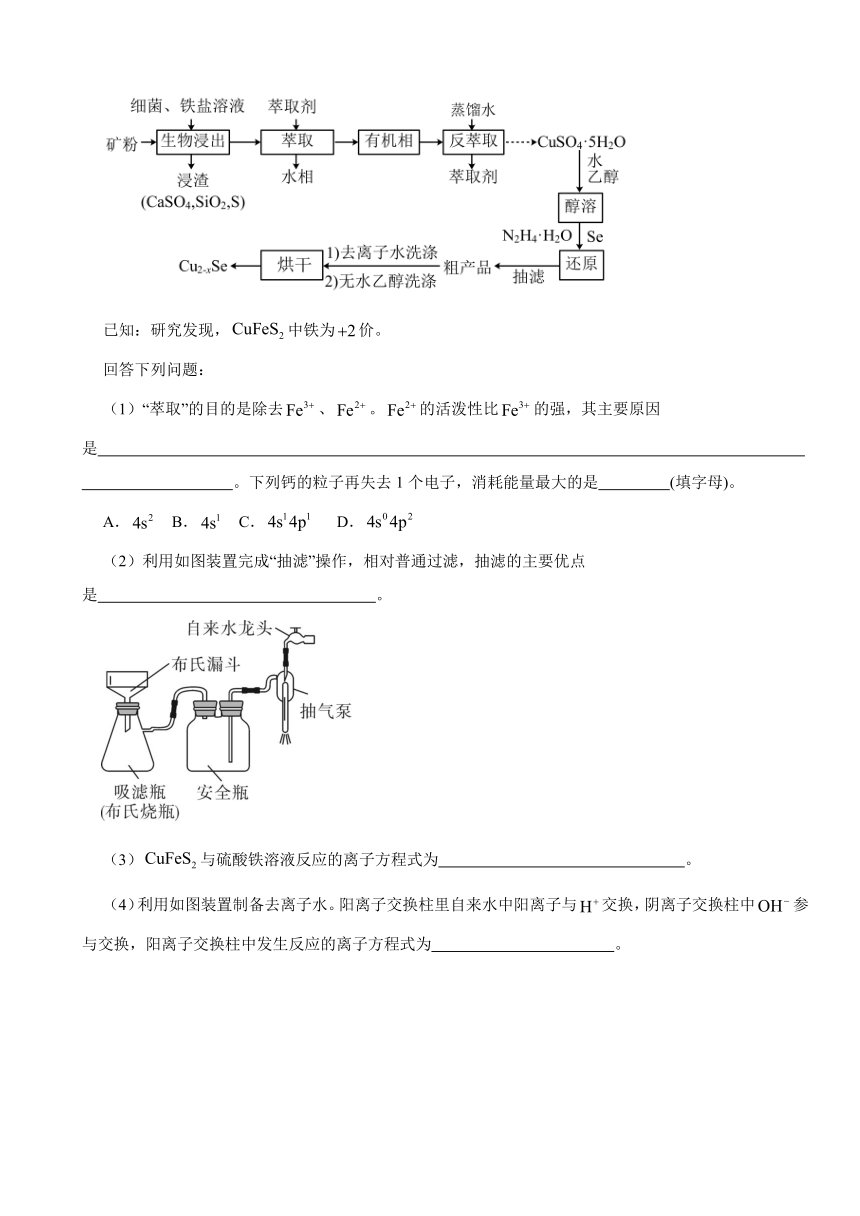
22.介孔纳米晶用作钠离子电池负极材料。某科研团队以某矿石(主要成分是、,含少量、等杂质)开发一种合成介孔的路线如图所示。
已知:研究发现,中铁为价。
回答下列问题:
(1)“萃取”的目的是除去、。的活泼性比的强,其主要原因是 。下列钙的粒子再失去1个电子,消耗能量最大的是 (填字母)。
A. B. C. D.
(2)利用如图装置完成“抽滤”操作,相对普通过滤,抽滤的主要优点是 。
(3)与硫酸铁溶液反应的离子方程式为 。
(4)利用如图装置制备去离子水。阳离子交换柱里自来水中阳离子与交换,阴离子交换柱中参与交换,阳离子交换柱中发生反应的离子方程式为 。
(5)钠离子电池如图所示。已知:钒(V)常见的化合价有、(铜以、、的形式存在),。
放电时,正极上转化成的电极反应式为 。充电时,生成理论上迁移 。
23.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为 。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为 。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为 。
(4)用c、d表示溶液中溶质的质量分数(w)为 。
(5)用S、d表示溶液中溶质的物质的量浓度(c)为 。
24.从低品位铜镍矿(含有、FeO、MgO、CuO等杂质)资源中提取镍和铜的一种工艺流程如下:
资料:一些物质的(25℃)如下。
物质
(1)上述流程中,加快反应速率的措施是 。
(2)浸出过程中通入的目的是 。
(3)萃取时发生反应:(HR、在有机层,、在水层)。
①某种HR的结构简式为 ,该分子中可能与形成配位键的,原子有 。
②解释反萃取时的作用: 。
(4)黄钠铁矾[]比更易形成沉淀。反应终点pH与、沉淀率的关系如下表。
反应终点pH 沉淀率/%
1.5 94.04 0.19
2.5 99.21 0.56
3.8 99.91 3.31
①生成黄钠铁矾的离子方程式是 。
②沉淀时最适宜选用的反应终点pH是 。
(5)第二次使用MgO调节pH使沉淀完全,宜将pH调节至 (填序号)。
a.6~7 b.9~10 c.11~12
答案解析部分
1.【答案】C
【解析】【解答】A. 已知核素相对原子量无法计算,故A不符合题意;
B. 质量数为131,故B不符合题意;
C. 原子序数为53,故C符合题意;
D. 中子数为131-53=78,故D不符合题意;
故答案为:C。
【分析】原子中,原子序数=质子数=核电荷数=核外电子数,放射性同位素 I,左下角53可表示质子数、核电荷数、核外电子数、原子序数。
2.【答案】A
【解析】【解答】A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应该用(干燥的)沙土铺盖灭火,A符合题意;
B.高锰酸钾固体受热后易分解,故需在棕色广口瓶中、阴冷处密封保存,B不符合题意;
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中,其目的是抑制氯化铁的水解,再加水稀释至所需浓度,C不符合题意;
D.如果不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,避免强碱的强烈的腐蚀性对皮肤造成二次伤害,不能使用强碱中和,用3%~5%NaHCO3溶液冲洗,D不符合题意;
故答案为:A。
【分析】依据物质的性质分析,其中A项金属钠着火生成过氧化钠,过氧化钠与水和二氧化碳反应并生成氧气。
3.【答案】D
【解析】【解答】A.核内无中子的原子是H原子,其单质H2与酸、键均不能发生反应,A不符合题意;
B.价电子构型为3s23p3的原子是P,P单质能与NaOH发生反应且不能产生氢气,而不能与稀硫酸反应,B不符合题意;
C.最外层电子数等于倒数第三层上的电子数的原子是Mg,Mg是比较活泼的金属,与NaOH溶液不能发生反应,C不符合题意;
D.N层上无电子,最外层上的电子数等于电子层数的原子是Al原子,单质Al是比较活泼的金属,能与稀硫酸和烧碱溶液发生反应产生氢气,D符合题意;
故答案为:D。
【分析】A.核内无中子的原子是H原子;
B.价电子构型为3s23p3的原子是P原子;
C.最外层电子数等于倒数第三层上的电子数的原子是Mg;
D.N层上无电子,最外层上的电子数等于电子层数的原子是Al原子。
4.【答案】A
【解析】【解答】A.乙醇中含少量水时,通常可以加入适量生石灰后再蒸馏,可收集到无水乙醇,所以A装置符合题意,A符合题意。
B.乙醇蒸气和水蒸气都可以被浓硫酸吸收,所以不能用浓硫酸洗气,也没有合适的溶剂只吸收水蒸气,B不符合题意;
C.乙醇是一种易挥发的液体,可以和水以任意比互溶,所以既不能降温让水结冰析出,C不符合题意;
D.也不能用萃取剂萃取,D不符合题意。
【分析】乙醇在水中溶解度较大,只能用蒸馏法。
5.【答案】B
【解析】【解答】A.和原子都属于6号C元素,原子核中均含有6个质子,A不符合题意;
B.的原子核外有6个电子,核外电子排布是2、4,故原子结构示意图为:,B符合题意;
C.和质子数相同,中子数不同,二者互为同位素,C不符合题意;
D.和原子核外都有6个电子,核外电子排布是2、4,故它们的核外电子排布相同,D不符合题意;
故答案为:B。
【分析】同位素定义:质子数相同,中子数不同的同种元素不同原子,同位素差异在于中子数不同,核外电子排布式完全相同。
6.【答案】B
【解析】【解答】A、氯化钾溶于水,氧化铜不溶于水,可以用溶解、过滤的方法分离,故A不符合题意;
B、碘单质受热升华,氯化钠受热不分解,可以用加热、升华的方法分离,故B符合题意;
C、KNO3的溶解度随温度升高变化大,NaCl溶解度随温度变化不大,可以用重结晶的方法分离,故C不符合题意;
D、食用油和汽油互溶,不能用分液的方法分离,应利用沸点不同,利用蒸馏的方法分离,故D不符合题意;
故答案为:B。
【分析】NaCl的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响大,则除去KNO3固体中混杂的NaCl,应溶解后冷却热饱和溶液,结晶分离是解答关键。
7.【答案】B
【解析】【解答】解: 质子数为6,质量数为14,质量数=质子数+中子数,中子数为14-6=8;
故答案为:B
【分析】质量数=质子数+中子数。
8.【答案】A
【解析】【解答】把100 mL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,所以混合溶液含有0.5amolMg2+;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,所以混合溶液含有bmolSO42-。根据电荷守恒可得:n(K+)+2n(Mg2+)=2n(SO42-),n(K+)+2amol=bmol,n(K+)=(2b-a)mol,c(K+)=(2b-a)mol/0.05L=20(2b-a) mol·L-1,
故答案为:A。
【分析】根据氢氧化钠的物质的量基酸镁离子的物质的量,根据氯化钡的物质的量计算硫酸根离子的总物质的量,然后根据电荷守恒计算钾离子的物质的量。
9.【答案】C
【解析】【解答】解:食用菜油与水分层,选择分液法分离,过滤分离不溶性固体与液体、蒸馏分离互溶但沸点不同的液体、萃取分离溶质在不同溶剂中溶解性差异大的混合物,
故选C.
【分析】食用菜油与水分层,选择分液法分离,以此来解答.
10.【答案】A
【解析】【解答】A.气体摩尔体积受温度和压强的影响,同温同压下,气体摩尔体积一定相同,在不同的温度和压强下,气体摩尔体积可能相同,也可能不同,故A符合题意;
B.气体体积V=nVm,而气体摩尔体积受温度和压强影响,故当气体的物质的量n相同时,气体的体积大小取决于温度和压强,故B不符合题意;
C.根据PV=nRT,相同压强下,体积之比等于温度之比,有 ,解得常温常压下,气体摩尔体积为24.5L/mol,故C不符合题意;
D.气体的密度ρ=M/Vm,故气体的摩尔质量M=ρVm,故标准状况下,某气体的密度为125g L-1,则该气体的摩尔质量为125g L-1×22.4L mol-1=28g mol-1,故D不符合题意。
故答案为:A。
【分析】
A.气体摩尔体积受温度和压强影响,当两者均改变时是有可能达到气体摩尔体积相同的情况;
B.根据气体摩尔体积公式,体积受温度和压强影响较大;
C.根据阿伏加德罗定律推论及理想气体状态方程PV=nRT,可以计算出此时的气体摩尔体积,注意此时的温度是K氏温度;
D.根据物质的量相关公式计算即可,且摩尔质量单位错误。
11.【答案】B
【解析】【解答】解:A.植物油与汽油都是有机物,所以植物油与汽油能相互溶解,所以不能用分液漏斗分离,故A错误;
B.四氯化碳是有机物,水是无机物,四氯化碳和水不互溶,所以能用分液漏斗分离,故B正确;
C.碘可以溶于四氯化碳形成溶液,所以不能用分液漏斗分离,故C错误;
D.乙醇和水能互溶,所以不能用分液漏斗分离,故D错误.
故选B.
【分析】能用分液漏斗分离的物质必须是两种相互不溶的液体,一般的来说:有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂.
12.【答案】D
【解析】【解答】A. 50mL 1 mol/L KCl溶液,溶液中Cl-浓度是 1 mol·L-1;
B. 20mL 3 mol/L NaCl溶液,溶液中Cl-浓度是 3 mol·L-1;
C. 25mL 2 mol/L MgCl2溶液,溶液中Cl-浓度是 4 mol·L-1;
D. 10mL 1.5 mol/L AlCl3溶液,溶液中Cl-浓度是 4.5mol·L-1;
故答案为:D。
【分析】写出电离方程式,结合电离方程式中的系数,找出氯离子和物质的量浓度的关系即可计算出氯离子的浓度大小
13.【答案】A
【解析】【解答】A。Cl-的物质的量浓度为1mol/L×2=2mol/L;A符合题意;
B.CaCl2的物质的量为0.1×1=0.1 molB不符合题意;取出50 mL后,剩余溶液中的浓度保持不变,C不符合题意;
D.溶液的体积为100毫升,而非溶剂的体积,D不符合题意;
故答案为:A
【分析】A.根据CaCl2溶液的浓度即可求出 Cl-的物质的量浓度;
B.根据n=cv计算即可得出答案;
C.配制好的溶液浓度一定,保持不变;
D.水为溶剂,溶剂的体积=溶液的体积-溶质的体积,据此即可得出答案。
14.【答案】C
【解析】【解答】根据溶液显电中性可知另一种离子一定是阴离子,忽略水的电离,如果是硫酸根离子,则其浓度是(0.2mol/L+0.1mol/L×2-0.1mol/L)/2=0.15mol/L,如果是氯离子,其浓度是0.2mol/L+0.1mol/L×2-0.1mol/L=0.3mol/L,
故答案为:C。
【分析】结合离子以及相应种类,根据电荷守恒进行计算,可知正电荷共有0.4mol/L,负电荷有0.1mol/L,可知缺少0.3mol/L的负电荷,即 Cl-0.3 mol·L-1 。
15.【答案】C
【解析】【解答】解:A、标况下VL氨气的物质的量为 mol,质量为 g,溶于1L水后所得溶液的质量分数ω= = ,然后带入c= = = mol/L,故A错误;
B、根据c= 可知:ω= ,故B错误;
C、标况下VL氨气的物质的量为 mol,质量为 g,溶于1L水后所得溶液的质量分数ω= = ,故C正确;
D、VL氨气的物质的量为 = mol,氨气质量为 g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为(= +1000)g,溶液体积为: = L,所以溶液的密度为: = g/mL,故D错误;
故选C.
【分析】A、表示出溶液的质量分数ω,然后带入c= 来计算;
B、根据c= 来计算;
C、根据质量分数= 来计算;
D、根据n= 计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V= 计算溶液的体积,由ρ= 计算溶液的密度.
16.【答案】D
【解析】【解答】解:A.在蒸发操作的过程中,当加热到有少量液体剩余时停止加热,此时剩下的少量液体可以利用余热蒸发干,故A正确;
B.蒸馏操作时,温度计水银球应靠近蒸馏烧瓶的支管口处,故B正确;
C.活塞到漏斗管口还残留一部分下层液体.如果将上层液体也从下口放出,残留的下层液体会一起被放出,上层液体就不纯净了,故分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C正确;
D.萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,密度也可以比水小,故D错误.
故选:D.
【分析】A.在蒸发操作的过程中,当加热到有少量液体剩余时停止加热,利用余热蒸发干;
B.温度计测量蒸气的温度;
C.活塞到漏斗管口还残留一部分下层液体;
D.萃取剂的选择与密度无关.
17.【答案】A
【解析】【解答】将标准状况下的a L HCl(气)的物质的量为 = mol,氯化氢的质量为 mol×36.5g/mol= g,所以溶液质量为1000g+ g=(1000+ )g,所以溶液的体积为 = L,所以溶液浓度为 = mol/L,A符合题意;
故答案为:A
【分析】根据公式计算HCl的物质的量,再根据溶液的密度计算溶液的体积,结合公式计算溶液的物质的量浓度。
18.【答案】C
【解析】【解答】VmLAl2(SO4)3溶液中Al3+物质的量n(Al3+)=a/27 mol,则VmLAl2(SO4)3溶液中n(SO42-)=a/27 mol×3/2=a/18 mol,所以VmLAl2(SO4)3溶液中c(SO42-)=a/18 mol÷(V×10-3)L=500a/9V mol/L;取V/4 mL溶液稀释到4V mL,即稀释了16倍,由于稀释前后SO42-物质的量不变,则稀释后硫酸根的浓度是125a/36V mol/L,C符合题意;
故答案为:C
【分析】由Al3+的质量,结合公式计算溶液中n(SO42-);再根据稀释过程中,溶质的物质的量保持不变,计算稀释后所得溶液中c(SO42-)。
19.【答案】D
【解析】【解答】A.氧化铁和氧化亚铁都是碱性氧化物,氧化铍属于两性氧化物,二氧化硅属于酸性氧化物,上述氧化物中只有二氧化硅不溶于稀硫酸,因此“酸浸”步骤所得“滤渣①”的主要成分为SiO2,故A说法不符合题意;
B.滤液①中含有的主要离子有H+、Be2+、Fe3+、Fe2+、和SO ,加入氢氧化钠溶液将pH调节至9,氢离子被中和,Be2+、Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,因此“滤液②”经处理后可获得副产品Na2SO4 10H2O,故B说法不符合题意;
C.Fe(OH)2和Fe(OH)3属于碱,Be(OH)2属于两性化合物,“碱溶”时只有氢氧化铍溶解在氢氧化钠溶液中,反应的离子方程式为:Be(OH)2+2OH-=BeO +2H2O,故C说法不符合题意;
D.滤液③的主要阴离子是BeO ,它发生水解的离子方程式为:BeO +2H2O Be(OH)2+2OH-,增大溶液的pH,平衡向左移动,不利于BeO 的水解,故D说法符合题意;
故答案为:D。
【分析】 硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等) 经H2SO4酸浸,滤渣①为SiO2,滤液①中含有的主要离子有H+、Be2+、Fe3+、Fe2+、和SO ,加入氢氧化钠溶液将pH调节至9,氢离子被中和,Be2+、Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,“滤液②”经处理后可获得副产品Na2SO4 10H2O,滤渣②为Fe(OH)2、Fe(OH)3、Be(OH)2,碱溶时发生反应Be(OH)2+2OH-=BeO +2H2O,滤液③的主要阴离子是BeO ,水解后得到Be(OH)2,最后加热分解得到BeO。
20.【答案】(1)、
(2)、II.现有下列物质:①Cl2、②稀硫酸、③熔化的KNO3、④无水酒精、⑤Cu(OH)2、⑥CO2、⑦镁铝合金,请回答下列问题(填序号):
(3)②⑦
(4)②③⑦
(5)③⑤
【解析】【解答】(1)有以下一些微粒:、、、、, 其中:
质子数相同中子数不同的同一种元素的不同核素互为同位素,则互为同位素的是、;
(2)的质子数和中子数分别是6、7,的质子数和中子数分别是19、20,的质子数和中子数分别是6、6,的质子数和中子数分别是7、7,的质子数和中子数分别是18、22,则中子数相等,但质子数不相等的是、;
(3)①Cl2是单质,不导电,不是电解质也不是非电解质;
②稀硫酸是混合物,可导电,不是电解质也不是非电解质;
③熔化的KNO3能电离出离子,可导电,是电解质;
④无水酒精不电离,不导电,是非电解质;
⑤Cu(OH)2能电离,固体不导电,是电解质;
⑥CO2不电离,不导电,是非电解质;
⑦镁铝合金是混合物,可导电,不是电解质也不是非电解质;
则属于混合物的有②⑦;
(4)根据以上分析可知能导电的物质有②③⑦;
(5)根据以上分析可知属于电解质的有③⑤。
【分析】(1)质子数相同中子数不同的同一种元素的不同核素互为同位素
(2)依据原子表示时左上角表示质量数、左下角表示质子数,质量数=质子数+中子数、质子数=核外电子数分析。
(3)依据在熔融状态下或者溶于水能导电的化合物,是电解质;在水中或者熔融状态下均不导电的化合物,是非电解质;单质和混合物既不是电解质也不是非电解质分析。
21.【答案】(1)35.6
(2)3
(3)1.5
(4)50%
【解析】【解答】(1)假设有1molO2,则可列出三段式:
3O2 2O3
起始(mol) 1 0
转化(mol) 0.3 0.2
平衡(mol) 0.7 0.2
则反应后所得气体为0.2molO3和0.7molO2,共0.9mol,反应前后气体总质量不变,混合气体的总质量为m=1mol×32g/mol=32g,则所得混合气的平均摩尔质量为 ;
故答案为:35.6;(2)此题可根据差量法计算,设生成臭氧的体积为X,则:
列方程式得 ,X=3L;
故答案为:3;(3)反应前氧气的物质的量为 ,故反应前氧气的质量为 ,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度为,
故答案为:1.5;(4) ,设臭氧的体积分数为a,根据氧原子守恒
0.04mol×a×3+0.04mol×(1-a)×2=
解得a=50%;
故答案为:50%。
【分析】(1)首先列三段式,再利用平均摩尔质量等于气体的总质量与总物质的量之比分析解答;(2)利用差量法根据化学方程式列比例式解题;(3)根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,计算出反应前氧气的物质的量,再计算反应前氧气的质量,再根据 计算混合气体的密度;(4)再根据n(混合气体)= ,再利用氧原子守恒混合气体中含有的氧原子等于增加的质量中氧原子的数目解题。
22.【答案】(1)基态、的价层电子排布式分别为、,而达到半充满稳定结构,能量较低,较活泼;B
(2)过滤较快、固体较干燥等合理答案
(3)
(4)
(5);2
【解析】【解答】(1)的活泼性比的强,其主要原因是:基态、的价层电子排布式分别为、,而达到半充满稳定结构,能量较低,较活泼;根据铁离子、亚铁离子价层电子排布式和洪特规则特例判断离子活泼性。A项代表基态钙原子,B项代表价钙离子,C项和D项代表钙原子的激发态,钙离子第二电离能大于第一电离能,
故答案为:B;
(2)抽滤是在减压条件下过滤,过滤速率较快,所得固体较干燥。溶剂易挥发(减压条件下,液体挥发温度降低);
(3)黄铜矿与硫酸铁反应生成亚铁盐和铜盐、硫单质,离子方程式为;
(4)阳离子交换柱中氢离子与碳酸氢根离子反应,反应的离子方程式为;
(5)根据图示,放电时钠离子向正极迁移,根据电荷守恒正极反应式为;充电时,阴极反应式为,则生成转移2mol电子,理论上迁移2。
【分析】(1)电子半充满时更稳定;
(2)抽滤的特点是速度快且更干燥;
(3)氧化还原反应的配平方法是先确定化合价的变化,根据化合价升降守恒,配出相应的化学计量数;
(4)碳酸氢根离子和氢离子反应生成二氧化碳和水;
(5)新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒;若是充电过程,则负极作为阴极,正极作为阳极,阴极电极反应式为负极的逆反应,阳极的电极反应式为正极的逆反应。
23.【答案】(1) g
(2) mol·L-1
(3)25dw mol·L-1
(4) %
(5) mol·L-
【解析】【解答】(1)溶解度为S,该饱和溶液的质量分数ω=S/(100+S),解得:S=100ω/(1 ω);
(2)氢氧化钠的物质的量是m/40 mol,则氢氧化钠的浓度c=m/40mol÷0.001VL=25m/V mol·L-1;
(3)根据 可知氢氧化钠的浓度c=1000dω/40=25dωmol/L;
(4)根据 可知质量分数ω=40c/1000d×100%=4c/d%;
(5)根据 可知c=1000d/40×S/(100+S)=25Sd/(100+S)mol/L。
故答案为:(1)100 w 1 w g(2)25 m V mol·L-1(3)25dw mol·L-1(4)4 c d %(5)25 S d 100 + S mol·L-
【分析】注意联系桥梁物质的量,利用基本公式进行推导得以上C的公式。
24.【答案】(1)研磨
(2)将氧化为,便于转化为沉淀除去
(3)O、N;加入,使逆向进行,进入水层
(4)或;2.5
(5)b
【解析】【解答】(1)将铜镍矿研磨,可以将固体颗粒减小,增大固体与溶液接触面积,从而加快浸出阶段反应速率。故加快反应速率的措施是研磨。
(2)具有氧化性,可将溶解后的转化为,便于转化为沉淀除去。
(3)① 分子中,若要与形成配位键,则分子需提供孤电子对,分子中存在孤电子对的原子为N原子和O原子;②反萃取时,加入稀硫酸,增大水层中浓度,使平衡逆向移动,使水层中浓度增大,即铜离子进入水层。
(4)①根据题目信息,水层中含有、、、等阳离子,加入硫酸钠和MgO后,转化为黄钠铁矾固体,对应的离子方程式为或。②根据题目信息,pH为1.5时沉淀率不高,沉淀不充分;pH为3.8时沉淀率稍高,在固体中混有的杂质较多,故最适宜的pH为2.5。
(5)第二次使用MgO调节pH使沉淀完全,即溶液中≤,根据的=,恰好完全沉淀时,=≈,=≈7.14,pH=-lg=-lg(7.14),故10>pH>9,故选择b。
【分析】(1)加快反应速率的方法可以使研磨固体,增大接触面积的方法;
(2)氧气可以将亚铁离子氧化为铁离子;
(3) ① 可以和铜离子结合,铜离子提供空轨道,另一些原子提供孤电子对;
② 增大氢离子的浓度,使平衡朝逆向移动;
(4) ① 钠离子和铁离子、硫酸根离子、水反应生成黄钠铁矾固体和氢离子;
② 要让铁离子沉淀的pH,要结合铁离子沉淀率和镍离子沉淀率判断;
(5)结合氢氧根离子和氢氧化镍的溶度积判断。
一、单选题
1.放射性同位素 I,其中数字“53”可以表示( )
A.相对原子量 B.质量数 C.原子序数 D.中子数
2.实验室中下列做法错误的是
A.金属钠着火时使用泡沫灭火器灭火
B.高锰酸钾固体保存在棕色广口瓶中
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加入水稀释
D.浓硫酸沾到皮肤上,立即用大量水冲洗,然后用3%~5%NaHCO3溶液冲洗
3.下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应,都产生H2的是( )
A.核内无中子的原子
B.价电子构型为3s23p3
C.最外层电子数等于倒数第三层上的电子数的原子
D.N层上无电子,最外层上的电子数等于电子层数的原子
4.下列装置可以分离乙醇和水的是( )
A. B.
C. D.
5.呼吸法在医学上常用于幽门螺旋杆菌的诊新,可用来测定文物年代,下列有关和的说法错误的是( )
A.和原子中均含有6个质子
B.的原子结构示意图:
C.和互为同位素
D.和原子的核外电子排布相同
6.下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 目的 分离方法 原理
A 除去KCl中的CuO 蒸发结晶 溶解度不同
B 除去碘中的NaCl 加热、升华 NaCl的熔点高,碘易升华
C 分离KNO3和NaCl 重结晶 KNO3的溶解度大于NaCl
D 分离食用油和汽油 分液 食用油和汽油的密度不同
A.A B.B C.C D.D
7.考古学常用来确定文物的历史年代,原子核内中子数是
A.6 B.8 C.14 D.20
8.把100 mL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.20 (2b-a) mol·L-1 B.20(b-2a) mol·L-1
C.10(2b-a) mol·L-1 D.10(b-2a) mol·L-1
9.如果你家里的食用菜油混有水分,你将采用下列何种方法分离( )
A.过滤 B.蒸馏 C.分液 D.萃取
10.下列关于气体摩尔体积的说法错误的是( )
A.不同的温度和压强下气体摩尔体积一定不同
B.相同物质的量的气体体积大小主要由温度和压强决定
C.在25℃和101kPa的条件下,气体摩尔体积约为24.5L·mol-1
D.标准状况下,某气体的密度为1.25g·L-1,则该气体的摩尔质量为28g·m-1
11.下列各组混合物能用分液漏斗直接分离的是( )
A.植物油与汽油 B.四氯化碳与水
C.四氯化碳和碘 D.水与乙醇
12.下列溶液中Cl-浓度最大的是( )
A.50mL 1 mol/L KCl溶液 B.20mL 3 mol/L NaCl溶液
C.25mL 2 mol/L MgCl2溶液 D.10mL 1.5 mol/L AlCl3溶液
13.关于100mL1mol/LCaCl2溶液的叙述正确的是( )
A.Cl-的物质的量浓度为2mol/L
B.CaCl2的物质的量为1mol
C.取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L
D.该溶液中水的体积为100 mL
14.某溶液中只含有四种离子,已知其中三种离子Na+、Mg2+、NO3-的物质的量浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.1 mol·L-1,则溶液中另一离子及其物质的量浓度可能( )
A.SO42-0.1 mol·L-1 B.Al3+0.2 mol·L-1
C.Cl-0.3 mol·L-1 D.K+0.4 mol·L-1
15.标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中正确的是( )
A.c= B.ω=
C.ω= D.ρ=
16.下列实验操作中,错误的( )
A.蒸发操作时,不能使混合物中的水分完全蒸干后,才停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
17.将标准状况下的 LHCl(g)溶于1000g水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是 ( )
A. mol/L B. mol/L
C. mol/L D. mo1/L
18.V mL Al2(SO4)3溶液中含有Al3+ a g,取V/4 mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是(mol/L)( )
A.125a/9V B.125a/18V C.125a/36V D.125a/54V
19.氧化铍(BeO)在航天航空等领域有着广泛的应用。一种以预处理后的硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)为原料提取BeO的流程如下图所示:
已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO
下列说法错误的是( )
A.“酸浸”步骤所得“滤渣①”的主要成分为SiO2
B.“滤液②”经处理后可获得副产品Na2SO4 10H2O
C.“碱溶”时,主要反应为Be(OH)2+2OH-=BeO +2H2O
D.“水解”时,适当增大溶液pH有利于提高BeO的提取率
二、综合题
20.分类法在化学中起着非常重要的作用:
I.由以下一些微粒:、、、、。其中:
(1)互为同位素的是
(2)中子数相等,但质子数不相等的是
(3)属于混合物的有
(4)能导电的物质有
(5)属于电解质的有
21.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为 g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
L。
(3)在臭氧发生装置中装入氧气100
mL,经反应最后气体体积变为95 mL(体积均在标准状况下测定),则混合气体的密度是 g·L-1(保留一位小数)
(4)实验室将氧气和臭氧的混合气体0.896 L(标准状况),通入盛有20.0 g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6
g。则原混合气中臭氧的体积分数
22.介孔纳米晶用作钠离子电池负极材料。某科研团队以某矿石(主要成分是、,含少量、等杂质)开发一种合成介孔的路线如图所示。
已知:研究发现,中铁为价。
回答下列问题:
(1)“萃取”的目的是除去、。的活泼性比的强,其主要原因是 。下列钙的粒子再失去1个电子,消耗能量最大的是 (填字母)。
A. B. C. D.
(2)利用如图装置完成“抽滤”操作,相对普通过滤,抽滤的主要优点是 。
(3)与硫酸铁溶液反应的离子方程式为 。
(4)利用如图装置制备去离子水。阳离子交换柱里自来水中阳离子与交换,阴离子交换柱中参与交换,阳离子交换柱中发生反应的离子方程式为 。
(5)钠离子电池如图所示。已知:钒(V)常见的化合价有、(铜以、、的形式存在),。
放电时,正极上转化成的电极反应式为 。充电时,生成理论上迁移 。
23.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为 。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为 。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为 。
(4)用c、d表示溶液中溶质的质量分数(w)为 。
(5)用S、d表示溶液中溶质的物质的量浓度(c)为 。
24.从低品位铜镍矿(含有、FeO、MgO、CuO等杂质)资源中提取镍和铜的一种工艺流程如下:
资料:一些物质的(25℃)如下。
物质
(1)上述流程中,加快反应速率的措施是 。
(2)浸出过程中通入的目的是 。
(3)萃取时发生反应:(HR、在有机层,、在水层)。
①某种HR的结构简式为 ,该分子中可能与形成配位键的,原子有 。
②解释反萃取时的作用: 。
(4)黄钠铁矾[]比更易形成沉淀。反应终点pH与、沉淀率的关系如下表。
反应终点pH 沉淀率/%
1.5 94.04 0.19
2.5 99.21 0.56
3.8 99.91 3.31
①生成黄钠铁矾的离子方程式是 。
②沉淀时最适宜选用的反应终点pH是 。
(5)第二次使用MgO调节pH使沉淀完全,宜将pH调节至 (填序号)。
a.6~7 b.9~10 c.11~12
答案解析部分
1.【答案】C
【解析】【解答】A. 已知核素相对原子量无法计算,故A不符合题意;
B. 质量数为131,故B不符合题意;
C. 原子序数为53,故C符合题意;
D. 中子数为131-53=78,故D不符合题意;
故答案为:C。
【分析】原子中,原子序数=质子数=核电荷数=核外电子数,放射性同位素 I,左下角53可表示质子数、核电荷数、核外电子数、原子序数。
2.【答案】A
【解析】【解答】A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应该用(干燥的)沙土铺盖灭火,A符合题意;
B.高锰酸钾固体受热后易分解,故需在棕色广口瓶中、阴冷处密封保存,B不符合题意;
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中,其目的是抑制氯化铁的水解,再加水稀释至所需浓度,C不符合题意;
D.如果不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,避免强碱的强烈的腐蚀性对皮肤造成二次伤害,不能使用强碱中和,用3%~5%NaHCO3溶液冲洗,D不符合题意;
故答案为:A。
【分析】依据物质的性质分析,其中A项金属钠着火生成过氧化钠,过氧化钠与水和二氧化碳反应并生成氧气。
3.【答案】D
【解析】【解答】A.核内无中子的原子是H原子,其单质H2与酸、键均不能发生反应,A不符合题意;
B.价电子构型为3s23p3的原子是P,P单质能与NaOH发生反应且不能产生氢气,而不能与稀硫酸反应,B不符合题意;
C.最外层电子数等于倒数第三层上的电子数的原子是Mg,Mg是比较活泼的金属,与NaOH溶液不能发生反应,C不符合题意;
D.N层上无电子,最外层上的电子数等于电子层数的原子是Al原子,单质Al是比较活泼的金属,能与稀硫酸和烧碱溶液发生反应产生氢气,D符合题意;
故答案为:D。
【分析】A.核内无中子的原子是H原子;
B.价电子构型为3s23p3的原子是P原子;
C.最外层电子数等于倒数第三层上的电子数的原子是Mg;
D.N层上无电子,最外层上的电子数等于电子层数的原子是Al原子。
4.【答案】A
【解析】【解答】A.乙醇中含少量水时,通常可以加入适量生石灰后再蒸馏,可收集到无水乙醇,所以A装置符合题意,A符合题意。
B.乙醇蒸气和水蒸气都可以被浓硫酸吸收,所以不能用浓硫酸洗气,也没有合适的溶剂只吸收水蒸气,B不符合题意;
C.乙醇是一种易挥发的液体,可以和水以任意比互溶,所以既不能降温让水结冰析出,C不符合题意;
D.也不能用萃取剂萃取,D不符合题意。
【分析】乙醇在水中溶解度较大,只能用蒸馏法。
5.【答案】B
【解析】【解答】A.和原子都属于6号C元素,原子核中均含有6个质子,A不符合题意;
B.的原子核外有6个电子,核外电子排布是2、4,故原子结构示意图为:,B符合题意;
C.和质子数相同,中子数不同,二者互为同位素,C不符合题意;
D.和原子核外都有6个电子,核外电子排布是2、4,故它们的核外电子排布相同,D不符合题意;
故答案为:B。
【分析】同位素定义:质子数相同,中子数不同的同种元素不同原子,同位素差异在于中子数不同,核外电子排布式完全相同。
6.【答案】B
【解析】【解答】A、氯化钾溶于水,氧化铜不溶于水,可以用溶解、过滤的方法分离,故A不符合题意;
B、碘单质受热升华,氯化钠受热不分解,可以用加热、升华的方法分离,故B符合题意;
C、KNO3的溶解度随温度升高变化大,NaCl溶解度随温度变化不大,可以用重结晶的方法分离,故C不符合题意;
D、食用油和汽油互溶,不能用分液的方法分离,应利用沸点不同,利用蒸馏的方法分离,故D不符合题意;
故答案为:B。
【分析】NaCl的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响大,则除去KNO3固体中混杂的NaCl,应溶解后冷却热饱和溶液,结晶分离是解答关键。
7.【答案】B
【解析】【解答】解: 质子数为6,质量数为14,质量数=质子数+中子数,中子数为14-6=8;
故答案为:B
【分析】质量数=质子数+中子数。
8.【答案】A
【解析】【解答】把100 mL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,所以混合溶液含有0.5amolMg2+;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,所以混合溶液含有bmolSO42-。根据电荷守恒可得:n(K+)+2n(Mg2+)=2n(SO42-),n(K+)+2amol=bmol,n(K+)=(2b-a)mol,c(K+)=(2b-a)mol/0.05L=20(2b-a) mol·L-1,
故答案为:A。
【分析】根据氢氧化钠的物质的量基酸镁离子的物质的量,根据氯化钡的物质的量计算硫酸根离子的总物质的量,然后根据电荷守恒计算钾离子的物质的量。
9.【答案】C
【解析】【解答】解:食用菜油与水分层,选择分液法分离,过滤分离不溶性固体与液体、蒸馏分离互溶但沸点不同的液体、萃取分离溶质在不同溶剂中溶解性差异大的混合物,
故选C.
【分析】食用菜油与水分层,选择分液法分离,以此来解答.
10.【答案】A
【解析】【解答】A.气体摩尔体积受温度和压强的影响,同温同压下,气体摩尔体积一定相同,在不同的温度和压强下,气体摩尔体积可能相同,也可能不同,故A符合题意;
B.气体体积V=nVm,而气体摩尔体积受温度和压强影响,故当气体的物质的量n相同时,气体的体积大小取决于温度和压强,故B不符合题意;
C.根据PV=nRT,相同压强下,体积之比等于温度之比,有 ,解得常温常压下,气体摩尔体积为24.5L/mol,故C不符合题意;
D.气体的密度ρ=M/Vm,故气体的摩尔质量M=ρVm,故标准状况下,某气体的密度为125g L-1,则该气体的摩尔质量为125g L-1×22.4L mol-1=28g mol-1,故D不符合题意。
故答案为:A。
【分析】
A.气体摩尔体积受温度和压强影响,当两者均改变时是有可能达到气体摩尔体积相同的情况;
B.根据气体摩尔体积公式,体积受温度和压强影响较大;
C.根据阿伏加德罗定律推论及理想气体状态方程PV=nRT,可以计算出此时的气体摩尔体积,注意此时的温度是K氏温度;
D.根据物质的量相关公式计算即可,且摩尔质量单位错误。
11.【答案】B
【解析】【解答】解:A.植物油与汽油都是有机物,所以植物油与汽油能相互溶解,所以不能用分液漏斗分离,故A错误;
B.四氯化碳是有机物,水是无机物,四氯化碳和水不互溶,所以能用分液漏斗分离,故B正确;
C.碘可以溶于四氯化碳形成溶液,所以不能用分液漏斗分离,故C错误;
D.乙醇和水能互溶,所以不能用分液漏斗分离,故D错误.
故选B.
【分析】能用分液漏斗分离的物质必须是两种相互不溶的液体,一般的来说:有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂.
12.【答案】D
【解析】【解答】A. 50mL 1 mol/L KCl溶液,溶液中Cl-浓度是 1 mol·L-1;
B. 20mL 3 mol/L NaCl溶液,溶液中Cl-浓度是 3 mol·L-1;
C. 25mL 2 mol/L MgCl2溶液,溶液中Cl-浓度是 4 mol·L-1;
D. 10mL 1.5 mol/L AlCl3溶液,溶液中Cl-浓度是 4.5mol·L-1;
故答案为:D。
【分析】写出电离方程式,结合电离方程式中的系数,找出氯离子和物质的量浓度的关系即可计算出氯离子的浓度大小
13.【答案】A
【解析】【解答】A。Cl-的物质的量浓度为1mol/L×2=2mol/L;A符合题意;
B.CaCl2的物质的量为0.1×1=0.1 molB不符合题意;取出50 mL后,剩余溶液中的浓度保持不变,C不符合题意;
D.溶液的体积为100毫升,而非溶剂的体积,D不符合题意;
故答案为:A
【分析】A.根据CaCl2溶液的浓度即可求出 Cl-的物质的量浓度;
B.根据n=cv计算即可得出答案;
C.配制好的溶液浓度一定,保持不变;
D.水为溶剂,溶剂的体积=溶液的体积-溶质的体积,据此即可得出答案。
14.【答案】C
【解析】【解答】根据溶液显电中性可知另一种离子一定是阴离子,忽略水的电离,如果是硫酸根离子,则其浓度是(0.2mol/L+0.1mol/L×2-0.1mol/L)/2=0.15mol/L,如果是氯离子,其浓度是0.2mol/L+0.1mol/L×2-0.1mol/L=0.3mol/L,
故答案为:C。
【分析】结合离子以及相应种类,根据电荷守恒进行计算,可知正电荷共有0.4mol/L,负电荷有0.1mol/L,可知缺少0.3mol/L的负电荷,即 Cl-0.3 mol·L-1 。
15.【答案】C
【解析】【解答】解:A、标况下VL氨气的物质的量为 mol,质量为 g,溶于1L水后所得溶液的质量分数ω= = ,然后带入c= = = mol/L,故A错误;
B、根据c= 可知:ω= ,故B错误;
C、标况下VL氨气的物质的量为 mol,质量为 g,溶于1L水后所得溶液的质量分数ω= = ,故C正确;
D、VL氨气的物质的量为 = mol,氨气质量为 g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为(= +1000)g,溶液体积为: = L,所以溶液的密度为: = g/mL,故D错误;
故选C.
【分析】A、表示出溶液的质量分数ω,然后带入c= 来计算;
B、根据c= 来计算;
C、根据质量分数= 来计算;
D、根据n= 计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V= 计算溶液的体积,由ρ= 计算溶液的密度.
16.【答案】D
【解析】【解答】解:A.在蒸发操作的过程中,当加热到有少量液体剩余时停止加热,此时剩下的少量液体可以利用余热蒸发干,故A正确;
B.蒸馏操作时,温度计水银球应靠近蒸馏烧瓶的支管口处,故B正确;
C.活塞到漏斗管口还残留一部分下层液体.如果将上层液体也从下口放出,残留的下层液体会一起被放出,上层液体就不纯净了,故分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C正确;
D.萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,密度也可以比水小,故D错误.
故选:D.
【分析】A.在蒸发操作的过程中,当加热到有少量液体剩余时停止加热,利用余热蒸发干;
B.温度计测量蒸气的温度;
C.活塞到漏斗管口还残留一部分下层液体;
D.萃取剂的选择与密度无关.
17.【答案】A
【解析】【解答】将标准状况下的a L HCl(气)的物质的量为 = mol,氯化氢的质量为 mol×36.5g/mol= g,所以溶液质量为1000g+ g=(1000+ )g,所以溶液的体积为 = L,所以溶液浓度为 = mol/L,A符合题意;
故答案为:A
【分析】根据公式计算HCl的物质的量,再根据溶液的密度计算溶液的体积,结合公式计算溶液的物质的量浓度。
18.【答案】C
【解析】【解答】VmLAl2(SO4)3溶液中Al3+物质的量n(Al3+)=a/27 mol,则VmLAl2(SO4)3溶液中n(SO42-)=a/27 mol×3/2=a/18 mol,所以VmLAl2(SO4)3溶液中c(SO42-)=a/18 mol÷(V×10-3)L=500a/9V mol/L;取V/4 mL溶液稀释到4V mL,即稀释了16倍,由于稀释前后SO42-物质的量不变,则稀释后硫酸根的浓度是125a/36V mol/L,C符合题意;
故答案为:C
【分析】由Al3+的质量,结合公式计算溶液中n(SO42-);再根据稀释过程中,溶质的物质的量保持不变,计算稀释后所得溶液中c(SO42-)。
19.【答案】D
【解析】【解答】A.氧化铁和氧化亚铁都是碱性氧化物,氧化铍属于两性氧化物,二氧化硅属于酸性氧化物,上述氧化物中只有二氧化硅不溶于稀硫酸,因此“酸浸”步骤所得“滤渣①”的主要成分为SiO2,故A说法不符合题意;
B.滤液①中含有的主要离子有H+、Be2+、Fe3+、Fe2+、和SO ,加入氢氧化钠溶液将pH调节至9,氢离子被中和,Be2+、Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,因此“滤液②”经处理后可获得副产品Na2SO4 10H2O,故B说法不符合题意;
C.Fe(OH)2和Fe(OH)3属于碱,Be(OH)2属于两性化合物,“碱溶”时只有氢氧化铍溶解在氢氧化钠溶液中,反应的离子方程式为:Be(OH)2+2OH-=BeO +2H2O,故C说法不符合题意;
D.滤液③的主要阴离子是BeO ,它发生水解的离子方程式为:BeO +2H2O Be(OH)2+2OH-,增大溶液的pH,平衡向左移动,不利于BeO 的水解,故D说法符合题意;
故答案为:D。
【分析】 硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等) 经H2SO4酸浸,滤渣①为SiO2,滤液①中含有的主要离子有H+、Be2+、Fe3+、Fe2+、和SO ,加入氢氧化钠溶液将pH调节至9,氢离子被中和,Be2+、Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,“滤液②”经处理后可获得副产品Na2SO4 10H2O,滤渣②为Fe(OH)2、Fe(OH)3、Be(OH)2,碱溶时发生反应Be(OH)2+2OH-=BeO +2H2O,滤液③的主要阴离子是BeO ,水解后得到Be(OH)2,最后加热分解得到BeO。
20.【答案】(1)、
(2)、II.现有下列物质:①Cl2、②稀硫酸、③熔化的KNO3、④无水酒精、⑤Cu(OH)2、⑥CO2、⑦镁铝合金,请回答下列问题(填序号):
(3)②⑦
(4)②③⑦
(5)③⑤
【解析】【解答】(1)有以下一些微粒:、、、、, 其中:
质子数相同中子数不同的同一种元素的不同核素互为同位素,则互为同位素的是、;
(2)的质子数和中子数分别是6、7,的质子数和中子数分别是19、20,的质子数和中子数分别是6、6,的质子数和中子数分别是7、7,的质子数和中子数分别是18、22,则中子数相等,但质子数不相等的是、;
(3)①Cl2是单质,不导电,不是电解质也不是非电解质;
②稀硫酸是混合物,可导电,不是电解质也不是非电解质;
③熔化的KNO3能电离出离子,可导电,是电解质;
④无水酒精不电离,不导电,是非电解质;
⑤Cu(OH)2能电离,固体不导电,是电解质;
⑥CO2不电离,不导电,是非电解质;
⑦镁铝合金是混合物,可导电,不是电解质也不是非电解质;
则属于混合物的有②⑦;
(4)根据以上分析可知能导电的物质有②③⑦;
(5)根据以上分析可知属于电解质的有③⑤。
【分析】(1)质子数相同中子数不同的同一种元素的不同核素互为同位素
(2)依据原子表示时左上角表示质量数、左下角表示质子数,质量数=质子数+中子数、质子数=核外电子数分析。
(3)依据在熔融状态下或者溶于水能导电的化合物,是电解质;在水中或者熔融状态下均不导电的化合物,是非电解质;单质和混合物既不是电解质也不是非电解质分析。
21.【答案】(1)35.6
(2)3
(3)1.5
(4)50%
【解析】【解答】(1)假设有1molO2,则可列出三段式:
3O2 2O3
起始(mol) 1 0
转化(mol) 0.3 0.2
平衡(mol) 0.7 0.2
则反应后所得气体为0.2molO3和0.7molO2,共0.9mol,反应前后气体总质量不变,混合气体的总质量为m=1mol×32g/mol=32g,则所得混合气的平均摩尔质量为 ;
故答案为:35.6;(2)此题可根据差量法计算,设生成臭氧的体积为X,则:
列方程式得 ,X=3L;
故答案为:3;(3)反应前氧气的物质的量为 ,故反应前氧气的质量为 ,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度为,
故答案为:1.5;(4) ,设臭氧的体积分数为a,根据氧原子守恒
0.04mol×a×3+0.04mol×(1-a)×2=
解得a=50%;
故答案为:50%。
【分析】(1)首先列三段式,再利用平均摩尔质量等于气体的总质量与总物质的量之比分析解答;(2)利用差量法根据化学方程式列比例式解题;(3)根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,计算出反应前氧气的物质的量,再计算反应前氧气的质量,再根据 计算混合气体的密度;(4)再根据n(混合气体)= ,再利用氧原子守恒混合气体中含有的氧原子等于增加的质量中氧原子的数目解题。
22.【答案】(1)基态、的价层电子排布式分别为、,而达到半充满稳定结构,能量较低,较活泼;B
(2)过滤较快、固体较干燥等合理答案
(3)
(4)
(5);2
【解析】【解答】(1)的活泼性比的强,其主要原因是:基态、的价层电子排布式分别为、,而达到半充满稳定结构,能量较低,较活泼;根据铁离子、亚铁离子价层电子排布式和洪特规则特例判断离子活泼性。A项代表基态钙原子,B项代表价钙离子,C项和D项代表钙原子的激发态,钙离子第二电离能大于第一电离能,
故答案为:B;
(2)抽滤是在减压条件下过滤,过滤速率较快,所得固体较干燥。溶剂易挥发(减压条件下,液体挥发温度降低);
(3)黄铜矿与硫酸铁反应生成亚铁盐和铜盐、硫单质,离子方程式为;
(4)阳离子交换柱中氢离子与碳酸氢根离子反应,反应的离子方程式为;
(5)根据图示,放电时钠离子向正极迁移,根据电荷守恒正极反应式为;充电时,阴极反应式为,则生成转移2mol电子,理论上迁移2。
【分析】(1)电子半充满时更稳定;
(2)抽滤的特点是速度快且更干燥;
(3)氧化还原反应的配平方法是先确定化合价的变化,根据化合价升降守恒,配出相应的化学计量数;
(4)碳酸氢根离子和氢离子反应生成二氧化碳和水;
(5)新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒;若是充电过程,则负极作为阴极,正极作为阳极,阴极电极反应式为负极的逆反应,阳极的电极反应式为正极的逆反应。
23.【答案】(1) g
(2) mol·L-1
(3)25dw mol·L-1
(4) %
(5) mol·L-
【解析】【解答】(1)溶解度为S,该饱和溶液的质量分数ω=S/(100+S),解得:S=100ω/(1 ω);
(2)氢氧化钠的物质的量是m/40 mol,则氢氧化钠的浓度c=m/40mol÷0.001VL=25m/V mol·L-1;
(3)根据 可知氢氧化钠的浓度c=1000dω/40=25dωmol/L;
(4)根据 可知质量分数ω=40c/1000d×100%=4c/d%;
(5)根据 可知c=1000d/40×S/(100+S)=25Sd/(100+S)mol/L。
故答案为:(1)100 w 1 w g(2)25 m V mol·L-1(3)25dw mol·L-1(4)4 c d %(5)25 S d 100 + S mol·L-
【分析】注意联系桥梁物质的量,利用基本公式进行推导得以上C的公式。
24.【答案】(1)研磨
(2)将氧化为,便于转化为沉淀除去
(3)O、N;加入,使逆向进行,进入水层
(4)或;2.5
(5)b
【解析】【解答】(1)将铜镍矿研磨,可以将固体颗粒减小,增大固体与溶液接触面积,从而加快浸出阶段反应速率。故加快反应速率的措施是研磨。
(2)具有氧化性,可将溶解后的转化为,便于转化为沉淀除去。
(3)① 分子中,若要与形成配位键,则分子需提供孤电子对,分子中存在孤电子对的原子为N原子和O原子;②反萃取时,加入稀硫酸,增大水层中浓度,使平衡逆向移动,使水层中浓度增大,即铜离子进入水层。
(4)①根据题目信息,水层中含有、、、等阳离子,加入硫酸钠和MgO后,转化为黄钠铁矾固体,对应的离子方程式为或。②根据题目信息,pH为1.5时沉淀率不高,沉淀不充分;pH为3.8时沉淀率稍高,在固体中混有的杂质较多,故最适宜的pH为2.5。
(5)第二次使用MgO调节pH使沉淀完全,即溶液中≤,根据的=,恰好完全沉淀时,=≈,=≈7.14,pH=-lg=-lg(7.14),故10>pH>9,故选择b。
【分析】(1)加快反应速率的方法可以使研磨固体,增大接触面积的方法;
(2)氧气可以将亚铁离子氧化为铁离子;
(3) ① 可以和铜离子结合,铜离子提供空轨道,另一些原子提供孤电子对;
② 增大氢离子的浓度,使平衡朝逆向移动;
(4) ① 钠离子和铁离子、硫酸根离子、水反应生成黄钠铁矾固体和氢离子;
② 要让铁离子沉淀的pH,要结合铁离子沉淀率和镍离子沉淀率判断;
(5)结合氢氧根离子和氢氧化镍的溶度积判断。
