化学人教版(2019)必修第一册2.3.2气体摩尔体积(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.2气体摩尔体积(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-11 21:43:28 | ||
图片预览






文档简介
(共26张PPT)
第2课时 气体摩尔体积
素养目标
1.由决定物质体积大小的三个因素出发,讨论1 mol不同状态物质体积大小的决定因素,最终形成气体摩尔体积的概念,逐步培养宏观辨识与微观探析能力。
2.由公式 逐步建立气体体积与气体物质的量间的换算关系,熟练掌握22.4 L·mol-1的应用,逐步形成证据推理与模型认知的思维习惯。
3.初步了解阿伏加德罗定律及简单推论,并能将该推论应用于有关气体的体积、压强、物质的量间的关系判断或计算,培养化学学科必备的科学探究精神。
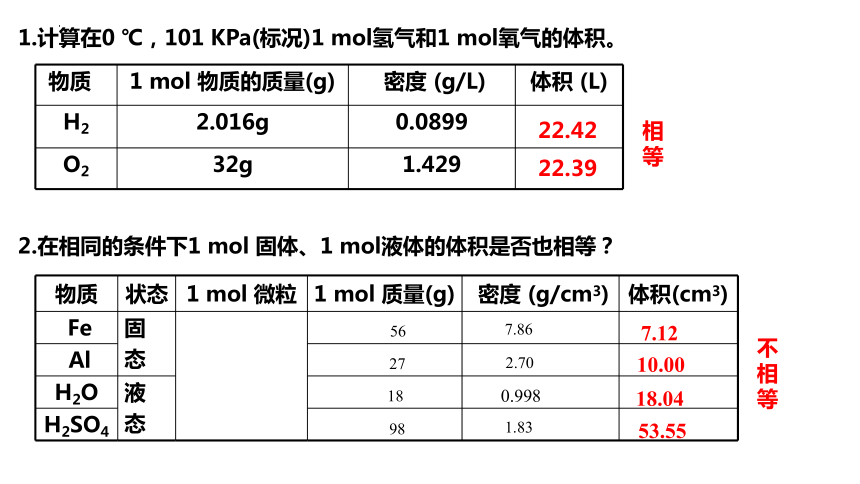
1.计算在0 ℃,101 KPa(标况)1 mol氢气和1 mol氧气的体积。
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.42
22.39
2.在相同的条件下1 mol 固体、1 mol液体的体积是否也相等?
物质 状态 1 mol 微粒 1 mol 质量(g) 密度 (g/cm3) 体积(cm3)
Fe 固 态
Al
H2O 液 态
H2SO4
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
0.998
不相等
相等
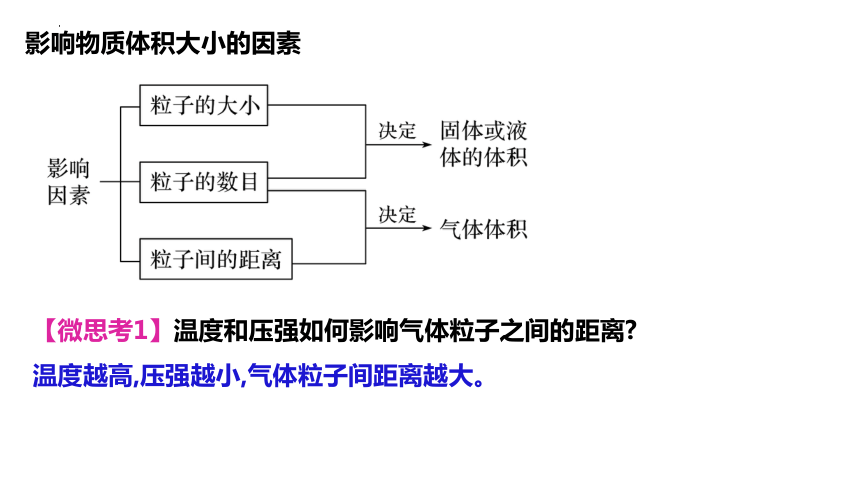
影响物质体积大小的因素
【微思考1】温度和压强如何影响气体粒子之间的距离
温度越高,压强越小,气体粒子间距离越大。
气体与液体一样是流体:它可以流动,可变形。与液体不同的是气体可以被压缩。气体的体积主要是由以下什么因素决定的( )
①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
C
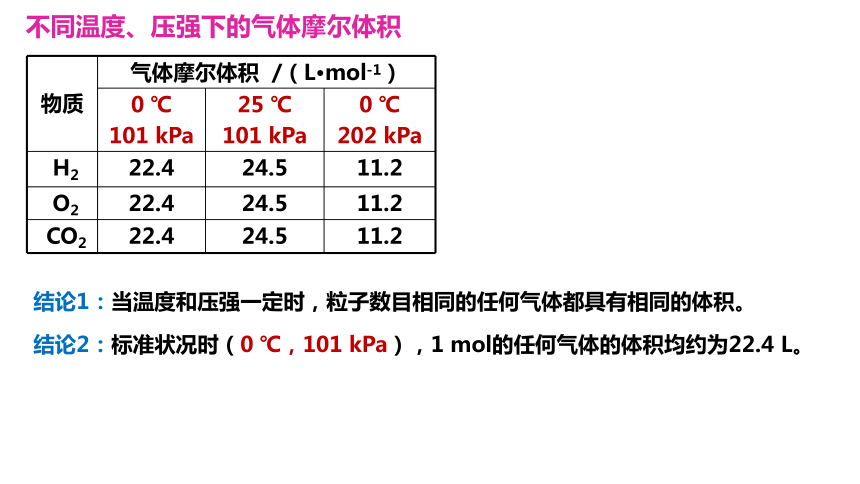
物质 气体摩尔体积 /(L·mol-1) 0 ℃ 101 kPa 25 ℃ 101 kPa 0 ℃
202 kPa
H2 22.4 24.5 11.2
O2 22.4 24.5 11.2
CO2 22.4 24.5 11.2
不同温度、压强下的气体摩尔体积
结论1:当温度和压强一定时,粒子数目相同的任何气体都具有相同的体积。
结论2:标准状况时(0 ℃,101 kPa),1 mol的任何气体的体积均约为22.4 L。
二、气体摩尔体积
标准状况下的气体摩尔体积
计算公式
【微思考2】请思考只有在标准状况下,气体摩尔体积的数值才为
22.4 L·mol-1吗 举例说明。
不一定。在很多状况下气体摩尔体积的数值为22.4 L·mol-1,如273 ℃、202 kPa下。
下列叙述正确的是( )
A.1 mol任何气体的体积都为22.4 L
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.只有在标准状况下,气体摩尔体积才约为22.4 L·mol-1
D.标准状况下,22.4 L任何气体的物质的量都是1 mol
D
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.常温常压下,48 g O3含有的氧原子数为3NA
C.标准状况下,22.4 L H2O所含分子数为NA
D.标准状况下,22.4 L H2所含原子数为NA
B
标准状况下气体体积的计算
(1)计算关系
②气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
【自我小测】判断正误:
(1)在相同条件下,1 mol任何物质的体积均相同。( )
(2)同温同压下,1 mol气体的体积均为22.4 L。( )
(3)标准状况下,1 mol任何物质的体积都约为22.4 L。( )
(4)同温同压下,相同体积的任何气体都含有相同数目的原子。( )
(5)同温同压下,相同体积的物质含有相同数目的分子。( )
×
×
×
×
×
误区警示
(1)在气体分子个数、温度、压强一定时,气体体积的大小取决于气体分子间的平均距离,与分子种类无关。
(2)气体摩尔体积只适用于气态物质且与气体种类无关,只要温度和压强一定,气体摩尔体积就一定。
(3)同温同压下:任何气体的摩尔体积Vm都相同,但不一定等于22.4 L·mol-1。
(4)不能混淆标准状况和常温常压,两者压强相同,但温度不同。因为温度升高气体分子之间的距离变大,所以常温常压下的气体摩尔体积比标准状况下的气体摩尔体积大。
(5)气体摩尔体积不能理解为体积,体积的单位是L或m3,而气体摩尔体积的单位是L·mol-1或m3· mol-1。
下列说法中正确的是( )
A.1 mol O2和1 mol N2所占的体积约为22.4 L
B.标准状况下,H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N原子的物质的量约为2 mol
D
(1)现有34 g某气体,摩尔质量为17 g·mol-1,则:
①该气体的物质的量为 mol。
②该气体所含分子数为 NA。
③该气体在标准状况下的体积为 L。
(2) g H2O中的氧原子数目与标准状况下22.4 L CO2中的氧原子数目相同。
①2 ②2 ③44.8 (2)36
同温同压下,相同体积的任何气体都含有相同数目的分子(“四同”)。
阿伏加德罗定律
不一定指标准状况
pV=nRT pV=
pV= pM=ρRT
【深化拓展】阿伏加德罗定律的推论
下列叙述不正确的是( )
A.同温同压下,1 mol H2和1 mol H2O一定具有相同的体积
B.常温常压下,等体积的O2和H2的物质的量相同
C.同温同压下,O2和H2的密度之比为16∶1
D.同温同压下,同容积的两个容器,一个盛有NO,另一个盛有N2和O2,
两容器内的气体一定具有相同的分子总数
A
同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是( )
A.两气体的物质的量之比为3∶2
B.两种容器的体积之比为2∶3
C.两种气体的分子数目相等
D.两种气体的密度之比是3∶2
A
一定温度和压强下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出如图所示四个体积大小不同的气球,下列说法正确的是( )
C
A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球③和气球④中气体密度之比为2∶1
D.气球①和气球④中气体物质的量之比为4∶1
Vm =
V
n
同温同压下,两种气体的体积如果不相同,请你推测其主要原因是( )
A.气体的分子大小不同
B.气体的物质的量不同
C.气体分子的化学性质不同
D.气体分子间的平均距离不同
B
如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为( )
A.22.0 L·mol-1
B.22.4 L·mol-1
C.22.8 L·mol-1
D.23.2 L·mol-1
C
下列叙述不正确的是( )
A.在标准状况下,1.5 mol O2的体积是33.6 L
B.在标准状况下,2 mol H2的体积是44.8 L
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.32 g O2的物质的量是1 mol
C
如图所示,①和②为两个容积相同的固定容器,图中“ ”和“ ”分别表示氢原子和氧原子,则下列说法正确的是( )
A.若①中的H2为1 mol,则②中所含原子总数为3.01×1023
B.①和②中气体的质量之比为1∶8
C.等物质的量的H2、O2的体积一定相等
D.两容器的温度和压强均相同
B
第2课时 气体摩尔体积
素养目标
1.由决定物质体积大小的三个因素出发,讨论1 mol不同状态物质体积大小的决定因素,最终形成气体摩尔体积的概念,逐步培养宏观辨识与微观探析能力。
2.由公式 逐步建立气体体积与气体物质的量间的换算关系,熟练掌握22.4 L·mol-1的应用,逐步形成证据推理与模型认知的思维习惯。
3.初步了解阿伏加德罗定律及简单推论,并能将该推论应用于有关气体的体积、压强、物质的量间的关系判断或计算,培养化学学科必备的科学探究精神。
1.计算在0 ℃,101 KPa(标况)1 mol氢气和1 mol氧气的体积。
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.42
22.39
2.在相同的条件下1 mol 固体、1 mol液体的体积是否也相等?
物质 状态 1 mol 微粒 1 mol 质量(g) 密度 (g/cm3) 体积(cm3)
Fe 固 态
Al
H2O 液 态
H2SO4
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
0.998
不相等
相等
影响物质体积大小的因素
【微思考1】温度和压强如何影响气体粒子之间的距离
温度越高,压强越小,气体粒子间距离越大。
气体与液体一样是流体:它可以流动,可变形。与液体不同的是气体可以被压缩。气体的体积主要是由以下什么因素决定的( )
①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
C
物质 气体摩尔体积 /(L·mol-1) 0 ℃ 101 kPa 25 ℃ 101 kPa 0 ℃
202 kPa
H2 22.4 24.5 11.2
O2 22.4 24.5 11.2
CO2 22.4 24.5 11.2
不同温度、压强下的气体摩尔体积
结论1:当温度和压强一定时,粒子数目相同的任何气体都具有相同的体积。
结论2:标准状况时(0 ℃,101 kPa),1 mol的任何气体的体积均约为22.4 L。
二、气体摩尔体积
标准状况下的气体摩尔体积
计算公式
【微思考2】请思考只有在标准状况下,气体摩尔体积的数值才为
22.4 L·mol-1吗 举例说明。
不一定。在很多状况下气体摩尔体积的数值为22.4 L·mol-1,如273 ℃、202 kPa下。
下列叙述正确的是( )
A.1 mol任何气体的体积都为22.4 L
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.只有在标准状况下,气体摩尔体积才约为22.4 L·mol-1
D.标准状况下,22.4 L任何气体的物质的量都是1 mol
D
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.常温常压下,48 g O3含有的氧原子数为3NA
C.标准状况下,22.4 L H2O所含分子数为NA
D.标准状况下,22.4 L H2所含原子数为NA
B
标准状况下气体体积的计算
(1)计算关系
②气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
【自我小测】判断正误:
(1)在相同条件下,1 mol任何物质的体积均相同。( )
(2)同温同压下,1 mol气体的体积均为22.4 L。( )
(3)标准状况下,1 mol任何物质的体积都约为22.4 L。( )
(4)同温同压下,相同体积的任何气体都含有相同数目的原子。( )
(5)同温同压下,相同体积的物质含有相同数目的分子。( )
×
×
×
×
×
误区警示
(1)在气体分子个数、温度、压强一定时,气体体积的大小取决于气体分子间的平均距离,与分子种类无关。
(2)气体摩尔体积只适用于气态物质且与气体种类无关,只要温度和压强一定,气体摩尔体积就一定。
(3)同温同压下:任何气体的摩尔体积Vm都相同,但不一定等于22.4 L·mol-1。
(4)不能混淆标准状况和常温常压,两者压强相同,但温度不同。因为温度升高气体分子之间的距离变大,所以常温常压下的气体摩尔体积比标准状况下的气体摩尔体积大。
(5)气体摩尔体积不能理解为体积,体积的单位是L或m3,而气体摩尔体积的单位是L·mol-1或m3· mol-1。
下列说法中正确的是( )
A.1 mol O2和1 mol N2所占的体积约为22.4 L
B.标准状况下,H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N原子的物质的量约为2 mol
D
(1)现有34 g某气体,摩尔质量为17 g·mol-1,则:
①该气体的物质的量为 mol。
②该气体所含分子数为 NA。
③该气体在标准状况下的体积为 L。
(2) g H2O中的氧原子数目与标准状况下22.4 L CO2中的氧原子数目相同。
①2 ②2 ③44.8 (2)36
同温同压下,相同体积的任何气体都含有相同数目的分子(“四同”)。
阿伏加德罗定律
不一定指标准状况
pV=nRT pV=
pV= pM=ρRT
【深化拓展】阿伏加德罗定律的推论
下列叙述不正确的是( )
A.同温同压下,1 mol H2和1 mol H2O一定具有相同的体积
B.常温常压下,等体积的O2和H2的物质的量相同
C.同温同压下,O2和H2的密度之比为16∶1
D.同温同压下,同容积的两个容器,一个盛有NO,另一个盛有N2和O2,
两容器内的气体一定具有相同的分子总数
A
同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是( )
A.两气体的物质的量之比为3∶2
B.两种容器的体积之比为2∶3
C.两种气体的分子数目相等
D.两种气体的密度之比是3∶2
A
一定温度和压强下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出如图所示四个体积大小不同的气球,下列说法正确的是( )
C
A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球③和气球④中气体密度之比为2∶1
D.气球①和气球④中气体物质的量之比为4∶1
Vm =
V
n
同温同压下,两种气体的体积如果不相同,请你推测其主要原因是( )
A.气体的分子大小不同
B.气体的物质的量不同
C.气体分子的化学性质不同
D.气体分子间的平均距离不同
B
如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为( )
A.22.0 L·mol-1
B.22.4 L·mol-1
C.22.8 L·mol-1
D.23.2 L·mol-1
C
下列叙述不正确的是( )
A.在标准状况下,1.5 mol O2的体积是33.6 L
B.在标准状况下,2 mol H2的体积是44.8 L
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.32 g O2的物质的量是1 mol
C
如图所示,①和②为两个容积相同的固定容器,图中“ ”和“ ”分别表示氢原子和氧原子,则下列说法正确的是( )
A.若①中的H2为1 mol,则②中所含原子总数为3.01×1023
B.①和②中气体的质量之比为1∶8
C.等物质的量的H2、O2的体积一定相等
D.两容器的温度和压强均相同
B
