2.1 钠及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1 钠及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 331.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-12 12:10:03 | ||
图片预览



文档简介
2.1 钠及其化合物 同步练习题
一、选择题
1.下列叙述中,正确的是
A.钠是银白色金属,硬度很大
B.将金属钠放在坩埚里用酒精灯加热,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体氧化钠
C.金属钠在空气中燃烧,生成过氧化钠
D.焰色试验是化学变化
2.传统文化中蕴含着丰富的化学知识。下列说法错误的是
A.“忽闻海上有仙山,山在虚无缥缈间”中描述的海市蜃楼现象,与胶体知识有关
B.“以火烧之,紫青烟起,乃真硝石也”这是利用“焰色反应”来鉴别硝石(KNO3)
C.“大漠孤烟直,长河落日圆”中的“烟”与“发烟”硝酸中的“烟”成份相同
D.“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面”,这是《本草纲目》中有关“石碱”的记载,此处的“石碱”是指K2CO3
3.图中相连物质间在一定条件下可以发生反应,下表提供的四组物质符合要求的是
选项 甲 乙 丙 丁
A
B Mg HCl NaOH
C NaOH
D HCl
A.A B.B C.C D.D
4.在化学实验中,具有安全和环保意识是重要的科学素养。下列做法不正确的是
A.酒精灯失火用湿抹布灭火 B.可用手直接取用金属钠
C.用点燃的方法处理CO尾气 D.、等固体不能随便丢弃
5.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列叙述中正确的是
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的Na2O
C.钠在盐酸中反应要比在蒸馏水中反应剧烈
D.金属钠着火时,可用水灭火
6.在隔绝空气的条件下让钠与溶液反应,实验时,往大试管中先加煤油,取三粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入溶液使煤油的液面至橡皮塞,并夹紧弹簧夹(如图)。下列叙述错误的是
A.剩余的钠放回原试剂瓶
B.溶液中有气泡生成,下层溶液出现白色絮状沉淀
C.大试管内和长颈漏斗内的液面都下降
D.钠与硫酸亚铁溶液反应的化学方程式为
7.下列关于金属钠性质的叙述错误的是
A.钠着火时不能用水扑灭
B.钠与氧气在加热条件下反应时,若氧气的量较少,则生成氧化钠
C.钠在空气中长期放置,最终变成碳酸钠
D.钠是金属,其密度比水的小
8.下列离子方程式正确的是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与水反应:2Na+2H+=2Na++H2↑
C.NH4HCO3与足量烧碱反应:HCO+OH﹣=CO+H2O
D.Na2CO3与足量盐酸反应:CO+2H+=CO2↑+H2O
二、非选择题
9.利用分类法研究化学物质可系统、全面认识物质的性质。下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、、、CuO
②HCl、、、
③NaOH、、KOH、
(1)三种物质依次是填化学式:①______;②______;③______。
(2)这三种物质相互作用可生成一种新物质,该反应是________反应。填四大基本反应类型。
(3)写出与足量稀硫酸反应的离子方程式:_____。
(4)NaHCO3与HCl在溶液能发生化学反应,试用离子方程式说明:_____。
10.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是___。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是___。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式___,生成物的颜色为___。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为___,检验该反应产生的气体的方法是___。
11.取等物质的量浓度的NaOH溶液两份A和B,每份100 mL。向其中各通入一定量的CO2,然后各取溶液10 mL,分别向稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸。标准状况下,产生CO2气体体积与所加盐酸体积之间的关系如图所示。回答下列问题:
(1)曲线A表明原溶液中通入CO2后,所得溶液中的溶质为________(写化学式),其物质的量之比为________。
(2)B曲线当耗盐酸0<V(HCl)<25 mL时发生的离子反应为:_______。加盐酸后,产生CO2体积的最大值为_______mL(不考虑CO2的溶解)。写出向该NaOH溶液中通入CO2得到B溶液的离子反应方程式__________。
(3)通过计算求出原NaOH溶液的物质的量浓度_______。
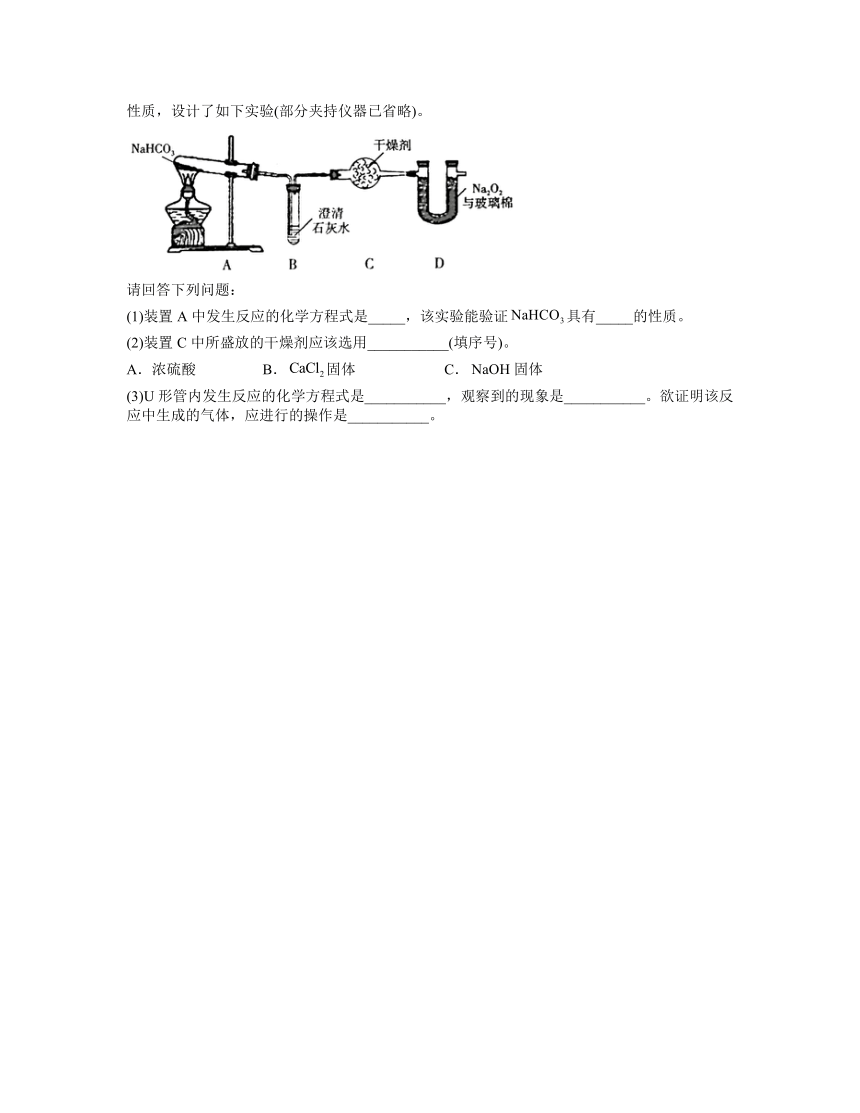
12.钠的化合物在生活、生产中有重要应用。化学兴趣小组的同学们为探究与的性质,设计了如下实验(部分夹持仪器已省略)。
请回答下列问题:
(1)装置A中发生反应的化学方程式是_____,该实验能验证具有_____的性质。
(2)装置C中所盛放的干燥剂应该选用___________(填序号)。
A.浓硫酸 B.固体 C.固体
(3)U形管内发生反应的化学方程式是___________,观察到的现象是___________。欲证明该反应中生成的气体,应进行的操作是___________。
【参考答案】
一、选择题
1.C
解析:A.钠很软,用小刀就可以切开,所以钠的硬度很小,A错误;
B.将金属钠放在石棉网上用酒精灯加热后,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体过氧化钠,B错误;
C.金属钠在空气中燃烧,生成过氧化钠,C正确;
D.焰色试验是金属元素的物理性质,D错误;
故选:C。
2.C
解析:A. 海上的空气中含有水分,属于胶体,故海市蜃楼与胶体知识有关,A正确;
B.硝石(KNO3)进行焰色试验时, 火焰呈紫色,故“以火烧之,紫青烟起,乃真硝石也”是利用了“焰色反应”,B正确;
C. “大漠孤烟直”中的“烟”是固体小颗粒引起的,“发烟”硝酸中的“烟”是硝酸小液滴引起的,二者成分不同,C不正确;
D.《本草纲目》中记载的 “石碱”,是从草木灰中提取所得,故此处的“石碱”是指K2CO3,D正确;
答案选C。
3.C
解析:A.氧化钠能与氧气反应、但不和碳酸氢钠反应;过氧化钠不和氧气反应、不和碳酸氢钠反应,不符合图示,A项错误;
B.镁能与盐酸反应、不与氢氧化钠不反应,氯化铜和盐酸不反应、和氢氧化钠反应生成氢氧化铜沉淀,不符合图示,B项错误;
C.氢氧化钙能与二氧化碳反应、和硫酸铜反应生成氢氧化铜沉淀,氢氧化钠与二氧化碳反应、与硫酸铜反应生成氢氧化铜沉淀,符合图示,C项正确;
D.碳酸钠能与氯化钡反应、与氢氧化钙反应,盐酸不能与氯化钡反应、能和氢氧化钙反应,不符合图示,D项错误;
故选C。
4.B
解析:A. 酒精灯失火用湿抹布灭火,故A正确;
B. 不可用手直接取用金属钠,应用镊子取用,故B错误;
C. CO燃烧生成二氧化碳,则可用点燃的方法处理CO尾气,故C正确;
D. 、等固体不能随便丢弃,应放到指定容器中,故D正确;
故选B。
5.C
解析:A. 钠可用小刀切割,硬度小,故A错误;
B. 钠放置在空气中,被缓慢氧化生成白色的Na2O,故B错误;
C. 盐酸中氢离子浓度比水中氢离子浓度大的多,故钠在盐酸中反应要比在蒸馏水中反应剧烈,故C正确;
D. Na能与H2O反应,故钠着火时只能用细沙盖灭,故D错误;
故选C。
6.C
【分析】钠的密度大于煤油,故钠在煤油底部,与硫酸亚铁溶液接触并发生反应,生成氢氧化亚铁、硫酸钠和氢气,反应的现象为溶液中有气泡生成,下层溶液出现白色絮状沉淀,据此分析。
解析:A.钠性质活泼,易与水、空气反应而引起火灾,故剩余的钠不能随意丢弃,应放回原试剂瓶,A正确;
B.钠与水反应生成和,与溶液反应生成白色絮状沉淀,B正确;
C.由于生成,反应一段时间后,大试管内液面下降,长颈漏斗中液面上升,C错误;
D.钠与水反应生成氢氧化钠,氢氧化钠与硫酸亚铁反应,生成氢氧化亚铁沉淀,反应的化学方程式为:,D正确;
故本题选C。
7.B
解析:A.钠与水会发生反应生成氢氧化钠和可燃性的氢气,所以钠着火时不能用水扑灭,A正确;
B.钠与氧气在加热条件下反应会生成过氧化钠,B错误;
C.钠在空气中长期放置,先与氧气反应生成氧化钠,氧化钠与水蒸气反应生成氢氧化钠,氢氧化钠易潮解,潮解的氢氧化钠会吸收空气中的二氧化碳最终变成碳酸钠,C正确;
D.钠为活泼金属,其密度比水小,比煤油大,D正确;
故选B。
8.D
解析:A.浓盐酸与铁屑反应:,A错误;
B.钠与水反应:,B错误;
C.NH4HCO3与足量烧碱反应:,C错误;
D.Na2CO3与足量盐酸反应:,D正确;
故选D。
二、非选择题
9. 化合 CO+2H+=H2O+CO2↑ HCO+H+=CO2↑+H2O
【分析】根据各组物质的组成设定分类标准进行分类;根据氧化还原反应的特征存在元素化合价变化判断;根据离子方程式的书写原则书写发生反应的离子方程式。
解析:(1)①中CO2是非金属氧化物,其他都是金属氧化物;②中H2O不是酸,其他都是酸;③中Na2CO3是盐,其他都是碱,故这三种物质分别是CO2、H2O、Na2CO3;故答案为:CO2、H2O、Na2CO3;
(2)生成NaHCO3的化学反应为Na2CO3+CO2+H2O=2NaHCO3,属于化合反应,故答案为:化合;
(3)Na2CO3是可溶性盐,硫酸是强酸,则Na2CO3与足量稀硫酸反应的离子方程式为CO+2H+=H2O+CO2↑,故答案为:CO+2H+=H2O+CO2↑;
(4)HCO是弱酸的酸式酸根,能与H+反应,其离子方程式为HCO+H+=CO2↑+H2O,故答案为:HCO+H+=CO2↑+H2O。
10. D D 2Na+O2Na2O2 淡黄色 2Na2O2+2H2O=4Na++4OH-+O2↑ 用带火星的木条放在试管口,看是否复燃
【分析】(1)结合钠的性质判断钠的保存方法;
(2)Na的性质活泼,易与空气中的氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3 xH2O,Na2CO3 xH2O风化脱水生成Na2CO3;
(3)钠在氧气中加热生成淡黄色固体过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,氧气具有助燃性,故检验方法为:用带火星的木条放在试管口,看是否复燃,若木条复燃,则说明生成了氧气。
解析:(1)钠的化学性质活泼,应密封保存,密度比水小,比煤油大,故应保存在煤油中;
故答案为D;
(2)Na的性质活泼,易与空气中的氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3 xH2O,Na2CO3 xH2O风化脱水生成Na2CO3;
故答案为D;
(3)钠在氧气中加热生成淡黄色固体过氧化钠,反应方程式为:2Na+O2Na2O2,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;氧气具有助燃性,故检验方法为:用带火星的木条放在试管口,看是否复燃,若木条复燃,则说明生成了氧气;
故答案为2Na+O2Na2O2;淡黄色;2Na2O2+2H2O=4Na++4OH-+O2↑;用带火星的木条放在试管口,看是否复燃。
【点睛】第(3)问书写过氧化钠与水反应的离子方程式难度不大,但是学生们仍然容易出错,就是错写成化学方程式。学生们做题时一定要认真审题,按要求作答,可以用笔进行重点圈画,提醒自己是写化学方程式还是离子方程式。
11. NaOH、Na2CO3 3:1 H++= 112 3OH-+2CO2=++H2O 0.75 mol·L-1
【分析】NaOH与CO2反应,反应后溶质可能为NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3,碳酸钠与盐酸反应分步进行,依次为:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,可见两个反应中消耗盐酸的体积相等,在曲线A中消耗盐酸体积在0~60 mL没有气体产生,当消耗的盐酸的体积在60~75 mL段消耗的盐酸的体积就是反应NaHCO3+HCl=NaCl+H2O+CO2↑消耗,根据前后体积大小可推出曲线A中含有NaOH和Na2CO3;曲线B中,0~25 mL消耗的盐酸体积小于25~75 mL消耗盐酸的体积,NaOH与CO2反应完后溶质为Na2CO3和NaHCO3,据此结合质量守恒解答。
解析:(1)根据NaOH与CO2的反应分析可知,反应后溶质可能为NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3,碳酸钠与盐酸反应分步进行,依次是:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,可知两个反应中消耗盐酸的体积相等,曲线A中加入盐酸的体积在0~60 mL时没有气体产生,消耗的盐酸的体积在60~75 mL段消耗的盐酸的体积是发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,则可推出曲线A中含有NaOH 和Na2CO3,有关反应的离子方程式为OH-+H+=H2O、+H+=、+H+=H2O+CO2↑,可根据碳酸氢钠完全生成CO2消耗盐酸的体积是V(HCl)=75 mL-60 mL=15 mL,可计算出Na2CO3转化成NaHCO3消耗盐酸的体积也是15 mL,则与NaOH发生反应OH-+H+=H2O消耗盐酸的体积V(HCl)=60 mL-15 mL=45 mL,根据n=c·V可知,物质的量浓度比等于溶液的体积比,故溶液中含有的NaOH与Na2CO3的物质的量的比n(NaOH):n(Na2CO3)=45 mL:15 mL=3:1;
(2)在曲线B中,消耗的盐酸体积0~25 mL段小于25~75 mL段,说明NaOH与CO2反应完后溶质为Na2CO3和NaHCO3,在0~25 mL时反应的离子方程式为:+H+=;当盐酸体积为75 mL时,产生CO2体积最大,在25~75 mL时发生的反应为+H+=H2O+CO2↑,n(CO2)=n(HCl)=c·V =0.1 mol/L×(75-25)×10-3 L=5×10-3 mol,即V(CO2)=5×10-3mol×22.4 L/mol=0.112 L=112 mL;
在B溶液中含有Na2CO3的物质的量n(Na2CO3)=c·V =0.1 mol/L×25×10-3 L=2.5×10-3 mol,含有NaHCO3的物质的量n(NaHCO3)=5×10-3 mol-2.5×10-3 mol=2.5×10-3 mol,所以n(Na2CO3):n(NaHCO3)=1:1,故向该NaOH溶液中通入CO2得到B溶液的离子反应方程式为:3OH-+2CO2=++H2O;
(3)无论溶质是哪种物质,当CO2恰好达到最大时,溶液中的溶质都是NaCl,根据元素守恒可知:n(NaOH)=n(HCl)=c·V =0.1 mol/L×75×10-3 =7.5×10-3 mol,则原NaOH溶液的浓度c(NaOH)==0.75 mol/L。
12.(1) 受热易分解不稳定
(2)B
(3) 淡黄色固体变为白色 用带火星的木条放到U形管支管口,带火星的木条复燃,证明生成氧气
解析:A中碳酸氢钠受热分解产生二氧化碳,通入澄清石灰水,证明产生了二氧化碳气体,干燥二氧化碳,二氧化碳与过氧化钠反应生成氧气,淡黄色固体变为白色。
(1)受热分解产生碳酸钠、二氧化碳和水,化学方程式是;该实验能验证具有受热易分解不稳定性;
(2)装置C干燥管中应盛放固体干燥剂,并且不与二氧化碳反应,故只能盛放氯化钙,故答案为:B;
(3)干燥的二氧化碳与过氧化钠发生反应,生成碳酸钠和氧气,化学方程式是;淡黄色固体变为白色,产生氧气,用带火星的木条放到U形管支管口,带火星的木条复燃,证明生成氧气
一、选择题
1.下列叙述中,正确的是
A.钠是银白色金属,硬度很大
B.将金属钠放在坩埚里用酒精灯加热,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体氧化钠
C.金属钠在空气中燃烧,生成过氧化钠
D.焰色试验是化学变化
2.传统文化中蕴含着丰富的化学知识。下列说法错误的是
A.“忽闻海上有仙山,山在虚无缥缈间”中描述的海市蜃楼现象,与胶体知识有关
B.“以火烧之,紫青烟起,乃真硝石也”这是利用“焰色反应”来鉴别硝石(KNO3)
C.“大漠孤烟直,长河落日圆”中的“烟”与“发烟”硝酸中的“烟”成份相同
D.“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面”,这是《本草纲目》中有关“石碱”的记载,此处的“石碱”是指K2CO3
3.图中相连物质间在一定条件下可以发生反应,下表提供的四组物质符合要求的是
选项 甲 乙 丙 丁
A
B Mg HCl NaOH
C NaOH
D HCl
A.A B.B C.C D.D
4.在化学实验中,具有安全和环保意识是重要的科学素养。下列做法不正确的是
A.酒精灯失火用湿抹布灭火 B.可用手直接取用金属钠
C.用点燃的方法处理CO尾气 D.、等固体不能随便丢弃
5.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列叙述中正确的是
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的Na2O
C.钠在盐酸中反应要比在蒸馏水中反应剧烈
D.金属钠着火时,可用水灭火
6.在隔绝空气的条件下让钠与溶液反应,实验时,往大试管中先加煤油,取三粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入溶液使煤油的液面至橡皮塞,并夹紧弹簧夹(如图)。下列叙述错误的是
A.剩余的钠放回原试剂瓶
B.溶液中有气泡生成,下层溶液出现白色絮状沉淀
C.大试管内和长颈漏斗内的液面都下降
D.钠与硫酸亚铁溶液反应的化学方程式为
7.下列关于金属钠性质的叙述错误的是
A.钠着火时不能用水扑灭
B.钠与氧气在加热条件下反应时,若氧气的量较少,则生成氧化钠
C.钠在空气中长期放置,最终变成碳酸钠
D.钠是金属,其密度比水的小
8.下列离子方程式正确的是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与水反应:2Na+2H+=2Na++H2↑
C.NH4HCO3与足量烧碱反应:HCO+OH﹣=CO+H2O
D.Na2CO3与足量盐酸反应:CO+2H+=CO2↑+H2O
二、非选择题
9.利用分类法研究化学物质可系统、全面认识物质的性质。下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、、、CuO
②HCl、、、
③NaOH、、KOH、
(1)三种物质依次是填化学式:①______;②______;③______。
(2)这三种物质相互作用可生成一种新物质,该反应是________反应。填四大基本反应类型。
(3)写出与足量稀硫酸反应的离子方程式:_____。
(4)NaHCO3与HCl在溶液能发生化学反应,试用离子方程式说明:_____。
10.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是___。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是___。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式___,生成物的颜色为___。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为___,检验该反应产生的气体的方法是___。
11.取等物质的量浓度的NaOH溶液两份A和B,每份100 mL。向其中各通入一定量的CO2,然后各取溶液10 mL,分别向稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸。标准状况下,产生CO2气体体积与所加盐酸体积之间的关系如图所示。回答下列问题:
(1)曲线A表明原溶液中通入CO2后,所得溶液中的溶质为________(写化学式),其物质的量之比为________。
(2)B曲线当耗盐酸0<V(HCl)<25 mL时发生的离子反应为:_______。加盐酸后,产生CO2体积的最大值为_______mL(不考虑CO2的溶解)。写出向该NaOH溶液中通入CO2得到B溶液的离子反应方程式__________。
(3)通过计算求出原NaOH溶液的物质的量浓度_______。
12.钠的化合物在生活、生产中有重要应用。化学兴趣小组的同学们为探究与的性质,设计了如下实验(部分夹持仪器已省略)。
请回答下列问题:
(1)装置A中发生反应的化学方程式是_____,该实验能验证具有_____的性质。
(2)装置C中所盛放的干燥剂应该选用___________(填序号)。
A.浓硫酸 B.固体 C.固体
(3)U形管内发生反应的化学方程式是___________,观察到的现象是___________。欲证明该反应中生成的气体,应进行的操作是___________。
【参考答案】
一、选择题
1.C
解析:A.钠很软,用小刀就可以切开,所以钠的硬度很小,A错误;
B.将金属钠放在石棉网上用酒精灯加热后,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体过氧化钠,B错误;
C.金属钠在空气中燃烧,生成过氧化钠,C正确;
D.焰色试验是金属元素的物理性质,D错误;
故选:C。
2.C
解析:A. 海上的空气中含有水分,属于胶体,故海市蜃楼与胶体知识有关,A正确;
B.硝石(KNO3)进行焰色试验时, 火焰呈紫色,故“以火烧之,紫青烟起,乃真硝石也”是利用了“焰色反应”,B正确;
C. “大漠孤烟直”中的“烟”是固体小颗粒引起的,“发烟”硝酸中的“烟”是硝酸小液滴引起的,二者成分不同,C不正确;
D.《本草纲目》中记载的 “石碱”,是从草木灰中提取所得,故此处的“石碱”是指K2CO3,D正确;
答案选C。
3.C
解析:A.氧化钠能与氧气反应、但不和碳酸氢钠反应;过氧化钠不和氧气反应、不和碳酸氢钠反应,不符合图示,A项错误;
B.镁能与盐酸反应、不与氢氧化钠不反应,氯化铜和盐酸不反应、和氢氧化钠反应生成氢氧化铜沉淀,不符合图示,B项错误;
C.氢氧化钙能与二氧化碳反应、和硫酸铜反应生成氢氧化铜沉淀,氢氧化钠与二氧化碳反应、与硫酸铜反应生成氢氧化铜沉淀,符合图示,C项正确;
D.碳酸钠能与氯化钡反应、与氢氧化钙反应,盐酸不能与氯化钡反应、能和氢氧化钙反应,不符合图示,D项错误;
故选C。
4.B
解析:A. 酒精灯失火用湿抹布灭火,故A正确;
B. 不可用手直接取用金属钠,应用镊子取用,故B错误;
C. CO燃烧生成二氧化碳,则可用点燃的方法处理CO尾气,故C正确;
D. 、等固体不能随便丢弃,应放到指定容器中,故D正确;
故选B。
5.C
解析:A. 钠可用小刀切割,硬度小,故A错误;
B. 钠放置在空气中,被缓慢氧化生成白色的Na2O,故B错误;
C. 盐酸中氢离子浓度比水中氢离子浓度大的多,故钠在盐酸中反应要比在蒸馏水中反应剧烈,故C正确;
D. Na能与H2O反应,故钠着火时只能用细沙盖灭,故D错误;
故选C。
6.C
【分析】钠的密度大于煤油,故钠在煤油底部,与硫酸亚铁溶液接触并发生反应,生成氢氧化亚铁、硫酸钠和氢气,反应的现象为溶液中有气泡生成,下层溶液出现白色絮状沉淀,据此分析。
解析:A.钠性质活泼,易与水、空气反应而引起火灾,故剩余的钠不能随意丢弃,应放回原试剂瓶,A正确;
B.钠与水反应生成和,与溶液反应生成白色絮状沉淀,B正确;
C.由于生成,反应一段时间后,大试管内液面下降,长颈漏斗中液面上升,C错误;
D.钠与水反应生成氢氧化钠,氢氧化钠与硫酸亚铁反应,生成氢氧化亚铁沉淀,反应的化学方程式为:,D正确;
故本题选C。
7.B
解析:A.钠与水会发生反应生成氢氧化钠和可燃性的氢气,所以钠着火时不能用水扑灭,A正确;
B.钠与氧气在加热条件下反应会生成过氧化钠,B错误;
C.钠在空气中长期放置,先与氧气反应生成氧化钠,氧化钠与水蒸气反应生成氢氧化钠,氢氧化钠易潮解,潮解的氢氧化钠会吸收空气中的二氧化碳最终变成碳酸钠,C正确;
D.钠为活泼金属,其密度比水小,比煤油大,D正确;
故选B。
8.D
解析:A.浓盐酸与铁屑反应:,A错误;
B.钠与水反应:,B错误;
C.NH4HCO3与足量烧碱反应:,C错误;
D.Na2CO3与足量盐酸反应:,D正确;
故选D。
二、非选择题
9. 化合 CO+2H+=H2O+CO2↑ HCO+H+=CO2↑+H2O
【分析】根据各组物质的组成设定分类标准进行分类;根据氧化还原反应的特征存在元素化合价变化判断;根据离子方程式的书写原则书写发生反应的离子方程式。
解析:(1)①中CO2是非金属氧化物,其他都是金属氧化物;②中H2O不是酸,其他都是酸;③中Na2CO3是盐,其他都是碱,故这三种物质分别是CO2、H2O、Na2CO3;故答案为:CO2、H2O、Na2CO3;
(2)生成NaHCO3的化学反应为Na2CO3+CO2+H2O=2NaHCO3,属于化合反应,故答案为:化合;
(3)Na2CO3是可溶性盐,硫酸是强酸,则Na2CO3与足量稀硫酸反应的离子方程式为CO+2H+=H2O+CO2↑,故答案为:CO+2H+=H2O+CO2↑;
(4)HCO是弱酸的酸式酸根,能与H+反应,其离子方程式为HCO+H+=CO2↑+H2O,故答案为:HCO+H+=CO2↑+H2O。
10. D D 2Na+O2Na2O2 淡黄色 2Na2O2+2H2O=4Na++4OH-+O2↑ 用带火星的木条放在试管口,看是否复燃
【分析】(1)结合钠的性质判断钠的保存方法;
(2)Na的性质活泼,易与空气中的氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3 xH2O,Na2CO3 xH2O风化脱水生成Na2CO3;
(3)钠在氧气中加热生成淡黄色固体过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,氧气具有助燃性,故检验方法为:用带火星的木条放在试管口,看是否复燃,若木条复燃,则说明生成了氧气。
解析:(1)钠的化学性质活泼,应密封保存,密度比水小,比煤油大,故应保存在煤油中;
故答案为D;
(2)Na的性质活泼,易与空气中的氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3 xH2O,Na2CO3 xH2O风化脱水生成Na2CO3;
故答案为D;
(3)钠在氧气中加热生成淡黄色固体过氧化钠,反应方程式为:2Na+O2Na2O2,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;氧气具有助燃性,故检验方法为:用带火星的木条放在试管口,看是否复燃,若木条复燃,则说明生成了氧气;
故答案为2Na+O2Na2O2;淡黄色;2Na2O2+2H2O=4Na++4OH-+O2↑;用带火星的木条放在试管口,看是否复燃。
【点睛】第(3)问书写过氧化钠与水反应的离子方程式难度不大,但是学生们仍然容易出错,就是错写成化学方程式。学生们做题时一定要认真审题,按要求作答,可以用笔进行重点圈画,提醒自己是写化学方程式还是离子方程式。
11. NaOH、Na2CO3 3:1 H++= 112 3OH-+2CO2=++H2O 0.75 mol·L-1
【分析】NaOH与CO2反应,反应后溶质可能为NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3,碳酸钠与盐酸反应分步进行,依次为:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,可见两个反应中消耗盐酸的体积相等,在曲线A中消耗盐酸体积在0~60 mL没有气体产生,当消耗的盐酸的体积在60~75 mL段消耗的盐酸的体积就是反应NaHCO3+HCl=NaCl+H2O+CO2↑消耗,根据前后体积大小可推出曲线A中含有NaOH和Na2CO3;曲线B中,0~25 mL消耗的盐酸体积小于25~75 mL消耗盐酸的体积,NaOH与CO2反应完后溶质为Na2CO3和NaHCO3,据此结合质量守恒解答。
解析:(1)根据NaOH与CO2的反应分析可知,反应后溶质可能为NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3,碳酸钠与盐酸反应分步进行,依次是:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,可知两个反应中消耗盐酸的体积相等,曲线A中加入盐酸的体积在0~60 mL时没有气体产生,消耗的盐酸的体积在60~75 mL段消耗的盐酸的体积是发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,则可推出曲线A中含有NaOH 和Na2CO3,有关反应的离子方程式为OH-+H+=H2O、+H+=、+H+=H2O+CO2↑,可根据碳酸氢钠完全生成CO2消耗盐酸的体积是V(HCl)=75 mL-60 mL=15 mL,可计算出Na2CO3转化成NaHCO3消耗盐酸的体积也是15 mL,则与NaOH发生反应OH-+H+=H2O消耗盐酸的体积V(HCl)=60 mL-15 mL=45 mL,根据n=c·V可知,物质的量浓度比等于溶液的体积比,故溶液中含有的NaOH与Na2CO3的物质的量的比n(NaOH):n(Na2CO3)=45 mL:15 mL=3:1;
(2)在曲线B中,消耗的盐酸体积0~25 mL段小于25~75 mL段,说明NaOH与CO2反应完后溶质为Na2CO3和NaHCO3,在0~25 mL时反应的离子方程式为:+H+=;当盐酸体积为75 mL时,产生CO2体积最大,在25~75 mL时发生的反应为+H+=H2O+CO2↑,n(CO2)=n(HCl)=c·V =0.1 mol/L×(75-25)×10-3 L=5×10-3 mol,即V(CO2)=5×10-3mol×22.4 L/mol=0.112 L=112 mL;
在B溶液中含有Na2CO3的物质的量n(Na2CO3)=c·V =0.1 mol/L×25×10-3 L=2.5×10-3 mol,含有NaHCO3的物质的量n(NaHCO3)=5×10-3 mol-2.5×10-3 mol=2.5×10-3 mol,所以n(Na2CO3):n(NaHCO3)=1:1,故向该NaOH溶液中通入CO2得到B溶液的离子反应方程式为:3OH-+2CO2=++H2O;
(3)无论溶质是哪种物质,当CO2恰好达到最大时,溶液中的溶质都是NaCl,根据元素守恒可知:n(NaOH)=n(HCl)=c·V =0.1 mol/L×75×10-3 =7.5×10-3 mol,则原NaOH溶液的浓度c(NaOH)==0.75 mol/L。
12.(1) 受热易分解不稳定
(2)B
(3) 淡黄色固体变为白色 用带火星的木条放到U形管支管口,带火星的木条复燃,证明生成氧气
解析:A中碳酸氢钠受热分解产生二氧化碳,通入澄清石灰水,证明产生了二氧化碳气体,干燥二氧化碳,二氧化碳与过氧化钠反应生成氧气,淡黄色固体变为白色。
(1)受热分解产生碳酸钠、二氧化碳和水,化学方程式是;该实验能验证具有受热易分解不稳定性;
(2)装置C干燥管中应盛放固体干燥剂,并且不与二氧化碳反应,故只能盛放氯化钙,故答案为:B;
(3)干燥的二氧化碳与过氧化钠发生反应,生成碳酸钠和氧气,化学方程式是;淡黄色固体变为白色,产生氧气,用带火星的木条放到U形管支管口,带火星的木条复燃,证明生成氧气
