化学九年级下人教版9.3溶液的浓度课件(31张ppt)
文档属性
| 名称 | 化学九年级下人教版9.3溶液的浓度课件(31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 818.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-03-27 17:42:20 | ||
图片预览









文档简介
课件31张PPT。第九单元 溶液课题3 溶液的浓度一溶质的质量分数
【实验探究1】分别在1号、2号、3号试管中加
入 0.5g、1g、1.5g固体硫酸铜, 再分别倒入
10mL水,振荡、溶解后,比较3种硫酸铜溶液
的颜色。
实验现象:1号试管中溶液颜色最浅;2号次之;
3号试管中的溶液颜色最深。
实验结论:溶液颜色越深、溶液越浓。【实验探究2】将刚才配好的硫酸铜溶液,取一支溶
液倒入2支空试管中往,其中一支加入水,振荡,观察颜
色。
实验现象:颜色明显变浅。
实验结论:影响溶液浓度的因素还有溶剂的质量。综上所述:
溶质质量、溶剂质量都会影响溶液的浓
度。今天的粥稠了,是潜意识和昨天的粥比、米多了;
今天的粥稀了,是潜意识和昨天的粥比、米少了。
张家认为的稠粥在李家可能就是稀粥。
怎样才能比出千家万户的粥,到底谁家的粥稠了、稀了?
取相同质量的粥,考察米的多少,便可知道谁家的粥
稠稀。或者说:溶液的浓、稀在数学上是这样表
达的:溶质质量溶液质量一 溶质的质量分数
定义:溶质的质量与溶液的质量之比
表达式:溶质的质量分数=
溶质质量 = 溶液质量×溶质的质量分数
溶液质量 = 溶剂质量 + 溶质质量
= 溶质质量÷溶质质量分数
= 溶液体积 × 溶液密度溶质质量溶液质量×100% 其单位为“1”。1.溶液的分类
(1)从能否继续溶解某种溶质把溶液分为:饱和溶液;不饱
和溶液。
(2)从溶质与溶剂的质量比把溶液分为:浓溶液;稀溶液。
2. 饱和溶液、不饱和溶液与“浓”“稀”溶液的关系饱和溶液、不饱和溶液与浓溶液、稀溶液
之间的关系结论:饱和溶液不一定是浓溶液,
稀溶液不一定是不饱和溶液浓溶液浓溶液稀溶液稀溶液如20 / ℃时,100g水中溶解20gNaCl,可
谓浓但没有饱和;
20 / ℃时,100g水中溶解0.153gCa(OH)2,
可谓稀但饱和.×100% = 13% 0.5g 0.5g + 10g×100% = 4.8 %三 溶液的计算
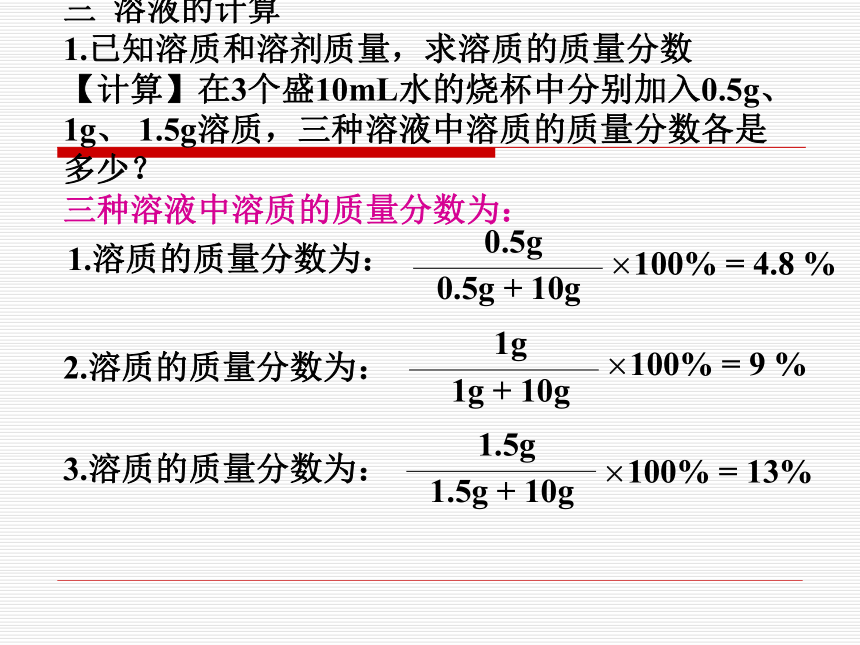
1.已知溶质和溶剂质量,求溶质的质量分数
【计算】在3个盛10mL水的烧杯中分别加入0.5g、
1g、 1.5g溶质,三种溶液中溶质的质量分数各是
多少?
三种溶液中溶质的质量分数为:
1.溶质的质量分数为:
1g 1g + 10g×100% = 9 %2.溶质的质量分数为: 1.5g 1.5g + 10g3.溶质的质量分数为: 【活动与探究】同学完成下表:(水的密度=1g·cm-1)结论:
1.氯化钠溶液是无色的、无法通过观察其颜色确定溶
液的 浓稀。
2.可以通过计算溶质的质量分数比较各溶液浓度的
大小。10 %20 %2.已知溶液质量和溶质的质量分数,求溶质和溶剂的
质 量 溶质质量 = 溶液质量×溶质的质量分数
例1.在农业生产上,常需要用质量分数为16%的氯化
钠 溶液来选种。现要配制150kg的这种溶液,需要
氯化钠和水的质量各是多少?
解:含溶质NaCl = 150kg×16% = 24kg
含溶剂水 = 溶液质量 — 溶质质量
= 150kg— 24kg
=126kg
答:-----------。例2.用A、B两个烧杯各取90g溶质的质量分数为10%
的硝酸钾溶液,再A向烧杯中加入10g硝酸钾,向B
烧杯中加入10g水,并用玻璃棒搅拌至全部溶解。求:
1.原溶液中溶质的质量、溶剂的质量各是多少?
2.向原溶液中增加10g硝酸钾(全部溶解)或增加
10g水后,溶液中溶质质量、溶剂质量、溶液质量各
是多少?
3.上述形成的两种溶液中溶质的质量分数各是多少?解: 1.原溶液中含硝酸钾:90g×10%=9g
含水:90g-9g=81g含硝酸钾:9; 含水:81g含硝酸钾:9g
含水:81gA含硝酸钾:9g
含水:81gB10g硝酸钾10g水2. ①增加10g硝酸钾后:A烧杯中
溶质质量 = 9g + 10g = 19g
溶剂质量=81g(不变)
溶液质量 = 19g+81g=100g
或90g+10g=100g ③④②加入10g水后:B烧杯中
溶质质量=9g(不变)
溶剂质量 = 81g + 10g =91g
溶液质量 = 9g + 91g = 100g
或90g + 10g=100g 3. ①增加10g硝酸钾后,A烧杯中: 19g100g×100% = 19 %溶质的质量分数 ②增加10g水后,B烧杯中: 9g100g×100% = 9 %溶质的质量分数 终上所述:
增加 ;
增加 。溶质质量则溶质和溶液质量同时
增加,溶液中溶质质量分数升高溶剂质量则溶剂和溶液质量同时
增加,溶液中溶质质量分数降低三、配制溶液的一般步骤
例3. 配制50g质量分数为5%的NaCl溶液,需NaCl
和H2O各多少克?
解:1.计算;需NaCl:50g×5%=2.5g
需H2O:50g -2.5g=47.5g2.称量;3.溶解;4.装瓶、贴签配制溶液需要的仪器:托盘天平、药匙、量筒、 胶头
滴管、烧杯、玻 璃棒、试剂瓶。2.用氯化钠固体配制50g质量分数为5%的氯化钠溶
液,下列仪器中需要用到的是( ) A. ②④⑥⑦ B. ①④⑤⑥ C. ①③⑤⑦ D. ①③④⑥B3.用氯化钠配制100g溶质质量分数为20%的氯化钠溶
液,现有下列操作①溶解;②称取氯化钠;③过滤;
④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是
( )
A. ①②③④ B. ⑤②④①
C. ①③⑤②④① D. ①③⑥⑤②④B 4.在40g溶质质量分数为15%的硝酸钾不饱和溶液中,
加入10g硝酸钾或10g水,计算所得溶液中溶质的质
量分数。 40g×15%40g×100% = 32 %解:加入10gKNO3 后,溶质的质量分数: 40g×15% 40g×100% = 12 %加入10gH2O后,溶质的质量分数: 答:---------。+ 10g+ 10g+ 10g 第二课时 溶质质量分数的计算
将1g食盐放入烧杯中,再加入9mL水,用玻璃棒搅
拌至溶解。再向上述烧杯中加入10mL水、搅拌(水
的密度1g·cm-3)求:1.试分别写出稀释前后溶质质
量、溶液质量、溶质质量分数。2.分析各量的变化
情况。稀释前溶质质量是1g、
溶液质量是10g、
溶质质量分数是10%稀释后溶质质量是1g、
溶液质量是20g、
溶质质量分数是5%答:1. 稀释前 稀释后2.稀释后溶液质量增加,溶质质量不变,溶质质量分数
减小.稀释前溶质的质量=稀释后溶质的质量 结论:溶质的质量分数减小一半,
加水的质量和对应溶液的质量一样多一 溶液稀释和配制问题的计算
家里做稀饭稠了,变稀的方法是加水,但加水前后稀饭中米粒
数不变.即:稀释前溶质的质量=稀释后溶质的质量 例1.化学实验室现有98%的浓硫酸,在实验中常需要用较稀的硫
酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为
20%的硫酸溶液,需要多少克水?
解1:设需加水的质量为x
答:--------。20%50g98%(50 + x) x=195g=××解2:设稀释后溶液的质量为y
59g×98% = 20%·y
y=245g
需水:245g—50g=195g例2.某工厂化验室配制5000g 20%的盐酸,需38%的
盐酸 多少毫升(密度为1.19g·mL—1)
分析:溶质的质量分数是质量比,不能把体积直接
代入公式计算。涉及到体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分
数
解:设需38%的盐酸体积为x
答:---------。5000g20%=×1.19 g · mL—1 · x · 38%x = 2211mL13g x二 溶质的质量分数应用于化学方程式的计算
例3.100g某硫酸溶液恰好与13g锌完全反应。
试计算这种硫酸中溶质的质量分数。
解:设100g硫酸溶液中溶质质量为x
Zn + H2SO4 = ZnSO4 + H2↑
65 98 x= 19.6g 13g x65 98溶质的质量分数= 100g19.6g ×100% = 19.6% 答:------。【课堂练习】1.把200g 20%食盐水溶液稀释成10%
的溶液需加水 多少克?
2.把30g质量分数为20%的氢氧化钠溶液加水稀释
到100g此溶液中氢氧化钠的质量分数为多少?200g (200g +x) = x=200g20%10%××解:设--------x答:--------30g×20%100g×100%=6%解:--------答:--------3.实验室要配制50g溶质质量分数为20%的硝酸钾溶液。
现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质
质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和
蒸馏水,请选用上述药品,设计配制方案填入下表:
解:
(1)50g、20%的KNO3溶液中含KNO3:50×20%=10g
含H2O:50g-10g=40g
(2) 20g、15%的KNO3溶液中含KNO3:20g×15%=3g
含H2O:20g-3g=17g
在20g、15%的溶液中,再加KNO3 :10g-3g=7g
再加H2O: 40g-17g=23g
(3)设在25g、40%的KNO3溶液加水的质量为x时,配成
50g、20%的KNO3溶液。25g(25g+x)40%×20%×x=25g=10g硝酸钾和40g水20g溶质质量分数为15%的硝酸钾溶液、7g硝酸钾和23g水25g溶质质量分数40%的硝酸钾溶液
和25g水【基础训练】1.某温度下,蒸干35g氯化钾溶液,得
到 10g,求该溶液中溶质的质量分数。
解:该溶液中溶质的质量分数:35g10g×100%=28.6%答:-------。2.把100g质量分数为98%的硫酸稀释成10%的稀硫
酸,需要水的质量是多少?
解:设-------x
答:------。100g (100g +x) = x=880g98%10%××3.某工厂化验室配制5000g 20%的盐酸,需要38%的
盐酸(密度为1.19g/mL)的体积是多少?
解:设------x
答:-------。4.配制500mL质量分数为10%的氢氧化钠溶液(密度
为1.1 ),需要氢氧化钠和水的质量各是多少?
解:含NaOH:500mL×1.1 ×10%=55g
含H2O:500mL×1.1 -55g = 495g
答:-------。5000g×20%x · 1.19 g/mL ×38%x=2211mL=5.100g某硫酸恰好与13g锌完全起反应。试计算这种
硫酸中溶质的质量分数。
解:设--------x
Zn + H2SO4 = ZnSO4 + H2
65 98
13g x
硫酸溶液的质量分数:
答:--------。65 9813g xx=19.6g100g19.6g×100%=19.6%6. 50g质量分数为38%的盐酸与足量大理石反应,生
成二氧化碳的质量是多少?这些二氧化碳的体积(
标准状况)是多少?(在标准状况下,二氧化碳的
密度为1.977g/L)
解:设---------x
CaCO3 + 2HCl = CaCl2 + H2O + CO2
73 44
50g×38% x73 4450g×38% xx=11.45g11.45g1.977g/L二氧化碳的体积:=5.8L答:--------。7.某食品加工厂生产的酱油中氯化钠的质量
分数为15%~18%,该厂日产酱油15t试。
计算该厂每月(按30天计)消耗氯化钠的
质量。
解:
67.5t ~ 81t
答:-----。15t15%30××15t18%30××~8.某注射用药液的配制方法如下:
(1)把1.0g药品溶于水制成4.0mL溶液a;
(2)取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
(3)取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
(4)取0.2mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中,药液很稀,其密度近似看作
。试求:
(1)最终得到的药液(溶液d)中溶质的质量分数;
(2)1.0g该药品可配制溶液d的体积是多少?
解:(1)
(2)
答:----------------。0.25×××100%=0.05%1÷0.05%g配制溶液d的体积是=1g/mL=2000mL×9.在20 ℃时,要提纯50g含有少量泥沙的粗盐,最
好用多少水来溶解粗盐?10.现欲配制10%的NaCl溶液100g,试简述配置过程。
学生讨论完成。100g36g=x50gx=139mL解:------------x答:-------------。【能力提高】将一瓶80g 溶质质量分数为10%的NaCl
溶液平均分为2等份,每份溶液中溶质的质量分数
为 ;若将其中的一份溶液中溶质的质量分数减小一
半,应加水 g,
若将另一份溶液中溶质的质量分数增大一倍,应加
入NaCl g。10%40x=5g 40g×10%40=20%解析:设加入的溶质质量为x,则由题意可得: 5+x+x配制10%的氯化钠溶液时,不会引起溶液中氯化钠的质量分数偏小的是( )
A.用量筒量取水时仰视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.氯化钠晶体不纯
D.转移已配好的溶液时,有少量溶液溅出 D
【实验探究1】分别在1号、2号、3号试管中加
入 0.5g、1g、1.5g固体硫酸铜, 再分别倒入
10mL水,振荡、溶解后,比较3种硫酸铜溶液
的颜色。
实验现象:1号试管中溶液颜色最浅;2号次之;
3号试管中的溶液颜色最深。
实验结论:溶液颜色越深、溶液越浓。【实验探究2】将刚才配好的硫酸铜溶液,取一支溶
液倒入2支空试管中往,其中一支加入水,振荡,观察颜
色。
实验现象:颜色明显变浅。
实验结论:影响溶液浓度的因素还有溶剂的质量。综上所述:
溶质质量、溶剂质量都会影响溶液的浓
度。今天的粥稠了,是潜意识和昨天的粥比、米多了;
今天的粥稀了,是潜意识和昨天的粥比、米少了。
张家认为的稠粥在李家可能就是稀粥。
怎样才能比出千家万户的粥,到底谁家的粥稠了、稀了?
取相同质量的粥,考察米的多少,便可知道谁家的粥
稠稀。或者说:溶液的浓、稀在数学上是这样表
达的:溶质质量溶液质量一 溶质的质量分数
定义:溶质的质量与溶液的质量之比
表达式:溶质的质量分数=
溶质质量 = 溶液质量×溶质的质量分数
溶液质量 = 溶剂质量 + 溶质质量
= 溶质质量÷溶质质量分数
= 溶液体积 × 溶液密度溶质质量溶液质量×100% 其单位为“1”。1.溶液的分类
(1)从能否继续溶解某种溶质把溶液分为:饱和溶液;不饱
和溶液。
(2)从溶质与溶剂的质量比把溶液分为:浓溶液;稀溶液。
2. 饱和溶液、不饱和溶液与“浓”“稀”溶液的关系饱和溶液、不饱和溶液与浓溶液、稀溶液
之间的关系结论:饱和溶液不一定是浓溶液,
稀溶液不一定是不饱和溶液浓溶液浓溶液稀溶液稀溶液如20 / ℃时,100g水中溶解20gNaCl,可
谓浓但没有饱和;
20 / ℃时,100g水中溶解0.153gCa(OH)2,
可谓稀但饱和.×100% = 13% 0.5g 0.5g + 10g×100% = 4.8 %三 溶液的计算
1.已知溶质和溶剂质量,求溶质的质量分数
【计算】在3个盛10mL水的烧杯中分别加入0.5g、
1g、 1.5g溶质,三种溶液中溶质的质量分数各是
多少?
三种溶液中溶质的质量分数为:
1.溶质的质量分数为:
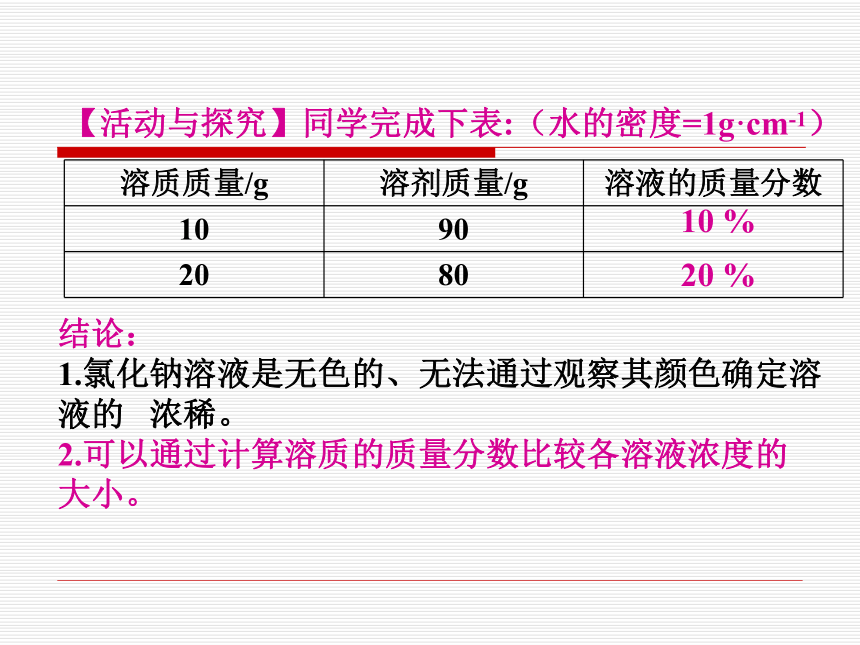
1g 1g + 10g×100% = 9 %2.溶质的质量分数为: 1.5g 1.5g + 10g3.溶质的质量分数为: 【活动与探究】同学完成下表:(水的密度=1g·cm-1)结论:
1.氯化钠溶液是无色的、无法通过观察其颜色确定溶
液的 浓稀。
2.可以通过计算溶质的质量分数比较各溶液浓度的
大小。10 %20 %2.已知溶液质量和溶质的质量分数,求溶质和溶剂的
质 量 溶质质量 = 溶液质量×溶质的质量分数
例1.在农业生产上,常需要用质量分数为16%的氯化
钠 溶液来选种。现要配制150kg的这种溶液,需要
氯化钠和水的质量各是多少?
解:含溶质NaCl = 150kg×16% = 24kg
含溶剂水 = 溶液质量 — 溶质质量
= 150kg— 24kg
=126kg
答:-----------。例2.用A、B两个烧杯各取90g溶质的质量分数为10%
的硝酸钾溶液,再A向烧杯中加入10g硝酸钾,向B
烧杯中加入10g水,并用玻璃棒搅拌至全部溶解。求:
1.原溶液中溶质的质量、溶剂的质量各是多少?
2.向原溶液中增加10g硝酸钾(全部溶解)或增加
10g水后,溶液中溶质质量、溶剂质量、溶液质量各
是多少?
3.上述形成的两种溶液中溶质的质量分数各是多少?解: 1.原溶液中含硝酸钾:90g×10%=9g
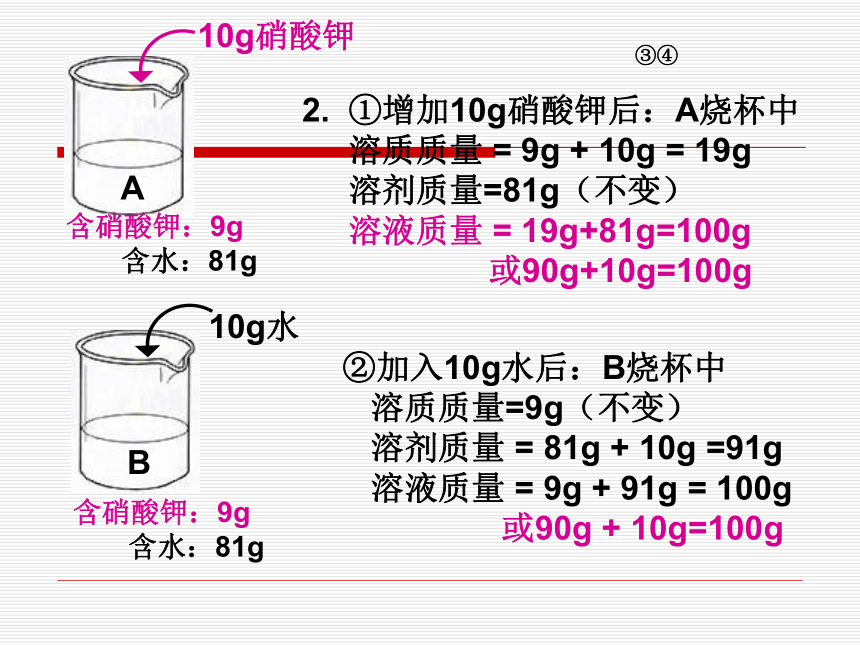
含水:90g-9g=81g含硝酸钾:9; 含水:81g含硝酸钾:9g
含水:81gA含硝酸钾:9g
含水:81gB10g硝酸钾10g水2. ①增加10g硝酸钾后:A烧杯中
溶质质量 = 9g + 10g = 19g
溶剂质量=81g(不变)
溶液质量 = 19g+81g=100g
或90g+10g=100g ③④②加入10g水后:B烧杯中
溶质质量=9g(不变)
溶剂质量 = 81g + 10g =91g
溶液质量 = 9g + 91g = 100g
或90g + 10g=100g 3. ①增加10g硝酸钾后,A烧杯中: 19g100g×100% = 19 %溶质的质量分数 ②增加10g水后,B烧杯中: 9g100g×100% = 9 %溶质的质量分数 终上所述:
增加 ;
增加 。溶质质量则溶质和溶液质量同时
增加,溶液中溶质质量分数升高溶剂质量则溶剂和溶液质量同时
增加,溶液中溶质质量分数降低三、配制溶液的一般步骤
例3. 配制50g质量分数为5%的NaCl溶液,需NaCl
和H2O各多少克?
解:1.计算;需NaCl:50g×5%=2.5g
需H2O:50g -2.5g=47.5g2.称量;3.溶解;4.装瓶、贴签配制溶液需要的仪器:托盘天平、药匙、量筒、 胶头
滴管、烧杯、玻 璃棒、试剂瓶。2.用氯化钠固体配制50g质量分数为5%的氯化钠溶
液,下列仪器中需要用到的是( ) A. ②④⑥⑦ B. ①④⑤⑥ C. ①③⑤⑦ D. ①③④⑥B3.用氯化钠配制100g溶质质量分数为20%的氯化钠溶
液,现有下列操作①溶解;②称取氯化钠;③过滤;
④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是
( )
A. ①②③④ B. ⑤②④①
C. ①③⑤②④① D. ①③⑥⑤②④B 4.在40g溶质质量分数为15%的硝酸钾不饱和溶液中,
加入10g硝酸钾或10g水,计算所得溶液中溶质的质
量分数。 40g×15%40g×100% = 32 %解:加入10gKNO3 后,溶质的质量分数: 40g×15% 40g×100% = 12 %加入10gH2O后,溶质的质量分数: 答:---------。+ 10g+ 10g+ 10g 第二课时 溶质质量分数的计算
将1g食盐放入烧杯中,再加入9mL水,用玻璃棒搅
拌至溶解。再向上述烧杯中加入10mL水、搅拌(水
的密度1g·cm-3)求:1.试分别写出稀释前后溶质质
量、溶液质量、溶质质量分数。2.分析各量的变化
情况。稀释前溶质质量是1g、
溶液质量是10g、
溶质质量分数是10%稀释后溶质质量是1g、
溶液质量是20g、
溶质质量分数是5%答:1. 稀释前 稀释后2.稀释后溶液质量增加,溶质质量不变,溶质质量分数
减小.稀释前溶质的质量=稀释后溶质的质量 结论:溶质的质量分数减小一半,
加水的质量和对应溶液的质量一样多一 溶液稀释和配制问题的计算
家里做稀饭稠了,变稀的方法是加水,但加水前后稀饭中米粒
数不变.即:稀释前溶质的质量=稀释后溶质的质量 例1.化学实验室现有98%的浓硫酸,在实验中常需要用较稀的硫
酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为
20%的硫酸溶液,需要多少克水?
解1:设需加水的质量为x
答:--------。20%50g98%(50 + x) x=195g=××解2:设稀释后溶液的质量为y
59g×98% = 20%·y
y=245g
需水:245g—50g=195g例2.某工厂化验室配制5000g 20%的盐酸,需38%的
盐酸 多少毫升(密度为1.19g·mL—1)
分析:溶质的质量分数是质量比,不能把体积直接
代入公式计算。涉及到体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分
数
解:设需38%的盐酸体积为x
答:---------。5000g20%=×1.19 g · mL—1 · x · 38%x = 2211mL13g x二 溶质的质量分数应用于化学方程式的计算
例3.100g某硫酸溶液恰好与13g锌完全反应。
试计算这种硫酸中溶质的质量分数。
解:设100g硫酸溶液中溶质质量为x
Zn + H2SO4 = ZnSO4 + H2↑
65 98 x= 19.6g 13g x65 98溶质的质量分数= 100g19.6g ×100% = 19.6% 答:------。【课堂练习】1.把200g 20%食盐水溶液稀释成10%
的溶液需加水 多少克?
2.把30g质量分数为20%的氢氧化钠溶液加水稀释
到100g此溶液中氢氧化钠的质量分数为多少?200g (200g +x) = x=200g20%10%××解:设--------x答:--------30g×20%100g×100%=6%解:--------答:--------3.实验室要配制50g溶质质量分数为20%的硝酸钾溶液。
现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质
质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和
蒸馏水,请选用上述药品,设计配制方案填入下表:
解:
(1)50g、20%的KNO3溶液中含KNO3:50×20%=10g
含H2O:50g-10g=40g
(2) 20g、15%的KNO3溶液中含KNO3:20g×15%=3g
含H2O:20g-3g=17g
在20g、15%的溶液中,再加KNO3 :10g-3g=7g
再加H2O: 40g-17g=23g
(3)设在25g、40%的KNO3溶液加水的质量为x时,配成
50g、20%的KNO3溶液。25g(25g+x)40%×20%×x=25g=10g硝酸钾和40g水20g溶质质量分数为15%的硝酸钾溶液、7g硝酸钾和23g水25g溶质质量分数40%的硝酸钾溶液
和25g水【基础训练】1.某温度下,蒸干35g氯化钾溶液,得
到 10g,求该溶液中溶质的质量分数。
解:该溶液中溶质的质量分数:35g10g×100%=28.6%答:-------。2.把100g质量分数为98%的硫酸稀释成10%的稀硫
酸,需要水的质量是多少?
解:设-------x
答:------。100g (100g +x) = x=880g98%10%××3.某工厂化验室配制5000g 20%的盐酸,需要38%的
盐酸(密度为1.19g/mL)的体积是多少?
解:设------x
答:-------。4.配制500mL质量分数为10%的氢氧化钠溶液(密度
为1.1 ),需要氢氧化钠和水的质量各是多少?
解:含NaOH:500mL×1.1 ×10%=55g
含H2O:500mL×1.1 -55g = 495g
答:-------。5000g×20%x · 1.19 g/mL ×38%x=2211mL=5.100g某硫酸恰好与13g锌完全起反应。试计算这种
硫酸中溶质的质量分数。
解:设--------x
Zn + H2SO4 = ZnSO4 + H2
65 98
13g x
硫酸溶液的质量分数:
答:--------。65 9813g xx=19.6g100g19.6g×100%=19.6%6. 50g质量分数为38%的盐酸与足量大理石反应,生
成二氧化碳的质量是多少?这些二氧化碳的体积(
标准状况)是多少?(在标准状况下,二氧化碳的
密度为1.977g/L)
解:设---------x
CaCO3 + 2HCl = CaCl2 + H2O + CO2
73 44
50g×38% x73 4450g×38% xx=11.45g11.45g1.977g/L二氧化碳的体积:=5.8L答:--------。7.某食品加工厂生产的酱油中氯化钠的质量
分数为15%~18%,该厂日产酱油15t试。
计算该厂每月(按30天计)消耗氯化钠的
质量。
解:
67.5t ~ 81t
答:-----。15t15%30××15t18%30××~8.某注射用药液的配制方法如下:
(1)把1.0g药品溶于水制成4.0mL溶液a;
(2)取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
(3)取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
(4)取0.2mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中,药液很稀,其密度近似看作
。试求:
(1)最终得到的药液(溶液d)中溶质的质量分数;
(2)1.0g该药品可配制溶液d的体积是多少?
解:(1)
(2)
答:----------------。0.25×××100%=0.05%1÷0.05%g配制溶液d的体积是=1g/mL=2000mL×9.在20 ℃时,要提纯50g含有少量泥沙的粗盐,最
好用多少水来溶解粗盐?10.现欲配制10%的NaCl溶液100g,试简述配置过程。
学生讨论完成。100g36g=x50gx=139mL解:------------x答:-------------。【能力提高】将一瓶80g 溶质质量分数为10%的NaCl
溶液平均分为2等份,每份溶液中溶质的质量分数
为 ;若将其中的一份溶液中溶质的质量分数减小一
半,应加水 g,
若将另一份溶液中溶质的质量分数增大一倍,应加
入NaCl g。10%40x=5g 40g×10%40=20%解析:设加入的溶质质量为x,则由题意可得: 5+x+x配制10%的氯化钠溶液时,不会引起溶液中氯化钠的质量分数偏小的是( )
A.用量筒量取水时仰视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.氯化钠晶体不纯
D.转移已配好的溶液时,有少量溶液溅出 D
同课章节目录
