3.1氯气及氯的化合物课堂同步练(含解析)2023-2024学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1氯气及氯的化合物课堂同步练(含解析)2023-2024学年上学期高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 149.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-12 00:00:00 | ||
图片预览



文档简介
3.1氯气及氯的化合物课堂同步练
一、单选题
1.下列各组物质相互反应,生成物不随反应条件或反应物的用量变化而变化的是( )
A.Na和 B.和Fe
C.C和 D.和NaOH
2.已知Q与R的摩尔质量之比为9∶22,在反应X+2Y=2Q+R中,当1.6 g X与Y完全反应后,生成4.4 gR,则参与反应的Y和生成的Q的质量之比为( )
A.46:9 B.32:9 C.23:9 D.16:9
3.下列关于氯气性质的描述错误的是( )
A.Fe在氯气中燃烧生成 B.能溶于水
C.有刺激性气味、有毒 D.能与氢气反应
4.已知Q与R的摩尔质量之比为9∶22,在反应X+2Y=2Q +R中,当1.6gX与一定量Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为( )
A.46∶9 B.32∶9 C.23∶9 D.16∶9
5.下列有关氯气的叙述中,不正确的是( )
A.氯气是一种黄绿色、有刺激性气味的气体
B.氯气、液氯是同一种物质
C.氯气不能溶于水
D.氯气是一种有毒的气体
6.2个 恰好能氧化5个 ,则还原产物中变价元素的化合价是( )
A.- 1 B.0 C.+1 D.+6
7.设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.Na2O2与CO2反应,生成1molO2时转移的电子数为4NA
B.0.1 mol·L-1硫酸溶液中含有的H+数为0.2NA
C.标准状况下,11.2L甲烷(CH4)含有的质子数为5NA
D.常温常压下,17g H2O2参加反应时转移电子数一定为NA
8.水是一种重要的资源,它在化学反应中担任着重要的角色,既可作为反应物又可作为生成物,如图中和水相连的物质都能和水发生反应,则有关说法正确的是( )
A.上述反应中属于氧化还原反应的有①②④⑥⑦⑧
B.①和⑦中都有氧气生成,且生成1 mol O2转移的电子数相同
C.①④⑧反应中,水都既不做氧化剂也不做还原剂
D.⑦中水做氧化剂,②中水做还原剂
9.工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
A.AlCl3 B.NaOH C.NaHCO3 D.AgNO3
10.设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA
B.常温下,22g CO2和N2O混合气体中,含有的原子数目为1.5NA
C.物质的量浓度为0.1mol L﹣1的MgCl2溶液中,含有Cl﹣个数为0.2NA
D.标准状况下,2.24LSO3中含有的氧原子数目为0.3NA
11.某汽车安全气囊装有一定质量的NaN,和CuO的混合物,汽车剧烈碰撞时,气囊中发生反应2NaN2+CuO=Na2O+3N2↑+Cu,从而使气囊充满氮气。则下列说法正确的是( )
A.NaN2与CuO均属于盐类物质
B.6.5gNaN2中含0.1mol氮原子
C.安全气囊中原料配比应为m(NaN2)/m(CuO)=2
D.每2mol NaN2发生反应,产生3mol N2
12.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 实验结论
A 向红色布条上滴加几滴新制氯水,红色布条褪色 新制氯水有漂白性
B 向FeCl3溶液中滴加维生素C溶液,溶液变为浅绿色 维生素C有氧化性
C 向某溶液中滴加AgNO3溶液,产生白色沉淀 溶液中一定含有Cl-
D 用洁净的铂丝蘸取某溶液在酒精灯外焰灼烧,火焰呈黄色 溶液中一定不含K+
A.A B.B C.C D.D
13.下列说法错误的是( )
A.漂白粉、漂粉精的有效成分均为Ca(ClO)2
B.Cl2、ClO2、O3都具有强氧化性,可作为自来水消毒剂
C.NaClO比HClO稳定,但也会缓慢分解
D.氯气是一种黄绿色气体,可用于制造有机溶剂、农药等,但氯气有毒,不可用于制药
14.向含有KI,NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr B.KCl和NaCl
C.KCl和NaBr D.KCl、NaCl和I2
15.已知Fe2+或I2能与H2O2在一定条件下发生下列反应:
Fe2+:①H2O2+2Fe2++2H+=2Fe3++2H2O;②H2O2+2Fe3+=2Fe2++2H++O2↑
I2:③H2O2+I2=2HIO;④……
下列说法错误的是( )
A.通过反应①②可知Fe2+为过氧化氢分解的催化剂
B.根据反应①可知,在该条件下,氧化性:H2O2>Fe3+
C.1molH2O2分解,转移的电子数为2NA
D.反应④为2HIO+H2O2=I2+2H2O+O2↑
16.已知反应KClO3+ 6HCl = KCl + 3Cl2↑+ 3H2O,若用K35ClO3与H37Cl作用,下列说法中正确的是( )
A.Cl2相对分子质量约为73.3 B.该反应转移电子数为6
C.KCl中只含有35Cl D.KCl中同时含有35Cl和37Cl
二、综合题
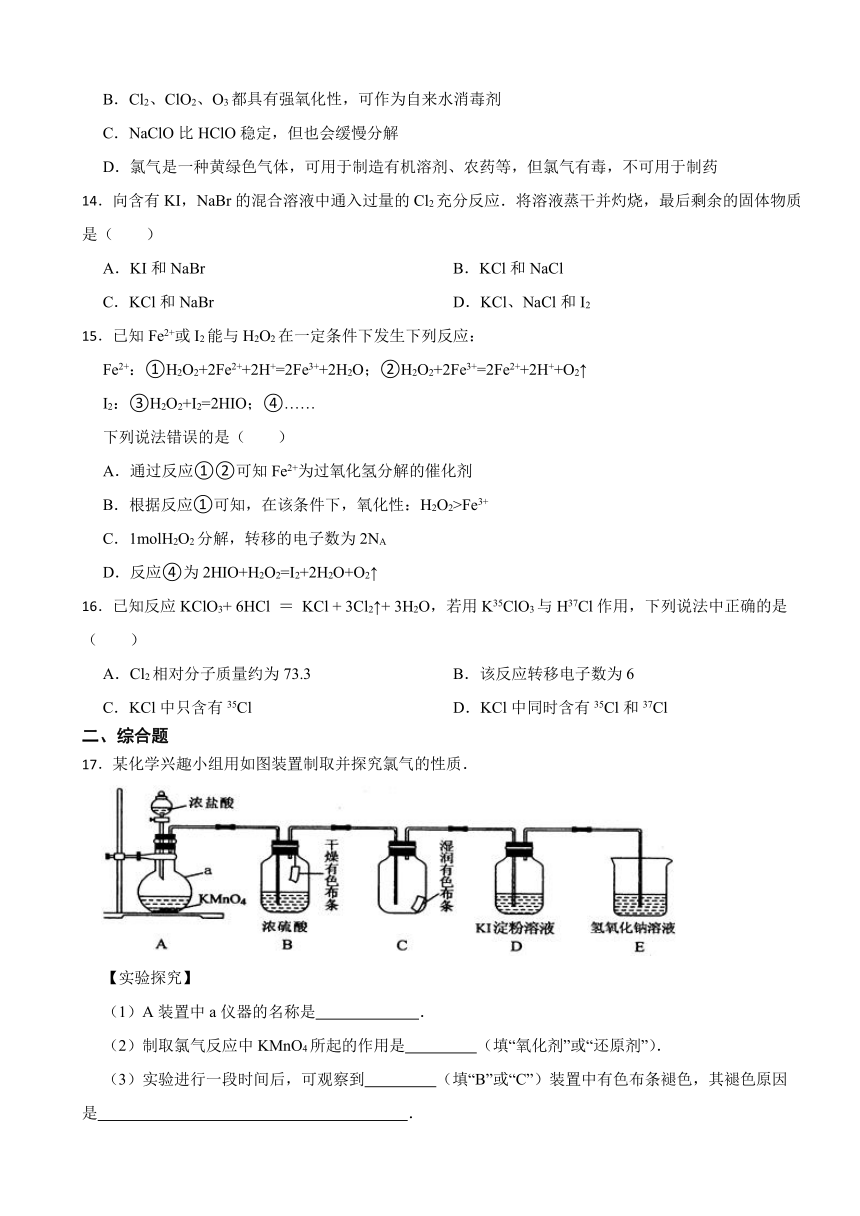
17.某化学兴趣小组用如图装置制取并探究氯气的性质.
【实验探究】
(1)A装置中a仪器的名称是 .
(2)制取氯气反应中KMnO4所起的作用是 (填“氧化剂”或“还原剂”).
(3)实验进行一段时间后,可观察到 (填“B”或“C”)装置中有色布条褪色,其褪色原因是 .
(4)当氯气进入D装置后,可观察到溶液颜色变为 (填“红色”或“蓝色”),写出相关反应的化学方程式 .
(5)E装置中NaOH溶液的作用是 .
(6)用31.6g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下 L氯气.(KMnO4的摩尔质量为158g mol﹣1)
(7)【知识拓展】
近年来,某些含氯的化合物(如ClO2、NaClO等)在生产、生活中应用广泛.
①高效净水剂ClO2中氯元素的化合价为 .
②NaClO是一种强氧化剂.某种家用洗涤剂含有NaClO,请写出NaClO在洗涤过程中的一种作用 .
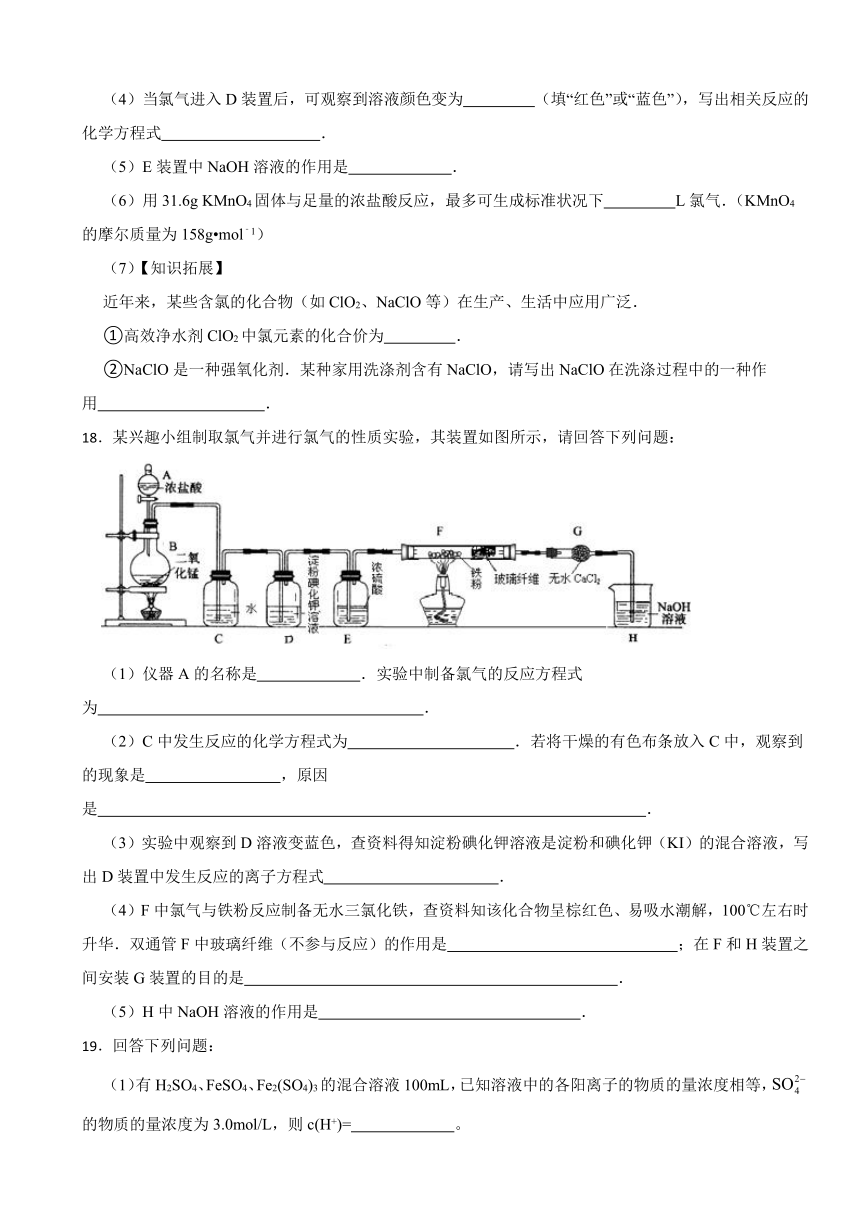
18.某兴趣小组制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:
(1)仪器A的名称是 .实验中制备氯气的反应方程式为 .
(2)C中发生反应的化学方程式为 .若将干燥的有色布条放入C中,观察到的现象是 ,原因是 .
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ;在F和H装置之间安装G装置的目的是 .
(5)H中NaOH溶液的作用是 .
19.回答下列问题:
(1)有H2SO4、FeSO4、Fe2(SO4)3的混合溶液100mL,已知溶液中的各阳离子的物质的量浓度相等,的物质的量浓度为3.0mol/L,则c(H+)= 。
(2)已知反应KClO3+6HCl(浓)=KCl+3Cl2+3H2O。
①用双线桥表示电子得失的数目与方向 。
②还原产物 ;发生氧化反应的是 。
③若有标准状况下336mL的氯气生成,则有 mol电子转移。
20.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目 :
KOCN+KOH+Cl2→CO2+N2+KCl+H2O
(3)若处理上述废水100L,使KCN完全转化为无毒物质,至少需液氯 g。
21.在稀硫酸中,KMnO4和H2O2能发生氧化还原反应.
氧化反应:H2O2﹣2e﹣═2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+═Mn2++4H2O
(1)写出该氧化还原反应的化学方程式: .
(2)反应中氧化剂是 ;被氧化元素是 ;若有0.5mol H2O2参加此反应,电子转移个数为 .
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5mol H2O2发生分解,电子转移个数为 .
答案解析部分
1.【答案】B
【解析】【解答】A.Na和在常温下反应生成氧化钠,在加热条件下反应生成过氧化钠,故不选A;
B.和Fe只在加热条件下反应生成氯化铁,故选B;
C.在氧气充足的条件下,C和反应生成二氧化碳;在氧气不足的条件下,C和反应生成一氧化碳,故不选C;
D.和少量NaOH反应生成碳酸钙沉淀,碳酸氢钠和水;和过量NaOH反应生成碳酸钙沉淀,碳酸钠和水,故不选D;
故答案为:B。
【分析】A、钠和氧气常温下生成氧化钠,加热生成过氧化钠;
B、氯气和铁反应,铁被氧化为最高价;
C、碳和过量氧气生成二氧化碳,少量氧气生成一氧化碳;
D、碳酸氢钙和少量氢氧化钠生成碳酸钙、碳酸氢钠和水,和过量氢氧化钠生成碳酸钙、碳酸钠和水。
2.【答案】D
【解析】【解答】可假设Q和R的相对分子质量分别为9a、22a,
设生成4.4gR需要Q的质量是x
X+2Y═ 2Q + R
18a 22a
x 4.4g
根据 ,解得x=3.6g,
由质量守恒可知参加反应的Y的质量为4.4g+3.6g-1.6g=6.4g,
所以参与反应的Y和生成物Q的质量之比为为6.4g:3.6g=16:9,
故答案为:D。
【分析】假设Q与R的摩尔质量分别为9a和22a,用4.4gR根据化学反应中质量守恒定律计算出Q的质量,以及Y的质量;
3.【答案】A
【解析】【解答】A.Fe在氯气中燃烧生成,A符合题意;
B.氯气能溶于水,且与水反应生成氯化氢和次氯酸,B不符合题意;
C.氯气是有刺激性气味、有毒的气体,C不符合题意;
D.氯气能与氢气反应生成氯化氢,D不符合题意;
故答案为:A。
【分析】依据氯气的性质分析,A项中氯气与金属反应生成高价态氯化物。
4.【答案】D
【解析】【解答】假设Q和R的相对分子质量分别为9a、22a,设生成4.4gR时生成Q的质量是x,
X+2Y= 2Q + R
18a 22a
x 4.4g
根据 = ,解得:x=3.6g,由质量守恒可知参加反应的Y的质量为:4.4g+3.6g-1.6g=6.4g,所以参与反应的Y和生成物Q的质量之比为为6.4g∶3.6g=16∶9,
故答案为:D。
【分析】列三段式可求解此类问题。
5.【答案】C
【解析】【解答】A.氯气是一种黄绿色、有刺激性气味的有毒气体,选项正确,A不符合题意;
B.液氯是指液态的氯气的,氯气和液氯是同一种物质,选项正确,B不符合题意;
C.氯气能溶于水,选项错误,C符合题意;
D.氯气是一种有毒气体,选项正确,D不符合题意;
故答案为:C
【分析】根据氯气的物理性质和化学性质进行分析。
6.【答案】B
【解析】【解答】根据题意,2个 恰好能氧化5个 ,则 中+4价硫元素化合价升高,且产物中硫元素应该是+6价,即硫化合价升高了2,每个硫失去2个电子,则失去电子总数为5×2=10,根据电子守恒,则得到电子总数也是10,阴离子 中X化合价为+5价,假设X化合价降低到x价,则有2×(5-x)=10,解得x=0,则产物中X为0价。
故答案为:B。
【分析】氧化还原反应中存在电子守恒关系,即得到电子总数等于失去电子总数,也可以看成化合价降低总数等于化合价升高总数。
7.【答案】C
【解析】【解答】A. Na2O2与CO2反应的化学方程式为: ,则生成1molO2时转移的电子数为2NA,故A不符合题意;
B. 溶液的体积未知,不能准确计算出溶液中含有的H+数,故B不符合题意;
C. 标准状况下,11.2L甲烷(CH4)的物质的量为 =0.5mol,则分子中的质子数为 =5NA,故C符合题意;
D. H2O2既可以作氧化剂,又可以作还原剂,如H2O2自身分解生成H2O和O2时,有关系式:H2O2 e-,则17g H2O2参加反应时转移电子数为 ,故D不符合题意;
故答案为:C。
【分析】A.根据反应方程式即可计算出电子数
B.根据n=cv计算物质的量,但是体积未知
C.根据n=计 算出物质的量,结合质子数即可计算
D.根据方程式即可计算
8.【答案】C
【解析】【解答】A.由分析可知,③⑤⑥即H2O与Na2O、SO3、Mg3N2的反应不属于氧化还原反应,其余反应均属于氧化还原反应,A不符合题意;
B.由分析可知,①中2Na2O2+2H2O=4NaOH+O2↑,生成1 mol O2转移2 mol e-,⑦中2F2+2H2O=4HF+O2,生成1 mol O2转移4 mol e-,B不符合题意;
C.由分析可知,①④⑧反应中,水都既不做氧化剂也不做还原剂,C符合题意;
D.由分析可知,⑦中水做还原剂,②中水做氧化剂,D不符合题意;
故答案为:C。
【分析】题干中发生的反应方程式分别为:①2Na2O2+2H2O=4NaOH+O2↑,②2Na+2H2O=2NaOH+H2↑,③Na2O+H2O = 2NaOH,④3NO2+H2O=2HNO3+NO,⑤SO3+H2O=H2SO4,⑥Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,⑦2F2+2H2O=4HF+O2,⑧Cl2+H2O=HCl+HClO,据此解题。
9.【答案】A
【解析】【解答】解:氯气部分溶于水,Cl2+H2O=HCl+HClO,所以溶液中存在氯气、盐酸、次氯酸等,与氯水中的物质不发生反应,
A、与氯化铝不反应,不变质,故A选;
B、NaOH与盐酸反应生成氯化钠和水,变质,故B不选;
C、NaHCO3与盐酸反应生成氯化钠、二氧化碳和水,而变质,故C不选;
D、AgNO3与盐酸反应生成难溶的氯化银,而变质,故D不选;
故选:A.
【分析】自来水用氯气消毒,氯气溶液水形成氯水,依据氯水的成分分析解答.
10.【答案】B
【解析】【解答】A、氯气与水的反应是可逆反应,故0.1 mol Cl2溶于水,转移的电子数目小于0.1NA,A不符合题意;
B、CO2和N2O的摩尔质量均为44g/mol,故22gCO2和N2O的混合物的物质的量为0.5mol,又因为CO2和N2O均为三原子分子,故0.5mol混合气体含1.5mol原子,因此原子个数为1.5NA,B符合题意;
C、物质的量浓度为0.1mol L﹣1的MgCl2溶液,没有给出溶液的体积,无法计算含有的Cl-个数,C不符合题意;
D、标况下SO3为固态,2.24LSO3的物质的量不是0.1mol,含有的氧原子数目不是0.3NA,D不符合题意;
故答案为:B
【分析】A.氯气溶于水的过程中,为可逆反应;
B.根据公式计算混合气体的物质的量,从而计算其所含的原子数;
C.未给出溶液的体积,无法进行计算;
D.标准状态下,SO3不是气体;
11.【答案】D
【解析】【解答】A.CuO属于氧化物,不属于盐类物质,A不符合题意;
B.6.5gNaN2的物质的量,因此6.5gNaN2中所含的氮原子数大于0.2NA,B不符合题意;
C.空气囊中原料的配比,则其质量比为,C不符合题意;
D.由反应的化学方程式可得关系式“2NaN2~3N2”,因此每生成2molNaN2,产生3molN2,D符合题意;
故答案为:D
【分析】A.CuO属于氧化物;
B.根据公式计算NaN2的物质的量,进而求出所含的氮原子数;
C.根据反应的化学方程式确定二者的物质的量之比,再结合公式确定其质量比;
D.根据关系式“2NaN2~3N2”进行计算;
12.【答案】A
【解析】【解答】A.新制氯水中含有次氯酸,次氯酸具有漂白性,向红色布条上滴加几滴新制氯水,红色布条褪色,能够证明新制氯水有漂白性,A项符合题意;
B.向FeCl3溶液中滴加维生素C溶液,溶液变为浅绿色,说明铁离子被还原,维生素C具有还原性,B项不符合题意;
C.向某溶液中滴加AgNO3溶液,产生白色沉淀,该沉淀可能为碳酸银,原溶液中可能含有碳酸根离子,不一定含有Cl-,C项不符合题意;
D.用洁净的铂丝蘸取某溶液在酒精灯外焰灼烧,火焰呈黄色,说明溶液中含有Na+,无法确定是否含有K+,因为观察钾元素的焰色试验火焰需要透过蓝色钴玻璃,D项不符合题意;
故答案为:A。
【分析】B.溶液变为浅绿色,有二价铁生成,被还原,说明维生素C具有还原性。
C.碳酸根也可以与硝酸银产生沉淀。
D.观察是否含有钾元素,必须透过蓝色钴玻璃。
13.【答案】D
【解析】【解答】A.漂白粉、漂粉精的有效成分均为Ca(ClO)2,A不符合题意;
B.Cl2、ClO2、O3都具有强氧化性,且还原产物均无毒,可作为自来水消毒剂,B不符合题意;
C.NaClO比HClO稳定,但NaClO在水溶液中会少量逐步生成HClO而后分解,C不符合题意;
D.氯气是一种黄绿色气体,可用于制造有机溶剂、农药等,虽然氯气有毒,但其化合物很多是无毒的,可用于制药,D符合题意;
故答案为:D。
【分析】依据氯及其化合物的性质和用途判断,其中D项中氯的化合物很多是无毒的,可用于制药。
14.【答案】B
【解析】【解答】解:向含有NaBr、KI的混合溶液中通入过量的Cl2充分反应,发生:Cl2+2KI=2KCl+I2,Cl2+2NaBr=2NaCl+Br2,加热时Br2易挥发,I2易升华,最后剩余的固体为KCl和NaCl,
故选B.
【分析】氧化性:Cl2>Br2>I2,向含有NaBr、KI的混合溶液中通入过量的Cl2充分反应,生成NaCl、KCl和Br2、I2,加热时Br2易挥发,I2易升华,以此可解答该题.
15.【答案】C
【解析】【解答】A、反应①②相加的总反应恰好为过氧化氢的分解:2H2O2=2H2O+O2↑,并且反应前后Fe2+无变化,选项A不符合题意;
B、反应①H2O2+2Fe2++2H+=2Fe3++2H2O中,过氧化氢为氧化剂,Fe3+为氧化产物,所以氧化性:H2O2>Fe3+,选项B不符合题意;
C、过氧化氢分解方程式为2H2O2=2H2O+O2↑,反应的电子转移数为2e-,所以1molH2O2分解,转移的电子数为NA,选项C符合题意;
D、过氧化氢分解反应为:2H2O2=2H2O+O2↑,减去反应③得到反应④为:2HIO+H2O2=I2+2H2O+O2↑,选项D不符合题意。
【分析】催化剂是参加反应,改变反应历程的物质。本题中亚铁离子加入以后,将过氧化氢分解这一步反应,变为两步反应,而两步反应加和的结果仍然是过氧化氢的分解总反应。所以对于反应④,就可以用总反应减去反应③计算得到,实际可以认为I2也是反应的催化剂。
16.【答案】A
【解析】【解答】A、3mol氯气中有1molCl-35和5molCl-37,平均摩尔质量为(1×35+5×37)/3mol=73.3g·mol-1,故A符合题意;
B、KClO3反应中只作氧化剂,转化成氯气,因此1molKClO3在此反应中得到电子物质的量为5mol,即该反应转移电子物质的量为5mol,故B不符合题意;
C、KCl中的Cl是HCl中的部分Cl,应是Cl-37,故C不符合题意;
D、根据C选项的分析,故D不符合题意。
故答案为:A
【分析】该题考察相对分子质量、氧化还原反应电子转移数目的计算、氧化还原反应的规律等。1、相对分子质量=分子中各原子的相对原子质量的和;2、氧化还原反应中电子转移的数目计算:失去的电子数或得到的电子数(注意不要把得到和失去电子一起计算);3、氧化还原反应遵循的原则:就近原则(也叫归中反应或歧化反应)。
17.【答案】(1)分液漏斗
(2)氧化剂
(3)C;氯气与水反应生成的次氯酸具有漂白性
(4)蓝色;Cl2+2KI=2KCl+I2
(5)尾气处理
(6)17.92
(7)+4;杀菌,消毒,漂白
【解析】【解答】解:(1)滴加浓盐酸时用分液漏斗,故答案为:分液漏斗;(2)由方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+8Cl2↑+8H2O得反应前后Mn元素价态降低,并根据“升失氧化还原剂,降得还原氧化剂”分析得KMnO4是氧化剂,故答案为:氧化剂;(3)因为干燥的Cl2本身不具有漂白性,不能将有色物质褪色,故B干燥布条不变色,C中布条有水,因此Cl2+H2O=HCl+HClO,生成的HClO具有漂白性能将有色物质褪色,故C褪色,故答案为:C;氯气与水反应生成的次氯酸具有漂白性;(4)氯气具有强氧化性,能够氧化碘离子生成单质碘,化学方程式:Cl2+2KI=2KCl+I2,碘遇到淀粉变蓝,所以会看到溶液变蓝;故答案为:蓝色;Cl2+2KI=2KCl+I2;(5)氯气是酸性有毒气体,不能直接排放到空气中,因此用碱液吸收;故答案为:尾气处理;(6)n(KMnO4)=31.6÷158=0.2mol
2KMnO4+16HCl(浓)=2KCl+2MnCl2+ 8Cl2↑+8H2O
2mol 8×22.4L
0.2mol 17.92L
故答案为:17.92;(7)①O元素化合价为﹣2价,化合物中化合价代数和为0,Cl元素的化合价为+4价,故答案为:+4;②NaClO是一种强氧化剂因此可用于杀菌消毒,NaClO本身又具有漂白性,故答案为:杀菌,消毒,漂白.
【分析】(1)根据中学化学常见的实验仪器名称,滴加浓盐酸时用分液漏斗;(2)据化学反应前后Mn元素价态,并根据“升失氧化还原剂,降得还原氧化剂”来分析;(3)据Cl2本身不具有漂白性,但是Cl2与H2O反应生成的HClO具有漂白性来分析;(4)氯气具有强氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;(5)氯气有毒不能直接排放到空气中;(6)据方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+8Cl2↑+8H2O计算(7)①据物质化合价代数和为0分析;②据NaClO是一种强氧化剂来分析;
18.【答案】(1)分液漏斗;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)Cl2+H2O=HCl+HClO;有色布条褪色;氯气与是反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色
(3)Cl2+2I﹣=I2+2Cl﹣
(4)防止氯化铁堵塞后面的导管;防止H中的水蒸气进入F中,使五水三氯化铁潮解
(5)吸收多余的氯气,防止空气污染
【解析】【解答】解:(1)依据仪器形状可知仪器A的名称是分液漏斗;实验室用加热二氧化锰与浓盐酸制取氯气,二者反应生成氯化锰、氯气和水,方程式:MnO2+4HCl( 浓) MnCl2+Cl2↑+2H2O;
故答案为:分液漏斗;MnO2+4HCl( 浓) MnCl2+Cl2↑+2H2O;(2)氯气与水反应生成盐酸和次氯酸,方程式:Cl2+H2O=HCl+HClO,次氯酸具有强氧化性,从而使有色布条褪色,所以若将干燥的有色布条放入C中,观察到的现象是有色布条褪色;
故答案为:Cl2+H2O=HCl+HClO;有色布条褪色;氯气与是反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色;(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝,离子方程式:Cl2+2I﹣=I2+2Cl﹣,
故答案为:Cl2+2I﹣=I2+2Cl﹣;(4)双通管F中玻璃纤维(不参与反应)的作用是防止氯化铁堵塞后面的导管;氯化铁易吸水潮解,所以应在F和H装置之间安装G装置;
故答案为:防止氯化铁堵塞后面的导管;防止H中的水蒸气进入F中,使五水三氯化铁潮解;(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠反应,H中NaOH溶液的作用是吸收多余的氯气,防止空气污染;
故答案为:吸收多余的氯气,防止空气污染.
【分析】(1)依据仪器形状说出其名称,实验室用加热二氧化锰与浓盐酸制取氯气,二者反应生成氯化锰、氯气和水;(2)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,据此解答;(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝;(4)依据生成的固体氯化铁能堵塞导管,导致发生爆炸,氯化铁易吸水潮解的性质解答;(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收过量的氯气.
19.【答案】(1)1.0mol/L
(2);Cl2;HCl;0.025
【解析】【解答】(1)有H2SO4、FeSO4、Fe2(SO4)3的混合溶液100mL,已知溶液中的各阳离子的物质的量浓度相等,的物质的量浓度为3.0mol/L,设H+的物质的量浓度为x,则依据电荷守恒,可建立如下等式:x+2x+3x=3.0×2,x=1.0mol/L,则c(H+)=1.0mol/L。故答案为:1.0mol/L;
(2)①反应KClO3+6HCl(浓)=KCl+3Cl2+3H2O中,KClO3是氧化剂,HCl是还原剂,电子转移的数目为5,则用双线桥表示电子得失的数目与方向:。
②在反应中,KClO3是氧化剂,HCl是还原剂,则氧化产物、还原产物都是Cl2;发生氧化反应的是HCl。
③由反应方程式,可建立如下关系式:3Cl2——5e-,若有标准状况下336mL的氯气生成,则电子转移的物质的量为=0.025mol。答案为:;Cl2;HCl;0.025。
【分析】(1)依据电荷守恒;
(2)①依据反应中化合价变化判断转移电子数,用双线桥表示;
②氧化剂元素化合价降低,得到电子被还原,得到还原产物; 还原剂元素化合价升高,失去电子,被氧化,得到氧化产物;
③依据得失电子守恒。
20.【答案】(1)碳(或C)
(2)
(3)177.5
【解析】【解答】(1)反应中C元素化合价由KCN中+2价升高为KOCN中+4价,C元素被氧化;(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2=2CO2+N2+6KCl+2H2O,电子转移的方向和数目可表示为 ;(3)废水中KCN的质量为650mg/L×100L=65000mg=65g,物质的量为65g÷65g/mol=1mol,使KCN完全转化为无毒物质,应生成CO2、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,电子转移守恒可知2×n(Cl2)=1mol×(4-2)+1mol×[0-(-3)],解得n(Cl2)=2.5mol,故需要氯气的质量为2.5mol×71g/mol=177.5g。
【分析】(1)化合价升高的元素被氧化;(2)根据反应中元素的化合价变化情况,根据电子得失守恒、原子守恒配平;(3)计算废水中KCN的质量,再根据n=m÷M计算KCN的物质的量,使KCN完全转化为无毒物质,生成CO2、N2,根据电子转移守恒计算n(Cl2),再根据m=nM计算需要氯气的质量。
21.【答案】(1)5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O
(2)KMnO4;氧;6.02×1023
(3)2H2O2 2H2O+O2↑;3.01×1023
【解析】【解答】解:(1)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:①氧化反应:H2O2﹣2e﹣═2H++O2↑②还原反应:MnO4﹣+5e﹣+8H+═Mn2++4H2O①×5+②×2得到:5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O;故答案为:5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O;(2)依据反应中化合价降低的元素是锰元素,从+7价降到+2价,所以氧化剂是KMnO4,过氧化氢中氧元素化合价从﹣1价升高到0价,做还原剂被氧化,若有0.5mol H2O2参加此反应,根据离子方程式5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O;可知转移电子数1mol,转移电子个数为6.02×1023;故答案为:KMnO4,氧,6.02×1023;(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:2H2O2 2H2O+O2↑; H2O2发生分解,氧元素化合价从﹣1价变化为0价和﹣2价,每2mol过氧化氢反应转移电子为2mol,若有0.5mol H2O2发生分解,则转移电子个数为0.5mol,即转移电子个数为3.01×1023;故答案为:2H2O2 2H2O+O2↑; 3.01×1023.
【分析】(1)依据氧化反应和还原反应电子守恒,合并书写离子方程式;(2)根据元素化合价变化判断氧化剂,元素化合价降低的物质做氧化剂,元素化合价升高做还原剂被氧化,依据离子方程式计算电子转移数;(3)锰离子催化过氧化氢分解生成水和氧气,依据分解反应计算电子转移数.
一、单选题
1.下列各组物质相互反应,生成物不随反应条件或反应物的用量变化而变化的是( )
A.Na和 B.和Fe
C.C和 D.和NaOH
2.已知Q与R的摩尔质量之比为9∶22,在反应X+2Y=2Q+R中,当1.6 g X与Y完全反应后,生成4.4 gR,则参与反应的Y和生成的Q的质量之比为( )
A.46:9 B.32:9 C.23:9 D.16:9
3.下列关于氯气性质的描述错误的是( )
A.Fe在氯气中燃烧生成 B.能溶于水
C.有刺激性气味、有毒 D.能与氢气反应
4.已知Q与R的摩尔质量之比为9∶22,在反应X+2Y=2Q +R中,当1.6gX与一定量Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为( )
A.46∶9 B.32∶9 C.23∶9 D.16∶9
5.下列有关氯气的叙述中,不正确的是( )
A.氯气是一种黄绿色、有刺激性气味的气体
B.氯气、液氯是同一种物质
C.氯气不能溶于水
D.氯气是一种有毒的气体
6.2个 恰好能氧化5个 ,则还原产物中变价元素的化合价是( )
A.- 1 B.0 C.+1 D.+6
7.设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.Na2O2与CO2反应,生成1molO2时转移的电子数为4NA
B.0.1 mol·L-1硫酸溶液中含有的H+数为0.2NA
C.标准状况下,11.2L甲烷(CH4)含有的质子数为5NA
D.常温常压下,17g H2O2参加反应时转移电子数一定为NA
8.水是一种重要的资源,它在化学反应中担任着重要的角色,既可作为反应物又可作为生成物,如图中和水相连的物质都能和水发生反应,则有关说法正确的是( )
A.上述反应中属于氧化还原反应的有①②④⑥⑦⑧
B.①和⑦中都有氧气生成,且生成1 mol O2转移的电子数相同
C.①④⑧反应中,水都既不做氧化剂也不做还原剂
D.⑦中水做氧化剂,②中水做还原剂
9.工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
A.AlCl3 B.NaOH C.NaHCO3 D.AgNO3
10.设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA
B.常温下,22g CO2和N2O混合气体中,含有的原子数目为1.5NA
C.物质的量浓度为0.1mol L﹣1的MgCl2溶液中,含有Cl﹣个数为0.2NA
D.标准状况下,2.24LSO3中含有的氧原子数目为0.3NA
11.某汽车安全气囊装有一定质量的NaN,和CuO的混合物,汽车剧烈碰撞时,气囊中发生反应2NaN2+CuO=Na2O+3N2↑+Cu,从而使气囊充满氮气。则下列说法正确的是( )
A.NaN2与CuO均属于盐类物质
B.6.5gNaN2中含0.1mol氮原子
C.安全气囊中原料配比应为m(NaN2)/m(CuO)=2
D.每2mol NaN2发生反应,产生3mol N2
12.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 实验结论
A 向红色布条上滴加几滴新制氯水,红色布条褪色 新制氯水有漂白性
B 向FeCl3溶液中滴加维生素C溶液,溶液变为浅绿色 维生素C有氧化性
C 向某溶液中滴加AgNO3溶液,产生白色沉淀 溶液中一定含有Cl-
D 用洁净的铂丝蘸取某溶液在酒精灯外焰灼烧,火焰呈黄色 溶液中一定不含K+
A.A B.B C.C D.D
13.下列说法错误的是( )
A.漂白粉、漂粉精的有效成分均为Ca(ClO)2
B.Cl2、ClO2、O3都具有强氧化性,可作为自来水消毒剂
C.NaClO比HClO稳定,但也会缓慢分解
D.氯气是一种黄绿色气体,可用于制造有机溶剂、农药等,但氯气有毒,不可用于制药
14.向含有KI,NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr B.KCl和NaCl
C.KCl和NaBr D.KCl、NaCl和I2
15.已知Fe2+或I2能与H2O2在一定条件下发生下列反应:
Fe2+:①H2O2+2Fe2++2H+=2Fe3++2H2O;②H2O2+2Fe3+=2Fe2++2H++O2↑
I2:③H2O2+I2=2HIO;④……
下列说法错误的是( )
A.通过反应①②可知Fe2+为过氧化氢分解的催化剂
B.根据反应①可知,在该条件下,氧化性:H2O2>Fe3+
C.1molH2O2分解,转移的电子数为2NA
D.反应④为2HIO+H2O2=I2+2H2O+O2↑
16.已知反应KClO3+ 6HCl = KCl + 3Cl2↑+ 3H2O,若用K35ClO3与H37Cl作用,下列说法中正确的是( )
A.Cl2相对分子质量约为73.3 B.该反应转移电子数为6
C.KCl中只含有35Cl D.KCl中同时含有35Cl和37Cl
二、综合题
17.某化学兴趣小组用如图装置制取并探究氯气的性质.
【实验探究】
(1)A装置中a仪器的名称是 .
(2)制取氯气反应中KMnO4所起的作用是 (填“氧化剂”或“还原剂”).
(3)实验进行一段时间后,可观察到 (填“B”或“C”)装置中有色布条褪色,其褪色原因是 .
(4)当氯气进入D装置后,可观察到溶液颜色变为 (填“红色”或“蓝色”),写出相关反应的化学方程式 .
(5)E装置中NaOH溶液的作用是 .
(6)用31.6g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下 L氯气.(KMnO4的摩尔质量为158g mol﹣1)
(7)【知识拓展】
近年来,某些含氯的化合物(如ClO2、NaClO等)在生产、生活中应用广泛.
①高效净水剂ClO2中氯元素的化合价为 .
②NaClO是一种强氧化剂.某种家用洗涤剂含有NaClO,请写出NaClO在洗涤过程中的一种作用 .
18.某兴趣小组制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:
(1)仪器A的名称是 .实验中制备氯气的反应方程式为 .
(2)C中发生反应的化学方程式为 .若将干燥的有色布条放入C中,观察到的现象是 ,原因是 .
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ;在F和H装置之间安装G装置的目的是 .
(5)H中NaOH溶液的作用是 .
19.回答下列问题:
(1)有H2SO4、FeSO4、Fe2(SO4)3的混合溶液100mL,已知溶液中的各阳离子的物质的量浓度相等,的物质的量浓度为3.0mol/L,则c(H+)= 。
(2)已知反应KClO3+6HCl(浓)=KCl+3Cl2+3H2O。
①用双线桥表示电子得失的数目与方向 。
②还原产物 ;发生氧化反应的是 。
③若有标准状况下336mL的氯气生成,则有 mol电子转移。
20.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目 :
KOCN+KOH+Cl2→CO2+N2+KCl+H2O
(3)若处理上述废水100L,使KCN完全转化为无毒物质,至少需液氯 g。
21.在稀硫酸中,KMnO4和H2O2能发生氧化还原反应.
氧化反应:H2O2﹣2e﹣═2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+═Mn2++4H2O
(1)写出该氧化还原反应的化学方程式: .
(2)反应中氧化剂是 ;被氧化元素是 ;若有0.5mol H2O2参加此反应,电子转移个数为 .
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5mol H2O2发生分解,电子转移个数为 .
答案解析部分
1.【答案】B
【解析】【解答】A.Na和在常温下反应生成氧化钠,在加热条件下反应生成过氧化钠,故不选A;
B.和Fe只在加热条件下反应生成氯化铁,故选B;
C.在氧气充足的条件下,C和反应生成二氧化碳;在氧气不足的条件下,C和反应生成一氧化碳,故不选C;
D.和少量NaOH反应生成碳酸钙沉淀,碳酸氢钠和水;和过量NaOH反应生成碳酸钙沉淀,碳酸钠和水,故不选D;
故答案为:B。
【分析】A、钠和氧气常温下生成氧化钠,加热生成过氧化钠;
B、氯气和铁反应,铁被氧化为最高价;
C、碳和过量氧气生成二氧化碳,少量氧气生成一氧化碳;
D、碳酸氢钙和少量氢氧化钠生成碳酸钙、碳酸氢钠和水,和过量氢氧化钠生成碳酸钙、碳酸钠和水。
2.【答案】D
【解析】【解答】可假设Q和R的相对分子质量分别为9a、22a,
设生成4.4gR需要Q的质量是x
X+2Y═ 2Q + R
18a 22a
x 4.4g
根据 ,解得x=3.6g,
由质量守恒可知参加反应的Y的质量为4.4g+3.6g-1.6g=6.4g,
所以参与反应的Y和生成物Q的质量之比为为6.4g:3.6g=16:9,
故答案为:D。
【分析】假设Q与R的摩尔质量分别为9a和22a,用4.4gR根据化学反应中质量守恒定律计算出Q的质量,以及Y的质量;
3.【答案】A
【解析】【解答】A.Fe在氯气中燃烧生成,A符合题意;
B.氯气能溶于水,且与水反应生成氯化氢和次氯酸,B不符合题意;
C.氯气是有刺激性气味、有毒的气体,C不符合题意;
D.氯气能与氢气反应生成氯化氢,D不符合题意;
故答案为:A。
【分析】依据氯气的性质分析,A项中氯气与金属反应生成高价态氯化物。
4.【答案】D
【解析】【解答】假设Q和R的相对分子质量分别为9a、22a,设生成4.4gR时生成Q的质量是x,
X+2Y= 2Q + R
18a 22a
x 4.4g
根据 = ,解得:x=3.6g,由质量守恒可知参加反应的Y的质量为:4.4g+3.6g-1.6g=6.4g,所以参与反应的Y和生成物Q的质量之比为为6.4g∶3.6g=16∶9,
故答案为:D。
【分析】列三段式可求解此类问题。
5.【答案】C
【解析】【解答】A.氯气是一种黄绿色、有刺激性气味的有毒气体,选项正确,A不符合题意;
B.液氯是指液态的氯气的,氯气和液氯是同一种物质,选项正确,B不符合题意;
C.氯气能溶于水,选项错误,C符合题意;
D.氯气是一种有毒气体,选项正确,D不符合题意;
故答案为:C
【分析】根据氯气的物理性质和化学性质进行分析。
6.【答案】B
【解析】【解答】根据题意,2个 恰好能氧化5个 ,则 中+4价硫元素化合价升高,且产物中硫元素应该是+6价,即硫化合价升高了2,每个硫失去2个电子,则失去电子总数为5×2=10,根据电子守恒,则得到电子总数也是10,阴离子 中X化合价为+5价,假设X化合价降低到x价,则有2×(5-x)=10,解得x=0,则产物中X为0价。
故答案为:B。
【分析】氧化还原反应中存在电子守恒关系,即得到电子总数等于失去电子总数,也可以看成化合价降低总数等于化合价升高总数。
7.【答案】C
【解析】【解答】A. Na2O2与CO2反应的化学方程式为: ,则生成1molO2时转移的电子数为2NA,故A不符合题意;
B. 溶液的体积未知,不能准确计算出溶液中含有的H+数,故B不符合题意;
C. 标准状况下,11.2L甲烷(CH4)的物质的量为 =0.5mol,则分子中的质子数为 =5NA,故C符合题意;
D. H2O2既可以作氧化剂,又可以作还原剂,如H2O2自身分解生成H2O和O2时,有关系式:H2O2 e-,则17g H2O2参加反应时转移电子数为 ,故D不符合题意;
故答案为:C。
【分析】A.根据反应方程式即可计算出电子数
B.根据n=cv计算物质的量,但是体积未知
C.根据n=计 算出物质的量,结合质子数即可计算
D.根据方程式即可计算
8.【答案】C
【解析】【解答】A.由分析可知,③⑤⑥即H2O与Na2O、SO3、Mg3N2的反应不属于氧化还原反应,其余反应均属于氧化还原反应,A不符合题意;
B.由分析可知,①中2Na2O2+2H2O=4NaOH+O2↑,生成1 mol O2转移2 mol e-,⑦中2F2+2H2O=4HF+O2,生成1 mol O2转移4 mol e-,B不符合题意;
C.由分析可知,①④⑧反应中,水都既不做氧化剂也不做还原剂,C符合题意;
D.由分析可知,⑦中水做还原剂,②中水做氧化剂,D不符合题意;
故答案为:C。
【分析】题干中发生的反应方程式分别为:①2Na2O2+2H2O=4NaOH+O2↑,②2Na+2H2O=2NaOH+H2↑,③Na2O+H2O = 2NaOH,④3NO2+H2O=2HNO3+NO,⑤SO3+H2O=H2SO4,⑥Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,⑦2F2+2H2O=4HF+O2,⑧Cl2+H2O=HCl+HClO,据此解题。
9.【答案】A
【解析】【解答】解:氯气部分溶于水,Cl2+H2O=HCl+HClO,所以溶液中存在氯气、盐酸、次氯酸等,与氯水中的物质不发生反应,
A、与氯化铝不反应,不变质,故A选;
B、NaOH与盐酸反应生成氯化钠和水,变质,故B不选;
C、NaHCO3与盐酸反应生成氯化钠、二氧化碳和水,而变质,故C不选;
D、AgNO3与盐酸反应生成难溶的氯化银,而变质,故D不选;
故选:A.
【分析】自来水用氯气消毒,氯气溶液水形成氯水,依据氯水的成分分析解答.
10.【答案】B
【解析】【解答】A、氯气与水的反应是可逆反应,故0.1 mol Cl2溶于水,转移的电子数目小于0.1NA,A不符合题意;
B、CO2和N2O的摩尔质量均为44g/mol,故22gCO2和N2O的混合物的物质的量为0.5mol,又因为CO2和N2O均为三原子分子,故0.5mol混合气体含1.5mol原子,因此原子个数为1.5NA,B符合题意;
C、物质的量浓度为0.1mol L﹣1的MgCl2溶液,没有给出溶液的体积,无法计算含有的Cl-个数,C不符合题意;
D、标况下SO3为固态,2.24LSO3的物质的量不是0.1mol,含有的氧原子数目不是0.3NA,D不符合题意;
故答案为:B
【分析】A.氯气溶于水的过程中,为可逆反应;
B.根据公式计算混合气体的物质的量,从而计算其所含的原子数;
C.未给出溶液的体积,无法进行计算;
D.标准状态下,SO3不是气体;
11.【答案】D
【解析】【解答】A.CuO属于氧化物,不属于盐类物质,A不符合题意;
B.6.5gNaN2的物质的量,因此6.5gNaN2中所含的氮原子数大于0.2NA,B不符合题意;
C.空气囊中原料的配比,则其质量比为,C不符合题意;
D.由反应的化学方程式可得关系式“2NaN2~3N2”,因此每生成2molNaN2,产生3molN2,D符合题意;
故答案为:D
【分析】A.CuO属于氧化物;
B.根据公式计算NaN2的物质的量,进而求出所含的氮原子数;
C.根据反应的化学方程式确定二者的物质的量之比,再结合公式确定其质量比;
D.根据关系式“2NaN2~3N2”进行计算;
12.【答案】A
【解析】【解答】A.新制氯水中含有次氯酸,次氯酸具有漂白性,向红色布条上滴加几滴新制氯水,红色布条褪色,能够证明新制氯水有漂白性,A项符合题意;
B.向FeCl3溶液中滴加维生素C溶液,溶液变为浅绿色,说明铁离子被还原,维生素C具有还原性,B项不符合题意;
C.向某溶液中滴加AgNO3溶液,产生白色沉淀,该沉淀可能为碳酸银,原溶液中可能含有碳酸根离子,不一定含有Cl-,C项不符合题意;
D.用洁净的铂丝蘸取某溶液在酒精灯外焰灼烧,火焰呈黄色,说明溶液中含有Na+,无法确定是否含有K+,因为观察钾元素的焰色试验火焰需要透过蓝色钴玻璃,D项不符合题意;
故答案为:A。
【分析】B.溶液变为浅绿色,有二价铁生成,被还原,说明维生素C具有还原性。
C.碳酸根也可以与硝酸银产生沉淀。
D.观察是否含有钾元素,必须透过蓝色钴玻璃。
13.【答案】D
【解析】【解答】A.漂白粉、漂粉精的有效成分均为Ca(ClO)2,A不符合题意;
B.Cl2、ClO2、O3都具有强氧化性,且还原产物均无毒,可作为自来水消毒剂,B不符合题意;
C.NaClO比HClO稳定,但NaClO在水溶液中会少量逐步生成HClO而后分解,C不符合题意;
D.氯气是一种黄绿色气体,可用于制造有机溶剂、农药等,虽然氯气有毒,但其化合物很多是无毒的,可用于制药,D符合题意;
故答案为:D。
【分析】依据氯及其化合物的性质和用途判断,其中D项中氯的化合物很多是无毒的,可用于制药。
14.【答案】B
【解析】【解答】解:向含有NaBr、KI的混合溶液中通入过量的Cl2充分反应,发生:Cl2+2KI=2KCl+I2,Cl2+2NaBr=2NaCl+Br2,加热时Br2易挥发,I2易升华,最后剩余的固体为KCl和NaCl,
故选B.
【分析】氧化性:Cl2>Br2>I2,向含有NaBr、KI的混合溶液中通入过量的Cl2充分反应,生成NaCl、KCl和Br2、I2,加热时Br2易挥发,I2易升华,以此可解答该题.
15.【答案】C
【解析】【解答】A、反应①②相加的总反应恰好为过氧化氢的分解:2H2O2=2H2O+O2↑,并且反应前后Fe2+无变化,选项A不符合题意;
B、反应①H2O2+2Fe2++2H+=2Fe3++2H2O中,过氧化氢为氧化剂,Fe3+为氧化产物,所以氧化性:H2O2>Fe3+,选项B不符合题意;
C、过氧化氢分解方程式为2H2O2=2H2O+O2↑,反应的电子转移数为2e-,所以1molH2O2分解,转移的电子数为NA,选项C符合题意;
D、过氧化氢分解反应为:2H2O2=2H2O+O2↑,减去反应③得到反应④为:2HIO+H2O2=I2+2H2O+O2↑,选项D不符合题意。
【分析】催化剂是参加反应,改变反应历程的物质。本题中亚铁离子加入以后,将过氧化氢分解这一步反应,变为两步反应,而两步反应加和的结果仍然是过氧化氢的分解总反应。所以对于反应④,就可以用总反应减去反应③计算得到,实际可以认为I2也是反应的催化剂。
16.【答案】A
【解析】【解答】A、3mol氯气中有1molCl-35和5molCl-37,平均摩尔质量为(1×35+5×37)/3mol=73.3g·mol-1,故A符合题意;
B、KClO3反应中只作氧化剂,转化成氯气,因此1molKClO3在此反应中得到电子物质的量为5mol,即该反应转移电子物质的量为5mol,故B不符合题意;
C、KCl中的Cl是HCl中的部分Cl,应是Cl-37,故C不符合题意;
D、根据C选项的分析,故D不符合题意。
故答案为:A
【分析】该题考察相对分子质量、氧化还原反应电子转移数目的计算、氧化还原反应的规律等。1、相对分子质量=分子中各原子的相对原子质量的和;2、氧化还原反应中电子转移的数目计算:失去的电子数或得到的电子数(注意不要把得到和失去电子一起计算);3、氧化还原反应遵循的原则:就近原则(也叫归中反应或歧化反应)。
17.【答案】(1)分液漏斗
(2)氧化剂
(3)C;氯气与水反应生成的次氯酸具有漂白性
(4)蓝色;Cl2+2KI=2KCl+I2
(5)尾气处理
(6)17.92
(7)+4;杀菌,消毒,漂白
【解析】【解答】解:(1)滴加浓盐酸时用分液漏斗,故答案为:分液漏斗;(2)由方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+8Cl2↑+8H2O得反应前后Mn元素价态降低,并根据“升失氧化还原剂,降得还原氧化剂”分析得KMnO4是氧化剂,故答案为:氧化剂;(3)因为干燥的Cl2本身不具有漂白性,不能将有色物质褪色,故B干燥布条不变色,C中布条有水,因此Cl2+H2O=HCl+HClO,生成的HClO具有漂白性能将有色物质褪色,故C褪色,故答案为:C;氯气与水反应生成的次氯酸具有漂白性;(4)氯气具有强氧化性,能够氧化碘离子生成单质碘,化学方程式:Cl2+2KI=2KCl+I2,碘遇到淀粉变蓝,所以会看到溶液变蓝;故答案为:蓝色;Cl2+2KI=2KCl+I2;(5)氯气是酸性有毒气体,不能直接排放到空气中,因此用碱液吸收;故答案为:尾气处理;(6)n(KMnO4)=31.6÷158=0.2mol
2KMnO4+16HCl(浓)=2KCl+2MnCl2+ 8Cl2↑+8H2O
2mol 8×22.4L
0.2mol 17.92L
故答案为:17.92;(7)①O元素化合价为﹣2价,化合物中化合价代数和为0,Cl元素的化合价为+4价,故答案为:+4;②NaClO是一种强氧化剂因此可用于杀菌消毒,NaClO本身又具有漂白性,故答案为:杀菌,消毒,漂白.
【分析】(1)根据中学化学常见的实验仪器名称,滴加浓盐酸时用分液漏斗;(2)据化学反应前后Mn元素价态,并根据“升失氧化还原剂,降得还原氧化剂”来分析;(3)据Cl2本身不具有漂白性,但是Cl2与H2O反应生成的HClO具有漂白性来分析;(4)氯气具有强氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;(5)氯气有毒不能直接排放到空气中;(6)据方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+8Cl2↑+8H2O计算(7)①据物质化合价代数和为0分析;②据NaClO是一种强氧化剂来分析;
18.【答案】(1)分液漏斗;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)Cl2+H2O=HCl+HClO;有色布条褪色;氯气与是反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色
(3)Cl2+2I﹣=I2+2Cl﹣
(4)防止氯化铁堵塞后面的导管;防止H中的水蒸气进入F中,使五水三氯化铁潮解
(5)吸收多余的氯气,防止空气污染
【解析】【解答】解:(1)依据仪器形状可知仪器A的名称是分液漏斗;实验室用加热二氧化锰与浓盐酸制取氯气,二者反应生成氯化锰、氯气和水,方程式:MnO2+4HCl( 浓) MnCl2+Cl2↑+2H2O;
故答案为:分液漏斗;MnO2+4HCl( 浓) MnCl2+Cl2↑+2H2O;(2)氯气与水反应生成盐酸和次氯酸,方程式:Cl2+H2O=HCl+HClO,次氯酸具有强氧化性,从而使有色布条褪色,所以若将干燥的有色布条放入C中,观察到的现象是有色布条褪色;
故答案为:Cl2+H2O=HCl+HClO;有色布条褪色;氯气与是反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色;(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝,离子方程式:Cl2+2I﹣=I2+2Cl﹣,
故答案为:Cl2+2I﹣=I2+2Cl﹣;(4)双通管F中玻璃纤维(不参与反应)的作用是防止氯化铁堵塞后面的导管;氯化铁易吸水潮解,所以应在F和H装置之间安装G装置;
故答案为:防止氯化铁堵塞后面的导管;防止H中的水蒸气进入F中,使五水三氯化铁潮解;(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠反应,H中NaOH溶液的作用是吸收多余的氯气,防止空气污染;
故答案为:吸收多余的氯气,防止空气污染.
【分析】(1)依据仪器形状说出其名称,实验室用加热二氧化锰与浓盐酸制取氯气,二者反应生成氯化锰、氯气和水;(2)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,据此解答;(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝;(4)依据生成的固体氯化铁能堵塞导管,导致发生爆炸,氯化铁易吸水潮解的性质解答;(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收过量的氯气.
19.【答案】(1)1.0mol/L
(2);Cl2;HCl;0.025
【解析】【解答】(1)有H2SO4、FeSO4、Fe2(SO4)3的混合溶液100mL,已知溶液中的各阳离子的物质的量浓度相等,的物质的量浓度为3.0mol/L,设H+的物质的量浓度为x,则依据电荷守恒,可建立如下等式:x+2x+3x=3.0×2,x=1.0mol/L,则c(H+)=1.0mol/L。故答案为:1.0mol/L;
(2)①反应KClO3+6HCl(浓)=KCl+3Cl2+3H2O中,KClO3是氧化剂,HCl是还原剂,电子转移的数目为5,则用双线桥表示电子得失的数目与方向:。
②在反应中,KClO3是氧化剂,HCl是还原剂,则氧化产物、还原产物都是Cl2;发生氧化反应的是HCl。
③由反应方程式,可建立如下关系式:3Cl2——5e-,若有标准状况下336mL的氯气生成,则电子转移的物质的量为=0.025mol。答案为:;Cl2;HCl;0.025。
【分析】(1)依据电荷守恒;
(2)①依据反应中化合价变化判断转移电子数,用双线桥表示;
②氧化剂元素化合价降低,得到电子被还原,得到还原产物; 还原剂元素化合价升高,失去电子,被氧化,得到氧化产物;
③依据得失电子守恒。
20.【答案】(1)碳(或C)
(2)
(3)177.5
【解析】【解答】(1)反应中C元素化合价由KCN中+2价升高为KOCN中+4价,C元素被氧化;(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2=2CO2+N2+6KCl+2H2O,电子转移的方向和数目可表示为 ;(3)废水中KCN的质量为650mg/L×100L=65000mg=65g,物质的量为65g÷65g/mol=1mol,使KCN完全转化为无毒物质,应生成CO2、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,电子转移守恒可知2×n(Cl2)=1mol×(4-2)+1mol×[0-(-3)],解得n(Cl2)=2.5mol,故需要氯气的质量为2.5mol×71g/mol=177.5g。
【分析】(1)化合价升高的元素被氧化;(2)根据反应中元素的化合价变化情况,根据电子得失守恒、原子守恒配平;(3)计算废水中KCN的质量,再根据n=m÷M计算KCN的物质的量,使KCN完全转化为无毒物质,生成CO2、N2,根据电子转移守恒计算n(Cl2),再根据m=nM计算需要氯气的质量。
21.【答案】(1)5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O
(2)KMnO4;氧;6.02×1023
(3)2H2O2 2H2O+O2↑;3.01×1023
【解析】【解答】解:(1)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:①氧化反应:H2O2﹣2e﹣═2H++O2↑②还原反应:MnO4﹣+5e﹣+8H+═Mn2++4H2O①×5+②×2得到:5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O;故答案为:5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O;(2)依据反应中化合价降低的元素是锰元素,从+7价降到+2价,所以氧化剂是KMnO4,过氧化氢中氧元素化合价从﹣1价升高到0价,做还原剂被氧化,若有0.5mol H2O2参加此反应,根据离子方程式5H2O2+2MnO4﹣+6H+=2Mn2++5O2↑+8H2O;可知转移电子数1mol,转移电子个数为6.02×1023;故答案为:KMnO4,氧,6.02×1023;(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:2H2O2 2H2O+O2↑; H2O2发生分解,氧元素化合价从﹣1价变化为0价和﹣2价,每2mol过氧化氢反应转移电子为2mol,若有0.5mol H2O2发生分解,则转移电子个数为0.5mol,即转移电子个数为3.01×1023;故答案为:2H2O2 2H2O+O2↑; 3.01×1023.
【分析】(1)依据氧化反应和还原反应电子守恒,合并书写离子方程式;(2)根据元素化合价变化判断氧化剂,元素化合价降低的物质做氧化剂,元素化合价升高做还原剂被氧化,依据离子方程式计算电子转移数;(3)锰离子催化过氧化氢分解生成水和氧气,依据分解反应计算电子转移数.
