实验活动5制作简单的燃料电池分层练习(含解析)2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 实验活动5制作简单的燃料电池分层练习(含解析)2023-2024学年高二上学期人教版(2019)化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-12 21:58:44 | ||
图片预览



文档简介
实验活动5制作简单的燃料电池
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.某原电池反应的离子方程式为Fe+ 2H+=Fe2++H2↑,则下列说法中正确的是
A.可用稀HNO3作电解质溶液 B.溶液中H+移向负极
C.电池放电过程中电解质溶液pH值减小 D.用铁作负极,铁质量不断减少
2.氢氧燃料电池被人们誉为“绿色电池”,具有广阔的发展前途。如图为电池示意图。已知电池工作时,电流从电极a经由导线流向电极b。则下列说法正确的是( )
A.该燃料电池能将电能转化为化学能
B.a极的反应为:O2+2H2O+4e-=4OH-
C.溶液中的OH-从右室向左室移动
D.电池中电解液的pH逐渐增大
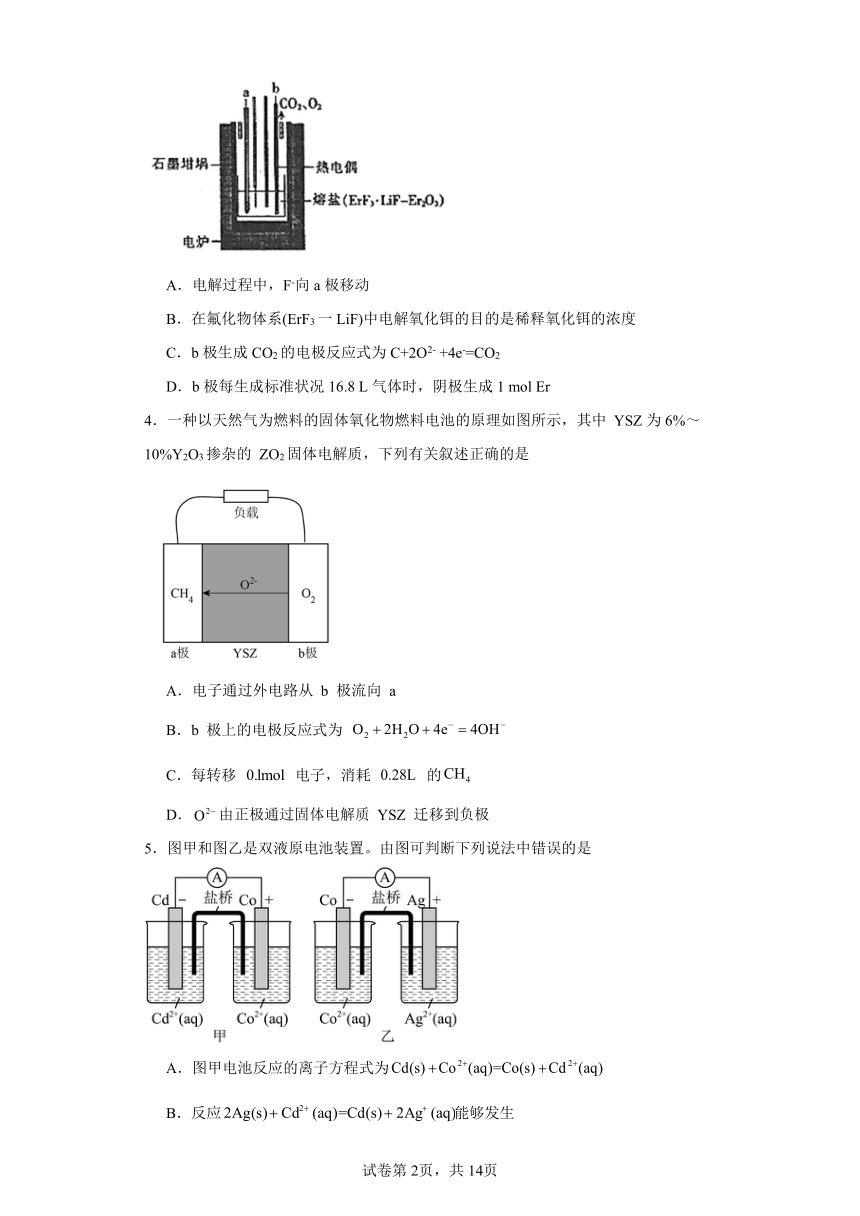
3.铒可作某些荧光材料的激活剂,利用电解法制备金属铒的示意图如图,下列说法正确的是( )
A.电解过程中,F-向a极移动
B.在氟化物体系(ErF3一LiF)中电解氧化铒的目的是稀释氧化铒的浓度
C.b极生成CO2的电极反应式为C+2O2- +4e-=CO2
D.b极每生成标准状况16.8 L气体时,阴极生成1 mol Er
4.一种以天然气为燃料的固体氧化物燃料电池的原理如图所示,其中 YSZ为6%~10%Y2O3掺杂的 ZO2固体电解质,下列有关叙述正确的是
A.电子通过外电路从 b 极流向 a
B.b 极上的电极反应式为
C.每转移 电子,消耗 的
D.由正极通过固体电解质 YSZ 迁移到负极
5.图甲和图乙是双液原电池装置。由图可判断下列说法中错误的是
A.图甲电池反应的离子方程式为
B.反应能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.当图乙中有电子通过外电路时,正极有析出
6.某科学家利用二氧化饰(CeO2)在太阳能作用下将H2O、CO2转变为H2、 CO,其过程如下所示:
mCeO2(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+x H2O+xCO2mCeO2+xH2+xCO2
下列说法不正确的是
A.该过程中CeO2是H2O、CO2转变为H2、CO反应的催化剂
B.利用CeO2作催化剂-既可使该转变过程速率提高。亦可减小能量的消 耗,并可提高反应物转化率
C.mmol CeO2参加反应,气体物质的量增加x mol
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH - - 2e = CO32- +2H2O
7.电致变色系统常用于汽车玻璃中,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。下列有关说法正确的是
已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色。
A.当X接电源正极时,此时Li+ 脱离离子储存层
B.当X接电源负极时,膜的透射率降低,可以有效阻挡阳光
C.当Y接电源正极时,离子储存层发生反应为:
D.在较长时间使用过程中,导电性聚合物电解质中Li+会大量减少
8.现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
A.阳极反应式为2H++2e-=H2↑ B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H+通过 D.E、G处加入的物质均为H2O
9.中科院化学研究所最新报道了化合物1催化CO2的氢化机理。其中化合物1(催化剂,固态)→化合物2(中间产物,固态)的过程和其相对能量曲线如图所示。下列有关该过程的说法正确的是
A.过程中经历两个过渡态TS11-2、TS21-2,说明该过程包含两个基元反应
B.该过程的总反应速率主要由过程①决定
C.升高温度,有利于过程②的进行
D.过程①的热化学方程式为I(s)+CO2(g)=I1-2(s)△H=-2.08kJ mol-1
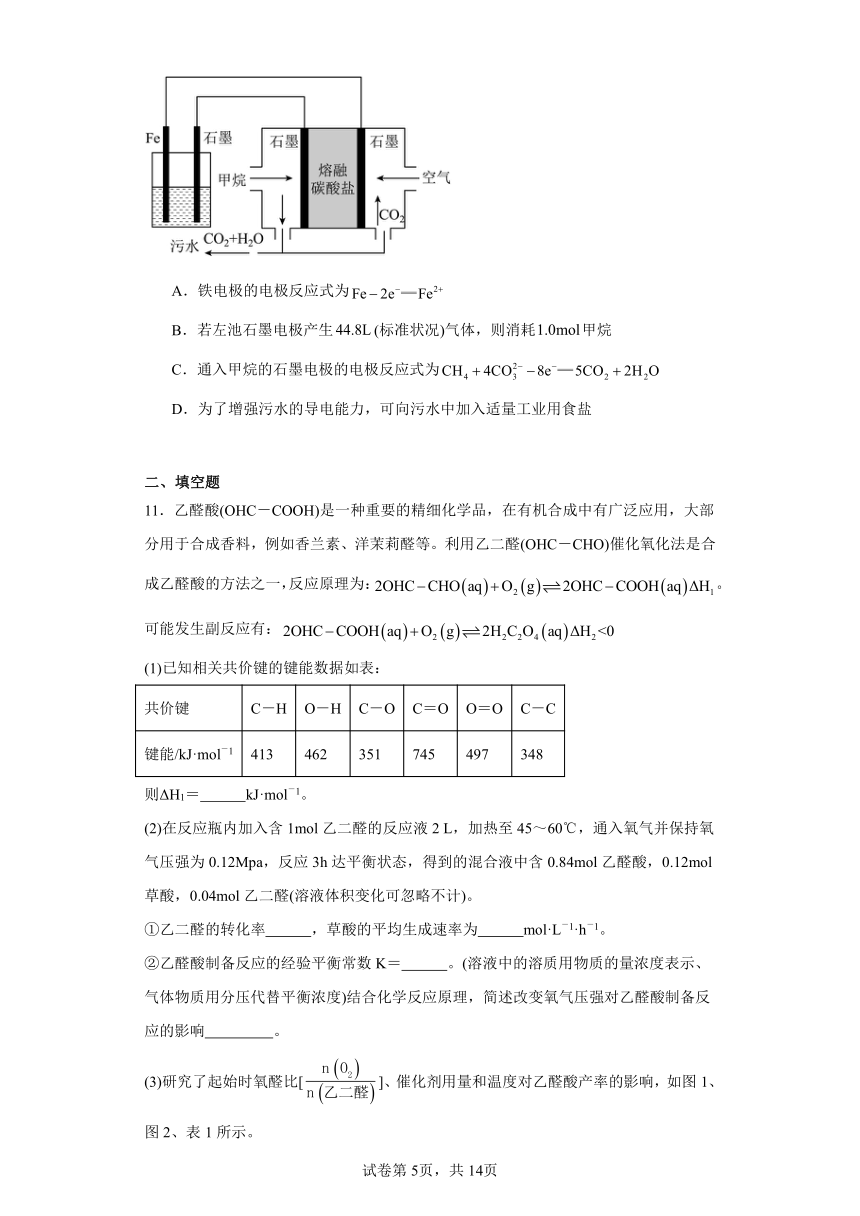
10.电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是
A.铁电极的电极反应式为
B.若左池石墨电极产生(标准状况)气体,则消耗甲烷
C.通入甲烷的石墨电极的电极反应式为
D.为了增强污水的导电能力,可向污水中加入适量工业用食盐
二、填空题
11.乙醛酸(OHC-COOH)是一种重要的精细化学品,在有机合成中有广泛应用,大部分用于合成香料,例如香兰素、洋茉莉醛等。利用乙二醛(OHC-CHO)催化氧化法是合成乙醛酸的方法之一,反应原理为:。可能发生副反应有:
(1)已知相关共价键的键能数据如表:
共价键 C-H O-H C-O C=O O=O C-C
键能/kJ·mol-1 413 462 351 745 497 348
则ΔH1= kJ·mol-1。
(2)在反应瓶内加入含1mol乙二醛的反应液2 L,加热至45~60℃,通入氧气并保持氧气压强为0.12Mpa,反应3h达平衡状态,得到的混合液中含0.84mol乙醛酸,0.12mol草酸,0.04mol乙二醛(溶液体积变化可忽略不计)。
①乙二醛的转化率 ,草酸的平均生成速率为 mol·L-1·h-1。
②乙醛酸制备反应的经验平衡常数K= 。(溶液中的溶质用物质的量浓度表示、气体物质用分压代替平衡浓度)结合化学反应原理,简述改变氧气压强对乙醛酸制备反应的影响 。
(3)研究了起始时氧醛比[]、催化剂用量和温度对乙醛酸产率的影响,如图1、图2、表1所示。
表1 温度对乙醛酸合成的影响
温度t(℃) 乙醛酸产率(%) 草酸产率(%) 产品色泽
30~45 46.2 8.6 洁白
45~60 82.4 16.0 白
60~75 81.6 18.2 微黄
①选择最佳氧醛比为 ;催化剂的合适用量为 。
②选择温度在45~60℃的理由是 。
12.以CO和H2为原料生产二甲醚(CH3OCH3)主要发生以下三个反应
(1)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H
该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4 molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为 mol·L—1min—1,CO的转化率为 。
(3)下列措施中,既能加快反应速率又能提高CH3OCH3产率的有 。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是 。
13.某化学兴趣小组的同学用以下装置研究电化学的问题。
(1)甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是 ,电池的总反应式用离子方程式表示为 。当导线中有1mol电子通过时,理论上两极的变化是 (填序号)。
A.锌片溶解了32.5g B.锌片增重32.5g
C.铜片上析出lgH2 D.铜片上析1molH2
(2)若乙装置中X、Y都是惰性电极,a是滴有酚酞试液的饱和NaCl溶液。
乙
则:X极上的电极反应式为 ,在X极附近观察到的现象是 ;Y极上的电极反应式为 ,检验该电极反应产物的方法是 。
(3)若要通过乙装置用电解方法精炼粗铜,电解质溶液a选用CuSO4溶液,则X电极的材料是 ,X极的电极反应式为 。
14.依据电化学知识,解决下列问题:
(1)图1为锌银电池,负极是Zn,正极是Ag2O,电解质是KOH。写出该电池负极电极反应式: ,电池工作时,正极区周围溶液的pH (填“增大”、“减小”、“不变”)。
(2)图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用该燃料电池为电源进行粗铜的精炼实验。
①写出A极的电极反应式: 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LO2时,C电极的质量变化为 。
15.NaCl 是一种基础化工原料,NaOH 也是一种基础化工原料,他们在生产、生活中有广泛的用途。请根据所学知识回答下列问题。
(1)请写出电解饱和食盐水的化学方程式: 。
(2)证明生产产物中的 Cl2 的方法是 。
(3)在电解饱和食盐水所涉及到的物质中,属于强电解质的是 。属于弱电解质的是 。写出该弱电解质的电离方程式 。
(4)电解产生的 Cl2 经过压缩后变成液氯,这是 (填“物理”或“化学”)变化,常通过管道进行输送到灌装车间,若管道不慎破裂,常用氨水来检查破裂处,破裂处会观察到大量 NH4Cl 白烟和 N2,请写出化学方程式 。
16.Ⅰ、下表是某研究性学习小组探究稀硫酸与金属锌反应的实验数据:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol·L-1 V(H2SO4)/mL 溶液温度/℃ 金属消失的时间/s
反应前 反应后
1 0.10 丝 0.5 50 20 34 500
2 0.10 粉末 0.5 50 20 35 50
3 0.10 丝 0.7 50 20 46 250
4 0.10 丝 0.8 50 20 35 200
5 0.10 粉末 0.8 50 20 36 25
6 0.10 丝 1.0 50 20 35 125
7 0.10 丝 1.0 50 35 50 50
8 0.10 丝 1.1 50 20 34 100
9 0.10 丝 1.1 50 35 51 40
实验数据可发现有一个数据明显有错误,该数据是实验 (填实验序号),理由是
Ⅱ、在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)2SO3(g) △H<0
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C. 降低温度 D.增加SO3的物质的量
17.工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
(1)用NaOH溶液吸收SO2发生的主要反应的离子方程式为 。
(2)图中,交换膜I应为 (填“阳离子”或“阴离子”)交换膜。
(3)当有1mol Na+通过阳离子交换膜时,a极生成气体 L(标准状况)。
(4)SO放电的电极反应式为 。
(5)通电开始后,阴极附近溶液pH会增大,请简述原因: 。
18.如图为相互串联的甲、乙两电解池,试回答以下问题:
(1)甲池若为用电解原理精炼铜的装置,则A是 极,材料是 ,电极反应式为 ,电解质溶液为 。当一极有纯铜析出时,另一极溶解的铜 (填“大于”“小于”或“等于”)。
(2)乙池中若滴入少量酚酞试液,电解一段时间后电极附近溶液呈 色,电极反应式为 。
(3)若甲池中电解质溶液为溶液,电解过程中阴极质量增加,则乙池中阳极放出的气体在标准状况下的体积为 L,若此时乙池剩余液体为,则电解后溶液的为 。
19.氢氧燃料电池是符合绿色化学理念的新型电源。如图为电池示意图,
请回答:
(1)通入H2的电极为 (填“正”或“负”)极,发生 反应(填“氧化”或“还原”),正极的电极反应式为 。
(2)标准状况下,通入5.6LH2,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
20.(1)利用电镀原理在铁件表面镀铜。装置如图所示:
①电镀时镀件作 (填“阳”或“阴”)极。
②与A连接的电极上发生的反应是 。
③若电镀前铁,铜两电极的质量相同,电镀完成后将它们取出,洗净、烘干、称量,二者质量差为1.28g,则电镀时电路中通过的电子为 mol。
(2)用如图所示装置进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是 (填标号)。
A.若阴极得到的电子数为2NA,则阳极质量减少64g
B.粗铜接A极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Au
三、实验探究题
21.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式 。
(2)乙中总反应的离子方程式: 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有 。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析
22.工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如图:
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为 ,“沉砷”中所用Na2S的电子式为 。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS;“沉砷”中FeSO4的作用是 。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是 (写名称)。并写出对应反应的离子方程式 。
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式 。
(5)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为 。
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为 。(填化学式)
23.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如下的实验:
Ⅰ.原电池原理判断金属的活泼性
(1)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,根据他的判断,两个装置中的Al是 极;实际实验时发现两个装置中的电流表偏转方向不同,则以下的判断正确的是
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
(2)乙同学设计了如图的实验装置,并测量和绘制了原电池的电流强度(I)随时间(t)的变化曲线,则图中0~t1阶段,负极材料是 ,正极的电极反应式是 ,t1后,外电路中电流方向发生改变,其原因是
Ⅱ.原电池原理改变化学反应速率
(3)丙同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是 。
(4)丁同学进一步研究硫酸铜用量的多少对反应速率的具体影响,设计了如下一系列实验,将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
A B C D E F
4mol/LH2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
则实验中V1= ,V6= ,V9= ;实验中有的需要加入一定体积的水,其作用是 ;实验结果发现:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.不可用稀HNO3作电解质溶液,否则得不到氢气,铁与硝酸反应生成硝酸铁、水和氮的氧化物,故A错误;
B.原电池中阳离子向正极移动,溶液中H+移向正极,故B错误;
C.电池放电过程中电解质溶液中氢离子减小,pH值增大,故C错误;
D.用铁作负极,Fe-2e-=Fe2+,铁质量不断减少,故D正确;
故选D。
2.B
【详解】A.燃料电池能将化学能转化为电能,故A错误;
B.电流从电极a经由导线流向电极b, a极为正极,电极反应为O2+2H2O+4e-=4OH-,故B正确;
C.电流从电极a经由导线流向电极b, a极为正极、b是负极,溶液中的OH-从a向b移动,故C错误;
D.氢氧燃料电池总反应为2H2 + O2 =2H2O,反应生成水,氢氧化钾浓度减小,电池中电解液的pH逐渐减小,故D错误;
选B。
3.D
【分析】b电极碳生成二氧化碳,化合价升高发生氧化反应,是阳极,那么a是阴极,据此回答问题。
【详解】A. 电解过程中,电解质中阳离子向阴极移动、阴离子向阳极移动,所以F-向阳极移动,即向b极移动,故A错误;
B. 在氟化物体系(ErF3一LiF)中电解氧化铒的目的是增强导电性,故B错误;
C. 根据图知,阳极上生成二氧化碳,则阳极反应式为C+2O2- -4e-=CO2,故C错误;
D. b极每生成标准状况16.8 L气体即物质的量是0.75mol时,由反应式C+2O2- -4e-=CO2,转移电子3mol,根据阴极得电子数等于阳极失电子数,可知阴极生成1 mol Er,故D正确;
故选:D。
4.D
【分析】该燃料电池中,通入甲烷的电极是负极、通入氧气的电极是正极,
【详解】A.电子流出的电极为负极、电子流入的电极为正极,电子从a沿导线流向b,A错误;
B.b电极上氧气得电子生成氧离子,电极反应式为O2+4e-=2O2-,B错误;
C.温度和压强未知导致气体摩尔体积未知,所以无法计算甲烷体积,C错误;
D.电解质中阴离子向负极移动,则O2-由正极通过固体电解质 YSZ 迁移到负极,D正确。
答案为D。
5.B
【详解】A.根据图甲可知,原电池中为负极,失电子,得电子,所以甲电池反应的离子方程式为,金属活动性Cd>Co, 故A正确;
B.根据图乙可知,原电池中为负极,失电子,得电子,所以乙电池反应的离子方程式为,金属活动性Co>Ag,则结合A中分析可知金属活动性Cd>Co>Ag,因此反应不能发生,故B错误;
C.原电池放电时,盐桥中的阴、阳离子定向移动使原电池内部形成通路,从而形成闭合回路,且盐桥可以使两个烧杯中的溶液保持电中性,故C正确;
D.根据可知,当有电子通过外电路时,正极有析出,故D正确;
答案为B。
6.B
【详解】A. 通过太阳能实现总反应H2O+CO2→H2+CO+O2可知:CeO2没有消耗,CeO2为催化剂,故A正确;
B.催化剂只能改变反应速率,影响反应历程,改变反应活化能,不影响平衡移动和转化率,故B错误;
C. 根据mCeO2(m-x)CeO2·xCe+xO2,mmol CeO2参加反应,气体物质的量增加x mol O2,故C正确;
D. CO在负极失电子生成CO2,在碱性条件下再与OH 生成CO32 ,故负极反应式应为:CO+4OH 2e ═CO32 +2H2O,故D正确;
答案选B。
7.B
【详解】A.当X接外接电源正极时,X极是阳极,此时Li+移向阴极,即进入离子储存层,故A错误;
B.当X接外接电源负极时,X为阴极,此时无色的WO3得电子被还原为蓝色的LiWO3,因此可以有效阻挡阳光,故B正确;
C.当Y接电源正极时,Y为阳极,电极反应为Li4Fe4[Fe(CN)6]3-4eˉ=Fe4[Fe(CN)6]3+4Li+,故C错误;
D.电致变色系统在较长时间的使用过程中,Li+不会参与电极反应,Li+的量可保持基本不变,故D错误;
故答案选B。
8.B
【分析】电解饱和Na2SO4溶液时,阳极上水电离出的OH-放电,失去电子发生氧化反应生成氧气,阴极上水电离出的H+放电,得到电子发生还原反应生成氢气,由于装置中放置了离子交换膜,在两极分别生成NaOH和H2SO4,需在阳极室一侧放置阴离子交换膜,只允许通过阴离子,在阴极一侧放置阳离子交换膜,只允许通过阳离子,则从E口处加入的物质为稀硫酸,阳极室的B出口放出氧气、A出口放出硫酸溶液,从G口处加入的物质为稀氢氧化钠溶液,阴极室的C出口放出氢气、D出口放出氢氧化钠溶液。
【详解】A.阳极上水电离出的OH-放电,失去电子发生氧化反应生成氧气,电极反应式为2H2O—4e—=4H++O2↑,故A错误;
B.由分析可知,阳极室中阳极上水电离出的OH-放电,破坏水的电离平衡,在阳极附近聚集大量氢离子,硫酸根通过阴离子交换膜a进入阳极室,则从A出口出来的是硫酸溶液,故B正确;
C.由分析可知,阳极室中阳极上水电离出的OH-放电,破坏水的电离平衡,在阳极附近聚集大量氢离子,硫酸根通过阴离子交换膜a进入阳极室,不允许氢离子通过,故C错误;
D.由分析可知,E、G处加入的物质分别为稀硫酸和稀氢氧化钠溶液,故D错误;
故选B。
9.A
【详解】A.由相对能量曲线可知,化合物1与CO2反应生成化合物2的过程中有两个过渡态TS11-2、TS21-2,说明这一过程包含两个基元反应,故A正确;
B.过程①的活化能为:(6.05-0.00)=6.05kJ·mol-1,②的活化能为:(11.28-2.08)=9.20kJ·mol-1,过程①的活化能小于过程②的活化能,过程①的反应速率大于过程②的反应速率,故该过程的总反应速率主要由过程②决定,故B错误;
C.过程②为放热反应,升高温度,反应逆向进行,不利于过程②的进行,故C错误;
D.过程①的热化学方程式为:I(s)+CO2(g)=I1-2(s)△H=2.08kJ·mol-1,故D错误;
故选A。
10.B
【详解】A.通入空气的电极上发生还原反应,所以通入空气的电极为正极,则铁作阳极,阳极上铁失电子发生氧化反应,电极反应式为,选项A正确;
B.石墨电极上逸出的气体为氢气,生成(标准状况)氢气时转移电子的物质的量为,消耗甲烷转移电子的物质的量为,根据得失电子守恒得,消耗甲烷的物质的量为,选项B错误;
C.负极上甲烷失去电子并与结合生成和,电极反应式为,选项C正确;
D.水是弱电解质,其导电能力较弱,为了增强溶液的导电能力,可以加入强电解质,选项D正确。
答案选B。
11. -303 96% 0.02 3675(MPa)-1 增大压强,一方面可以加快乙醛酸制备反应的反应速率,另一方面也有利于增大乙二醛的转化率;(但是氧气压强不宜过高,过高会使乙醛酸进一步被氧化,减少乙醛酸的产率。) 0.55 0.20g 温度较低时,反应速率较慢;温度高于60℃,乙醛酸产率下降,副产物草酸产率增加,产品的纯度下降(产品的颜色可能是乙醛酸分解产物污染了产品)
【详解】(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,该反应的反应热为:2molC-H、1molO=O总键能与2molC-O、2molO-H总键能之差,△H1=2mol×413kJ mol-1+1mol×497kJ mol-1-2mol×(351kJ mol-1+462kJ mol-1)=-303kJ mol-1;
(2)在反应瓶内加入含1mol乙二醛的反应液2 L,加热至45~60℃,通入氧气并保持氧气压强为0.12Mpa,反应3h达平衡状态,得到的混合液中含0.84mol乙醛酸,0.12mol草酸,0.04mol乙二醛(溶液体积变化可忽略不计)。
①乙二醛的转化率为,草酸的平均生成速率为=0.02mol·L-1·h-1;
②根据反应,结合计算可知,乙醛酸的浓度为0.42mol/L,乙二醛的浓度为0.02mol/L,乙醛酸制备反应的经验平衡常数K==3765(MPa)-1;增大压强,一方面可以加快乙醛酸制备反应的反应速率,另一方面也有利于增大乙二醛的转化率;(但是氧气压强不宜过高,过高会使乙醛酸进一步被氧化,减少乙醛酸的产率);
(3) ①根据图1中氧醛比对产物产率的影响,选择最佳氧醛比为0.55;催化剂的合适用量为0.20g;
②温度较低时,反应速率较慢;温度高于60℃,乙醛酸产率下降,副产物草酸产率增加,产品的纯度下降(产品的颜色可能是乙醛酸分解产物污染了产品),故选择温度在45~60℃。
12. -263 kJ mol-1 K12·K2·K3 0.12mol·L 1·min 1 60% D 反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率
【详解】(1)由盖斯定律可得,总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ·mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12·K2·K3 .
(2)可用体积分数求出各物质的浓度,然后再利用平衡常数的公式求出平衡常数,相同条件下,气体的体积分数等于其物质的量分数,设参加反应的n(CO)=xmol,
该反应中 4H2(g)+2CO(g)CH3OCH3(g)+H2O(g),
开始(mol) 8.0 4.0 0 0
反应(mol) 2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物质的量分数= ×100%=1/6,解得:x=2.4;用CH3OCH3的浓度变化表示该反应的速率为 =0.12mol·L 1·min 1 ;则CO的转化率为2.4mol/4mol×100%=60%;(3)A、分离出二甲醚,降低生成物浓度,减慢反应速率,故A错误;B、升高温度,加快反应速率,平衡逆向移动,产率降低,故B错误;C、改用高效催化剂,加快反应速率,但平衡不移动,故C错误;D、增大压强,加快反应速率,平衡正向移动,能加快反应速率又能提高CH3OCH3产率,D正确;故选D。(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。
13. Cu Zn+2H+=Zn2++H2↑ AC 2H2O+2e-=H2+2OH- 有气泡产生,溶液变红色 2Cl--2e-=Cl2 湿润的淀粉KI试纸检验生成的气体,试纸变蓝 纯铜 Cu+2e-=Cu2+
【分析】(1)甲装置中锌做负极失电子生成锌离子,铜做正极,溶液中氢离子得到电子生成氢气,电池反应是锌和稀硫酸的反应,依据电子转移守恒计算和分析两个电极变化;
(2)电解池中,a是滴有酚酞试液的饱和NaCl溶液,X与电源负极连接做电解池的阴极,溶液中氢离子得到电子生成氢气;Y和电源连接做电解池的阳极,溶液中氯离子失电子生成氯气,阴极附近氢氧根离子浓度增大,溶液成红色,电极反应过程中生成氢氧化钠、氢气、氯气;
(3)电解方法精炼粗铜,粗铜做阳极,精铜做阴极,含铜离子的盐溶液做电解质溶液。
【详解】(1)甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是铜,溶液中氢离子得到电子生成氢气,电极反应2H++2e-=H2↑,锌做负极失电子生成锌离子,电极反应为:Zn-2e-=Zn2+,电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,当导线中有1mol电子通过时,负极锌物质的量减小0.5mol,质量减小0.5mol×65g/mol=32.5g;铜片上放出氢气,阳极电子守恒生成氢气的物质的量0.5mol,质量为0.5mol×2g/mol=1g,所以选项中AC正确;
故答案为:Cu;Zn+2H+=Zn2++H2↑;AC;
(2)电解池中,a是滴有酚酞试液的饱和NaCl溶液,X与电源负极连接做电解池的阴极,溶液中氢离子得到电子生成氢气,电极反应式为:2H2O+2e-=H2+2OH-,溶液显碱性,溶液变红色;Y和电源连接做电解池的阳极,溶液中氯离子失电子生成氯气,电极反应式:2Cl--2e-=Cl2,检验氯气的方法为用湿润的淀粉KI试纸放在出口,试纸变蓝;
故答案为:2H2O+2e-=H2+2OH-;有气泡产生,溶液变红色;2Cl--2e-=Cl2;湿润的淀粉KI试纸检验生成的气体,试纸变蓝;
(3)电解方法精炼粗铜,电解质溶液a选用CuSO4溶液,阳极Y为粗铜,阴极x为纯铜,铜离子得到电子生成铜,电极反应为Cu2++2e-=Cu;故答案为:纯铜;Cu2++2e-=Cu。
【点睛】考查了原电池、电解池原理的分析应用,主要是电极反应,电极产物判断,掌握基础是关键。
14. Zn+2OH--2e-=Zn(OH)2 增大 CO-2e-+CO32-=2CO2 D 增加12.8g
【详解】(1) 图1为锌银电池,负极是Zn,正极是Ag2O,电解质是KOH。
则负极电极反应式为:Zn-2e-+2OH-=Zn(OH)2 答案为:Zn-2e-+2OH-=Zn(OH)2;
正极电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-,因此,电池工作时,正极区周围溶液的pH增大。答案为:增大.
(2) ①图2中,A电极为负极,从箭头所指方向我们可确定反应物为CO、CO32-,生成物为CO2。电极反应式为:CO-2e-+CO32-=2CO2 答案为:CO-2e-+CO32-=2CO2;
②因为粗铜应作阳极,所以粗铜应与燃料电池的正极即B电极相连。答案为D.
③利用得失电子守恒,可建立如下关系式:
O2 ——2Cu
0.1mol 0.2mol
答案为:增加12.8g.
15. 2NaCl+2H2O2NaOH+H2↑+Cl2 ↑ 将湿润的淀粉碘化钾试纸置于试管口,若试纸变蓝色则产生了氯气 氯化钠、氢氧化钠 水 H2O H+ +OH- 物理 8NH4Cl+3Cl2=6NH4Cl+N2
【分析】(1)电解食盐水时,氯离子在阳极放电生成氯气,氢离子在阴极放电生成氢气;
(2)检验氯气是利用湿润的碘化钾淀粉试纸变蓝证明;
(3)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,完全电离的电解质是强电解质,部分电离的是弱电解质。
(4)物质的三态变化是物理变化;氯气能够氧化氨气生成氮气,据此分析。
【详解】(1)电解食盐水时,氯离子在阳极放电生成氯气,氯气是黄绿色气体,有刺激性气味,氢离子在阴极放电生成氢气,电解方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2 ↑;
故答案为:2NaCl+2H2O2NaOH+H2↑+Cl2 ↑;
(2)检验氯气是利用氯气的氧化性,氯气把碘离子氧化为碘单质,碘能够使淀粉溶液变蓝,因此反应产生的气体遇到湿润的碘化钾淀粉试纸变蓝的现象,即可证明反应产生了氯气;
故答案为:将湿润的淀粉碘化钾试纸置于试管口,若试纸变蓝色则产生了氯气。
(3) 根据电解质与非电解质、强电解质与弱电解质的概念可知:在电解饱和食盐水所涉及到的物质中,属于强电解质的是氯化钠、氢氧化钠;属于弱电解质的是水,其电离方程式为:H2O H+ +OH-。
故答案为:氯化钠、氢氧化钠;水;H2O H+ +OH-
(4) Cl2经过压缩后变成液氯,属于物理变化;氯气能够氧化氨气生成氮气,化学方程式为: 8NH4Cl+3Cl2=6NH4Cl+N2 ;
故答案为:物理;8NH4Cl+3Cl2=6NH4Cl+N2
【点睛】本题通过电解饱和食盐水考查了电解方程式的书写、电极产物的检验、电解质与非电解质、强电解质与弱电解质的辨析等内容,题目难度不大。
16. ③ 硫酸均过量,锌均全部反应,且锌质量一样,故反应放出热量一样,使等体积溶液温度升高值相近 15~20min和25~30 min 增加了O2的量 A B
【详解】Ⅰ等量的金属和酸反应放出的热量基本相同,实验③中,硫酸均过量,锌均全部反应,且锌质量一样,故反应放出热量一样,使等体积溶液温度升高值相近;正确答案:③;硫酸均过量,锌均全部反应,且锌质量一样,故反应放出热量一样,使等体积溶液温度升高值相近 。
Ⅱ、(1)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可以知道在和出现平台,各组分的物质的量不变,反应处于平衡状态;正确答案:和。
(2)由图可以知道,反应进行至时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;由图可以知道,反应向正反应进行,到反应混合物单位时间内的变化量增大,说明反应速率增大,改变瞬间,各物质的物质的量不变;加了催化剂,增大反应速率, A正确;缩小容器体积,增大压强,增大反应速率,B正确; 降低温度反应速率降低,C错误;改变瞬间,各物质的物质的量不变,不是增加的物质的量,D错误;正确答案:增大氧气的浓度;AB.
17. SO2+2OH-=+H2O 阳离子 11.2 -2e-+H2O=+2H+ H+放电促进水的电离,使OH-浓度增大
【分析】电解Na2SO3溶液过程中,若要实现循环再生NaOH,同时得到H2SO4,则发生氧化反应生成,因此b电极发生氧化反应,移向右侧,电极反应为:-2e-+H2O=+2H+,交换膜II为阴离子交换膜,a电极发生还原反应,Na+移向左侧,电极反应为:2H2O+2e-=H2↑+2OH-,交换膜I为阳离子交换膜,据此解答。
【详解】(1)NaOH溶液吸收SO2发生的主要反应为2NaOH+SO2=Na2SO3+H2O,离子方程式为:SO2+2OH-=+H2O;
(2)由上述分析可知,交换膜I为阳离子交换膜;
(3)当有1mol Na+通过阳离子交换膜时,电解池中有1mol电子转移,根据a极电极反应式2H2O+2e-=H2↑+2OH-可知,将生产0.5molH2,在标准状况下体积为0.5mol×22.4L/mol=11.2L;
(4)发生氧化反应生成,电极反应式为-2e-+H2O=+2H+;
(5)通电后,阴极电极反应式为2H2O+2e-=H2↑+2OH-,其本质是水电离出的H+放电,电解过程中促进水的电离,使阴极负极溶液OH-浓度增大,从而使溶液pH增大。
18. 阴 纯铜 溶液 小于 红 4.48 14
【详解】与电源负极相连的电极是电解池的阴极,与电源正极相连的电极是电解池的阳极。由图示装置知甲池中A为阴极,B为阳极,乙池中为阴极,C(碳棒)为阳极。
(1)甲池若为用电解原理精炼铜的装置,则A是阴极,材料是纯铜,电极反应式为,电解质溶液为溶液,阳极材料为粗铜,电极反应式为等(据粗铜中杂质成分而定),根据电极反应和得失电子守恒知,阴极有纯铜析出时,阳极溶解的铜小于。
(2)乙池中实质是电解溶液,C(碳棒)为电解池的阳极,放电生成氯气,铁 为电解池的阴极,电极反应式为,阴极区溶液呈碱性,若滴入少量酚酞试液,电解一段时间后电极附近溶液呈红色。
(3)若甲池电解质溶液为溶液,阴极质量增加,即生成铜的质量为,物质的量为,根据电极反应式知,转移电子的物质的量为,根据得失电子守恒知乙池中阳极放出氯气的物质的量为,在标准状况下的体积为;甲乙两池串联,转移电子数相等,根据知,生成的物质的量为,溶液的体积为0.4L,,故溶液。
19. 负 氧化 O2+4e +2H2O=4OH- 0.4
【分析】由图可知该装置为氢氧燃料电池,通入H2的电极为负极,发生氧化反应,通入O2的电极为正极,发生还原反应,根据氧化还原反应中得失电子守恒进行计算。
【详解】(1)根据上述分析:通入H2的电极为负极,发生氧化反应;通入O2的电极为正极,发生还原反应,则正极的电极反应式为O2+4e +2H2O=4OH-,故答案:负;氧化;O2+4e +2H2O=4OH-;
(2)标准状况下,5.6LH2为0.25mol,若能量转化率为80%,根据H2-2e-+2OH-=2H2O,则导线中通过电子的物质的量=0.25mol 2=0.4mol,故答案:0.4mol。
20. 阴 Cu-2e-=Cu2+ 0.02 BD
【分析】(1)镀铜时,铜作阳极,失电子生成铜离子,而镀件作阴极,铜离子得电子生成单质铜。
(2)铜的电解精炼时,粗铜作阳极,失电子生成离子,而溶液中的铜离子在阴极得电子生成单质铜。
【详解】(1)①电镀时镀件上要生成铜,发生还原反应,所以镀件作电解池的阴极。
②A为直流电源的正极,与A连接的电极作阳极,即铜作阳极,失去电子发生氧化反应,电极反应是Cu-2e-=Cu2+。
③阳极上铜失电子发生氧化反应,阴极上Cu2+得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为1.28g,二者质量差的一半为阴极析出的铜,则转移电子的物质的量=×2=0.02mol。
(2)A.粗铜作为阳极,则粗铜中的Al、Zn、Cu都可以失去电子,所以当转移电子数为2mol时,阳极质量减少量不能确定,A说法错误;
B.电解精炼,粗铜发生氧化反应生成铜离子进入溶液,所以粗铜接A极,发生氧化反应,B说法正确;
C.溶液中Cu2+向阴极移动,得电子发生还原反应生成Cu,C说法错误;
D.在精炼过程中,粗铜中Ag、Au不放电,在电极下形成阳极泥,所以利用阳极泥可回收Ag、Au,D说法正确;
答案为BD。
21. 2H++2e-==H2↑ 2Al+2OH-+2H2O==2AlO2-+3H2↑ Mg Al AD
【详解】(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,正极反应为2H++2e-=H2↑,负极反应为Mg-2e-=Mg2+;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,电池总反应为:2Al+2OH-+2H2O==2AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故错误;
C.该实验对研究物质的性质有实用价值,和金属活动顺序表无关,不是活泼的金属在原电池中一定做负极,故错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故正确;
故选AD。
22. 33 与过量的S2-结合生成FeS沉淀,防止As2O3与S2-结合生成AsS(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果) 稀硫酸、高锰酸钾溶液 Fe3O4+8H+=Fe2++2Fe3++4H2O 、5 Fe2+ ++ 8H+ = 5Fe3+ + Mn2+ + 4H2O AsO+I2+2OH-=2I-+AsO+H2O 2AsO+2SO2+2H+=As2O3+2SO+H2O SO2
【分析】酸性高浓度含砷废水加入硫化钠、硫酸亚铁,其中硫酸亚铁可除去过量的硫离子,过滤得到As2S3和FeS,焙烧,可生成As2O3、氧化铁,加入氢氧化钠溶液生成Na3AsO3,氧化生成Na3AsO4,生成的气体为二氧化硫,与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3,以此解答该题。
【详解】(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素在P的下一周期,原子序数为15+18=33,硫化钠为离子化合物,电子式为,故答案为:33;;
(2)FeSO4的作用是除去过量的硫离子,As2S3+3S2 2使平衡逆向进行,提高沉砷效果,亚铁离子与过量的S2 结合生成FeS沉淀,防止As2O3与S2 结合生成,故答案为:与过量的S2-结合生成FeS沉淀,防止As2O3与S2-结合生成AsS(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果);
(3)四氧化三铁含有+2价铁,具有还原性,可在酸性条件下与高锰酸钾反应,溶液褪色,则可用硫酸、高锰酸钾检验,离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O、5 Fe2+ ++ 8H+ = 5Fe3+ + Mn2+ + 4H2O,故答案为:稀硫酸、高锰酸钾溶液;Fe3O4+8H+=Fe2++2Fe3++4H2O、5 Fe2+ ++ 8H+ = 5Fe3+ + Mn2+ + 4H2O;
(4)单质碘具有氧化性,碱性条件下和AsO反应生成2I-和AsO,离子方程式为:AsO+I2+2OH-=2I-+AsO+H2O,故答案为:AsO+I2+2OH-=2I-+AsO+H2O;
(5)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为2AsO+2SO2+2H+=As2O3+2SO+H2O,故答案为:2AsO+2SO2+2H+=As2O3+2SO+H2O;
(6) As4S4中As为+2价、S为 2价,且生成As2O3,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole ,则4molS元素化合价升高6价,生成物化合价为+4价,应为SO2,故答案为:SO2。
【点睛】本题考查了物质制备方案设计,制备类化学流程题注意①先是确定要制备什么物质,从题干或问题中获取有用信息,②分析流程中的每一步骤,从几个方面了解流程:反应物是什么?反应方程式是什么?该反应造成了什么后果?对制造产品有什么作用?③从问题中获取信息,帮助解题。标准化问题要标准化回答。
23. 正 AD Al 2H++NO3-+e-=NO2↑+H2O 开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变 Ag2SO4 30 10 17.5 确保所有实验中溶液总体积相等,有效控制变量,只研究CuSO4浓度对反应速率的影响 当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降
【分析】Ⅰ.(1)实际发生自发性氧化还原反应的物质,前一装置中金属与氢离子反应,而后一装置中是铝与碱溶液反应,两者发生的反应不同;
(2)乙同学设计的实验装置,铝、铜、浓硝酸构成的原电池,根据测量和绘制原电池的电流强度(I)随时间(t)的变化曲线,电流先减小,且电流方向改变,后由小变大,开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,锌能将Ag2SO4中的银置换出来,银、锌、硫酸构成原电池加快反应速率;
(4)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同。A组中硫酸为30mL,那么其它组硫酸量也都为30mL。而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,所以V6=10mL,V9=17.5mL,V1=30mL;当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降。
【详解】Ⅰ.(1)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,根据他的判断,铝活泼性比镁弱,两个装置中的Al是正极;实际实验时发现两个装置中的电流表偏转方向不同:
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质,注意实际发生自发性氧化还原反应的物质,前一装置中金属与氢离子反应,而后一装置中是铝与碱溶液反应,两者发生的反应不同,故A正确;
B.镁的金属性一定比铝的金属性强,故B错误;
C.两实验的反应实质不同,不能得出:“金属活动性顺序已过时,已没有实用价值”的结论,故C错误;
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析,故D正确;
故答案为:正;AD;
(2)乙同学设计的实验装置,根据测量和绘制原电池的电流强度(I)随时间(t)的变化曲线,电流先减小,且电流方向改变,后由小变大,则图中0~t1阶段,铝比铜还原性强,铝先与硝酸反应,还原剂是铝,负极材料是Al,正极硝酸根离子得电子发生还原反应,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,t1后,外电路中电流方向发生改变,其原因是开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变;
故答案为:Al;2H++NO3-+e-=NO2↑+H2O;开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变;
Ⅱ.(3)Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,锌能将Ag2SO4中的银置换出来,银、锌、硫酸构成原电池加快反应速率,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4。故答案为:Ag2SO4;
(4)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同。A组中硫酸为30mL,那么其它组硫酸量也都为30mL。而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,所以V6=10mL,V9=17.5mL,V1=30mL,各量如表:
A B C D E F
4mol/LH2SO4/mL 30 V130 V230 V330 V430 V530
饱和CuSO4溶液/mL 0 0.5 2.5 5 V610 20
H2O/mL V720 V819.5 V917.5 V1015 10 0
则实验中V1=30,V6=10,V9=17.5;实验中有的需要加入一定体积的水,其作用是确保所有实验中溶液总体积相等,有效控制变量,只研究CuSO4浓度对反应速率的影响;实验结果发现:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。氢气生成速率下降的主要原因当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降。
故答案为:30;10;17.5;确保所有实验中溶液总体积相等,有效控制变量,只研究CuSO4浓度对反应速率的影响;当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降。
【点睛】本题考查了原电池原理、反应速率计算和化学平衡化学反应速率的影响因素等,涉及化学反应速率、化学平衡的计算以及平衡移动等问题,侧重于学生的分析能力和计算能力的考查,题目难度中等。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.某原电池反应的离子方程式为Fe+ 2H+=Fe2++H2↑,则下列说法中正确的是
A.可用稀HNO3作电解质溶液 B.溶液中H+移向负极
C.电池放电过程中电解质溶液pH值减小 D.用铁作负极,铁质量不断减少
2.氢氧燃料电池被人们誉为“绿色电池”,具有广阔的发展前途。如图为电池示意图。已知电池工作时,电流从电极a经由导线流向电极b。则下列说法正确的是( )
A.该燃料电池能将电能转化为化学能
B.a极的反应为:O2+2H2O+4e-=4OH-
C.溶液中的OH-从右室向左室移动
D.电池中电解液的pH逐渐增大
3.铒可作某些荧光材料的激活剂,利用电解法制备金属铒的示意图如图,下列说法正确的是( )
A.电解过程中,F-向a极移动
B.在氟化物体系(ErF3一LiF)中电解氧化铒的目的是稀释氧化铒的浓度
C.b极生成CO2的电极反应式为C+2O2- +4e-=CO2
D.b极每生成标准状况16.8 L气体时,阴极生成1 mol Er
4.一种以天然气为燃料的固体氧化物燃料电池的原理如图所示,其中 YSZ为6%~10%Y2O3掺杂的 ZO2固体电解质,下列有关叙述正确的是
A.电子通过外电路从 b 极流向 a
B.b 极上的电极反应式为
C.每转移 电子,消耗 的
D.由正极通过固体电解质 YSZ 迁移到负极
5.图甲和图乙是双液原电池装置。由图可判断下列说法中错误的是
A.图甲电池反应的离子方程式为
B.反应能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.当图乙中有电子通过外电路时,正极有析出
6.某科学家利用二氧化饰(CeO2)在太阳能作用下将H2O、CO2转变为H2、 CO,其过程如下所示:
mCeO2(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+x H2O+xCO2mCeO2+xH2+xCO2
下列说法不正确的是
A.该过程中CeO2是H2O、CO2转变为H2、CO反应的催化剂
B.利用CeO2作催化剂-既可使该转变过程速率提高。亦可减小能量的消 耗,并可提高反应物转化率
C.mmol CeO2参加反应,气体物质的量增加x mol
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH - - 2e = CO32- +2H2O
7.电致变色系统常用于汽车玻璃中,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。下列有关说法正确的是
已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色。
A.当X接电源正极时,此时Li+ 脱离离子储存层
B.当X接电源负极时,膜的透射率降低,可以有效阻挡阳光
C.当Y接电源正极时,离子储存层发生反应为:
D.在较长时间使用过程中,导电性聚合物电解质中Li+会大量减少
8.现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
A.阳极反应式为2H++2e-=H2↑ B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H+通过 D.E、G处加入的物质均为H2O
9.中科院化学研究所最新报道了化合物1催化CO2的氢化机理。其中化合物1(催化剂,固态)→化合物2(中间产物,固态)的过程和其相对能量曲线如图所示。下列有关该过程的说法正确的是
A.过程中经历两个过渡态TS11-2、TS21-2,说明该过程包含两个基元反应
B.该过程的总反应速率主要由过程①决定
C.升高温度,有利于过程②的进行
D.过程①的热化学方程式为I(s)+CO2(g)=I1-2(s)△H=-2.08kJ mol-1
10.电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是
A.铁电极的电极反应式为
B.若左池石墨电极产生(标准状况)气体,则消耗甲烷
C.通入甲烷的石墨电极的电极反应式为
D.为了增强污水的导电能力,可向污水中加入适量工业用食盐
二、填空题
11.乙醛酸(OHC-COOH)是一种重要的精细化学品,在有机合成中有广泛应用,大部分用于合成香料,例如香兰素、洋茉莉醛等。利用乙二醛(OHC-CHO)催化氧化法是合成乙醛酸的方法之一,反应原理为:。可能发生副反应有:
(1)已知相关共价键的键能数据如表:
共价键 C-H O-H C-O C=O O=O C-C
键能/kJ·mol-1 413 462 351 745 497 348
则ΔH1= kJ·mol-1。
(2)在反应瓶内加入含1mol乙二醛的反应液2 L,加热至45~60℃,通入氧气并保持氧气压强为0.12Mpa,反应3h达平衡状态,得到的混合液中含0.84mol乙醛酸,0.12mol草酸,0.04mol乙二醛(溶液体积变化可忽略不计)。
①乙二醛的转化率 ,草酸的平均生成速率为 mol·L-1·h-1。
②乙醛酸制备反应的经验平衡常数K= 。(溶液中的溶质用物质的量浓度表示、气体物质用分压代替平衡浓度)结合化学反应原理,简述改变氧气压强对乙醛酸制备反应的影响 。
(3)研究了起始时氧醛比[]、催化剂用量和温度对乙醛酸产率的影响,如图1、图2、表1所示。
表1 温度对乙醛酸合成的影响
温度t(℃) 乙醛酸产率(%) 草酸产率(%) 产品色泽
30~45 46.2 8.6 洁白
45~60 82.4 16.0 白
60~75 81.6 18.2 微黄
①选择最佳氧醛比为 ;催化剂的合适用量为 。
②选择温度在45~60℃的理由是 。
12.以CO和H2为原料生产二甲醚(CH3OCH3)主要发生以下三个反应
(1)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H
该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4 molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为 mol·L—1min—1,CO的转化率为 。
(3)下列措施中,既能加快反应速率又能提高CH3OCH3产率的有 。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是 。
13.某化学兴趣小组的同学用以下装置研究电化学的问题。
(1)甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是 ,电池的总反应式用离子方程式表示为 。当导线中有1mol电子通过时,理论上两极的变化是 (填序号)。
A.锌片溶解了32.5g B.锌片增重32.5g
C.铜片上析出lgH2 D.铜片上析1molH2
(2)若乙装置中X、Y都是惰性电极,a是滴有酚酞试液的饱和NaCl溶液。
乙
则:X极上的电极反应式为 ,在X极附近观察到的现象是 ;Y极上的电极反应式为 ,检验该电极反应产物的方法是 。
(3)若要通过乙装置用电解方法精炼粗铜,电解质溶液a选用CuSO4溶液,则X电极的材料是 ,X极的电极反应式为 。
14.依据电化学知识,解决下列问题:
(1)图1为锌银电池,负极是Zn,正极是Ag2O,电解质是KOH。写出该电池负极电极反应式: ,电池工作时,正极区周围溶液的pH (填“增大”、“减小”、“不变”)。
(2)图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用该燃料电池为电源进行粗铜的精炼实验。
①写出A极的电极反应式: 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LO2时,C电极的质量变化为 。
15.NaCl 是一种基础化工原料,NaOH 也是一种基础化工原料,他们在生产、生活中有广泛的用途。请根据所学知识回答下列问题。
(1)请写出电解饱和食盐水的化学方程式: 。
(2)证明生产产物中的 Cl2 的方法是 。
(3)在电解饱和食盐水所涉及到的物质中,属于强电解质的是 。属于弱电解质的是 。写出该弱电解质的电离方程式 。
(4)电解产生的 Cl2 经过压缩后变成液氯,这是 (填“物理”或“化学”)变化,常通过管道进行输送到灌装车间,若管道不慎破裂,常用氨水来检查破裂处,破裂处会观察到大量 NH4Cl 白烟和 N2,请写出化学方程式 。
16.Ⅰ、下表是某研究性学习小组探究稀硫酸与金属锌反应的实验数据:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol·L-1 V(H2SO4)/mL 溶液温度/℃ 金属消失的时间/s
反应前 反应后
1 0.10 丝 0.5 50 20 34 500
2 0.10 粉末 0.5 50 20 35 50
3 0.10 丝 0.7 50 20 46 250
4 0.10 丝 0.8 50 20 35 200
5 0.10 粉末 0.8 50 20 36 25
6 0.10 丝 1.0 50 20 35 125
7 0.10 丝 1.0 50 35 50 50
8 0.10 丝 1.1 50 20 34 100
9 0.10 丝 1.1 50 35 51 40
实验数据可发现有一个数据明显有错误,该数据是实验 (填实验序号),理由是
Ⅱ、在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)2SO3(g) △H<0
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C. 降低温度 D.增加SO3的物质的量
17.工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
(1)用NaOH溶液吸收SO2发生的主要反应的离子方程式为 。
(2)图中,交换膜I应为 (填“阳离子”或“阴离子”)交换膜。
(3)当有1mol Na+通过阳离子交换膜时,a极生成气体 L(标准状况)。
(4)SO放电的电极反应式为 。
(5)通电开始后,阴极附近溶液pH会增大,请简述原因: 。
18.如图为相互串联的甲、乙两电解池,试回答以下问题:
(1)甲池若为用电解原理精炼铜的装置,则A是 极,材料是 ,电极反应式为 ,电解质溶液为 。当一极有纯铜析出时,另一极溶解的铜 (填“大于”“小于”或“等于”)。
(2)乙池中若滴入少量酚酞试液,电解一段时间后电极附近溶液呈 色,电极反应式为 。
(3)若甲池中电解质溶液为溶液,电解过程中阴极质量增加,则乙池中阳极放出的气体在标准状况下的体积为 L,若此时乙池剩余液体为,则电解后溶液的为 。
19.氢氧燃料电池是符合绿色化学理念的新型电源。如图为电池示意图,
请回答:
(1)通入H2的电极为 (填“正”或“负”)极,发生 反应(填“氧化”或“还原”),正极的电极反应式为 。
(2)标准状况下,通入5.6LH2,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
20.(1)利用电镀原理在铁件表面镀铜。装置如图所示:
①电镀时镀件作 (填“阳”或“阴”)极。
②与A连接的电极上发生的反应是 。
③若电镀前铁,铜两电极的质量相同,电镀完成后将它们取出,洗净、烘干、称量,二者质量差为1.28g,则电镀时电路中通过的电子为 mol。
(2)用如图所示装置进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是 (填标号)。
A.若阴极得到的电子数为2NA,则阳极质量减少64g
B.粗铜接A极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Au
三、实验探究题
21.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式 。
(2)乙中总反应的离子方程式: 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有 。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析
22.工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如图:
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为 ,“沉砷”中所用Na2S的电子式为 。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS;“沉砷”中FeSO4的作用是 。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是 (写名称)。并写出对应反应的离子方程式 。
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式 。
(5)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为 。
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为 。(填化学式)
23.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如下的实验:
Ⅰ.原电池原理判断金属的活泼性
(1)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,根据他的判断,两个装置中的Al是 极;实际实验时发现两个装置中的电流表偏转方向不同,则以下的判断正确的是
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
(2)乙同学设计了如图的实验装置,并测量和绘制了原电池的电流强度(I)随时间(t)的变化曲线,则图中0~t1阶段,负极材料是 ,正极的电极反应式是 ,t1后,外电路中电流方向发生改变,其原因是
Ⅱ.原电池原理改变化学反应速率
(3)丙同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是 。
(4)丁同学进一步研究硫酸铜用量的多少对反应速率的具体影响,设计了如下一系列实验,将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
A B C D E F
4mol/LH2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
则实验中V1= ,V6= ,V9= ;实验中有的需要加入一定体积的水,其作用是 ;实验结果发现:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.不可用稀HNO3作电解质溶液,否则得不到氢气,铁与硝酸反应生成硝酸铁、水和氮的氧化物,故A错误;
B.原电池中阳离子向正极移动,溶液中H+移向正极,故B错误;
C.电池放电过程中电解质溶液中氢离子减小,pH值增大,故C错误;
D.用铁作负极,Fe-2e-=Fe2+,铁质量不断减少,故D正确;
故选D。
2.B
【详解】A.燃料电池能将化学能转化为电能,故A错误;
B.电流从电极a经由导线流向电极b, a极为正极,电极反应为O2+2H2O+4e-=4OH-,故B正确;
C.电流从电极a经由导线流向电极b, a极为正极、b是负极,溶液中的OH-从a向b移动,故C错误;
D.氢氧燃料电池总反应为2H2 + O2 =2H2O,反应生成水,氢氧化钾浓度减小,电池中电解液的pH逐渐减小,故D错误;
选B。
3.D
【分析】b电极碳生成二氧化碳,化合价升高发生氧化反应,是阳极,那么a是阴极,据此回答问题。
【详解】A. 电解过程中,电解质中阳离子向阴极移动、阴离子向阳极移动,所以F-向阳极移动,即向b极移动,故A错误;
B. 在氟化物体系(ErF3一LiF)中电解氧化铒的目的是增强导电性,故B错误;
C. 根据图知,阳极上生成二氧化碳,则阳极反应式为C+2O2- -4e-=CO2,故C错误;
D. b极每生成标准状况16.8 L气体即物质的量是0.75mol时,由反应式C+2O2- -4e-=CO2,转移电子3mol,根据阴极得电子数等于阳极失电子数,可知阴极生成1 mol Er,故D正确;
故选:D。
4.D
【分析】该燃料电池中,通入甲烷的电极是负极、通入氧气的电极是正极,
【详解】A.电子流出的电极为负极、电子流入的电极为正极,电子从a沿导线流向b,A错误;
B.b电极上氧气得电子生成氧离子,电极反应式为O2+4e-=2O2-,B错误;
C.温度和压强未知导致气体摩尔体积未知,所以无法计算甲烷体积,C错误;
D.电解质中阴离子向负极移动,则O2-由正极通过固体电解质 YSZ 迁移到负极,D正确。
答案为D。
5.B
【详解】A.根据图甲可知,原电池中为负极,失电子,得电子,所以甲电池反应的离子方程式为,金属活动性Cd>Co, 故A正确;
B.根据图乙可知,原电池中为负极,失电子,得电子,所以乙电池反应的离子方程式为,金属活动性Co>Ag,则结合A中分析可知金属活动性Cd>Co>Ag,因此反应不能发生,故B错误;
C.原电池放电时,盐桥中的阴、阳离子定向移动使原电池内部形成通路,从而形成闭合回路,且盐桥可以使两个烧杯中的溶液保持电中性,故C正确;
D.根据可知,当有电子通过外电路时,正极有析出,故D正确;
答案为B。
6.B
【详解】A. 通过太阳能实现总反应H2O+CO2→H2+CO+O2可知:CeO2没有消耗,CeO2为催化剂,故A正确;
B.催化剂只能改变反应速率,影响反应历程,改变反应活化能,不影响平衡移动和转化率,故B错误;
C. 根据mCeO2(m-x)CeO2·xCe+xO2,mmol CeO2参加反应,气体物质的量增加x mol O2,故C正确;
D. CO在负极失电子生成CO2,在碱性条件下再与OH 生成CO32 ,故负极反应式应为:CO+4OH 2e ═CO32 +2H2O,故D正确;
答案选B。
7.B
【详解】A.当X接外接电源正极时,X极是阳极,此时Li+移向阴极,即进入离子储存层,故A错误;
B.当X接外接电源负极时,X为阴极,此时无色的WO3得电子被还原为蓝色的LiWO3,因此可以有效阻挡阳光,故B正确;
C.当Y接电源正极时,Y为阳极,电极反应为Li4Fe4[Fe(CN)6]3-4eˉ=Fe4[Fe(CN)6]3+4Li+,故C错误;
D.电致变色系统在较长时间的使用过程中,Li+不会参与电极反应,Li+的量可保持基本不变,故D错误;
故答案选B。
8.B
【分析】电解饱和Na2SO4溶液时,阳极上水电离出的OH-放电,失去电子发生氧化反应生成氧气,阴极上水电离出的H+放电,得到电子发生还原反应生成氢气,由于装置中放置了离子交换膜,在两极分别生成NaOH和H2SO4,需在阳极室一侧放置阴离子交换膜,只允许通过阴离子,在阴极一侧放置阳离子交换膜,只允许通过阳离子,则从E口处加入的物质为稀硫酸,阳极室的B出口放出氧气、A出口放出硫酸溶液,从G口处加入的物质为稀氢氧化钠溶液,阴极室的C出口放出氢气、D出口放出氢氧化钠溶液。
【详解】A.阳极上水电离出的OH-放电,失去电子发生氧化反应生成氧气,电极反应式为2H2O—4e—=4H++O2↑,故A错误;
B.由分析可知,阳极室中阳极上水电离出的OH-放电,破坏水的电离平衡,在阳极附近聚集大量氢离子,硫酸根通过阴离子交换膜a进入阳极室,则从A出口出来的是硫酸溶液,故B正确;
C.由分析可知,阳极室中阳极上水电离出的OH-放电,破坏水的电离平衡,在阳极附近聚集大量氢离子,硫酸根通过阴离子交换膜a进入阳极室,不允许氢离子通过,故C错误;
D.由分析可知,E、G处加入的物质分别为稀硫酸和稀氢氧化钠溶液,故D错误;
故选B。
9.A
【详解】A.由相对能量曲线可知,化合物1与CO2反应生成化合物2的过程中有两个过渡态TS11-2、TS21-2,说明这一过程包含两个基元反应,故A正确;
B.过程①的活化能为:(6.05-0.00)=6.05kJ·mol-1,②的活化能为:(11.28-2.08)=9.20kJ·mol-1,过程①的活化能小于过程②的活化能,过程①的反应速率大于过程②的反应速率,故该过程的总反应速率主要由过程②决定,故B错误;
C.过程②为放热反应,升高温度,反应逆向进行,不利于过程②的进行,故C错误;
D.过程①的热化学方程式为:I(s)+CO2(g)=I1-2(s)△H=2.08kJ·mol-1,故D错误;
故选A。
10.B
【详解】A.通入空气的电极上发生还原反应,所以通入空气的电极为正极,则铁作阳极,阳极上铁失电子发生氧化反应,电极反应式为,选项A正确;
B.石墨电极上逸出的气体为氢气,生成(标准状况)氢气时转移电子的物质的量为,消耗甲烷转移电子的物质的量为,根据得失电子守恒得,消耗甲烷的物质的量为,选项B错误;
C.负极上甲烷失去电子并与结合生成和,电极反应式为,选项C正确;
D.水是弱电解质,其导电能力较弱,为了增强溶液的导电能力,可以加入强电解质,选项D正确。
答案选B。
11. -303 96% 0.02 3675(MPa)-1 增大压强,一方面可以加快乙醛酸制备反应的反应速率,另一方面也有利于增大乙二醛的转化率;(但是氧气压强不宜过高,过高会使乙醛酸进一步被氧化,减少乙醛酸的产率。) 0.55 0.20g 温度较低时,反应速率较慢;温度高于60℃,乙醛酸产率下降,副产物草酸产率增加,产品的纯度下降(产品的颜色可能是乙醛酸分解产物污染了产品)
【详解】(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,该反应的反应热为:2molC-H、1molO=O总键能与2molC-O、2molO-H总键能之差,△H1=2mol×413kJ mol-1+1mol×497kJ mol-1-2mol×(351kJ mol-1+462kJ mol-1)=-303kJ mol-1;
(2)在反应瓶内加入含1mol乙二醛的反应液2 L,加热至45~60℃,通入氧气并保持氧气压强为0.12Mpa,反应3h达平衡状态,得到的混合液中含0.84mol乙醛酸,0.12mol草酸,0.04mol乙二醛(溶液体积变化可忽略不计)。
①乙二醛的转化率为,草酸的平均生成速率为=0.02mol·L-1·h-1;
②根据反应,结合计算可知,乙醛酸的浓度为0.42mol/L,乙二醛的浓度为0.02mol/L,乙醛酸制备反应的经验平衡常数K==3765(MPa)-1;增大压强,一方面可以加快乙醛酸制备反应的反应速率,另一方面也有利于增大乙二醛的转化率;(但是氧气压强不宜过高,过高会使乙醛酸进一步被氧化,减少乙醛酸的产率);
(3) ①根据图1中氧醛比对产物产率的影响,选择最佳氧醛比为0.55;催化剂的合适用量为0.20g;
②温度较低时,反应速率较慢;温度高于60℃,乙醛酸产率下降,副产物草酸产率增加,产品的纯度下降(产品的颜色可能是乙醛酸分解产物污染了产品),故选择温度在45~60℃。
12. -263 kJ mol-1 K12·K2·K3 0.12mol·L 1·min 1 60% D 反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率
【详解】(1)由盖斯定律可得,总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ·mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12·K2·K3 .
(2)可用体积分数求出各物质的浓度,然后再利用平衡常数的公式求出平衡常数,相同条件下,气体的体积分数等于其物质的量分数,设参加反应的n(CO)=xmol,
该反应中 4H2(g)+2CO(g)CH3OCH3(g)+H2O(g),
开始(mol) 8.0 4.0 0 0
反应(mol) 2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物质的量分数= ×100%=1/6,解得:x=2.4;用CH3OCH3的浓度变化表示该反应的速率为 =0.12mol·L 1·min 1 ;则CO的转化率为2.4mol/4mol×100%=60%;(3)A、分离出二甲醚,降低生成物浓度,减慢反应速率,故A错误;B、升高温度,加快反应速率,平衡逆向移动,产率降低,故B错误;C、改用高效催化剂,加快反应速率,但平衡不移动,故C错误;D、增大压强,加快反应速率,平衡正向移动,能加快反应速率又能提高CH3OCH3产率,D正确;故选D。(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。
13. Cu Zn+2H+=Zn2++H2↑ AC 2H2O+2e-=H2+2OH- 有气泡产生,溶液变红色 2Cl--2e-=Cl2 湿润的淀粉KI试纸检验生成的气体,试纸变蓝 纯铜 Cu+2e-=Cu2+
【分析】(1)甲装置中锌做负极失电子生成锌离子,铜做正极,溶液中氢离子得到电子生成氢气,电池反应是锌和稀硫酸的反应,依据电子转移守恒计算和分析两个电极变化;
(2)电解池中,a是滴有酚酞试液的饱和NaCl溶液,X与电源负极连接做电解池的阴极,溶液中氢离子得到电子生成氢气;Y和电源连接做电解池的阳极,溶液中氯离子失电子生成氯气,阴极附近氢氧根离子浓度增大,溶液成红色,电极反应过程中生成氢氧化钠、氢气、氯气;
(3)电解方法精炼粗铜,粗铜做阳极,精铜做阴极,含铜离子的盐溶液做电解质溶液。
【详解】(1)甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料是铜,溶液中氢离子得到电子生成氢气,电极反应2H++2e-=H2↑,锌做负极失电子生成锌离子,电极反应为:Zn-2e-=Zn2+,电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,当导线中有1mol电子通过时,负极锌物质的量减小0.5mol,质量减小0.5mol×65g/mol=32.5g;铜片上放出氢气,阳极电子守恒生成氢气的物质的量0.5mol,质量为0.5mol×2g/mol=1g,所以选项中AC正确;
故答案为:Cu;Zn+2H+=Zn2++H2↑;AC;
(2)电解池中,a是滴有酚酞试液的饱和NaCl溶液,X与电源负极连接做电解池的阴极,溶液中氢离子得到电子生成氢气,电极反应式为:2H2O+2e-=H2+2OH-,溶液显碱性,溶液变红色;Y和电源连接做电解池的阳极,溶液中氯离子失电子生成氯气,电极反应式:2Cl--2e-=Cl2,检验氯气的方法为用湿润的淀粉KI试纸放在出口,试纸变蓝;
故答案为:2H2O+2e-=H2+2OH-;有气泡产生,溶液变红色;2Cl--2e-=Cl2;湿润的淀粉KI试纸检验生成的气体,试纸变蓝;
(3)电解方法精炼粗铜,电解质溶液a选用CuSO4溶液,阳极Y为粗铜,阴极x为纯铜,铜离子得到电子生成铜,电极反应为Cu2++2e-=Cu;故答案为:纯铜;Cu2++2e-=Cu。
【点睛】考查了原电池、电解池原理的分析应用,主要是电极反应,电极产物判断,掌握基础是关键。
14. Zn+2OH--2e-=Zn(OH)2 增大 CO-2e-+CO32-=2CO2 D 增加12.8g
【详解】(1) 图1为锌银电池,负极是Zn,正极是Ag2O,电解质是KOH。
则负极电极反应式为:Zn-2e-+2OH-=Zn(OH)2 答案为:Zn-2e-+2OH-=Zn(OH)2;
正极电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-,因此,电池工作时,正极区周围溶液的pH增大。答案为:增大.
(2) ①图2中,A电极为负极,从箭头所指方向我们可确定反应物为CO、CO32-,生成物为CO2。电极反应式为:CO-2e-+CO32-=2CO2 答案为:CO-2e-+CO32-=2CO2;
②因为粗铜应作阳极,所以粗铜应与燃料电池的正极即B电极相连。答案为D.
③利用得失电子守恒,可建立如下关系式:
O2 ——2Cu
0.1mol 0.2mol
答案为:增加12.8g.
15. 2NaCl+2H2O2NaOH+H2↑+Cl2 ↑ 将湿润的淀粉碘化钾试纸置于试管口,若试纸变蓝色则产生了氯气 氯化钠、氢氧化钠 水 H2O H+ +OH- 物理 8NH4Cl+3Cl2=6NH4Cl+N2
【分析】(1)电解食盐水时,氯离子在阳极放电生成氯气,氢离子在阴极放电生成氢气;
(2)检验氯气是利用湿润的碘化钾淀粉试纸变蓝证明;
(3)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,完全电离的电解质是强电解质,部分电离的是弱电解质。
(4)物质的三态变化是物理变化;氯气能够氧化氨气生成氮气,据此分析。
【详解】(1)电解食盐水时,氯离子在阳极放电生成氯气,氯气是黄绿色气体,有刺激性气味,氢离子在阴极放电生成氢气,电解方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2 ↑;
故答案为:2NaCl+2H2O2NaOH+H2↑+Cl2 ↑;
(2)检验氯气是利用氯气的氧化性,氯气把碘离子氧化为碘单质,碘能够使淀粉溶液变蓝,因此反应产生的气体遇到湿润的碘化钾淀粉试纸变蓝的现象,即可证明反应产生了氯气;
故答案为:将湿润的淀粉碘化钾试纸置于试管口,若试纸变蓝色则产生了氯气。
(3) 根据电解质与非电解质、强电解质与弱电解质的概念可知:在电解饱和食盐水所涉及到的物质中,属于强电解质的是氯化钠、氢氧化钠;属于弱电解质的是水,其电离方程式为:H2O H+ +OH-。
故答案为:氯化钠、氢氧化钠;水;H2O H+ +OH-
(4) Cl2经过压缩后变成液氯,属于物理变化;氯气能够氧化氨气生成氮气,化学方程式为: 8NH4Cl+3Cl2=6NH4Cl+N2 ;
故答案为:物理;8NH4Cl+3Cl2=6NH4Cl+N2
【点睛】本题通过电解饱和食盐水考查了电解方程式的书写、电极产物的检验、电解质与非电解质、强电解质与弱电解质的辨析等内容,题目难度不大。
16. ③ 硫酸均过量,锌均全部反应,且锌质量一样,故反应放出热量一样,使等体积溶液温度升高值相近 15~20min和25~30 min 增加了O2的量 A B
【详解】Ⅰ等量的金属和酸反应放出的热量基本相同,实验③中,硫酸均过量,锌均全部反应,且锌质量一样,故反应放出热量一样,使等体积溶液温度升高值相近;正确答案:③;硫酸均过量,锌均全部反应,且锌质量一样,故反应放出热量一样,使等体积溶液温度升高值相近 。
Ⅱ、(1)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可以知道在和出现平台,各组分的物质的量不变,反应处于平衡状态;正确答案:和。
(2)由图可以知道,反应进行至时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;由图可以知道,反应向正反应进行,到反应混合物单位时间内的变化量增大,说明反应速率增大,改变瞬间,各物质的物质的量不变;加了催化剂,增大反应速率, A正确;缩小容器体积,增大压强,增大反应速率,B正确; 降低温度反应速率降低,C错误;改变瞬间,各物质的物质的量不变,不是增加的物质的量,D错误;正确答案:增大氧气的浓度;AB.
17. SO2+2OH-=+H2O 阳离子 11.2 -2e-+H2O=+2H+ H+放电促进水的电离,使OH-浓度增大
【分析】电解Na2SO3溶液过程中,若要实现循环再生NaOH,同时得到H2SO4,则发生氧化反应生成,因此b电极发生氧化反应,移向右侧,电极反应为:-2e-+H2O=+2H+,交换膜II为阴离子交换膜,a电极发生还原反应,Na+移向左侧,电极反应为:2H2O+2e-=H2↑+2OH-,交换膜I为阳离子交换膜,据此解答。
【详解】(1)NaOH溶液吸收SO2发生的主要反应为2NaOH+SO2=Na2SO3+H2O,离子方程式为:SO2+2OH-=+H2O;
(2)由上述分析可知,交换膜I为阳离子交换膜;
(3)当有1mol Na+通过阳离子交换膜时,电解池中有1mol电子转移,根据a极电极反应式2H2O+2e-=H2↑+2OH-可知,将生产0.5molH2,在标准状况下体积为0.5mol×22.4L/mol=11.2L;
(4)发生氧化反应生成,电极反应式为-2e-+H2O=+2H+;
(5)通电后,阴极电极反应式为2H2O+2e-=H2↑+2OH-,其本质是水电离出的H+放电,电解过程中促进水的电离,使阴极负极溶液OH-浓度增大,从而使溶液pH增大。
18. 阴 纯铜 溶液 小于 红 4.48 14
【详解】与电源负极相连的电极是电解池的阴极,与电源正极相连的电极是电解池的阳极。由图示装置知甲池中A为阴极,B为阳极,乙池中为阴极,C(碳棒)为阳极。
(1)甲池若为用电解原理精炼铜的装置,则A是阴极,材料是纯铜,电极反应式为,电解质溶液为溶液,阳极材料为粗铜,电极反应式为等(据粗铜中杂质成分而定),根据电极反应和得失电子守恒知,阴极有纯铜析出时,阳极溶解的铜小于。
(2)乙池中实质是电解溶液,C(碳棒)为电解池的阳极,放电生成氯气,铁 为电解池的阴极,电极反应式为,阴极区溶液呈碱性,若滴入少量酚酞试液,电解一段时间后电极附近溶液呈红色。
(3)若甲池电解质溶液为溶液,阴极质量增加,即生成铜的质量为,物质的量为,根据电极反应式知,转移电子的物质的量为,根据得失电子守恒知乙池中阳极放出氯气的物质的量为,在标准状况下的体积为;甲乙两池串联,转移电子数相等,根据知,生成的物质的量为,溶液的体积为0.4L,,故溶液。
19. 负 氧化 O2+4e +2H2O=4OH- 0.4
【分析】由图可知该装置为氢氧燃料电池,通入H2的电极为负极,发生氧化反应,通入O2的电极为正极,发生还原反应,根据氧化还原反应中得失电子守恒进行计算。
【详解】(1)根据上述分析:通入H2的电极为负极,发生氧化反应;通入O2的电极为正极,发生还原反应,则正极的电极反应式为O2+4e +2H2O=4OH-,故答案:负;氧化;O2+4e +2H2O=4OH-;
(2)标准状况下,5.6LH2为0.25mol,若能量转化率为80%,根据H2-2e-+2OH-=2H2O,则导线中通过电子的物质的量=0.25mol 2=0.4mol,故答案:0.4mol。
20. 阴 Cu-2e-=Cu2+ 0.02 BD
【分析】(1)镀铜时,铜作阳极,失电子生成铜离子,而镀件作阴极,铜离子得电子生成单质铜。
(2)铜的电解精炼时,粗铜作阳极,失电子生成离子,而溶液中的铜离子在阴极得电子生成单质铜。
【详解】(1)①电镀时镀件上要生成铜,发生还原反应,所以镀件作电解池的阴极。
②A为直流电源的正极,与A连接的电极作阳极,即铜作阳极,失去电子发生氧化反应,电极反应是Cu-2e-=Cu2+。
③阳极上铜失电子发生氧化反应,阴极上Cu2+得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为1.28g,二者质量差的一半为阴极析出的铜,则转移电子的物质的量=×2=0.02mol。
(2)A.粗铜作为阳极,则粗铜中的Al、Zn、Cu都可以失去电子,所以当转移电子数为2mol时,阳极质量减少量不能确定,A说法错误;
B.电解精炼,粗铜发生氧化反应生成铜离子进入溶液,所以粗铜接A极,发生氧化反应,B说法正确;
C.溶液中Cu2+向阴极移动,得电子发生还原反应生成Cu,C说法错误;
D.在精炼过程中,粗铜中Ag、Au不放电,在电极下形成阳极泥,所以利用阳极泥可回收Ag、Au,D说法正确;
答案为BD。
21. 2H++2e-==H2↑ 2Al+2OH-+2H2O==2AlO2-+3H2↑ Mg Al AD
【详解】(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,正极反应为2H++2e-=H2↑,负极反应为Mg-2e-=Mg2+;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,电池总反应为:2Al+2OH-+2H2O==2AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故错误;
C.该实验对研究物质的性质有实用价值,和金属活动顺序表无关,不是活泼的金属在原电池中一定做负极,故错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故正确;
故选AD。
22. 33 与过量的S2-结合生成FeS沉淀,防止As2O3与S2-结合生成AsS(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果) 稀硫酸、高锰酸钾溶液 Fe3O4+8H+=Fe2++2Fe3++4H2O 、5 Fe2+ ++ 8H+ = 5Fe3+ + Mn2+ + 4H2O AsO+I2+2OH-=2I-+AsO+H2O 2AsO+2SO2+2H+=As2O3+2SO+H2O SO2
【分析】酸性高浓度含砷废水加入硫化钠、硫酸亚铁,其中硫酸亚铁可除去过量的硫离子,过滤得到As2S3和FeS,焙烧,可生成As2O3、氧化铁,加入氢氧化钠溶液生成Na3AsO3,氧化生成Na3AsO4,生成的气体为二氧化硫,与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3,以此解答该题。
【详解】(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素在P的下一周期,原子序数为15+18=33,硫化钠为离子化合物,电子式为,故答案为:33;;
(2)FeSO4的作用是除去过量的硫离子,As2S3+3S2 2使平衡逆向进行,提高沉砷效果,亚铁离子与过量的S2 结合生成FeS沉淀,防止As2O3与S2 结合生成,故答案为:与过量的S2-结合生成FeS沉淀,防止As2O3与S2-结合生成AsS(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果);
(3)四氧化三铁含有+2价铁,具有还原性,可在酸性条件下与高锰酸钾反应,溶液褪色,则可用硫酸、高锰酸钾检验,离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O、5 Fe2+ ++ 8H+ = 5Fe3+ + Mn2+ + 4H2O,故答案为:稀硫酸、高锰酸钾溶液;Fe3O4+8H+=Fe2++2Fe3++4H2O、5 Fe2+ ++ 8H+ = 5Fe3+ + Mn2+ + 4H2O;
(4)单质碘具有氧化性,碱性条件下和AsO反应生成2I-和AsO,离子方程式为:AsO+I2+2OH-=2I-+AsO+H2O,故答案为:AsO+I2+2OH-=2I-+AsO+H2O;
(5)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为2AsO+2SO2+2H+=As2O3+2SO+H2O,故答案为:2AsO+2SO2+2H+=As2O3+2SO+H2O;
(6) As4S4中As为+2价、S为 2价,且生成As2O3,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole ,则4molS元素化合价升高6价,生成物化合价为+4价,应为SO2,故答案为:SO2。
【点睛】本题考查了物质制备方案设计,制备类化学流程题注意①先是确定要制备什么物质,从题干或问题中获取有用信息,②分析流程中的每一步骤,从几个方面了解流程:反应物是什么?反应方程式是什么?该反应造成了什么后果?对制造产品有什么作用?③从问题中获取信息,帮助解题。标准化问题要标准化回答。
23. 正 AD Al 2H++NO3-+e-=NO2↑+H2O 开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变 Ag2SO4 30 10 17.5 确保所有实验中溶液总体积相等,有效控制变量,只研究CuSO4浓度对反应速率的影响 当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降
【分析】Ⅰ.(1)实际发生自发性氧化还原反应的物质,前一装置中金属与氢离子反应,而后一装置中是铝与碱溶液反应,两者发生的反应不同;
(2)乙同学设计的实验装置,铝、铜、浓硝酸构成的原电池,根据测量和绘制原电池的电流强度(I)随时间(t)的变化曲线,电流先减小,且电流方向改变,后由小变大,开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,锌能将Ag2SO4中的银置换出来,银、锌、硫酸构成原电池加快反应速率;
(4)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同。A组中硫酸为30mL,那么其它组硫酸量也都为30mL。而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,所以V6=10mL,V9=17.5mL,V1=30mL;当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降。
【详解】Ⅰ.(1)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,根据他的判断,铝活泼性比镁弱,两个装置中的Al是正极;实际实验时发现两个装置中的电流表偏转方向不同:
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质,注意实际发生自发性氧化还原反应的物质,前一装置中金属与氢离子反应,而后一装置中是铝与碱溶液反应,两者发生的反应不同,故A正确;
B.镁的金属性一定比铝的金属性强,故B错误;
C.两实验的反应实质不同,不能得出:“金属活动性顺序已过时,已没有实用价值”的结论,故C错误;
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析,故D正确;
故答案为:正;AD;
(2)乙同学设计的实验装置,根据测量和绘制原电池的电流强度(I)随时间(t)的变化曲线,电流先减小,且电流方向改变,后由小变大,则图中0~t1阶段,铝比铜还原性强,铝先与硝酸反应,还原剂是铝,负极材料是Al,正极硝酸根离子得电子发生还原反应,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,t1后,外电路中电流方向发生改变,其原因是开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变;
故答案为:Al;2H++NO3-+e-=NO2↑+H2O;开始时Al比Cu活泼,Al作负极,Al在浓硝酸中钝化,表面形成致密的氧化膜后阻止了铝与硝酸的反应,装置中反应转变为铜和浓硝酸的反应,此时铜作负极,铝片作正极,故电流方向发生改变;
Ⅱ.(3)Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,锌能将Ag2SO4中的银置换出来,银、锌、硫酸构成原电池加快反应速率,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4。故答案为:Ag2SO4;
(4)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同。A组中硫酸为30mL,那么其它组硫酸量也都为30mL。而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,所以V6=10mL,V9=17.5mL,V1=30mL,各量如表:
A B C D E F
4mol/LH2SO4/mL 30 V130 V230 V330 V430 V530
饱和CuSO4溶液/mL 0 0.5 2.5 5 V610 20
H2O/mL V720 V819.5 V917.5 V1015 10 0
则实验中V1=30,V6=10,V9=17.5;实验中有的需要加入一定体积的水,其作用是确保所有实验中溶液总体积相等,有效控制变量,只研究CuSO4浓度对反应速率的影响;实验结果发现:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。氢气生成速率下降的主要原因当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降。
故答案为:30;10;17.5;确保所有实验中溶液总体积相等,有效控制变量,只研究CuSO4浓度对反应速率的影响;当加入过量的CuSO4溶液后,生成的单质Cu会大量沉积在Zn的表面,减小了Zn与溶液的反应接触面积,反应速率下降。
【点睛】本题考查了原电池原理、反应速率计算和化学平衡化学反应速率的影响因素等,涉及化学反应速率、化学平衡的计算以及平衡移动等问题,侧重于学生的分析能力和计算能力的考查,题目难度中等。
答案第1页,共2页
答案第1页,共2页
