2023—2024学年人教版(五四学制)化学八年级全一册第五单元 化学方程式 单元题(含答案)
文档属性
| 名称 | 2023—2024学年人教版(五四学制)化学八年级全一册第五单元 化学方程式 单元题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 567.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 08:54:23 | ||
图片预览




文档简介
2023—2024学年人教版(五四学制)化学八年级全一册第五单元 化学方程式 单元题含答案
人教版(五四学制)第五单元 化学方程式
一、选择题。
1、在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质 W G H P
反应前质量/g 18 1 2 32
反应后质量/g 待测 26 2 12
关于此反应的认识不正确的是( )。
A.物质H一定是该反应的催化剂
B.该反应一定是化合反应
C.W、P是反应物
D.待测值为13
2、在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。) 下列说法不正确的是( )
A.X的化学式是CO B.反应前后固体的质量不变
C.中碳元素的化合价为+4 D.该反应有元素的化合价发生改变
3、关于水的性质和组成,下列说法正确的是( )
A.从宏观组成上看,水是由氢气和氧气组成的
B.从微观结构上看,水分子是由氢分子和氧分子构成
C.水电解实验中负极和正极上产生的气体体积比为2:1
D.水电解该实验说明了水分子是由氢和氧构成
4、如图所示表示A、B、C、D四种物质在密闭容器中充分反应后质量分数的变化,则有关说法错误的是( )
A.该反应可以表示为A+BC
B.物质D有可能是该反应的催化剂
C.发生变化的A、C两物质的质量比为9:1
D.若m克A和n克B反应,则生成C的质量可能小于或等于(m+n)克
5、化学方程式:2N2H4+X=3N2+ 4H2O是发射通讯卫星的火箭发生的化学反应。X的化学式是( )
A. NO2 B. N2O C. N2O3 D. N2O4
6、工业上利用下列反应制取金属Hg:4HgS+4CaO=4Hg+3X+CaSO4。该反应中X的化学式为( )
A.CaS B.SO2 C.CaSO3 D.CaSO3
7、地球上有丰富的水资源,科学家一直在研究成本低、效率高的催化剂,使水发生反应获得氢能。下面说法不正确的是( )
A.保持水化学性质的最小微粒是氢原子和氧原子
B.电解水时负极产生的气体是氢气
C.生活中可利用煮沸的方式降低水的硬度
D.催化剂在化学反应前后,化学性质和质量不发生改变
8、下列有关“守恒”的叙述中,正确的是( )
A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等
B.在反应3Cu+8HNO3═3Cu(N03)2+2X↑+4H20中的X的化学式是NO2
C.加热24.5gKClO3和4gMnO2的混合物,反应一段时间后,剩余固体24.9g,则O2的质量为3.6g
D.某纯净物在氧气中燃烧后生成CO2、SO2和CO,该物质中一定含有C、S、O元素
9、分析推理是化学学习中常用的思维方法,下列推理正确的是( )
A. 氧化物都含氧元素,含氧元素的化合物都是氧化物
B. 含碳元素的物质充分燃烧会生成CO2, 所以燃烧能生成CO2的物质一定是碳元素
C. 置换反应必须有单质参与,有单质参与的反应都是置换反应
D. 原子和分子都是构成物质的微粒,因此物质不是由分子构成,就一定是由原子构成
10、根据化学方程式不能获得的信息是( )
A.该反应中的反应物和生成物 B.化学反应的快慢
C.反应发生所需要的条件 D.参加反应的各粒子的相对质量
11、下列关于电解水的叙述中正确的是( )
A.为增强水的导电性,常在水中加入一定量的稀硫酸或氢氧化钠溶液
B.在水电解器中加满水,然后接通交流电源
C.电解水的实验证明水是由氢气、氧气两种物质组成的
D.A为电源正极,相连的玻璃管内得到的气体能在空气中燃烧
12、利用天平进行定量研究,最早提出质量守恒定律的科学家是 ( )
A.拉瓦锡 B.门捷列夫 C.徐寿 D.屠呦呦
13、在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前的质量(克) 24.5 5 0.1 0.4
反应后的质量(克) 0 5 15 x
下列说法正确的是( )
A.乙是反应物 B.丁是催化剂
C.该反应为化合反应 D.x=10
14、根据化学方程式不能获得的信息是( )
A.反应中的反应物和生成物 B.各反应物、生成物之间的质量比
C.化学反应速率的快慢程度 D.反应发生所需要的条件
15、《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。太阳能的利用是热门研究方向之一。例如,通过光催化可将H2O、CO2转化为H2、CO、CH4(甲烷)、CH3OH(甲醇)等太阳能燃料,示意图如图。H2O、CO2转化得到的太阳能燃料中,属于氧化物的是( )
A.氢气 B.一氧化碳 C.甲烷 D.甲醇
16、下列对“质量守恒定律”的理解,正确的是 ( )
A.10 g冰受热融化成10 g水,符合质量守恒定律
B.蜡烛燃烧后质量减轻,不符合质量守恒定律
C.镁条在空气中燃烧后,生成物的质量比原来的镁条大,不符合质量守恒定律
D.任何化学反应中参加反应的各物质的质量总和都等于反应后各生成物的质量总和
二、填空题。
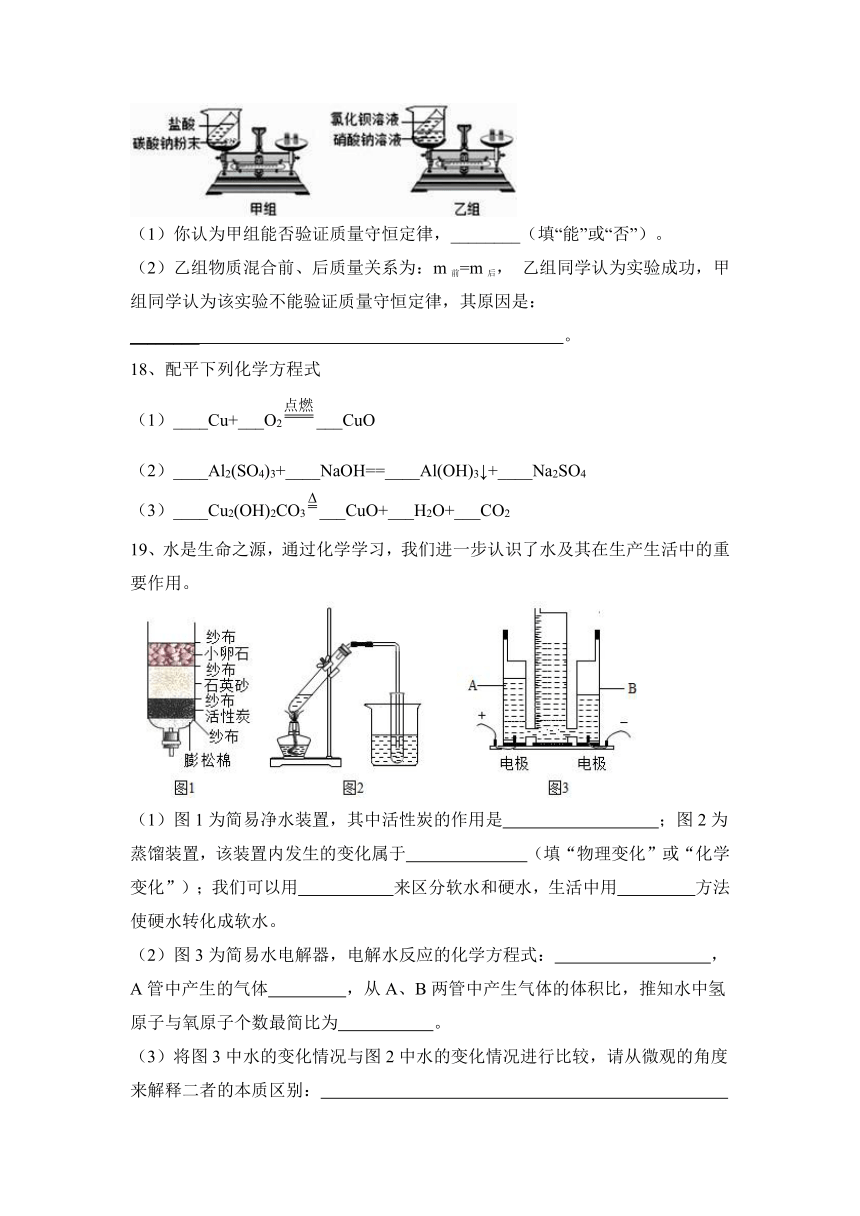
17、如图所示是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根据图示进行思考回答:(假设甲、乙两组药品混合前质量均为m前, 混合后质量均为 m 后)
(1)你认为甲组能否验证质量守恒定律,________(填“能”或“否”)。
(2)乙组物质混合前、后质量关系为:m前=m后, 乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,其原因是:
________ 。
18、配平下列化学方程式
(1)____Cu+___O2___CuO
(2)____Al2(SO4)3+____NaOH==____Al(OH)3↓+____Na2SO4
(3)____Cu2(OH)2CO3___CuO+___H2O+___CO2
19、水是生命之源,通过化学学习,我们进一步认识了水及其在生产生活中的重要作用。
(1)图1为简易净水装置,其中活性炭的作用是 ;图2为蒸馏装置,该装置内发生的变化属于 (填“物理变化”或“化学变化”);我们可以用 来区分软水和硬水,生活中用 方法使硬水转化成软水。
(2)图3为简易水电解器,电解水反应的化学方程式: ,A管中产生的气体 ,从A、B两管中产生气体的体积比,推知水中氢原子与氧原子个数最简比为 。
(3)将图3中水的变化情况与图2中水的变化情况进行比较,请从微观的角度来解释二者的本质区别:
。
20、在一定密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 氧气 二氧化碳 水蒸气 M
反应前质量/g 100 1 1 46
反应后质量/g 4 89 55 x
(1)根据质量守恒定律,你认为x的值应为 。
(2)未知物质M一定含有的元素为 。
(3)已知未知物质M的相对分子质量为46,推出其化学式为 。
(4)该反应的化学方程式为 。
三、简答题。
21、从分子和原子的角度解释,为什么参加化学反应的各物质的质量总和一定等于反应后生成的各物质的质量总和。
_____________________________________________________________________
_____________________________________________________________________
______________________________________________________________。
四、实验题。
22、某研究小组在学习氧气的化学性质时发现:铁丝燃烧有火星没火焰,蜡烛燃烧有火焰.该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的化学方程式:____ 。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生 (如图所示).由此可知:蜡烛燃烧产生的火焰是由____(填“固态”或“气态”) 物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
物质 熔点/℃ 沸点/℃ 燃烧时温度/℃ 有无火焰
一氧化碳 ﹣205.1 ﹣191.5 约2600 有
石蜡 50-70 300-550 约600 有
铁 1535 2750 约1800 无
钠 97.8 883 约1400 ?
由表可知:物质燃烧能否产生火焰与其____(填“熔点”或“沸点”)和燃烧时温 度有关.由此推测:钠在燃烧时,____(填“有”或“没有”)火焰产生.
(4)木炭在纯氧中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是____ 。
23、根据以下实验方案,探究化学反应前后各物质的质量是否相等,请将你的思考及实验结果写在短线处。
【实验探究】同学们用托盘天平分别称量反应前后物质的质量。
实验方案 方案一 方案二
实验装置
实验过程 分别将反应物及反应容器放在托盘天平上,用砝码平衡
取下烧杯,将铁钉浸到硫酸铜溶液中,反应生成硫酸亚铁和铜,观察到的现象是 ,溶液由蓝色逐渐变为浅绿色;再将其放回托盘天平,天平的指针 (填“向左”“向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的H2O2溶液进入烧杯中,完全反应后放回托盘天平,天平指针 (填“向左”“向右”或“不”)偏转
【反思评价】上述天平不平衡的方案中,导致天平不平衡的物质是 。
【小结归纳】有气体参加或生成的化学反应,用来验证质量守恒定律时,必须
在 容器中进行。
【解释应用】化学反应中,反应前后 不变,所以纸张燃烧后剩余灰烬的质量变小 (填“遵循”或“不遵循”)质量守恒定律,理由是 。
五、计算题。
24、实验室制取氧气时,某同学取一定质量的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图中甲,回答下列问题。
(反应的化学方程式:2KMnO4K2MnO4+MnO2+O2↑)
(1) 请根据图中数据计算高锰酸钾的质量为多少?(写出计算过程)
(2) 请在乙坐标中,画出固体中锰元素质量在t0~t5时段变化示意图。
2023—2024学年人教版(五四学制)化学八年级全一册第五单元 化学方程式 单元题含答案
人教版(五四学制)第五单元 化学方程式
一、选择题。
1、在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质 W G H P
反应前质量/g 18 1 2 32
反应后质量/g 待测 26 2 12
关于此反应的认识不正确的是( )。
A.物质H一定是该反应的催化剂
B.该反应一定是化合反应
C.W、P是反应物
D.待测值为13
【答案】A
2、在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。) 下列说法不正确的是( )
A.X的化学式是CO B.反应前后固体的质量不变
C.中碳元素的化合价为+4 D.该反应有元素的化合价发生改变
【答案】B
3、关于水的性质和组成,下列说法正确的是( )
A.从宏观组成上看,水是由氢气和氧气组成的
B.从微观结构上看,水分子是由氢分子和氧分子构成
C.水电解实验中负极和正极上产生的气体体积比为2:1
D.水电解该实验说明了水分子是由氢和氧构成
【答案】C
4、如图所示表示A、B、C、D四种物质在密闭容器中充分反应后质量分数的变化,则有关说法错误的是( )
A.该反应可以表示为A+BC
B.物质D有可能是该反应的催化剂
C.发生变化的A、C两物质的质量比为9:1
D.若m克A和n克B反应,则生成C的质量可能小于或等于(m+n)克
【答案】C
5、化学方程式:2N2H4+X=3N2+ 4H2O是发射通讯卫星的火箭发生的化学反应。X的化学式是( )
A. NO2 B. N2O C. N2O3 D. N2O4
【答案】D
6、工业上利用下列反应制取金属Hg:4HgS+4CaO=4Hg+3X+CaSO4。该反应中X的化学式为( )
A.CaS B.SO2 C.CaSO3 D.CaSO3
【答案】A
7、地球上有丰富的水资源,科学家一直在研究成本低、效率高的催化剂,使水发生反应获得氢能。下面说法不正确的是( )
A.保持水化学性质的最小微粒是氢原子和氧原子
B.电解水时负极产生的气体是氢气
C.生活中可利用煮沸的方式降低水的硬度
D.催化剂在化学反应前后,化学性质和质量不发生改变
【答案】A
8、下列有关“守恒”的叙述中,正确的是( )
A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等
B.在反应3Cu+8HNO3═3Cu(N03)2+2X↑+4H20中的X的化学式是NO2
C.加热24.5gKClO3和4gMnO2的混合物,反应一段时间后,剩余固体24.9g,则O2的质量为3.6g
D.某纯净物在氧气中燃烧后生成CO2、SO2和CO,该物质中一定含有C、S、O元素
【答案】C
9、分析推理是化学学习中常用的思维方法,下列推理正确的是( )
A. 氧化物都含氧元素,含氧元素的化合物都是氧化物
B. 含碳元素的物质充分燃烧会生成CO2, 所以燃烧能生成CO2的物质一定是碳元素
C. 置换反应必须有单质参与,有单质参与的反应都是置换反应
D. 原子和分子都是构成物质的微粒,因此物质不是由分子构成,就一定是由原子构成
【答案】B
10、根据化学方程式不能获得的信息是( )
A.该反应中的反应物和生成物 B.化学反应的快慢
C.反应发生所需要的条件 D.参加反应的各粒子的相对质量
【答案】B
11、下列关于电解水的叙述中正确的是( )
A.为增强水的导电性,常在水中加入一定量的稀硫酸或氢氧化钠溶液
B.在水电解器中加满水,然后接通交流电源
C.电解水的实验证明水是由氢气、氧气两种物质组成的
D.A为电源正极,相连的玻璃管内得到的气体能在空气中燃烧
【答案】A
12、利用天平进行定量研究,最早提出质量守恒定律的科学家是 ( )
A.拉瓦锡 B.门捷列夫 C.徐寿 D.屠呦呦
【答案】A
13、在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前的质量(克) 24.5 5 0.1 0.4
反应后的质量(克) 0 5 15 x
下列说法正确的是( )
A.乙是反应物 B.丁是催化剂
C.该反应为化合反应 D.x=10
【答案】D
14、根据化学方程式不能获得的信息是( )
A.反应中的反应物和生成物 B.各反应物、生成物之间的质量比
C.化学反应速率的快慢程度 D.反应发生所需要的条件
【答案】C
15、《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。太阳能的利用是热门研究方向之一。例如,通过光催化可将H2O、CO2转化为H2、CO、CH4(甲烷)、CH3OH(甲醇)等太阳能燃料,示意图如图。H2O、CO2转化得到的太阳能燃料中,属于氧化物的是( )
A.氢气 B.一氧化碳 C.甲烷 D.甲醇
【答案】B
16、下列对“质量守恒定律”的理解,正确的是 ( )
A.10 g冰受热融化成10 g水,符合质量守恒定律
B.蜡烛燃烧后质量减轻,不符合质量守恒定律
C.镁条在空气中燃烧后,生成物的质量比原来的镁条大,不符合质量守恒定律
D.任何化学反应中参加反应的各物质的质量总和都等于反应后各生成物的质量总和
【答案】D
二、填空题。
17、如图所示是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根据图示进行思考回答:(假设甲、乙两组药品混合前质量均为m前, 混合后质量均为 m 后)
(1)你认为甲组能否验证质量守恒定律,________(填“能”或“否”)。
(2)乙组物质混合前、后质量关系为:m前=m后, 乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,其原因是:
________ 。
【答案】(1)否 (2)两种药品不发生化学反应,不能验证质量守恒定律
18、配平下列化学方程式
(1)____Cu+___O2___CuO
(2)____Al2(SO4)3+____NaOH==____Al(OH)3↓+____Na2SO4
(3)____Cu2(OH)2CO3___CuO+___H2O+___CO2
【答案】 (1) 2 1 2 1
(2) 6 2 3 1 (3) 2 1 1
19、水是生命之源,通过化学学习,我们进一步认识了水及其在生产生活中的重要作用。
(1)图1为简易净水装置,其中活性炭的作用是 ;图2为蒸馏装置,该装置内发生的变化属于 (填“物理变化”或“化学变化”);我们可以用 来区分软水和硬水,生活中用 方法使硬水转化成软水。
(2)图3为简易水电解器,电解水反应的化学方程式: ,A管中产生的气体 ,从A、B两管中产生气体的体积比,推知水中氢原子与氧原子个数最简比为 。
(3)将图3中水的变化情况与图2中水的变化情况进行比较,请从微观的角度来解释二者的本质区别:
。
【答案】(1)吸附色素异味等;物理变化;肥皂水;煮沸。
(2)2H2O 2H2↑+O2↑;氧气;2:1。
(3)图3中:水分子分解生成氢原子和氧原子,氢原子结合生成氢分子,氧原子结合生成氧分子,即分子发生改变;
图2中:水分子之间的间隔先变大,后变小,即分子没有改变。
20、在一定密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 氧气 二氧化碳 水蒸气 M
反应前质量/g 100 1 1 46
反应后质量/g 4 89 55 x
(1)根据质量守恒定律,你认为x的值应为 。
(2)未知物质M一定含有的元素为 。
(3)已知未知物质M的相对分子质量为46,推出其化学式为 。
(4)该反应的化学方程式为 。
【答案】(1)0 (2)C、H、O (3)C2H5OH.
(4)C2H5OH+3O22CO2+3H2O
三、简答题。
21、从分子和原子的角度解释,为什么参加化学反应的各物质的质量总和一定等于反应后生成的各物质的质量总和。
_____________________________________________________________________
_____________________________________________________________________
______________________________________________________________。
【答案】因为化学反应实质是构成物质的分子分裂成原子,原子又重新组合成新分子的过程,反应前后原子种类、数目和质量都不变。所以由微粒聚集起来的宏观物质在参加化学反应前后质量的总和不变
四、实验题。
22、某研究小组在学习氧气的化学性质时发现:铁丝燃烧有火星没火焰,蜡烛燃烧有火焰.该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的化学方程式:____ 。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生 (如图所示).由此可知:蜡烛燃烧产生的火焰是由____(填“固态”或“气态”) 物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
物质 熔点/℃ 沸点/℃ 燃烧时温度/℃ 有无火焰
一氧化碳 ﹣205.1 ﹣191.5 约2600 有
石蜡 50-70 300-550 约600 有
铁 1535 2750 约1800 无
钠 97.8 883 约1400 ?
由表可知:物质燃烧能否产生火焰与其____(填“熔点”或“沸点”)和燃烧时温 度有关.由此推测:钠在燃烧时,____(填“有”或“没有”)火焰产生.
(4)木炭在纯氧中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是____ 。
【答案】(1) (2)气态 (3) 沸点 有
(4)木炭在燃烧时生成了可燃性的气体
23、根据以下实验方案,探究化学反应前后各物质的质量是否相等,请将你的思考及实验结果写在短线处。
【实验探究】同学们用托盘天平分别称量反应前后物质的质量。
实验方案 方案一 方案二
实验装置
实验过程 分别将反应物及反应容器放在托盘天平上,用砝码平衡
取下烧杯,将铁钉浸到硫酸铜溶液中,反应生成硫酸亚铁和铜,观察到的现象是 ,溶液由蓝色逐渐变为浅绿色;再将其放回托盘天平,天平的指针 (填“向左”“向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的H2O2溶液进入烧杯中,完全反应后放回托盘天平,天平指针 (填“向左”“向右”或“不”)偏转
【反思评价】上述天平不平衡的方案中,导致天平不平衡的物质是 。
【小结归纳】有气体参加或生成的化学反应,用来验证质量守恒定律时,必须
在 容器中进行。
【解释应用】化学反应中,反应前后 不变,所以纸张燃烧后剩余灰烬的质量变小 (填“遵循”或“不遵循”)质量守恒定律,理由是 。
【答案】铁钉表面有红色物质析出 不 向右 氧气 密闭 原子的种类、数目、质量 遵循 纸张燃烧生成的气体等物质扩散到空气中,使剩余固体质量变小
五、计算题。
24、实验室制取氧气时,某同学取一定质量的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图中甲,回答下列问题。
(反应的化学方程式:2KMnO4K2MnO4+MnO2+O2↑)
(3) 请根据图中数据计算高锰酸钾的质量为多少?(写出计算过程)
(4) 请在乙坐标中,画出固体中锰元素质量在t0~t5时段变化示意图。
【答案】(1) 3.2 g; (2)如图所示:
人教版(五四学制)第五单元 化学方程式
一、选择题。
1、在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质 W G H P
反应前质量/g 18 1 2 32
反应后质量/g 待测 26 2 12
关于此反应的认识不正确的是( )。
A.物质H一定是该反应的催化剂
B.该反应一定是化合反应
C.W、P是反应物
D.待测值为13
2、在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。) 下列说法不正确的是( )
A.X的化学式是CO B.反应前后固体的质量不变
C.中碳元素的化合价为+4 D.该反应有元素的化合价发生改变
3、关于水的性质和组成,下列说法正确的是( )
A.从宏观组成上看,水是由氢气和氧气组成的
B.从微观结构上看,水分子是由氢分子和氧分子构成
C.水电解实验中负极和正极上产生的气体体积比为2:1
D.水电解该实验说明了水分子是由氢和氧构成
4、如图所示表示A、B、C、D四种物质在密闭容器中充分反应后质量分数的变化,则有关说法错误的是( )
A.该反应可以表示为A+BC
B.物质D有可能是该反应的催化剂
C.发生变化的A、C两物质的质量比为9:1
D.若m克A和n克B反应,则生成C的质量可能小于或等于(m+n)克
5、化学方程式:2N2H4+X=3N2+ 4H2O是发射通讯卫星的火箭发生的化学反应。X的化学式是( )
A. NO2 B. N2O C. N2O3 D. N2O4
6、工业上利用下列反应制取金属Hg:4HgS+4CaO=4Hg+3X+CaSO4。该反应中X的化学式为( )
A.CaS B.SO2 C.CaSO3 D.CaSO3
7、地球上有丰富的水资源,科学家一直在研究成本低、效率高的催化剂,使水发生反应获得氢能。下面说法不正确的是( )
A.保持水化学性质的最小微粒是氢原子和氧原子
B.电解水时负极产生的气体是氢气
C.生活中可利用煮沸的方式降低水的硬度
D.催化剂在化学反应前后,化学性质和质量不发生改变
8、下列有关“守恒”的叙述中,正确的是( )
A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等
B.在反应3Cu+8HNO3═3Cu(N03)2+2X↑+4H20中的X的化学式是NO2
C.加热24.5gKClO3和4gMnO2的混合物,反应一段时间后,剩余固体24.9g,则O2的质量为3.6g
D.某纯净物在氧气中燃烧后生成CO2、SO2和CO,该物质中一定含有C、S、O元素
9、分析推理是化学学习中常用的思维方法,下列推理正确的是( )
A. 氧化物都含氧元素,含氧元素的化合物都是氧化物
B. 含碳元素的物质充分燃烧会生成CO2, 所以燃烧能生成CO2的物质一定是碳元素
C. 置换反应必须有单质参与,有单质参与的反应都是置换反应
D. 原子和分子都是构成物质的微粒,因此物质不是由分子构成,就一定是由原子构成
10、根据化学方程式不能获得的信息是( )
A.该反应中的反应物和生成物 B.化学反应的快慢
C.反应发生所需要的条件 D.参加反应的各粒子的相对质量
11、下列关于电解水的叙述中正确的是( )
A.为增强水的导电性,常在水中加入一定量的稀硫酸或氢氧化钠溶液
B.在水电解器中加满水,然后接通交流电源
C.电解水的实验证明水是由氢气、氧气两种物质组成的
D.A为电源正极,相连的玻璃管内得到的气体能在空气中燃烧
12、利用天平进行定量研究,最早提出质量守恒定律的科学家是 ( )
A.拉瓦锡 B.门捷列夫 C.徐寿 D.屠呦呦
13、在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前的质量(克) 24.5 5 0.1 0.4
反应后的质量(克) 0 5 15 x
下列说法正确的是( )
A.乙是反应物 B.丁是催化剂
C.该反应为化合反应 D.x=10
14、根据化学方程式不能获得的信息是( )
A.反应中的反应物和生成物 B.各反应物、生成物之间的质量比
C.化学反应速率的快慢程度 D.反应发生所需要的条件
15、《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。太阳能的利用是热门研究方向之一。例如,通过光催化可将H2O、CO2转化为H2、CO、CH4(甲烷)、CH3OH(甲醇)等太阳能燃料,示意图如图。H2O、CO2转化得到的太阳能燃料中,属于氧化物的是( )
A.氢气 B.一氧化碳 C.甲烷 D.甲醇
16、下列对“质量守恒定律”的理解,正确的是 ( )
A.10 g冰受热融化成10 g水,符合质量守恒定律
B.蜡烛燃烧后质量减轻,不符合质量守恒定律
C.镁条在空气中燃烧后,生成物的质量比原来的镁条大,不符合质量守恒定律
D.任何化学反应中参加反应的各物质的质量总和都等于反应后各生成物的质量总和
二、填空题。
17、如图所示是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根据图示进行思考回答:(假设甲、乙两组药品混合前质量均为m前, 混合后质量均为 m 后)
(1)你认为甲组能否验证质量守恒定律,________(填“能”或“否”)。
(2)乙组物质混合前、后质量关系为:m前=m后, 乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,其原因是:
________ 。
18、配平下列化学方程式
(1)____Cu+___O2___CuO
(2)____Al2(SO4)3+____NaOH==____Al(OH)3↓+____Na2SO4
(3)____Cu2(OH)2CO3___CuO+___H2O+___CO2
19、水是生命之源,通过化学学习,我们进一步认识了水及其在生产生活中的重要作用。
(1)图1为简易净水装置,其中活性炭的作用是 ;图2为蒸馏装置,该装置内发生的变化属于 (填“物理变化”或“化学变化”);我们可以用 来区分软水和硬水,生活中用 方法使硬水转化成软水。
(2)图3为简易水电解器,电解水反应的化学方程式: ,A管中产生的气体 ,从A、B两管中产生气体的体积比,推知水中氢原子与氧原子个数最简比为 。
(3)将图3中水的变化情况与图2中水的变化情况进行比较,请从微观的角度来解释二者的本质区别:
。
20、在一定密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 氧气 二氧化碳 水蒸气 M
反应前质量/g 100 1 1 46
反应后质量/g 4 89 55 x
(1)根据质量守恒定律,你认为x的值应为 。
(2)未知物质M一定含有的元素为 。
(3)已知未知物质M的相对分子质量为46,推出其化学式为 。
(4)该反应的化学方程式为 。
三、简答题。
21、从分子和原子的角度解释,为什么参加化学反应的各物质的质量总和一定等于反应后生成的各物质的质量总和。
_____________________________________________________________________
_____________________________________________________________________
______________________________________________________________。
四、实验题。
22、某研究小组在学习氧气的化学性质时发现:铁丝燃烧有火星没火焰,蜡烛燃烧有火焰.该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的化学方程式:____ 。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生 (如图所示).由此可知:蜡烛燃烧产生的火焰是由____(填“固态”或“气态”) 物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
物质 熔点/℃ 沸点/℃ 燃烧时温度/℃ 有无火焰
一氧化碳 ﹣205.1 ﹣191.5 约2600 有
石蜡 50-70 300-550 约600 有
铁 1535 2750 约1800 无
钠 97.8 883 约1400 ?
由表可知:物质燃烧能否产生火焰与其____(填“熔点”或“沸点”)和燃烧时温 度有关.由此推测:钠在燃烧时,____(填“有”或“没有”)火焰产生.
(4)木炭在纯氧中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是____ 。
23、根据以下实验方案,探究化学反应前后各物质的质量是否相等,请将你的思考及实验结果写在短线处。
【实验探究】同学们用托盘天平分别称量反应前后物质的质量。
实验方案 方案一 方案二
实验装置
实验过程 分别将反应物及反应容器放在托盘天平上,用砝码平衡
取下烧杯,将铁钉浸到硫酸铜溶液中,反应生成硫酸亚铁和铜,观察到的现象是 ,溶液由蓝色逐渐变为浅绿色;再将其放回托盘天平,天平的指针 (填“向左”“向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的H2O2溶液进入烧杯中,完全反应后放回托盘天平,天平指针 (填“向左”“向右”或“不”)偏转
【反思评价】上述天平不平衡的方案中,导致天平不平衡的物质是 。
【小结归纳】有气体参加或生成的化学反应,用来验证质量守恒定律时,必须
在 容器中进行。
【解释应用】化学反应中,反应前后 不变,所以纸张燃烧后剩余灰烬的质量变小 (填“遵循”或“不遵循”)质量守恒定律,理由是 。
五、计算题。
24、实验室制取氧气时,某同学取一定质量的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图中甲,回答下列问题。
(反应的化学方程式:2KMnO4K2MnO4+MnO2+O2↑)
(1) 请根据图中数据计算高锰酸钾的质量为多少?(写出计算过程)
(2) 请在乙坐标中,画出固体中锰元素质量在t0~t5时段变化示意图。
2023—2024学年人教版(五四学制)化学八年级全一册第五单元 化学方程式 单元题含答案
人教版(五四学制)第五单元 化学方程式
一、选择题。
1、在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质 W G H P
反应前质量/g 18 1 2 32
反应后质量/g 待测 26 2 12
关于此反应的认识不正确的是( )。
A.物质H一定是该反应的催化剂
B.该反应一定是化合反应
C.W、P是反应物
D.待测值为13
【答案】A
2、在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。) 下列说法不正确的是( )
A.X的化学式是CO B.反应前后固体的质量不变
C.中碳元素的化合价为+4 D.该反应有元素的化合价发生改变
【答案】B
3、关于水的性质和组成,下列说法正确的是( )
A.从宏观组成上看,水是由氢气和氧气组成的
B.从微观结构上看,水分子是由氢分子和氧分子构成
C.水电解实验中负极和正极上产生的气体体积比为2:1
D.水电解该实验说明了水分子是由氢和氧构成
【答案】C
4、如图所示表示A、B、C、D四种物质在密闭容器中充分反应后质量分数的变化,则有关说法错误的是( )
A.该反应可以表示为A+BC
B.物质D有可能是该反应的催化剂
C.发生变化的A、C两物质的质量比为9:1
D.若m克A和n克B反应,则生成C的质量可能小于或等于(m+n)克
【答案】C
5、化学方程式:2N2H4+X=3N2+ 4H2O是发射通讯卫星的火箭发生的化学反应。X的化学式是( )
A. NO2 B. N2O C. N2O3 D. N2O4
【答案】D
6、工业上利用下列反应制取金属Hg:4HgS+4CaO=4Hg+3X+CaSO4。该反应中X的化学式为( )
A.CaS B.SO2 C.CaSO3 D.CaSO3
【答案】A
7、地球上有丰富的水资源,科学家一直在研究成本低、效率高的催化剂,使水发生反应获得氢能。下面说法不正确的是( )
A.保持水化学性质的最小微粒是氢原子和氧原子
B.电解水时负极产生的气体是氢气
C.生活中可利用煮沸的方式降低水的硬度
D.催化剂在化学反应前后,化学性质和质量不发生改变
【答案】A
8、下列有关“守恒”的叙述中,正确的是( )
A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等
B.在反应3Cu+8HNO3═3Cu(N03)2+2X↑+4H20中的X的化学式是NO2
C.加热24.5gKClO3和4gMnO2的混合物,反应一段时间后,剩余固体24.9g,则O2的质量为3.6g
D.某纯净物在氧气中燃烧后生成CO2、SO2和CO,该物质中一定含有C、S、O元素
【答案】C
9、分析推理是化学学习中常用的思维方法,下列推理正确的是( )
A. 氧化物都含氧元素,含氧元素的化合物都是氧化物
B. 含碳元素的物质充分燃烧会生成CO2, 所以燃烧能生成CO2的物质一定是碳元素
C. 置换反应必须有单质参与,有单质参与的反应都是置换反应
D. 原子和分子都是构成物质的微粒,因此物质不是由分子构成,就一定是由原子构成
【答案】B
10、根据化学方程式不能获得的信息是( )
A.该反应中的反应物和生成物 B.化学反应的快慢
C.反应发生所需要的条件 D.参加反应的各粒子的相对质量
【答案】B
11、下列关于电解水的叙述中正确的是( )
A.为增强水的导电性,常在水中加入一定量的稀硫酸或氢氧化钠溶液
B.在水电解器中加满水,然后接通交流电源
C.电解水的实验证明水是由氢气、氧气两种物质组成的
D.A为电源正极,相连的玻璃管内得到的气体能在空气中燃烧
【答案】A
12、利用天平进行定量研究,最早提出质量守恒定律的科学家是 ( )
A.拉瓦锡 B.门捷列夫 C.徐寿 D.屠呦呦
【答案】A
13、在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前的质量(克) 24.5 5 0.1 0.4
反应后的质量(克) 0 5 15 x
下列说法正确的是( )
A.乙是反应物 B.丁是催化剂
C.该反应为化合反应 D.x=10
【答案】D
14、根据化学方程式不能获得的信息是( )
A.反应中的反应物和生成物 B.各反应物、生成物之间的质量比
C.化学反应速率的快慢程度 D.反应发生所需要的条件
【答案】C
15、《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。太阳能的利用是热门研究方向之一。例如,通过光催化可将H2O、CO2转化为H2、CO、CH4(甲烷)、CH3OH(甲醇)等太阳能燃料,示意图如图。H2O、CO2转化得到的太阳能燃料中,属于氧化物的是( )
A.氢气 B.一氧化碳 C.甲烷 D.甲醇
【答案】B
16、下列对“质量守恒定律”的理解,正确的是 ( )
A.10 g冰受热融化成10 g水,符合质量守恒定律
B.蜡烛燃烧后质量减轻,不符合质量守恒定律
C.镁条在空气中燃烧后,生成物的质量比原来的镁条大,不符合质量守恒定律
D.任何化学反应中参加反应的各物质的质量总和都等于反应后各生成物的质量总和
【答案】D
二、填空题。
17、如图所示是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根据图示进行思考回答:(假设甲、乙两组药品混合前质量均为m前, 混合后质量均为 m 后)
(1)你认为甲组能否验证质量守恒定律,________(填“能”或“否”)。
(2)乙组物质混合前、后质量关系为:m前=m后, 乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,其原因是:
________ 。
【答案】(1)否 (2)两种药品不发生化学反应,不能验证质量守恒定律
18、配平下列化学方程式
(1)____Cu+___O2___CuO
(2)____Al2(SO4)3+____NaOH==____Al(OH)3↓+____Na2SO4
(3)____Cu2(OH)2CO3___CuO+___H2O+___CO2
【答案】 (1) 2 1 2 1
(2) 6 2 3 1 (3) 2 1 1
19、水是生命之源,通过化学学习,我们进一步认识了水及其在生产生活中的重要作用。
(1)图1为简易净水装置,其中活性炭的作用是 ;图2为蒸馏装置,该装置内发生的变化属于 (填“物理变化”或“化学变化”);我们可以用 来区分软水和硬水,生活中用 方法使硬水转化成软水。
(2)图3为简易水电解器,电解水反应的化学方程式: ,A管中产生的气体 ,从A、B两管中产生气体的体积比,推知水中氢原子与氧原子个数最简比为 。
(3)将图3中水的变化情况与图2中水的变化情况进行比较,请从微观的角度来解释二者的本质区别:
。
【答案】(1)吸附色素异味等;物理变化;肥皂水;煮沸。
(2)2H2O 2H2↑+O2↑;氧气;2:1。
(3)图3中:水分子分解生成氢原子和氧原子,氢原子结合生成氢分子,氧原子结合生成氧分子,即分子发生改变;
图2中:水分子之间的间隔先变大,后变小,即分子没有改变。
20、在一定密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 氧气 二氧化碳 水蒸气 M
反应前质量/g 100 1 1 46
反应后质量/g 4 89 55 x
(1)根据质量守恒定律,你认为x的值应为 。
(2)未知物质M一定含有的元素为 。
(3)已知未知物质M的相对分子质量为46,推出其化学式为 。
(4)该反应的化学方程式为 。
【答案】(1)0 (2)C、H、O (3)C2H5OH.
(4)C2H5OH+3O22CO2+3H2O
三、简答题。
21、从分子和原子的角度解释,为什么参加化学反应的各物质的质量总和一定等于反应后生成的各物质的质量总和。
_____________________________________________________________________
_____________________________________________________________________
______________________________________________________________。
【答案】因为化学反应实质是构成物质的分子分裂成原子,原子又重新组合成新分子的过程,反应前后原子种类、数目和质量都不变。所以由微粒聚集起来的宏观物质在参加化学反应前后质量的总和不变
四、实验题。
22、某研究小组在学习氧气的化学性质时发现:铁丝燃烧有火星没火焰,蜡烛燃烧有火焰.该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的化学方程式:____ 。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生 (如图所示).由此可知:蜡烛燃烧产生的火焰是由____(填“固态”或“气态”) 物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
物质 熔点/℃ 沸点/℃ 燃烧时温度/℃ 有无火焰
一氧化碳 ﹣205.1 ﹣191.5 约2600 有
石蜡 50-70 300-550 约600 有
铁 1535 2750 约1800 无
钠 97.8 883 约1400 ?
由表可知:物质燃烧能否产生火焰与其____(填“熔点”或“沸点”)和燃烧时温 度有关.由此推测:钠在燃烧时,____(填“有”或“没有”)火焰产生.
(4)木炭在纯氧中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是____ 。
【答案】(1) (2)气态 (3) 沸点 有
(4)木炭在燃烧时生成了可燃性的气体
23、根据以下实验方案,探究化学反应前后各物质的质量是否相等,请将你的思考及实验结果写在短线处。
【实验探究】同学们用托盘天平分别称量反应前后物质的质量。
实验方案 方案一 方案二
实验装置
实验过程 分别将反应物及反应容器放在托盘天平上,用砝码平衡
取下烧杯,将铁钉浸到硫酸铜溶液中,反应生成硫酸亚铁和铜,观察到的现象是 ,溶液由蓝色逐渐变为浅绿色;再将其放回托盘天平,天平的指针 (填“向左”“向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的H2O2溶液进入烧杯中,完全反应后放回托盘天平,天平指针 (填“向左”“向右”或“不”)偏转
【反思评价】上述天平不平衡的方案中,导致天平不平衡的物质是 。
【小结归纳】有气体参加或生成的化学反应,用来验证质量守恒定律时,必须
在 容器中进行。
【解释应用】化学反应中,反应前后 不变,所以纸张燃烧后剩余灰烬的质量变小 (填“遵循”或“不遵循”)质量守恒定律,理由是 。
【答案】铁钉表面有红色物质析出 不 向右 氧气 密闭 原子的种类、数目、质量 遵循 纸张燃烧生成的气体等物质扩散到空气中,使剩余固体质量变小
五、计算题。
24、实验室制取氧气时,某同学取一定质量的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图中甲,回答下列问题。
(反应的化学方程式:2KMnO4K2MnO4+MnO2+O2↑)
(3) 请根据图中数据计算高锰酸钾的质量为多少?(写出计算过程)
(4) 请在乙坐标中,画出固体中锰元素质量在t0~t5时段变化示意图。
【答案】(1) 3.2 g; (2)如图所示:
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
