人教版 高化 选择性必修1 4.5 实验活动5 制作简单的燃料电池 同步练习(含解析)
文档属性
| 名称 | 人教版 高化 选择性必修1 4.5 实验活动5 制作简单的燃料电池 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 761.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-14 10:12:59 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
3.5 实验活动5 制作简单的燃料电池 同步练习(含解析)
一、单选题
1.下列电池不属于化学电池的是( )
A.锂电池 B.太阳能电池 C.燃料电池 D.碱性干电池
2.化学与生活、社会发展息息相关。下列说法错误的是( )
A.燃料电池的能量转化率可达100%
B.用可溶性的铝盐或铁盐处理水中的悬浮物
C.体积分数75%的乙醇溶液可用于医疗消毒
D.食品中用木糖醇作甜味剂,可降低糖尿病的发病率
3.下列几种化学电池中,不属于可充电电池的是( )
A.碱性锌锰电池 B.手机用锂电池
C.汽车用铅蓄电池 D.玩具用镍氢电池
4.铁镍可充电电池的充、放电总反应表示为:NiO2+Fe+2H2OFe(OH)2+Ni(OH)2,由此可知,该电池放电时的负极是( )
A.Fe B.Ni(OH)2 C.Fe(OH)2 D.NiO2
5.液流电池是一种将正负极的电解质溶液分开,各自循环的高性能蓄电池,由于存放电解质溶液的液罐和反应场所分离,液流电池能够突破传统电池的体积限制,具有电池容量高、循环使用寿命长的特点。下列有关液流电池的说法错误的是( )
A.放电时,电子由负极经外电路流向正极
B.放电时,正极发生还原反应
C.正负极电解质溶液的成分可能不同
D.液流电池能将化学能全部转化成电能
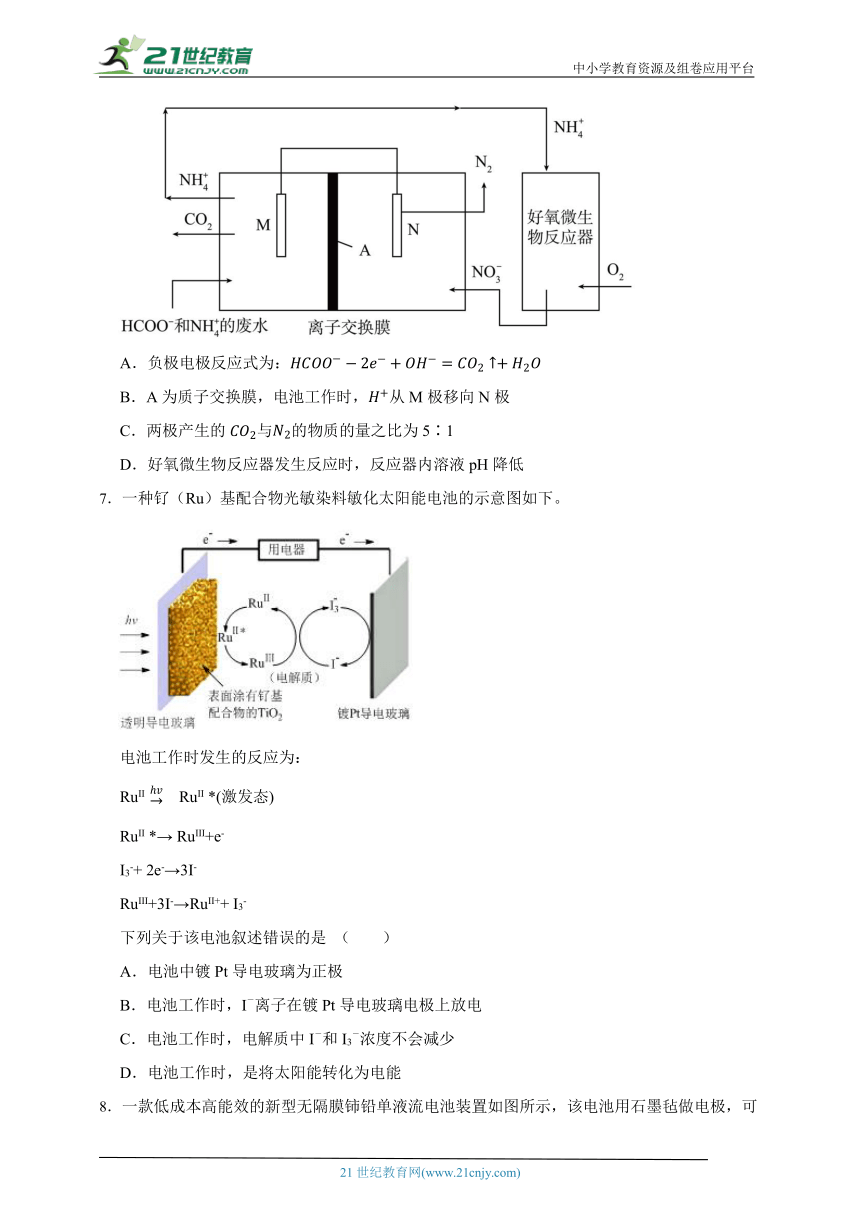
6.利用微生物电池去除废水中的,实现碳氮联合转化。工作原理如图所示,其中M、N为厌氧微生物电极。下列说法错误的是( )
A.负极电极反应式为:
B.A为质子交换膜,电池工作时,从M极移向N极
C.两极产生的与的物质的量之比为5∶1
D.好氧微生物反应器发生反应时,反应器内溶液pH降低
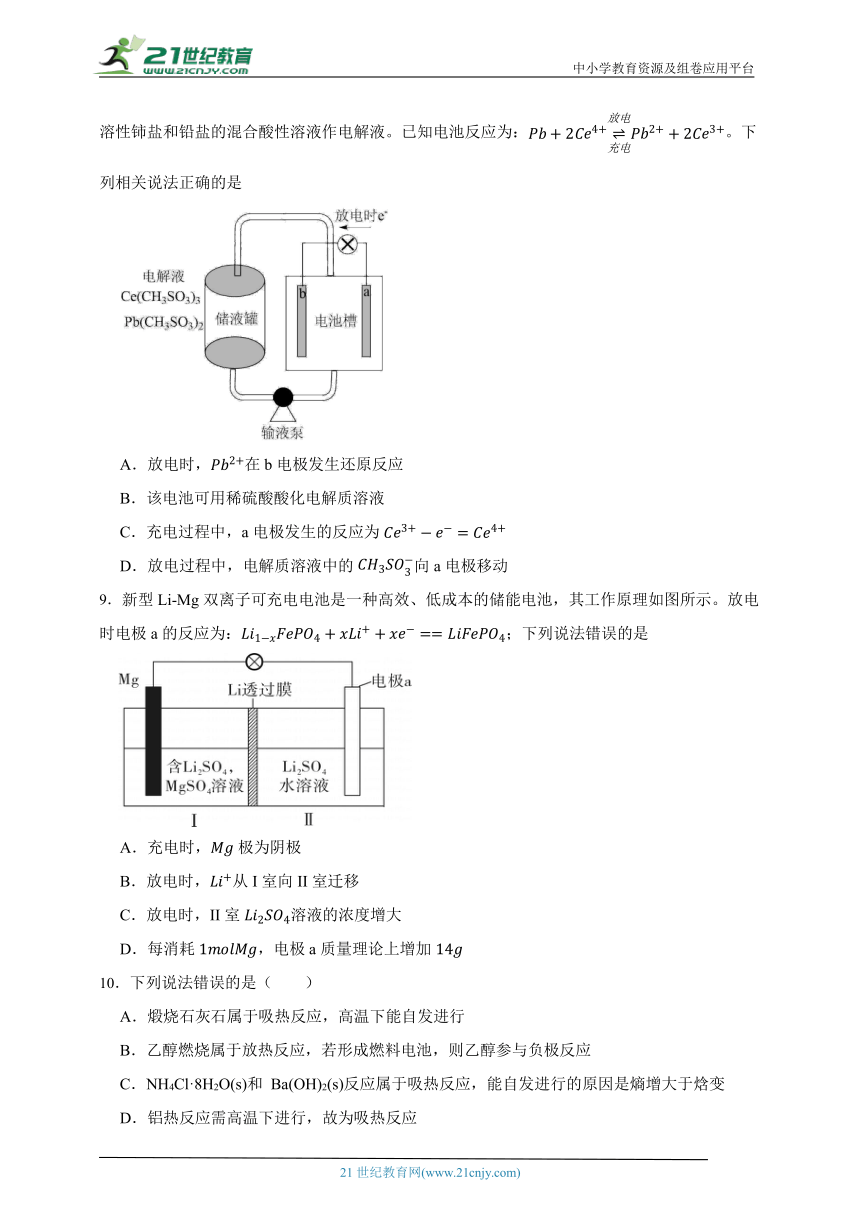
7.一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。
电池工作时发生的反应为:
RuII RuII *(激发态)
RuII *→ RuIII+e-
I3-+ 2e-→3I-
RuIII+3I-→RuII++ I3-
下列关于该电池叙述错误的是 ( )
A.电池中镀Pt导电玻璃为正极
B.电池工作时,I-离子在镀Pt导电玻璃电极上放电
C.电池工作时,电解质中I-和I3-浓度不会减少
D.电池工作时,是将太阳能转化为电能
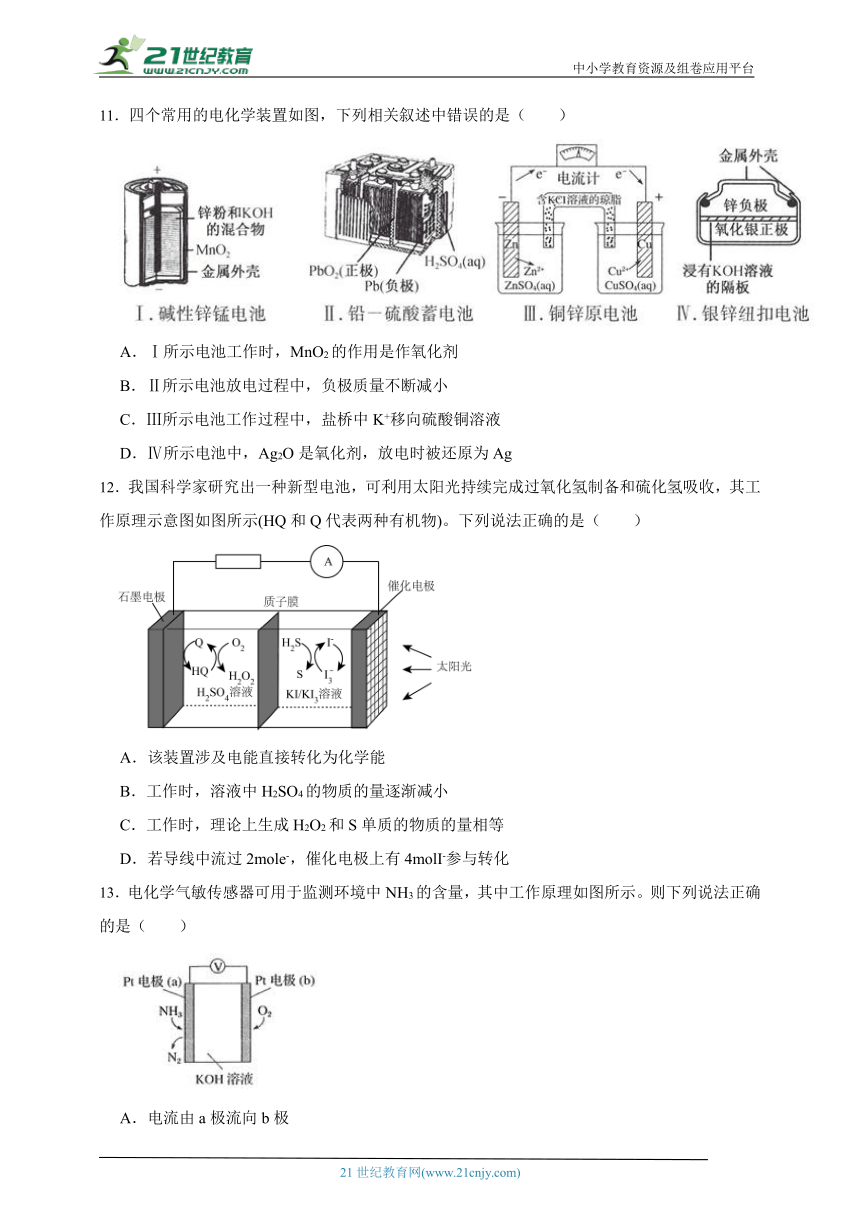
8.一款低成本高能效的新型无隔膜铈铅单液流电池装置如图所示,该电池用石墨毡做电极,可溶性铈盐和铅盐的混合酸性溶液作电解液。已知电池反应为:。下列相关说法正确的是
A.放电时,在b电极发生还原反应
B.该电池可用稀硫酸酸化电解质溶液
C.充电过程中,a电极发生的反应为
D.放电过程中,电解质溶液中的向a电极移动
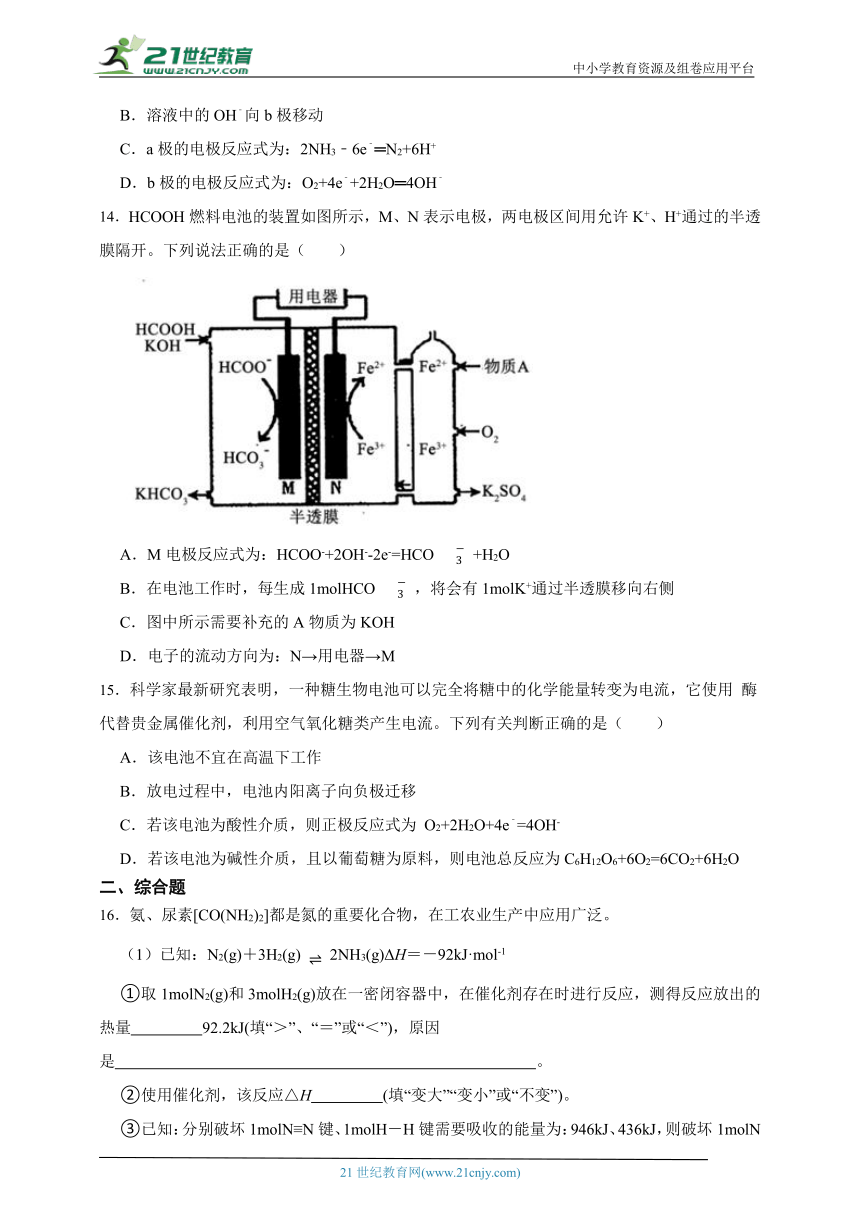
9.新型Li-Mg双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图所示。放电时电极a的反应为:;下列说法错误的是
A.充电时,极为阴极
B.放电时,从I室向II室迁移
C.放电时,II室溶液的浓度增大
D.每消耗,电极a质量理论上增加
10.下列说法错误的是( )
A.煅烧石灰石属于吸热反应,高温下能自发进行
B.乙醇燃烧属于放热反应,若形成燃料电池,则乙醇参与负极反应
C.NH4Cl·8H2O(s)和 Ba(OH)2(s)反应属于吸热反应,能自发进行的原因是熵增大于焓变
D.铝热反应需高温下进行,故为吸热反应
11.四个常用的电化学装置如图,下列相关叙述中错误的是( )
A.Ⅰ所示电池工作时,MnO2的作用是作氧化剂
B.Ⅱ所示电池放电过程中,负极质量不断减小
C.Ⅲ所示电池工作过程中,盐桥中K+移向硫酸铜溶液
D.Ⅳ所示电池中,Ag2O是氧化剂,放电时被还原为Ag
12.我国科学家研究出一种新型电池,可利用太阳光持续完成过氧化氢制备和硫化氢吸收,其工作原理示意图如图所示(HQ和Q代表两种有机物)。下列说法正确的是( )
A.该装置涉及电能直接转化为化学能
B.工作时,溶液中H2SO4的物质的量逐渐减小
C.工作时,理论上生成H2O2和S单质的物质的量相等
D.若导线中流过2mole-,催化电极上有4molI-参与转化
13.电化学气敏传感器可用于监测环境中NH3的含量,其中工作原理如图所示。则下列说法正确的是( )
A.电流由a极流向b极
B.溶液中的OH﹣向b极移动
C.a极的电极反应式为:2NH3﹣6e﹣═N2+6H+
D.b极的电极反应式为:O2+4e﹣+2H2O═4OH﹣
14.HCOOH燃料电池的装置如图所示,M、N表示电极,两电极区间用允许K+、H+通过的半透膜隔开。下列说法正确的是( )
A.M电极反应式为:HCOO-+2OH--2e-=HCO +H2O
B.在电池工作时,每生成1molHCO ,将会有1molK+通过半透膜移向右侧
C.图中所示需要补充的A物质为KOH
D.电子的流动方向为:N→用电器→M
15.科学家最新研究表明,一种糖生物电池可以完全将糖中的化学能量转变为电流,它使用 酶代替贵金属催化剂,利用空气氧化糖类产生电流。下列有关判断正确的是( )
A.该电池不宜在高温下工作
B.放电过程中,电池内阳离子向负极迁移
C.若该电池为酸性介质,则正极反应式为 O2+2H2O+4e﹣=4OH-
D.若该电池为碱性介质,且以葡萄糖为原料,则电池总反应为C6H12O6+6O2=6CO2+6H2O
二、综合题
16.氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92.2kJ(填“>”、“=”或“<”),原因是 。
②使用催化剂,该反应△H (填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为 kJ.
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)=H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
回答下列问题:
电池中的负极为 (填“甲”或“乙”),甲的电极反应式为 ,
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为 L。
17.可用于合成多种化工原料。用
生产绿色燃料甲醇时发生反应A:
(1)反应A的平衡常数表达式是 。
(2)已知:
不易直接测得,为了通过
和
计算得
,还需测定如下反应的反应热: 。
(3)在体积为1L的恒容密闭容器中发生反应A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对
平衡转化率影响的曲线。
①反应A的
0(填“>”或“<”)。
②曲线c对应的投料是 (填“[1mol,3mol] ”、“[1mol,4mol] ”或“[1mol,6mol]”)。
③℃时,曲线c对应的化学平衡常数 1(填“>”、“<”或“=”)。
(4)甲醇燃料电池(NaOH作电解质溶液)负极的电极方程式为 。
(5)在一定条件下,利用
合成
的反应过程中会有副反应:
。压强一定时,将初始投料比一定的
和
按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对
、CO的产率影响如图1所示,温度对
的转化率影响如图2所示。
由图像可知,升高温度,
的实际转化率提高而甲醇的产率降低,其原因是 。
答案解析部分
1.【答案】B
【解析】【解答】锂电池、燃料电池、碱性干电池都是化学能变为电能的装置,属于化学电池,太阳能电池是将太阳能转化为电能的装置,不属于化学电池,故B符合题意。
故答案为:B。
【分析】化学电池指通过化学反应,将化学能转化为电能的装置,太阳能电池是李用哪个太阳能发电,将太阳能转化为电能。
2.【答案】A
【解析】【解答】A.燃料电池是将化学能转变为电能的装置,还会伴有热能等能量的释放,能量转化率不会达100%,A项符合题意;
B.可溶性的铝盐和铁盐水解分别生成氢氧化铝胶体、氢氧化铁胶体,具有吸附性,吸附水中的悬浮物,B项不符合题意;
C.酒精能够使蛋白质变性,而75%的酒精溶液杀菌消毒效果最好,则医用酒精体积分数是75%,C项不符合题意;
D.木糖醇属于多元醇而不属于多羟基醛或酮,不属于糖类物质,食品中用木糖醇作甜味剂,可降低糖尿病的发病率,D项不符合题意;
故答案为:A。
【分析】A.燃料电池的能量转换率较高;
B.可溶性的铝盐和铁盐水解分别生成氢氧化铝胶体、氢氧化铁胶体;
C.医用酒精体积分数是75%;
D.木糖醇属于多元醇,不属于糖类物质。
3.【答案】A
【解析】【解答】A、碱性锌锰电池属于一次电池,不属于可充电电池;
B、手机用锂电池属于可充电电池;
C、汽车用铅蓄电池属于可充电电池;
D、玩具用镍氢电池属于可充电电池;
故答案为:A。
【分析】 常见电池有一次电池、二次电池以及燃料电池,其中一次电池不能充电而重复使用,常见碱性锌锰电池为一次电池,据此解答。
4.【答案】A
【解析】【解答】A.Fe为放电时的负极,故A符合题意;
B.Ni(OH)2为充电时的阳极,故B不符合题意;
C.Fe(OH)2为充电时的阴极,故C不符合题意;
D.NiO2为放电时的正极,故D不符合题意;
故答案为:A。
【分析】负极失电子,化合价升高,金属单质在化学反应中化合价升高,作为负极。
5.【答案】D
【解析】【解答】A.原电池放电时,电子由负极经外电路流向正极,故A不符合题意;
B.原电池放电时,正极发生得电子的还原反应,故B不符合题意;
C.由题给信息可知,液流电池是利用正负极电解液分开,各自循环的一种高性能蓄电池,则正负极电解质溶液的成分可能不同,故C不符合题意;
D.液流电池能将化学能部分转化成电能,部分转化为热能,故D符合题意;
故答案为:D。
【分析】A.原电池放电时,电子由负极经外电路流向正极;
B.原电池放电时,正极发生得电子的还原反应;
C.由题给信息可知,液流电池是利用正负极电解液分开,各自循环的一种高性能蓄电池;
D.电池能将化学能部分转化成电能,部分转化为热能。
6.【答案】A
【解析】【解答】A.M极为负极,电极反应式为,A符合题意;
B.原电池工作时,H+从M极向N极移动,故A为质子交换膜,B不符合题意;
C.电路中转移10mol电子时,M极生成5molCO2,N极生成1molN2,两极产生的CO2和N2的物质的量之比为5:1,C不符合题意;
D.好氧微生物反应器发生反应,生成氢离子,反应器内溶液pH降低,D不符合题意;
故答案为:A。
【分析】A、甲酸根转化为二氧化碳,化合价升高,M为负极;
B、氢离子在M很差,移向N,所以A为质子交换膜;
C、M极生成5molCO2,N极生成1molN2,两者的物质的量之比为5:1;
D、,生成氢离子,反应器内溶液pH降低。
7.【答案】B
【解析】【解答】根据上述分析,结合图示信息得,
A. 由图可知,镀Pt导电玻璃极为电子流入的一极,所以为正极,A项不符合题意;
B. 原电池中阴离子在负极周围,所以I-离子不在镀Pt导电玻璃电极上放电,B项符合题意;
C. 电池的电解质溶液中I-的浓度和I3-的浓度不变,C项不符合题意;
D. 由图可知该电池是将太阳能转化为电能的装置,D项不符合题意。
故答案为:B。
【分析】由图电子的移动方向可知,半导材料TiO2为原电池的负极,镀Pt导电玻璃为原电池的正极,电解质为I3-和I-的混合物,I3-在正极上得电子被还原,正极反应为I3-+2e-=3I-,由此分析解答。
8.【答案】D
【解析】【解答】A.由题中方程式可知放电过程是,发生在a电极氧化反应 ,A不符合题意;
B.硫酸根离子会与铅离子反应生成硫酸铅沉淀,所以不能用稀硫酸酸化电解质溶液,B不符合题意;
C.充电过程中,a电极发生的反应为,C不符合题意;
D.放电过程中,内电路电流的方向是a-b,所以电解质溶液中的向a电极移动,D符合题意;
故答案为:D。
【分析】A.反应中元素化合价升高,发生氧化反应,元素化合价降低,发生还原反应;
B.硫酸根离子会与铅离子反应生成硫酸铅沉淀;
C.充电时,阳极失电子,发生氧化反应;
D.放电时,内电路中阴离子移向阳极、阳离子移向阴极。
9.【答案】C
【解析】【解答】A.放电时电极a的反应为:,a为正极,为负极,所以充电时为阴极,A不符合题意;
B.放电时I室为负极区,II室为正极区,阳离子向正极移动,所以向II室迁移,B不符合题意;
C.放电时电极a的反应为:,消耗,所以溶液的浓度减小,C符合题意;
D.放电时发生反应:,当有发生反应时,转移,电极a质量理论上增加,质量为:,D不符合题意;
故答案为:C。
【分析】放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;原电池“同性相吸”,阳离子移向正极,阴离子移向负极。
10.【答案】D
【解析】【解答】A. 煅烧石灰石生成氧化钙和二氧化碳,属于吸热反应, H>0, S>0,根据 G= H-T S<0能自发进行可知,该反应在高温下能自发进行,A不符合题意;
B. 反应能设计成原电池的是自发进行的氧化还原反应, H<0;乙醇燃烧属于氧化还原反应, H<0,若形成燃料电池,则乙醇参与负极反应,失电子发生氧化反应,B不符合题意;
C. 根据 G= H-T S<0能自发进行可知,该反应为吸热反应, H>0,则该反应 S>0,且熵增大于焓变,C不符合题意;
D. 铝热反应的发生需要在高温下引发反应,反应发生后放出大量的热,所以该反应为放热反应, D符合题意;
故答案为:D
【分析】A.根据复合判据 G= H-T S<0,判断反应能否自发进行;
B.燃烧反应都属于放热反应,在燃料电池中,燃料作为负极反应物;
C.根据复合判据 G= H-T S<0,判断反应自发进行的原因;
D.铝热反应为放热反应;
11.【答案】B
【解析】【解答】A.碱性锌锰电池,MnO2是氧化剂,在正极上被还原,故A不符合题意;
B.铅的化合价升高,发生氧化反应,电极反应式为:Pb+ -2e-=PbSO4,生成硫酸铅,质量不断增加,故B符合题意;
C.原电池中阳离子向正极移动,所以盐桥中K+移向硫酸铜溶液,故C不符合题意;
D.该原电池中,正极上氧化银得电子生成银,所以Ag2O作氧化剂发生还原反应,故D不符合题意;
故答案为:B。
【分析】A.氧化剂产能过程当中所含元素化合价降低;
B.依据产生离子与电解质溶液反应生成新物质;
C.原电池中阳离子向正极移动;
D.氧化剂产能过程当中所含元素化合价降低。
12.【答案】C
【解析】【解答】A.该装置太阳能和化学能转化为电能,故A不符合题意;
B.由分析可知,该电池总反应为H2S+O2 = S↓+H2O2,硫酸浓度保持不变,故B不符合题意;
C.由分析可知,当电路中转移2mol电子时,负极生成1mol,最终反应生成1molS,正极生成2molHQ,最终生成1mol H2O2,理论上生成H2O2和S单质的物质的量相等,故C符合题意;
D.催化电极为负极,电极反应式为,导线中流过2mole-,催化电极上有3molI-参与转化,故D不符合题意;
故答案为:C。
【分析】A.太阳能和化学能转化为电能;
B.依据电池总反应;
C.利用得失电子守恒;
D.利用电极反应式分析。
13.【答案】D
【解析】【解答】A. 氧气在b极发生还原反应,则b极为正极,电流由正极流向负极,则电流由b极流向a极,A不符合题意;
B. 溶液中的阴离子会移向负极,故OH﹣向a极移动,B不符合题意;
C. a极通入氨气生成氮气,电解质环境是碱性,则a极的电极反应式为:2NH3+6OH﹣﹣6e﹣═N2+6H2O,C不符合题意;
D. b极氧气得电子被还原,电极反应式为:O2+4e﹣+2H2O═4OH﹣,D符合题意;
故答案为:D
【分析】在该原电池装置中,a电极为负极,NH3发生失电子的氧化反应,生成N2,其电极反应式为:2NH3-6e-+6OH-=N2+6H2O;b电极为正极,O2发生得电子的还原反应,生成OH-,其电极反应式为:O2+4e-+2H2O=4OH-;据此结合选项分析。
14.【答案】A
【解析】【解答】A.由以上分析知,M电极为负极,反应式为:HCOO-+2OH--2e-=HCO +H2O,故A符合题意;
B.负极反应式为HCOO-+2OH--2e-=HCO +H2O,根据溶液呈电中性知,在电池工作时,每生成1molHCO ,将会有2molK+通过半透膜移向右侧,故B不符合题意;
C.由以上分析知,图中所示需要补充的A物质为H2SO4,故C不符合题意;
D.原电池中电子从负极经导线流向正极,故电子的流动方向为:M→用电器→N,故D不符合题意;
故答案为:A。
【分析】HCOOH燃料电池是原电池装置,原电池工作时,负极发生失电子的氧化反应,根据图示中各电极上物质的变化,负极上HCOO-被氧化为HCO ,电极反应式为HCOO-+2OH--2e-=HCO +H2O。根据图示,加入 A发生的离子反应为4Fe2+ +4H+ +O2=Fe3+ + 2H2O,消耗H+,K2SO4从装置中流出,故放电过程中加入的物质A为H2SO4。该燃料电池的正极Fe2+和Fe3+存在着循环,正极上本质是O2得到电子,故燃料电池的总反应本质是HCOOH和 O2反应生成HCO ,结合原子守恒和电荷守恒,配平离子方程式为2HCOOH +2OH- +O2 = 2 HCO + 2H2O。
15.【答案】A
【解析】【解答】A.糖生物电池中的催化剂为生物酶,高温条件下生物酶死亡,催化活性减弱,糖电池工作效率降低或不工作,所以糖电池不宜在高温下工作,故A符合题意;
B.原电池放电时,内电路中阳离子移向正极、阴离子移向负极,故B不符合题意;
C.该电池中糖类所在电极为负极,通入氧气的电极为正极,酸性介质中氧气得电子生成水,电极反应式为O2+4e-+4H+=2H2O,故C不符合题意;
D.葡萄糖碱性原电池的总反应为C6H12O6+6O2+12OH-=6CO32﹣+12H2O,故D不符合题意;
故答案为:A。
【分析】A.生物酶适宜的环境是常温,高温条件下生物霉死亡;
B.原电池放电时,内电路中阳离子移向正极,阴离子移向负极;
C.该电池中,空气氧化糖类产生电流,则糖类所在电极为负极,通入氧气的电极为正极;
D.碱性介质中葡萄糖氧化生成CO32﹣。
16.【答案】(1)<;由于该反应是可逆反应,反应物无法全部转化为生成物;不变;391
(2)2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol;甲;CO(NH2)2+H2O﹣6e﹣= CO2↑+N2↑+6H+;33.6
【解析】【解答】(1)①N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,
故答案为:<;由于该反应是可逆反应,反应物无法全部转化为生成物;②催化剂改变反应速率不改变化学平衡,反应热不变,
故答案为:不变;③已知:分别破坏1 mol N≡N键、1 mol H H键需要吸收的能量为:946 kJ、436 kJ,设破坏1 mol N H键需要吸收的能量为x,根据N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,焓变=反应物总键能 生成物的总键能,即946 kJ/mol+3×436 kJ/mol 6x = -92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol N H键需要吸收的能量为:391 kJ;
故答案为:391;(2)①由Ⅰ. 2NH3(g)+CO2(g)= NH2CO2NH4(s) H = -159.5kJ mol-1
Ⅱ.NH2CO2NH4(s)= CO(NH2)2(s)+H2O(g) △H = +116.5kJ mol-1
Ⅲ. H2O(l)=H2O(g) △H=+44.0kJ mol-1
结合盖斯定律可知,①+②-③得到2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l),其△H = 159.5 kJ mol 1+(+116.5kJ mol 1) (+44.0kJ mol 1)= 87.0kJ mol 1,则CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol,
故答案为:2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol;
②根据图示可知,甲电极上CO(NH2)2反应生成二氧化碳和氮气,N元素化合价升高,失电子,为电源的负极,电解质溶液为酸性,则其电极反应式为:CO(NH2)2+H2O﹣6e﹣= CO2↑+N2↑+6H+,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,根据关系式2 CO(NH2)2 3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol 22.4 L/mol = 33.6 L,
故答案为:甲;CO(NH2)2+H2O﹣6e﹣= CO2↑+N2↑+6H+;33.6。
【分析】(1)①合成氨反应为可逆反应,不可能进行到底,故在实际生产中1 mol N2和3 mol H2不可能生成2 mol NH3,放出的热量也必定小于92 kJ;②催化剂改变反应速率不改变化学平衡及△H;③ΔH=反应物的键能之和—生成物的键能之和,据此分析作答;(2)①根据盖斯定律计算;②该电池CO(NH2)2在负极失电子生成二氧化碳和氮气,氧气在正极反应生成水,电解质溶液中含氢离子,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,据此分析作答;
17.【答案】(1)
(2)或
(3)<;[1mol,6mol];<
(4)
(5)升高温度,反应B(副反应)的速率增加得比反应(A)快
【解析】【解答】(1)平衡常数表达式是平衡时生成物浓度幂之积除以反应物浓度幂之积,反应A的平衡常数表达式为:K= 。
(2)为了通过ΔH2和ΔH3计算ΔH1,需要有氢气参加反应,同时要删掉氧气,所以需要测定反应2H2(g)+O2(g)=2H2O(g)或H2O(l)的反应热,然后利用盖斯定律就可以求出ΔH1。
(3)①从曲线可知,温度升高,二氧化碳的平衡转化率降低,说明该反应的正反应是放热反应,所以 ΔH1<0。
②当二氧化碳的物质的量一定,增加氢气的物质的量,可以增大二氧化碳的平衡转化率,曲线c对应的二氧化碳的平衡转化率最大,所以曲线c对应的投料是[1mol,6mol]。
③曲线c的投料是1molCO2,6molH2。T1℃时,达到平衡时二氧化碳的转化率为65%,即二氧化碳转化了0.65mol,根据反应方程式,转化的氢气的物质的量为1.95mol,生成的甲醇和水蒸气的物质的量都是0.65mol,平衡时二氧化碳的物质的量为0.35mol,氢气的物质的量为6mol-1.95mol=4.05mol,容器体积为1L,物质的量和浓度相等,所以化学平衡常数K=
。
(4)甲醇燃料电池(NaOH作电解质溶液)负极是甲醇失去电子生成
,电极方程式为:CH3OH-6e-+8OH-=
+6H2O 。
(5)升高温度,反应速率加快,二氧化碳实际转化率提高;温度升高,CO的产率升高,说明副反应是吸热反应,反应A 是放热反应,升高温度,副反应速率比A更快,则生成了更多的CO,导致甲醇的产率降低。
【分析】(1)平衡常数表达式是平衡时生成物浓度幂之积除以反应物浓度幂之积;
(2)依据盖斯定律分析解答;
(3)①从曲线可知,温度升高,二氧化碳的平衡转化率降低;
②当二氧化碳的物质的量一定, 增加氢气的物质的量,可以增大二氧化碳的平衡转化率,曲线c对应的二氧化碳的平衡转化率最大;
③曲线c的投料是1molCO2,6molH2。T1℃时,达到平衡时二氧化碳的转化率为65%,即二氧化碳转化了0.65mol,根据反应方程式,求出平衡时CO2,H2、CH3OH、H2O的物质的量,容器体积为1L,物质的量和浓度相等,带入化学平衡常数K的公式即可求出K表达式即可求出K,与1进行比较;
(4)甲醇燃料电池(NaOH作电解质溶液)负极是甲醇失去电子生成CO32- ;
(5)温度升高,CO的产率升高,说明副反应是吸热反应,反应A是放热反应,升高温度,副反应速率比A更快。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.5 实验活动5 制作简单的燃料电池 同步练习(含解析)
一、单选题
1.下列电池不属于化学电池的是( )
A.锂电池 B.太阳能电池 C.燃料电池 D.碱性干电池
2.化学与生活、社会发展息息相关。下列说法错误的是( )
A.燃料电池的能量转化率可达100%
B.用可溶性的铝盐或铁盐处理水中的悬浮物
C.体积分数75%的乙醇溶液可用于医疗消毒
D.食品中用木糖醇作甜味剂,可降低糖尿病的发病率
3.下列几种化学电池中,不属于可充电电池的是( )
A.碱性锌锰电池 B.手机用锂电池
C.汽车用铅蓄电池 D.玩具用镍氢电池
4.铁镍可充电电池的充、放电总反应表示为:NiO2+Fe+2H2OFe(OH)2+Ni(OH)2,由此可知,该电池放电时的负极是( )
A.Fe B.Ni(OH)2 C.Fe(OH)2 D.NiO2
5.液流电池是一种将正负极的电解质溶液分开,各自循环的高性能蓄电池,由于存放电解质溶液的液罐和反应场所分离,液流电池能够突破传统电池的体积限制,具有电池容量高、循环使用寿命长的特点。下列有关液流电池的说法错误的是( )
A.放电时,电子由负极经外电路流向正极
B.放电时,正极发生还原反应
C.正负极电解质溶液的成分可能不同
D.液流电池能将化学能全部转化成电能
6.利用微生物电池去除废水中的,实现碳氮联合转化。工作原理如图所示,其中M、N为厌氧微生物电极。下列说法错误的是( )
A.负极电极反应式为:
B.A为质子交换膜,电池工作时,从M极移向N极
C.两极产生的与的物质的量之比为5∶1
D.好氧微生物反应器发生反应时,反应器内溶液pH降低
7.一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。
电池工作时发生的反应为:
RuII RuII *(激发态)
RuII *→ RuIII+e-
I3-+ 2e-→3I-
RuIII+3I-→RuII++ I3-
下列关于该电池叙述错误的是 ( )
A.电池中镀Pt导电玻璃为正极
B.电池工作时,I-离子在镀Pt导电玻璃电极上放电
C.电池工作时,电解质中I-和I3-浓度不会减少
D.电池工作时,是将太阳能转化为电能
8.一款低成本高能效的新型无隔膜铈铅单液流电池装置如图所示,该电池用石墨毡做电极,可溶性铈盐和铅盐的混合酸性溶液作电解液。已知电池反应为:。下列相关说法正确的是
A.放电时,在b电极发生还原反应
B.该电池可用稀硫酸酸化电解质溶液
C.充电过程中,a电极发生的反应为
D.放电过程中,电解质溶液中的向a电极移动
9.新型Li-Mg双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图所示。放电时电极a的反应为:;下列说法错误的是
A.充电时,极为阴极
B.放电时,从I室向II室迁移
C.放电时,II室溶液的浓度增大
D.每消耗,电极a质量理论上增加
10.下列说法错误的是( )
A.煅烧石灰石属于吸热反应,高温下能自发进行
B.乙醇燃烧属于放热反应,若形成燃料电池,则乙醇参与负极反应
C.NH4Cl·8H2O(s)和 Ba(OH)2(s)反应属于吸热反应,能自发进行的原因是熵增大于焓变
D.铝热反应需高温下进行,故为吸热反应
11.四个常用的电化学装置如图,下列相关叙述中错误的是( )
A.Ⅰ所示电池工作时,MnO2的作用是作氧化剂
B.Ⅱ所示电池放电过程中,负极质量不断减小
C.Ⅲ所示电池工作过程中,盐桥中K+移向硫酸铜溶液
D.Ⅳ所示电池中,Ag2O是氧化剂,放电时被还原为Ag
12.我国科学家研究出一种新型电池,可利用太阳光持续完成过氧化氢制备和硫化氢吸收,其工作原理示意图如图所示(HQ和Q代表两种有机物)。下列说法正确的是( )
A.该装置涉及电能直接转化为化学能
B.工作时,溶液中H2SO4的物质的量逐渐减小
C.工作时,理论上生成H2O2和S单质的物质的量相等
D.若导线中流过2mole-,催化电极上有4molI-参与转化
13.电化学气敏传感器可用于监测环境中NH3的含量,其中工作原理如图所示。则下列说法正确的是( )
A.电流由a极流向b极
B.溶液中的OH﹣向b极移动
C.a极的电极反应式为:2NH3﹣6e﹣═N2+6H+
D.b极的电极反应式为:O2+4e﹣+2H2O═4OH﹣
14.HCOOH燃料电池的装置如图所示,M、N表示电极,两电极区间用允许K+、H+通过的半透膜隔开。下列说法正确的是( )
A.M电极反应式为:HCOO-+2OH--2e-=HCO +H2O
B.在电池工作时,每生成1molHCO ,将会有1molK+通过半透膜移向右侧
C.图中所示需要补充的A物质为KOH
D.电子的流动方向为:N→用电器→M
15.科学家最新研究表明,一种糖生物电池可以完全将糖中的化学能量转变为电流,它使用 酶代替贵金属催化剂,利用空气氧化糖类产生电流。下列有关判断正确的是( )
A.该电池不宜在高温下工作
B.放电过程中,电池内阳离子向负极迁移
C.若该电池为酸性介质,则正极反应式为 O2+2H2O+4e﹣=4OH-
D.若该电池为碱性介质,且以葡萄糖为原料,则电池总反应为C6H12O6+6O2=6CO2+6H2O
二、综合题
16.氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92.2kJ(填“>”、“=”或“<”),原因是 。
②使用催化剂,该反应△H (填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为 kJ.
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)=H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
回答下列问题:
电池中的负极为 (填“甲”或“乙”),甲的电极反应式为 ,
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为 L。
17.可用于合成多种化工原料。用
生产绿色燃料甲醇时发生反应A:
(1)反应A的平衡常数表达式是 。
(2)已知:
不易直接测得,为了通过
和
计算得
,还需测定如下反应的反应热: 。
(3)在体积为1L的恒容密闭容器中发生反应A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对
平衡转化率影响的曲线。
①反应A的
0(填“>”或“<”)。
②曲线c对应的投料是 (填“[1mol,3mol] ”、“[1mol,4mol] ”或“[1mol,6mol]”)。
③℃时,曲线c对应的化学平衡常数 1(填“>”、“<”或“=”)。
(4)甲醇燃料电池(NaOH作电解质溶液)负极的电极方程式为 。
(5)在一定条件下,利用
合成
的反应过程中会有副反应:
。压强一定时,将初始投料比一定的
和
按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对
、CO的产率影响如图1所示,温度对
的转化率影响如图2所示。
由图像可知,升高温度,
的实际转化率提高而甲醇的产率降低,其原因是 。
答案解析部分
1.【答案】B
【解析】【解答】锂电池、燃料电池、碱性干电池都是化学能变为电能的装置,属于化学电池,太阳能电池是将太阳能转化为电能的装置,不属于化学电池,故B符合题意。
故答案为:B。
【分析】化学电池指通过化学反应,将化学能转化为电能的装置,太阳能电池是李用哪个太阳能发电,将太阳能转化为电能。
2.【答案】A
【解析】【解答】A.燃料电池是将化学能转变为电能的装置,还会伴有热能等能量的释放,能量转化率不会达100%,A项符合题意;
B.可溶性的铝盐和铁盐水解分别生成氢氧化铝胶体、氢氧化铁胶体,具有吸附性,吸附水中的悬浮物,B项不符合题意;
C.酒精能够使蛋白质变性,而75%的酒精溶液杀菌消毒效果最好,则医用酒精体积分数是75%,C项不符合题意;
D.木糖醇属于多元醇而不属于多羟基醛或酮,不属于糖类物质,食品中用木糖醇作甜味剂,可降低糖尿病的发病率,D项不符合题意;
故答案为:A。
【分析】A.燃料电池的能量转换率较高;
B.可溶性的铝盐和铁盐水解分别生成氢氧化铝胶体、氢氧化铁胶体;
C.医用酒精体积分数是75%;
D.木糖醇属于多元醇,不属于糖类物质。
3.【答案】A
【解析】【解答】A、碱性锌锰电池属于一次电池,不属于可充电电池;
B、手机用锂电池属于可充电电池;
C、汽车用铅蓄电池属于可充电电池;
D、玩具用镍氢电池属于可充电电池;
故答案为:A。
【分析】 常见电池有一次电池、二次电池以及燃料电池,其中一次电池不能充电而重复使用,常见碱性锌锰电池为一次电池,据此解答。
4.【答案】A
【解析】【解答】A.Fe为放电时的负极,故A符合题意;
B.Ni(OH)2为充电时的阳极,故B不符合题意;
C.Fe(OH)2为充电时的阴极,故C不符合题意;
D.NiO2为放电时的正极,故D不符合题意;
故答案为:A。
【分析】负极失电子,化合价升高,金属单质在化学反应中化合价升高,作为负极。
5.【答案】D
【解析】【解答】A.原电池放电时,电子由负极经外电路流向正极,故A不符合题意;
B.原电池放电时,正极发生得电子的还原反应,故B不符合题意;
C.由题给信息可知,液流电池是利用正负极电解液分开,各自循环的一种高性能蓄电池,则正负极电解质溶液的成分可能不同,故C不符合题意;
D.液流电池能将化学能部分转化成电能,部分转化为热能,故D符合题意;
故答案为:D。
【分析】A.原电池放电时,电子由负极经外电路流向正极;
B.原电池放电时,正极发生得电子的还原反应;
C.由题给信息可知,液流电池是利用正负极电解液分开,各自循环的一种高性能蓄电池;
D.电池能将化学能部分转化成电能,部分转化为热能。
6.【答案】A
【解析】【解答】A.M极为负极,电极反应式为,A符合题意;
B.原电池工作时,H+从M极向N极移动,故A为质子交换膜,B不符合题意;
C.电路中转移10mol电子时,M极生成5molCO2,N极生成1molN2,两极产生的CO2和N2的物质的量之比为5:1,C不符合题意;
D.好氧微生物反应器发生反应,生成氢离子,反应器内溶液pH降低,D不符合题意;
故答案为:A。
【分析】A、甲酸根转化为二氧化碳,化合价升高,M为负极;
B、氢离子在M很差,移向N,所以A为质子交换膜;
C、M极生成5molCO2,N极生成1molN2,两者的物质的量之比为5:1;
D、,生成氢离子,反应器内溶液pH降低。
7.【答案】B
【解析】【解答】根据上述分析,结合图示信息得,
A. 由图可知,镀Pt导电玻璃极为电子流入的一极,所以为正极,A项不符合题意;
B. 原电池中阴离子在负极周围,所以I-离子不在镀Pt导电玻璃电极上放电,B项符合题意;
C. 电池的电解质溶液中I-的浓度和I3-的浓度不变,C项不符合题意;
D. 由图可知该电池是将太阳能转化为电能的装置,D项不符合题意。
故答案为:B。
【分析】由图电子的移动方向可知,半导材料TiO2为原电池的负极,镀Pt导电玻璃为原电池的正极,电解质为I3-和I-的混合物,I3-在正极上得电子被还原,正极反应为I3-+2e-=3I-,由此分析解答。
8.【答案】D
【解析】【解答】A.由题中方程式可知放电过程是,发生在a电极氧化反应 ,A不符合题意;
B.硫酸根离子会与铅离子反应生成硫酸铅沉淀,所以不能用稀硫酸酸化电解质溶液,B不符合题意;
C.充电过程中,a电极发生的反应为,C不符合题意;
D.放电过程中,内电路电流的方向是a-b,所以电解质溶液中的向a电极移动,D符合题意;
故答案为:D。
【分析】A.反应中元素化合价升高,发生氧化反应,元素化合价降低,发生还原反应;
B.硫酸根离子会与铅离子反应生成硫酸铅沉淀;
C.充电时,阳极失电子,发生氧化反应;
D.放电时,内电路中阴离子移向阳极、阳离子移向阴极。
9.【答案】C
【解析】【解答】A.放电时电极a的反应为:,a为正极,为负极,所以充电时为阴极,A不符合题意;
B.放电时I室为负极区,II室为正极区,阳离子向正极移动,所以向II室迁移,B不符合题意;
C.放电时电极a的反应为:,消耗,所以溶液的浓度减小,C符合题意;
D.放电时发生反应:,当有发生反应时,转移,电极a质量理论上增加,质量为:,D不符合题意;
故答案为:C。
【分析】放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;原电池“同性相吸”,阳离子移向正极,阴离子移向负极。
10.【答案】D
【解析】【解答】A. 煅烧石灰石生成氧化钙和二氧化碳,属于吸热反应, H>0, S>0,根据 G= H-T S<0能自发进行可知,该反应在高温下能自发进行,A不符合题意;
B. 反应能设计成原电池的是自发进行的氧化还原反应, H<0;乙醇燃烧属于氧化还原反应, H<0,若形成燃料电池,则乙醇参与负极反应,失电子发生氧化反应,B不符合题意;
C. 根据 G= H-T S<0能自发进行可知,该反应为吸热反应, H>0,则该反应 S>0,且熵增大于焓变,C不符合题意;
D. 铝热反应的发生需要在高温下引发反应,反应发生后放出大量的热,所以该反应为放热反应, D符合题意;
故答案为:D
【分析】A.根据复合判据 G= H-T S<0,判断反应能否自发进行;
B.燃烧反应都属于放热反应,在燃料电池中,燃料作为负极反应物;
C.根据复合判据 G= H-T S<0,判断反应自发进行的原因;
D.铝热反应为放热反应;
11.【答案】B
【解析】【解答】A.碱性锌锰电池,MnO2是氧化剂,在正极上被还原,故A不符合题意;
B.铅的化合价升高,发生氧化反应,电极反应式为:Pb+ -2e-=PbSO4,生成硫酸铅,质量不断增加,故B符合题意;
C.原电池中阳离子向正极移动,所以盐桥中K+移向硫酸铜溶液,故C不符合题意;
D.该原电池中,正极上氧化银得电子生成银,所以Ag2O作氧化剂发生还原反应,故D不符合题意;
故答案为:B。
【分析】A.氧化剂产能过程当中所含元素化合价降低;
B.依据产生离子与电解质溶液反应生成新物质;
C.原电池中阳离子向正极移动;
D.氧化剂产能过程当中所含元素化合价降低。
12.【答案】C
【解析】【解答】A.该装置太阳能和化学能转化为电能,故A不符合题意;
B.由分析可知,该电池总反应为H2S+O2 = S↓+H2O2,硫酸浓度保持不变,故B不符合题意;
C.由分析可知,当电路中转移2mol电子时,负极生成1mol,最终反应生成1molS,正极生成2molHQ,最终生成1mol H2O2,理论上生成H2O2和S单质的物质的量相等,故C符合题意;
D.催化电极为负极,电极反应式为,导线中流过2mole-,催化电极上有3molI-参与转化,故D不符合题意;
故答案为:C。
【分析】A.太阳能和化学能转化为电能;
B.依据电池总反应;
C.利用得失电子守恒;
D.利用电极反应式分析。
13.【答案】D
【解析】【解答】A. 氧气在b极发生还原反应,则b极为正极,电流由正极流向负极,则电流由b极流向a极,A不符合题意;
B. 溶液中的阴离子会移向负极,故OH﹣向a极移动,B不符合题意;
C. a极通入氨气生成氮气,电解质环境是碱性,则a极的电极反应式为:2NH3+6OH﹣﹣6e﹣═N2+6H2O,C不符合题意;
D. b极氧气得电子被还原,电极反应式为:O2+4e﹣+2H2O═4OH﹣,D符合题意;
故答案为:D
【分析】在该原电池装置中,a电极为负极,NH3发生失电子的氧化反应,生成N2,其电极反应式为:2NH3-6e-+6OH-=N2+6H2O;b电极为正极,O2发生得电子的还原反应,生成OH-,其电极反应式为:O2+4e-+2H2O=4OH-;据此结合选项分析。
14.【答案】A
【解析】【解答】A.由以上分析知,M电极为负极,反应式为:HCOO-+2OH--2e-=HCO +H2O,故A符合题意;
B.负极反应式为HCOO-+2OH--2e-=HCO +H2O,根据溶液呈电中性知,在电池工作时,每生成1molHCO ,将会有2molK+通过半透膜移向右侧,故B不符合题意;
C.由以上分析知,图中所示需要补充的A物质为H2SO4,故C不符合题意;
D.原电池中电子从负极经导线流向正极,故电子的流动方向为:M→用电器→N,故D不符合题意;
故答案为:A。
【分析】HCOOH燃料电池是原电池装置,原电池工作时,负极发生失电子的氧化反应,根据图示中各电极上物质的变化,负极上HCOO-被氧化为HCO ,电极反应式为HCOO-+2OH--2e-=HCO +H2O。根据图示,加入 A发生的离子反应为4Fe2+ +4H+ +O2=Fe3+ + 2H2O,消耗H+,K2SO4从装置中流出,故放电过程中加入的物质A为H2SO4。该燃料电池的正极Fe2+和Fe3+存在着循环,正极上本质是O2得到电子,故燃料电池的总反应本质是HCOOH和 O2反应生成HCO ,结合原子守恒和电荷守恒,配平离子方程式为2HCOOH +2OH- +O2 = 2 HCO + 2H2O。
15.【答案】A
【解析】【解答】A.糖生物电池中的催化剂为生物酶,高温条件下生物酶死亡,催化活性减弱,糖电池工作效率降低或不工作,所以糖电池不宜在高温下工作,故A符合题意;
B.原电池放电时,内电路中阳离子移向正极、阴离子移向负极,故B不符合题意;
C.该电池中糖类所在电极为负极,通入氧气的电极为正极,酸性介质中氧气得电子生成水,电极反应式为O2+4e-+4H+=2H2O,故C不符合题意;
D.葡萄糖碱性原电池的总反应为C6H12O6+6O2+12OH-=6CO32﹣+12H2O,故D不符合题意;
故答案为:A。
【分析】A.生物酶适宜的环境是常温,高温条件下生物霉死亡;
B.原电池放电时,内电路中阳离子移向正极,阴离子移向负极;
C.该电池中,空气氧化糖类产生电流,则糖类所在电极为负极,通入氧气的电极为正极;
D.碱性介质中葡萄糖氧化生成CO32﹣。
16.【答案】(1)<;由于该反应是可逆反应,反应物无法全部转化为生成物;不变;391
(2)2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol;甲;CO(NH2)2+H2O﹣6e﹣= CO2↑+N2↑+6H+;33.6
【解析】【解答】(1)①N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,
故答案为:<;由于该反应是可逆反应,反应物无法全部转化为生成物;②催化剂改变反应速率不改变化学平衡,反应热不变,
故答案为:不变;③已知:分别破坏1 mol N≡N键、1 mol H H键需要吸收的能量为:946 kJ、436 kJ,设破坏1 mol N H键需要吸收的能量为x,根据N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,焓变=反应物总键能 生成物的总键能,即946 kJ/mol+3×436 kJ/mol 6x = -92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol N H键需要吸收的能量为:391 kJ;
故答案为:391;(2)①由Ⅰ. 2NH3(g)+CO2(g)= NH2CO2NH4(s) H = -159.5kJ mol-1
Ⅱ.NH2CO2NH4(s)= CO(NH2)2(s)+H2O(g) △H = +116.5kJ mol-1
Ⅲ. H2O(l)=H2O(g) △H=+44.0kJ mol-1
结合盖斯定律可知,①+②-③得到2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l),其△H = 159.5 kJ mol 1+(+116.5kJ mol 1) (+44.0kJ mol 1)= 87.0kJ mol 1,则CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol,
故答案为:2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol;
②根据图示可知,甲电极上CO(NH2)2反应生成二氧化碳和氮气,N元素化合价升高,失电子,为电源的负极,电解质溶液为酸性,则其电极反应式为:CO(NH2)2+H2O﹣6e﹣= CO2↑+N2↑+6H+,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,根据关系式2 CO(NH2)2 3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol 22.4 L/mol = 33.6 L,
故答案为:甲;CO(NH2)2+H2O﹣6e﹣= CO2↑+N2↑+6H+;33.6。
【分析】(1)①合成氨反应为可逆反应,不可能进行到底,故在实际生产中1 mol N2和3 mol H2不可能生成2 mol NH3,放出的热量也必定小于92 kJ;②催化剂改变反应速率不改变化学平衡及△H;③ΔH=反应物的键能之和—生成物的键能之和,据此分析作答;(2)①根据盖斯定律计算;②该电池CO(NH2)2在负极失电子生成二氧化碳和氮气,氧气在正极反应生成水,电解质溶液中含氢离子,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,据此分析作答;
17.【答案】(1)
(2)或
(3)<;[1mol,6mol];<
(4)
(5)升高温度,反应B(副反应)的速率增加得比反应(A)快
【解析】【解答】(1)平衡常数表达式是平衡时生成物浓度幂之积除以反应物浓度幂之积,反应A的平衡常数表达式为:K= 。
(2)为了通过ΔH2和ΔH3计算ΔH1,需要有氢气参加反应,同时要删掉氧气,所以需要测定反应2H2(g)+O2(g)=2H2O(g)或H2O(l)的反应热,然后利用盖斯定律就可以求出ΔH1。
(3)①从曲线可知,温度升高,二氧化碳的平衡转化率降低,说明该反应的正反应是放热反应,所以 ΔH1<0。
②当二氧化碳的物质的量一定,增加氢气的物质的量,可以增大二氧化碳的平衡转化率,曲线c对应的二氧化碳的平衡转化率最大,所以曲线c对应的投料是[1mol,6mol]。
③曲线c的投料是1molCO2,6molH2。T1℃时,达到平衡时二氧化碳的转化率为65%,即二氧化碳转化了0.65mol,根据反应方程式,转化的氢气的物质的量为1.95mol,生成的甲醇和水蒸气的物质的量都是0.65mol,平衡时二氧化碳的物质的量为0.35mol,氢气的物质的量为6mol-1.95mol=4.05mol,容器体积为1L,物质的量和浓度相等,所以化学平衡常数K=
。
(4)甲醇燃料电池(NaOH作电解质溶液)负极是甲醇失去电子生成
,电极方程式为:CH3OH-6e-+8OH-=
+6H2O 。
(5)升高温度,反应速率加快,二氧化碳实际转化率提高;温度升高,CO的产率升高,说明副反应是吸热反应,反应A 是放热反应,升高温度,副反应速率比A更快,则生成了更多的CO,导致甲醇的产率降低。
【分析】(1)平衡常数表达式是平衡时生成物浓度幂之积除以反应物浓度幂之积;
(2)依据盖斯定律分析解答;
(3)①从曲线可知,温度升高,二氧化碳的平衡转化率降低;
②当二氧化碳的物质的量一定, 增加氢气的物质的量,可以增大二氧化碳的平衡转化率,曲线c对应的二氧化碳的平衡转化率最大;
③曲线c的投料是1molCO2,6molH2。T1℃时,达到平衡时二氧化碳的转化率为65%,即二氧化碳转化了0.65mol,根据反应方程式,求出平衡时CO2,H2、CH3OH、H2O的物质的量,容器体积为1L,物质的量和浓度相等,带入化学平衡常数K的公式即可求出K表达式即可求出K,与1进行比较;
(4)甲醇燃料电池(NaOH作电解质溶液)负极是甲醇失去电子生成CO32- ;
(5)温度升高,CO的产率升高,说明副反应是吸热反应,反应A是放热反应,升高温度,副反应速率比A更快。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
