人教版 高化 选择性必修1 2.1 化学反应速率 第2课时 同步练习(含解析)
文档属性
| 名称 | 人教版 高化 选择性必修1 2.1 化学反应速率 第2课时 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 592.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-14 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2.1 化学反应速率 第2课时 同步练习(含解析)
一、单选题
1.将一片在空气中久置的铝片投入足量的0.5mol·L-1的硫酸中,产生氢气的速率v(H2)与反应时间t的关系如图所示。下列说法错误的是( )
A.为增大v(H2),可投入一片铜片,并与铝片接触
B.ab段v(H2)增大的原因是该反应放热,使反应体系的温度升高
C.t=b时,反应处于平衡状态
D.oa段反应的离子方程式为:Al2O3+6H+=2Al3++3H2O
2.下列有关化学反应速率的说法正确的是( )
A.在金属钠与足量水反应中,增加水的量能加快反应速率
B.的催化氧化是一个放热反应,所以降低温度,反应速率加快
C.用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率
D.实验室用碳酸钙和盐酸反应制取,用碳酸钙粉末比块状反应要快
3.在一定温度下,向2L密闭容器中加入2molHI(g),发生反应2HI(g) H2(g)+I2(g),4s时生成0.2molH2,则以HI表示该时段的化学反应速率是( )
A.0.05mol·L-1·s-1 B.0.1mol·L-1·s-1
C.0.2mol·L-1·s-1 D.0.8mol·L-1·s-1
4.在A(g)+2B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.3mol/(L·s) B.v(B)=0.5mol/(L·s)
C.v(C)=0.8mol/(L·s) D.v(D)=1.0mol/(L·s)
5.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A) =0.6mol·L-1·s-1 B.v(B) =0.4mol·L-1·s-1
C.v(C) =0.9mol·L-1·s-1 D.v(D) =1.0mol·L-1·s-1
6.化学与生活息息相关,下列说法错误的是( )
A.冰淇淋的运输常用干冰来保冷是利用干冰升华发生吸热反应
B.食品中添加抗氧化剂可减缓食品变质速率
C.“刀耕火种”的原理是以灰肥田,降低土壤酸度
D.打开啤酒瓶盖子会有气泡逸出与平衡的移动有关
7.化学反应速率在工农业生产和日常生活中有重要作用,下列说法正确的是( )
A.在化学工业中,使用催化剂一定能提产率
B.将肉类等食品进行低温冷藏,能使其永远不会腐败变质
C.茶叶等包装中加入的还原性铁粉,能显著延长茶叶的储存时间
D.在室外,夏天面粉发酵速度与冬天面粉发酵速度相差不大
8.下列关于化学反应速率的说法不正确的是( )
A.化学反应速率是衡量化学反应进行快慢的物理量
B.化学反应速率的常用单位是mol·L-1·s-1和mol·L-1·min-1
C.对任何化学反应而言,化学反应速率越快,反应现象就越明显
D.可以用单位时间内反应物或生成物的物质的量浓度的变化来表示
9.有研究认为,强碱性溶液中反应分三步进行,其中两步如下:
第一步
第三步
下列说法正确的是( )
A.是该化学反应的催化剂
B.反应的第二步为
C.由K可判断反应第三步比第一步快
D.第一、三步反应中,只有第三步为氧化还原反应
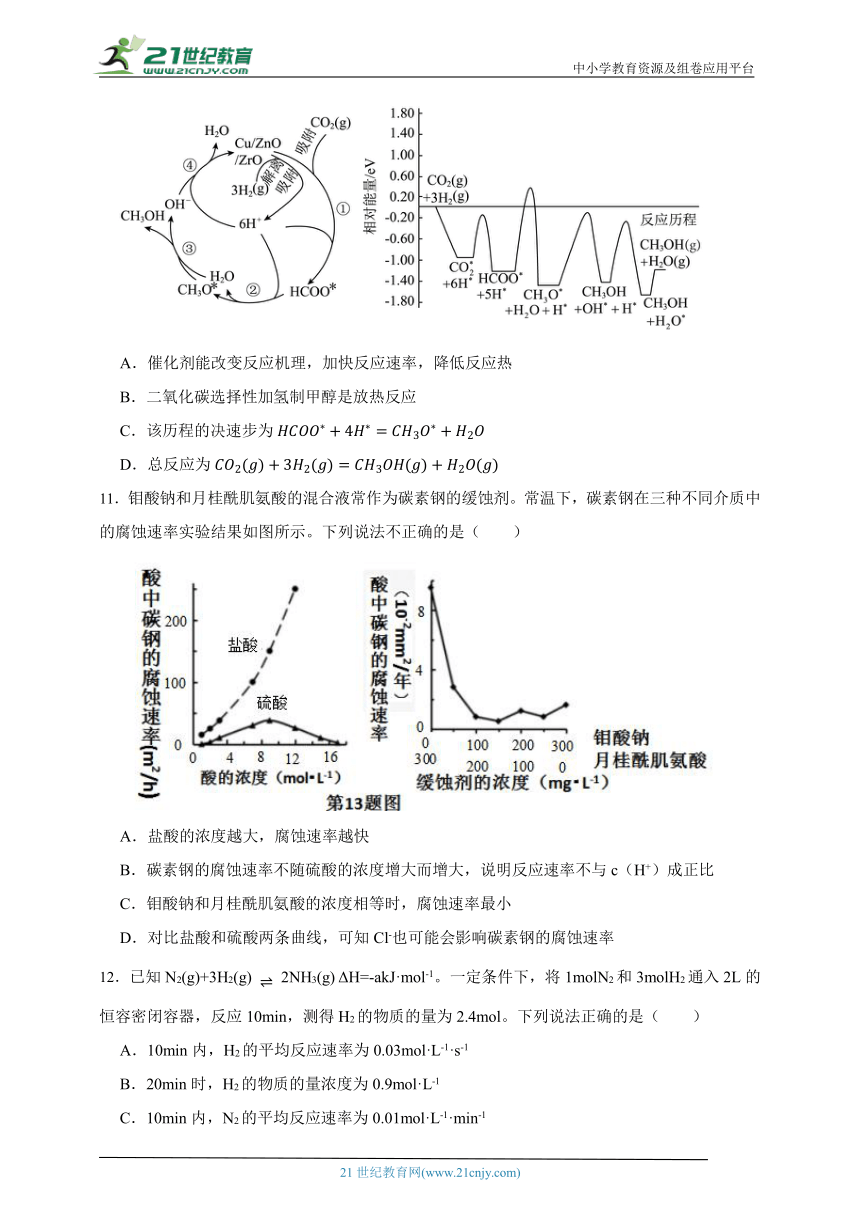
10.二氧化碳选择性加氢制甲醇是解决温室效应、发展绿色能源和实现经济可持续发展的重要途径之一。常温常压下利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注),下列说法错误的是
A.催化剂能改变反应机理,加快反应速率,降低反应热
B.二氧化碳选择性加氢制甲醇是放热反应
C.该历程的决速步为
D.总反应为
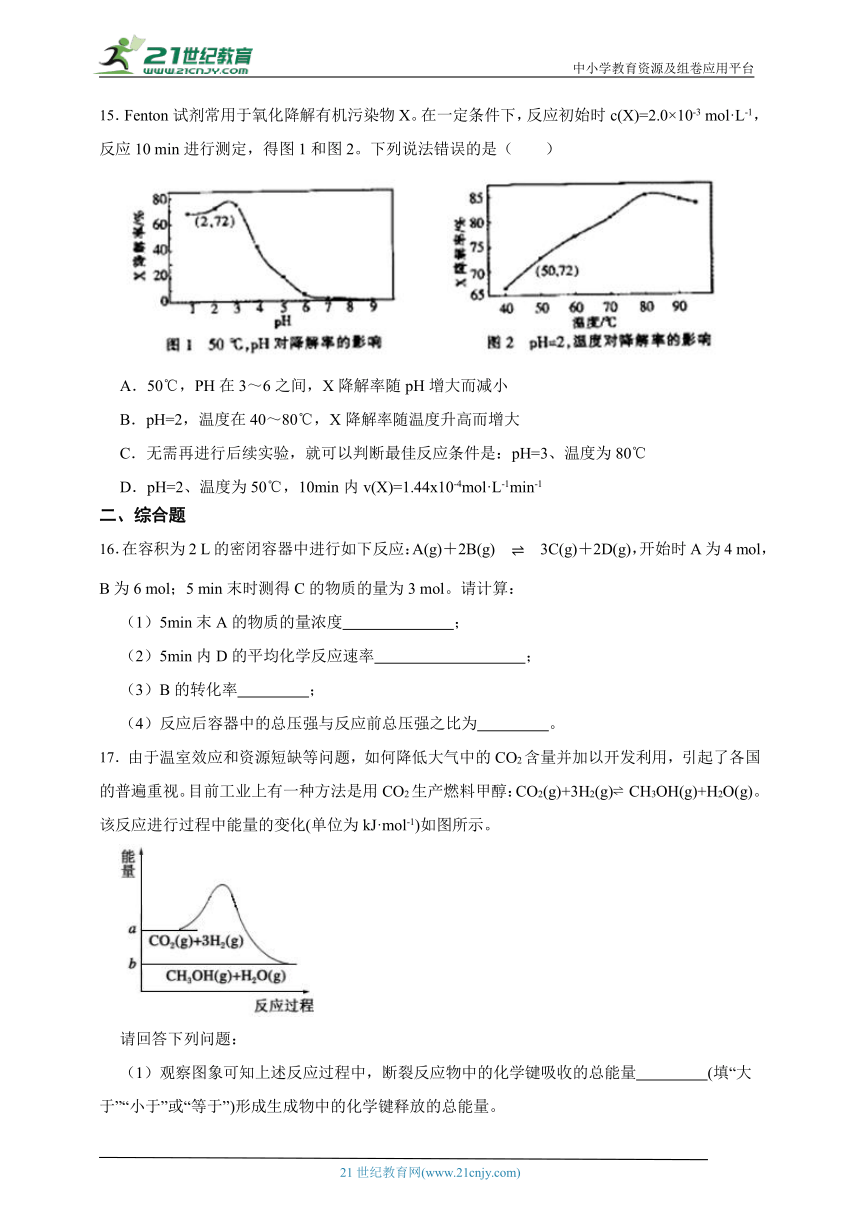
11.钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )
A.盐酸的浓度越大,腐蚀速率越快
B.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
C.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
12.已知N2(g)+3H2(g) 2NH3(g) ΔH=-akJ·mol-1。一定条件下,将1molN2和3molH2通入2L的恒容密闭容器,反应10min,测得H2的物质的量为2.4mol。下列说法正确的是( )
A.10min内,H2的平均反应速率为0.03mol·L-1·s-1
B.20min时,H2的物质的量浓度为0.9mol·L-1
C.10min内,N2的平均反应速率为0.01mol·L-1·min-1
D.达平衡时,N2和H2反应放出的热量为akJ
13.如图是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图(Ea表示活化能),下列说法错误的是( )
A.增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小
B.第一步反应的速率小于第二步反应
C.总反应为放热反应
D.升高温度,Ea1、Ea2均增大,反应速率加快
14.已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是( )
A.反应速率:v正(b点)<v正(d点)
B.前10min内用v(N2O4)表示的平均反应速率为0.04mol/(L·min)
C.25min时,导致平衡移动的原因是升高温度
D.a和c点:Qc(浓度熵)<K(平衡常数)
15.Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法错误的是( )
A.50℃,PH在3~6之间,X降解率随pH增大而减小
B.pH=2,温度在40~80℃,X降解率随温度升高而增大
C.无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃
D.pH=2、温度为50℃,10min内v(X)=1.44x10-4mol·L-1min-1
二、综合题
16.在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
(1)5min末A的物质的量浓度 ;
(2)5min内D的平均化学反应速率 ;
(3)B的转化率 ;
(4)反应后容器中的总压强与反应前总压强之比为 。
17.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
请回答下列问题:
(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量 (填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式: 。甲醇分子中的化学键类型是 (填“离子键“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是 ,发生的是 (填"氧化"或"还原")反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施: ;
18.据统计,约有90%以上的工业过程中需要使用催化剂,因此,对催化剂的研究已成为重要课题。
(1)I.结合实验与计算机模拟结果,研究了N2与H2在固体催化剂表面合成NH3的反应历程。图示为反应历程中的势能面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。
氨气的脱附是 (填“吸热”或“放热”)过程,合成氨的热化学方程式为 。
(2)当使用铁催化剂时,合成氨的速率方程式为w = k1 p(N2) -k2 ,其中w为反应的瞬时总速率,等于正反应速率和逆反应速率之差,k1、k2是正、逆反应速率常数,则合成氨反应N2+3H2 2NH3的平衡常数Kp= (用k1、k2表示)。
(3)在使用同一催化剂时,将2.0molN2和6.0molH2 通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化,曲线B表示T1时n(NH3)的变化,T2时反应到a点恰好达到平衡。
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正) v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2,试说明理由 。
(4)Ⅱ.用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的过程中,还会生成CH4、C3H6、C4H8等副产物,若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性(选择性指的是转化的CO2中生成C2H4的百分比)。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:
助剂 CO2转化率(%) 各产物在所有产物中的占比(%)
C2H4 C3H6 其他
Na 42.5 35.9 39.6 24.5
K 27.2 75.6 22.8 1.6
Cu 9.8 80.7 12.5 6.8
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是 。
答案解析部分
1.【答案】C
【解析】【解答】A.投入一片铜片,并与铝片接触,与稀硫酸形成原电池,可以加快化学反应速率,A不符合题意;
B.在反应过程中浓度减小,反应速率减小,但是铝片与稀硫酸反应生成氢气是放热反应,温度升高加快化学反应速率,B不符合题意;
C.t=b时,v(H2)达到最大值,正反应速率不等于逆反应速率,反应没有达到平衡状态,C符合题意;
D.空气中久置的铝片表面生成三氧化二铝,oa段为三氧化铝和稀硫酸反应生成硫酸铝和水,离子方程式为:Al2O3+6H+=2Al3++3H2O,D不符合题意;
故答案为:C。
【分析】该反应化学反应速率先增大后减小,该反应放热,温度升高,化学反应速率加快,随后浓度减小起到主导作用,化学反应速率减慢
2.【答案】D
【解析】【解答】A.增加水的量,水为纯液体,不影响反应速率,反应速率不变,故A不符合题意;
B.降低温度,反应速率减小,故B不符合题意;
C.浓硫酸和锌反应生成二氧化硫,不生成氢气,故C不符合题意;
D.相同质量的粉末状碳酸钙比块状碳酸钙表面积大,反应物接触面积越大,化学反应速率越大,则实验室用碳酸钙和盐酸反应制取,用碳酸钙粉末比块状反应要快,故D符合题意;
故答案为:D。
【分析】A.固体和纯液体浓度是个定值,增加其量不改变化学反应速率
B.任何反应,降低温度,化学反应速率都降低
C.浓硫酸与稀硫酸反应原理发生改变
D.增大固体表面积,化学反应速率加快
3.【答案】A
【解析】【解答】4s时生成0.2molH2,结合方程式可知消耗的HI的物质的量为0.4mol,容器体积为2L,则 ,
故答案为:A。
【分析】根据速率的计算公式,速率等于浓度变化量除以时间,再根据化学计量系数之比等于反应速率之比,来计算出碘化氢的速率。
4.【答案】A
【解析】【解答】A. v(A)=0.3mol/(L·s)
B. v(A)=v(B)=0.5mol/(L·s)= 0.25mol/(L·s);
C. v(A)=v(C)=0.8mol/(L·s)=0.267 mol/(L·s);
D. v(A)=v(D)=1.0mol/(L·s)=0.25 mol/(L·s);
所以反应最快的是v(A)=0.3mol/(L·s),选A。
【分析】比较反应速率大小时应统一单位,根据化学反应速率之比等于化学计量数之比换算成同一物质表示的反应速率,再进行比较。
5.【答案】B
【解析】【解答】A.都用B来表示,为 0.3mol·L-1·s-1
B. 0.4mol·L-1·s-1
C. 0.3mol·L-1·s-1
D. 0.25mol·L-1·s-1
故答案为:B
【分析】比较速率要换成同种物质
6.【答案】A
【解析】【解答】A.干冰升华是物理变化,是吸热过程不是吸热反应,A符合题意;
B.食品中添加抗氧化剂可减缓食品变质速率,B不符合题意;
C.“刀耕火种”的原理是以灰肥田,草木灰的主要成分是碳酸钾,碳酸根水解使溶液呈碱性,降低土壤酸度,C不符合题意;
D.打开啤酒瓶盖子会使压强减小,有气泡逸出与平衡的移动有关,D不符合题意;
故答案为:A。
【分析】A.没有新物质生成的变化属于物理变化;
B.在食品中添加抗氧化剂,减少氧气的含量,可减缓食品变质速率;
C.草木灰的成分为碳酸钾,水解显碱性;
D.啤酒瓶中存在二氧化碳的溶解平衡,打开瓶盖子后,内部压强减小,二氧化碳逸出。
7.【答案】C
【解析】【解答】A.在化学工业中,使用催化剂能提高反应速率,但不影响化学平衡的移动,则不能提高产率,A项不符合题意;
B.将肉类等食品进行低温冷藏,能抑制细菌的生长和繁殖,但不能杀死细菌,则不能使其永远不腐败变质,B项不符合题意;
C.茶叶等包装中加入的还原性铁粉能消耗氧气,所以能显著延长茶叶的储存时间,C项符合题意;
D.夏天室外的温度比冬天室外的温度高,温度越高反应速率越快,则夏天面粉发酵速度比冬天面粉发酵速度快,D项不符合题意;
故答案为:C。
【分析】依据影响反应速率的因素分析。
8.【答案】C
【解析】【解答】A.化学反应速率是衡量化学反应进行快慢的物理量,选项正确,A不符合题意;
B.化学反应速率常用的单位有mol·L-1·s-1或mol·L-1·min-1,选项正确,B不符合题意;
C.某些化学反应过程中,无明显现象产生,因此反应速率越快,现象不一定越明显,选项错误,C符合题意;
D.反应速率通常用单位时间内反应物物质的量浓度的减小,或生成物物质的量浓度的减小来表示,选项正确,D不符合题意;
故答案为:C
【分析】此题是对反应速率定义的考查,结合反应速率的定义进行分析即可。
9.【答案】B
【解析】【解答】A.第一步水解产生了OH-,第三步又消耗了OH-,所以OH-是整个反应的中间产物,不是催化剂,故A不符合题意;
B. 总反应-第一步反应-第三步反应可得第二步为HOCl+I-→HOI + Cl-,故B符合题意;
C.平衡常数的数值大小可以判断反应进行的程度,不能判断反应速率大小,故C不符合题意;
D.第一步反应是水解反应,不是氧化还原反应,第三步是酸碱中和反应,也不是氧化还原反应,故D不符合题意;
故答案为:B。
【分析】A.根据中间体反应前和反应后均没有,只在过程中出现;催化剂是在前边的化学反应中是反应物,在后边的反应中又是生成物;
B. 依据总反应-第一步反应-第三步反应;
C.平衡常数的数值大小可以判断反应进行的程度,不能判断反应速率大小;
D.第一步反应是水解反应,第三步是酸碱中和反应。
10.【答案】A
【解析】【解答】A.催化剂能改变反应机理,加快反应速率,不能改变反应热,选项A符合题意;
B.由反应历程图可知反应物的总能量大于生成物的总能量,该反应为放热反应,选项B不符合题意;
C.的活化能最大,是该历程的决速步,选项C不符合题意;
D.该反应的反应物是和,生成物是和,则总反应为,选项D不符合题意;
故答案为:A。
【分析】A.催化剂不影响反应热;
B.反应物的总能量大于生成物的总能量的反应为放热反应;
C.活化能越大反应速率越慢,慢反应是整个反应的决速步骤;
D.该反应是和反应生成和。
11.【答案】B
【解析】【解答】A.由图可知,盐酸的浓度越大,腐蚀速率越快,选项正确,A不符合题意;
B.碳素钢的腐蚀速率不随硫酸浓度增大而增大,是由于SO42-浓度引起的,选项错误,B符合题意;
C.由图可知,当钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小,选项正确,C不符合题意;
D.由于腐蚀速率随盐酸浓度的增大而增大,随硫酸浓度的增大,出现先增大后减小的现象,因此可说明Cl-、SO42-都会影响碳素钢的腐蚀速率,选项正确,D不符合题意;
故答案为:B
【分析】此题是对反应速率影响因素的考查,结合图像中曲线的变化趋势进行分析即可。
12.【答案】C
【解析】【解答】A.由题干数据10min内知 (H2)= =0.03mol·L-1·min-1,A不符合题意;
B.该反应随着浓度下降反应速率会变慢,故20min时,H2的物质的量浓度大于0.9mol·L-1,B不符合题意。
C.由A项分析结合反应速率之比等于化学计量系数比可知, (N2)=0.01mol·L-1·min-1, C符合题意;
D.该反应为可逆反应,转化率不会达到100%,D不符合题意;
故答案为:C。
【分析】A.根据v=计算;
B.浓度减小,反应速率减慢;
C.根据反应速率之比等于化学计量系数比计算;
D.可逆反应不能完全进行。
13.【答案】D
【解析】【解答】A.Cl2是该反应的反应物,增大反应物的浓度,反应速率增大,但增大氯气的浓度不影响ΔH的大小,故A不符合题意;
B.第一步反应所需活化能Ea1大于第二步反应所需活化能Ea2,第一步反应单位体积内活化分子百分数低于第二步反应,故第二步反应速率更大,故B不符合题意;
C.反应物总能量大于生成物总能量,为放热反应,故C不符合题意;
D.Ea1、Ea2分别为第一步反应、第二步反应所需活化能,升高温度,反应所需活化能不变,即Ea1、Ea2不变,故D符合题意;
故答案为:D。
【分析】A.增大反应物的浓度可以增大反应速率,焓变与起始和最终的物质有关系
B.活化能越大,速率越慢
C.根据能量图即可判断
D.温度升高,活化能不变,速率加快
14.【答案】A
【解析】【解答】A. 经分析,X为NO2,Y为N2O4,c(NO2)b<c(NO2)d,则v正(b点)<v正(d点),A符合题意;
B. 0-10min内,v(N2O4)= =0.02 mol/(L·min),B不符合题意;
C. 25min时,c(NO2)突然增大,再慢慢减小,而c(N2O4)则慢慢增大,说明此时平衡的移动是由增加NO2的浓度引起的,C不符合题意;
D. a点,c(NO2)在增大,c(N2O4)在减小,说明平衡向逆反应方向移动,则a点Qc>K;c点,c(NO2)在减小,c(N2O4)在增大,说明平衡向正反应方向移动,则c点Qc<K;D不符合题意;
故答案为:A。
【分析】0-10min内,Δc(X)=0.4mol/L,Δc(Y)=0.2mol/L ,则可以推出X为NO2,Y为N2O4;25min时,NO2的浓度突然增大,然后再减小,而N2O4的浓度是逐渐增大,由此可以推出此时是增加了NO2的浓度引起的平衡的移动。
15.【答案】C
【解析】【解答】A.由图1可知,50℃时,PH在3~6之间,X降解率随PH增大而减小,故A不符合题意;
B.由图2可知,pH=2时,温度在40~80℃,X降解率温度升高而增大,故B不符合题意;
C.溶液pH值、温度会影响X的降解率,需要进行pH=3、温度对X降解率影响实验或温度为80℃、pH对X降解率影响实验才能确定最佳pH值、温度,故C符合题意;
D.由图2可知,pH=2,50℃时到达平衡时X的转化率为72%,X的浓度变化量=2.0×10-3mol L-1×72%=1.44×10-3mol L-1,故v(X)= =1.44×10-4mol L-1min-1,故D不符合题意;
故答案为:C。
【分析】A.结合图示即可看出pH对降解率的影响
B.结合图示,即可看出温度和降解率的关秀
C.考查的是最佳条件的判断,还需要做多次实验进行判定
D.根据数据利用公式即可计算出速率的大小
16.【答案】(1)1.5 mol/L
(2)0.2mol/(L min)
(3)33.33%
(4)6:5
【解析】【解答】(1)
A(g)+ 2B(g) 3C(g)+ 2D(g)
起始(mol) 4 6 0 0
转化(mol) 1 2 3 2
5min末(mol) 3 4 3 2
C(A)=3mol/2L=1.5mol/L
(2)v(D)=(2mol/2L)/5min=0.2mol/(L min)
(3)B的转化率=2mol/6mol×100%=33.3%;
(4)气体压强之比等于气体物质的量之比,反应后容器中的总压强与反应前总压强之比=(3+4+3+2):(4+6)=12:10=6:5。
【分析】根据5min后的数据,结合三行式计算出平衡时各物质的物质的量,根据速率公式计算出速率,根据转化率公式计算转化率,根据压强与物质的量成正比计算出压强之比
17.【答案】(1)小于
(2);共价键
(3)甲醇;氧化
(4)升高温度、使用合适的催化剂、增大压强、增大反应物的浓度等
【解析】【解答】(1)从图象分析,反应物能量高于生成物,反应放热,说明反应物键能和小于生成物,故答案为:小于;(2)C原子形成四个共价键,H只形成1个化学键,O形成2个化学键,结合乙醇的结构可知甲醇的结构式为: ;两非金属元素的原子间形成的是共价键,(3)负极是电子流出的极,甲醇在负极失电子发生氧化反应,故答案为:甲醇;氧化;(4)欲使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)速率加快,可以升高温度、使用合适的催化剂、增大压强、增大反应物的浓度等;
【分析】根据图像的高低可以判断能量大小关系,可以判断出反应类型。(3)燃料电池属于原电池,负极根据化合价升高来判断产物,利用实质是氧化还原反应进行判断。
18.【答案】(1)吸热;N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
(2)
(3)>;不能,因为温度不同,催化剂的活性不同,对反应速率造成的影响不同
(4)K;助剂K降低了生成乙烯的反应所需要的活化能,加快乙烯生成速率而对其他副反应的速率几乎无影响
【解析】【解答】I(1) NH3 →NH3的过程为脱附,由图知,氨气脱附后能量升高,则氨气的脱附过程是吸热过程,由能量图可知,氮气和氢气被破坏生成1molN和3molH时吸收热量(21-17)kJ、1molN和3molH生成1mol NH3(g)时放热50kJ,则氮气和氢气生成1mol氨气需要放出46kJ的热量,可得合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。
(2) 当平衡时,合成氨的瞬时总速率w = k1 p(N2) -k2 =0,则 ,得合成氨反应N2+3H2 2NH3的平衡常数 。
(3) ①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时 ,平衡时气体总量为(1.0+3.0+2.0)mol=6.0mol,平衡时气体的压强是起始时的 ,合成氨的正反应是气体体积减小的反应,随着反应的进行,容器内压强降低,若某时刻,容器内气体的压强为起始时的80%,说明反应未平衡,反应正向进行,则 。
②虽然反应时使用同一催化剂,都是将2.0molN2和6.0molH2 通入体积为1L的密闭容器中,但分别在T1和T2温度下进行反应。不能根据图示信息判断温度的相对大小,因为温度不同,催化剂的活性不同,对反应速率造成的影响不同。
Ⅱ (4) 由表中数据可知,Na的其它副反应占比大,Cu的CO2转化率低,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K助剂效果最好,不仅能提高单位时间内乙烯产量,并且其他副反应占比少,故答案为:K;加入助剂能提高单位时间内乙烯产量的根本原因是:助剂K降低了生成乙烯的反应所需要的活化能,加快乙烯生成速率而对其他副反应的速率几乎无影响。
【分析】由图中信息判断氨气脱附后能量变化、从而判断脱附过程的热效应,由能量图计算出氮气和氢气生成1mol氨气的焓变、据此可得合成氨反应的热化学方程式; 当平衡时,合成氨的瞬时总速率w = k1 p(N2) -k2 =0,据此可计算出合成氨反应N2+3H2 2NH3的平衡常数。由已知条件、结合三段式计算,可知平衡时气体的压强是起始时的 ,而某时刻容器内气体的压强为起始时的80%,说明反应未平衡,并可结合合成氨反应特点判断正逆反应速率的相对大小。由表中数据即可判断哪种助剂效果最好,加入助剂能提高单位时间内乙烯产量的根本原因,从活化能的角度展开。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.1 化学反应速率 第2课时 同步练习(含解析)
一、单选题
1.将一片在空气中久置的铝片投入足量的0.5mol·L-1的硫酸中,产生氢气的速率v(H2)与反应时间t的关系如图所示。下列说法错误的是( )
A.为增大v(H2),可投入一片铜片,并与铝片接触
B.ab段v(H2)增大的原因是该反应放热,使反应体系的温度升高
C.t=b时,反应处于平衡状态
D.oa段反应的离子方程式为:Al2O3+6H+=2Al3++3H2O
2.下列有关化学反应速率的说法正确的是( )
A.在金属钠与足量水反应中,增加水的量能加快反应速率
B.的催化氧化是一个放热反应,所以降低温度,反应速率加快
C.用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率
D.实验室用碳酸钙和盐酸反应制取,用碳酸钙粉末比块状反应要快
3.在一定温度下,向2L密闭容器中加入2molHI(g),发生反应2HI(g) H2(g)+I2(g),4s时生成0.2molH2,则以HI表示该时段的化学反应速率是( )
A.0.05mol·L-1·s-1 B.0.1mol·L-1·s-1
C.0.2mol·L-1·s-1 D.0.8mol·L-1·s-1
4.在A(g)+2B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.3mol/(L·s) B.v(B)=0.5mol/(L·s)
C.v(C)=0.8mol/(L·s) D.v(D)=1.0mol/(L·s)
5.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A) =0.6mol·L-1·s-1 B.v(B) =0.4mol·L-1·s-1
C.v(C) =0.9mol·L-1·s-1 D.v(D) =1.0mol·L-1·s-1
6.化学与生活息息相关,下列说法错误的是( )
A.冰淇淋的运输常用干冰来保冷是利用干冰升华发生吸热反应
B.食品中添加抗氧化剂可减缓食品变质速率
C.“刀耕火种”的原理是以灰肥田,降低土壤酸度
D.打开啤酒瓶盖子会有气泡逸出与平衡的移动有关
7.化学反应速率在工农业生产和日常生活中有重要作用,下列说法正确的是( )
A.在化学工业中,使用催化剂一定能提产率
B.将肉类等食品进行低温冷藏,能使其永远不会腐败变质
C.茶叶等包装中加入的还原性铁粉,能显著延长茶叶的储存时间
D.在室外,夏天面粉发酵速度与冬天面粉发酵速度相差不大
8.下列关于化学反应速率的说法不正确的是( )
A.化学反应速率是衡量化学反应进行快慢的物理量
B.化学反应速率的常用单位是mol·L-1·s-1和mol·L-1·min-1
C.对任何化学反应而言,化学反应速率越快,反应现象就越明显
D.可以用单位时间内反应物或生成物的物质的量浓度的变化来表示
9.有研究认为,强碱性溶液中反应分三步进行,其中两步如下:
第一步
第三步
下列说法正确的是( )
A.是该化学反应的催化剂
B.反应的第二步为
C.由K可判断反应第三步比第一步快
D.第一、三步反应中,只有第三步为氧化还原反应
10.二氧化碳选择性加氢制甲醇是解决温室效应、发展绿色能源和实现经济可持续发展的重要途径之一。常温常压下利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注),下列说法错误的是
A.催化剂能改变反应机理,加快反应速率,降低反应热
B.二氧化碳选择性加氢制甲醇是放热反应
C.该历程的决速步为
D.总反应为
11.钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )
A.盐酸的浓度越大,腐蚀速率越快
B.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
C.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
12.已知N2(g)+3H2(g) 2NH3(g) ΔH=-akJ·mol-1。一定条件下,将1molN2和3molH2通入2L的恒容密闭容器,反应10min,测得H2的物质的量为2.4mol。下列说法正确的是( )
A.10min内,H2的平均反应速率为0.03mol·L-1·s-1
B.20min时,H2的物质的量浓度为0.9mol·L-1
C.10min内,N2的平均反应速率为0.01mol·L-1·min-1
D.达平衡时,N2和H2反应放出的热量为akJ
13.如图是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图(Ea表示活化能),下列说法错误的是( )
A.增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小
B.第一步反应的速率小于第二步反应
C.总反应为放热反应
D.升高温度,Ea1、Ea2均增大,反应速率加快
14.已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是( )
A.反应速率:v正(b点)<v正(d点)
B.前10min内用v(N2O4)表示的平均反应速率为0.04mol/(L·min)
C.25min时,导致平衡移动的原因是升高温度
D.a和c点:Qc(浓度熵)<K(平衡常数)
15.Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法错误的是( )
A.50℃,PH在3~6之间,X降解率随pH增大而减小
B.pH=2,温度在40~80℃,X降解率随温度升高而增大
C.无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃
D.pH=2、温度为50℃,10min内v(X)=1.44x10-4mol·L-1min-1
二、综合题
16.在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
(1)5min末A的物质的量浓度 ;
(2)5min内D的平均化学反应速率 ;
(3)B的转化率 ;
(4)反应后容器中的总压强与反应前总压强之比为 。
17.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
请回答下列问题:
(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量 (填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式: 。甲醇分子中的化学键类型是 (填“离子键“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是 ,发生的是 (填"氧化"或"还原")反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施: ;
18.据统计,约有90%以上的工业过程中需要使用催化剂,因此,对催化剂的研究已成为重要课题。
(1)I.结合实验与计算机模拟结果,研究了N2与H2在固体催化剂表面合成NH3的反应历程。图示为反应历程中的势能面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。
氨气的脱附是 (填“吸热”或“放热”)过程,合成氨的热化学方程式为 。
(2)当使用铁催化剂时,合成氨的速率方程式为w = k1 p(N2) -k2 ,其中w为反应的瞬时总速率,等于正反应速率和逆反应速率之差,k1、k2是正、逆反应速率常数,则合成氨反应N2+3H2 2NH3的平衡常数Kp= (用k1、k2表示)。
(3)在使用同一催化剂时,将2.0molN2和6.0molH2 通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化,曲线B表示T1时n(NH3)的变化,T2时反应到a点恰好达到平衡。
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正) v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2,试说明理由 。
(4)Ⅱ.用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的过程中,还会生成CH4、C3H6、C4H8等副产物,若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性(选择性指的是转化的CO2中生成C2H4的百分比)。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:
助剂 CO2转化率(%) 各产物在所有产物中的占比(%)
C2H4 C3H6 其他
Na 42.5 35.9 39.6 24.5
K 27.2 75.6 22.8 1.6
Cu 9.8 80.7 12.5 6.8
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是 。
答案解析部分
1.【答案】C
【解析】【解答】A.投入一片铜片,并与铝片接触,与稀硫酸形成原电池,可以加快化学反应速率,A不符合题意;
B.在反应过程中浓度减小,反应速率减小,但是铝片与稀硫酸反应生成氢气是放热反应,温度升高加快化学反应速率,B不符合题意;
C.t=b时,v(H2)达到最大值,正反应速率不等于逆反应速率,反应没有达到平衡状态,C符合题意;
D.空气中久置的铝片表面生成三氧化二铝,oa段为三氧化铝和稀硫酸反应生成硫酸铝和水,离子方程式为:Al2O3+6H+=2Al3++3H2O,D不符合题意;
故答案为:C。
【分析】该反应化学反应速率先增大后减小,该反应放热,温度升高,化学反应速率加快,随后浓度减小起到主导作用,化学反应速率减慢
2.【答案】D
【解析】【解答】A.增加水的量,水为纯液体,不影响反应速率,反应速率不变,故A不符合题意;
B.降低温度,反应速率减小,故B不符合题意;
C.浓硫酸和锌反应生成二氧化硫,不生成氢气,故C不符合题意;
D.相同质量的粉末状碳酸钙比块状碳酸钙表面积大,反应物接触面积越大,化学反应速率越大,则实验室用碳酸钙和盐酸反应制取,用碳酸钙粉末比块状反应要快,故D符合题意;
故答案为:D。
【分析】A.固体和纯液体浓度是个定值,增加其量不改变化学反应速率
B.任何反应,降低温度,化学反应速率都降低
C.浓硫酸与稀硫酸反应原理发生改变
D.增大固体表面积,化学反应速率加快
3.【答案】A
【解析】【解答】4s时生成0.2molH2,结合方程式可知消耗的HI的物质的量为0.4mol,容器体积为2L,则 ,
故答案为:A。
【分析】根据速率的计算公式,速率等于浓度变化量除以时间,再根据化学计量系数之比等于反应速率之比,来计算出碘化氢的速率。
4.【答案】A
【解析】【解答】A. v(A)=0.3mol/(L·s)
B. v(A)=v(B)=0.5mol/(L·s)= 0.25mol/(L·s);
C. v(A)=v(C)=0.8mol/(L·s)=0.267 mol/(L·s);
D. v(A)=v(D)=1.0mol/(L·s)=0.25 mol/(L·s);
所以反应最快的是v(A)=0.3mol/(L·s),选A。
【分析】比较反应速率大小时应统一单位,根据化学反应速率之比等于化学计量数之比换算成同一物质表示的反应速率,再进行比较。
5.【答案】B
【解析】【解答】A.都用B来表示,为 0.3mol·L-1·s-1
B. 0.4mol·L-1·s-1
C. 0.3mol·L-1·s-1
D. 0.25mol·L-1·s-1
故答案为:B
【分析】比较速率要换成同种物质
6.【答案】A
【解析】【解答】A.干冰升华是物理变化,是吸热过程不是吸热反应,A符合题意;
B.食品中添加抗氧化剂可减缓食品变质速率,B不符合题意;
C.“刀耕火种”的原理是以灰肥田,草木灰的主要成分是碳酸钾,碳酸根水解使溶液呈碱性,降低土壤酸度,C不符合题意;
D.打开啤酒瓶盖子会使压强减小,有气泡逸出与平衡的移动有关,D不符合题意;
故答案为:A。
【分析】A.没有新物质生成的变化属于物理变化;
B.在食品中添加抗氧化剂,减少氧气的含量,可减缓食品变质速率;
C.草木灰的成分为碳酸钾,水解显碱性;
D.啤酒瓶中存在二氧化碳的溶解平衡,打开瓶盖子后,内部压强减小,二氧化碳逸出。
7.【答案】C
【解析】【解答】A.在化学工业中,使用催化剂能提高反应速率,但不影响化学平衡的移动,则不能提高产率,A项不符合题意;
B.将肉类等食品进行低温冷藏,能抑制细菌的生长和繁殖,但不能杀死细菌,则不能使其永远不腐败变质,B项不符合题意;
C.茶叶等包装中加入的还原性铁粉能消耗氧气,所以能显著延长茶叶的储存时间,C项符合题意;
D.夏天室外的温度比冬天室外的温度高,温度越高反应速率越快,则夏天面粉发酵速度比冬天面粉发酵速度快,D项不符合题意;
故答案为:C。
【分析】依据影响反应速率的因素分析。
8.【答案】C
【解析】【解答】A.化学反应速率是衡量化学反应进行快慢的物理量,选项正确,A不符合题意;
B.化学反应速率常用的单位有mol·L-1·s-1或mol·L-1·min-1,选项正确,B不符合题意;
C.某些化学反应过程中,无明显现象产生,因此反应速率越快,现象不一定越明显,选项错误,C符合题意;
D.反应速率通常用单位时间内反应物物质的量浓度的减小,或生成物物质的量浓度的减小来表示,选项正确,D不符合题意;
故答案为:C
【分析】此题是对反应速率定义的考查,结合反应速率的定义进行分析即可。
9.【答案】B
【解析】【解答】A.第一步水解产生了OH-,第三步又消耗了OH-,所以OH-是整个反应的中间产物,不是催化剂,故A不符合题意;
B. 总反应-第一步反应-第三步反应可得第二步为HOCl+I-→HOI + Cl-,故B符合题意;
C.平衡常数的数值大小可以判断反应进行的程度,不能判断反应速率大小,故C不符合题意;
D.第一步反应是水解反应,不是氧化还原反应,第三步是酸碱中和反应,也不是氧化还原反应,故D不符合题意;
故答案为:B。
【分析】A.根据中间体反应前和反应后均没有,只在过程中出现;催化剂是在前边的化学反应中是反应物,在后边的反应中又是生成物;
B. 依据总反应-第一步反应-第三步反应;
C.平衡常数的数值大小可以判断反应进行的程度,不能判断反应速率大小;
D.第一步反应是水解反应,第三步是酸碱中和反应。
10.【答案】A
【解析】【解答】A.催化剂能改变反应机理,加快反应速率,不能改变反应热,选项A符合题意;
B.由反应历程图可知反应物的总能量大于生成物的总能量,该反应为放热反应,选项B不符合题意;
C.的活化能最大,是该历程的决速步,选项C不符合题意;
D.该反应的反应物是和,生成物是和,则总反应为,选项D不符合题意;
故答案为:A。
【分析】A.催化剂不影响反应热;
B.反应物的总能量大于生成物的总能量的反应为放热反应;
C.活化能越大反应速率越慢,慢反应是整个反应的决速步骤;
D.该反应是和反应生成和。
11.【答案】B
【解析】【解答】A.由图可知,盐酸的浓度越大,腐蚀速率越快,选项正确,A不符合题意;
B.碳素钢的腐蚀速率不随硫酸浓度增大而增大,是由于SO42-浓度引起的,选项错误,B符合题意;
C.由图可知,当钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小,选项正确,C不符合题意;
D.由于腐蚀速率随盐酸浓度的增大而增大,随硫酸浓度的增大,出现先增大后减小的现象,因此可说明Cl-、SO42-都会影响碳素钢的腐蚀速率,选项正确,D不符合题意;
故答案为:B
【分析】此题是对反应速率影响因素的考查,结合图像中曲线的变化趋势进行分析即可。
12.【答案】C
【解析】【解答】A.由题干数据10min内知 (H2)= =0.03mol·L-1·min-1,A不符合题意;
B.该反应随着浓度下降反应速率会变慢,故20min时,H2的物质的量浓度大于0.9mol·L-1,B不符合题意。
C.由A项分析结合反应速率之比等于化学计量系数比可知, (N2)=0.01mol·L-1·min-1, C符合题意;
D.该反应为可逆反应,转化率不会达到100%,D不符合题意;
故答案为:C。
【分析】A.根据v=计算;
B.浓度减小,反应速率减慢;
C.根据反应速率之比等于化学计量系数比计算;
D.可逆反应不能完全进行。
13.【答案】D
【解析】【解答】A.Cl2是该反应的反应物,增大反应物的浓度,反应速率增大,但增大氯气的浓度不影响ΔH的大小,故A不符合题意;
B.第一步反应所需活化能Ea1大于第二步反应所需活化能Ea2,第一步反应单位体积内活化分子百分数低于第二步反应,故第二步反应速率更大,故B不符合题意;
C.反应物总能量大于生成物总能量,为放热反应,故C不符合题意;
D.Ea1、Ea2分别为第一步反应、第二步反应所需活化能,升高温度,反应所需活化能不变,即Ea1、Ea2不变,故D符合题意;
故答案为:D。
【分析】A.增大反应物的浓度可以增大反应速率,焓变与起始和最终的物质有关系
B.活化能越大,速率越慢
C.根据能量图即可判断
D.温度升高,活化能不变,速率加快
14.【答案】A
【解析】【解答】A. 经分析,X为NO2,Y为N2O4,c(NO2)b<c(NO2)d,则v正(b点)<v正(d点),A符合题意;
B. 0-10min内,v(N2O4)= =0.02 mol/(L·min),B不符合题意;
C. 25min时,c(NO2)突然增大,再慢慢减小,而c(N2O4)则慢慢增大,说明此时平衡的移动是由增加NO2的浓度引起的,C不符合题意;
D. a点,c(NO2)在增大,c(N2O4)在减小,说明平衡向逆反应方向移动,则a点Qc>K;c点,c(NO2)在减小,c(N2O4)在增大,说明平衡向正反应方向移动,则c点Qc<K;D不符合题意;
故答案为:A。
【分析】0-10min内,Δc(X)=0.4mol/L,Δc(Y)=0.2mol/L ,则可以推出X为NO2,Y为N2O4;25min时,NO2的浓度突然增大,然后再减小,而N2O4的浓度是逐渐增大,由此可以推出此时是增加了NO2的浓度引起的平衡的移动。
15.【答案】C
【解析】【解答】A.由图1可知,50℃时,PH在3~6之间,X降解率随PH增大而减小,故A不符合题意;
B.由图2可知,pH=2时,温度在40~80℃,X降解率温度升高而增大,故B不符合题意;
C.溶液pH值、温度会影响X的降解率,需要进行pH=3、温度对X降解率影响实验或温度为80℃、pH对X降解率影响实验才能确定最佳pH值、温度,故C符合题意;
D.由图2可知,pH=2,50℃时到达平衡时X的转化率为72%,X的浓度变化量=2.0×10-3mol L-1×72%=1.44×10-3mol L-1,故v(X)= =1.44×10-4mol L-1min-1,故D不符合题意;
故答案为:C。
【分析】A.结合图示即可看出pH对降解率的影响
B.结合图示,即可看出温度和降解率的关秀
C.考查的是最佳条件的判断,还需要做多次实验进行判定
D.根据数据利用公式即可计算出速率的大小
16.【答案】(1)1.5 mol/L
(2)0.2mol/(L min)
(3)33.33%
(4)6:5
【解析】【解答】(1)
A(g)+ 2B(g) 3C(g)+ 2D(g)
起始(mol) 4 6 0 0
转化(mol) 1 2 3 2
5min末(mol) 3 4 3 2
C(A)=3mol/2L=1.5mol/L
(2)v(D)=(2mol/2L)/5min=0.2mol/(L min)
(3)B的转化率=2mol/6mol×100%=33.3%;
(4)气体压强之比等于气体物质的量之比,反应后容器中的总压强与反应前总压强之比=(3+4+3+2):(4+6)=12:10=6:5。
【分析】根据5min后的数据,结合三行式计算出平衡时各物质的物质的量,根据速率公式计算出速率,根据转化率公式计算转化率,根据压强与物质的量成正比计算出压强之比
17.【答案】(1)小于
(2);共价键
(3)甲醇;氧化
(4)升高温度、使用合适的催化剂、增大压强、增大反应物的浓度等
【解析】【解答】(1)从图象分析,反应物能量高于生成物,反应放热,说明反应物键能和小于生成物,故答案为:小于;(2)C原子形成四个共价键,H只形成1个化学键,O形成2个化学键,结合乙醇的结构可知甲醇的结构式为: ;两非金属元素的原子间形成的是共价键,(3)负极是电子流出的极,甲醇在负极失电子发生氧化反应,故答案为:甲醇;氧化;(4)欲使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)速率加快,可以升高温度、使用合适的催化剂、增大压强、增大反应物的浓度等;
【分析】根据图像的高低可以判断能量大小关系,可以判断出反应类型。(3)燃料电池属于原电池,负极根据化合价升高来判断产物,利用实质是氧化还原反应进行判断。
18.【答案】(1)吸热;N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
(2)
(3)>;不能,因为温度不同,催化剂的活性不同,对反应速率造成的影响不同
(4)K;助剂K降低了生成乙烯的反应所需要的活化能,加快乙烯生成速率而对其他副反应的速率几乎无影响
【解析】【解答】I(1) NH3 →NH3的过程为脱附,由图知,氨气脱附后能量升高,则氨气的脱附过程是吸热过程,由能量图可知,氮气和氢气被破坏生成1molN和3molH时吸收热量(21-17)kJ、1molN和3molH生成1mol NH3(g)时放热50kJ,则氮气和氢气生成1mol氨气需要放出46kJ的热量,可得合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。
(2) 当平衡时,合成氨的瞬时总速率w = k1 p(N2) -k2 =0,则 ,得合成氨反应N2+3H2 2NH3的平衡常数 。
(3) ①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时 ,平衡时气体总量为(1.0+3.0+2.0)mol=6.0mol,平衡时气体的压强是起始时的 ,合成氨的正反应是气体体积减小的反应,随着反应的进行,容器内压强降低,若某时刻,容器内气体的压强为起始时的80%,说明反应未平衡,反应正向进行,则 。
②虽然反应时使用同一催化剂,都是将2.0molN2和6.0molH2 通入体积为1L的密闭容器中,但分别在T1和T2温度下进行反应。不能根据图示信息判断温度的相对大小,因为温度不同,催化剂的活性不同,对反应速率造成的影响不同。
Ⅱ (4) 由表中数据可知,Na的其它副反应占比大,Cu的CO2转化率低,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K助剂效果最好,不仅能提高单位时间内乙烯产量,并且其他副反应占比少,故答案为:K;加入助剂能提高单位时间内乙烯产量的根本原因是:助剂K降低了生成乙烯的反应所需要的活化能,加快乙烯生成速率而对其他副反应的速率几乎无影响。
【分析】由图中信息判断氨气脱附后能量变化、从而判断脱附过程的热效应,由能量图计算出氮气和氢气生成1mol氨气的焓变、据此可得合成氨反应的热化学方程式; 当平衡时,合成氨的瞬时总速率w = k1 p(N2) -k2 =0,据此可计算出合成氨反应N2+3H2 2NH3的平衡常数。由已知条件、结合三段式计算,可知平衡时气体的压强是起始时的 ,而某时刻容器内气体的压强为起始时的80%,说明反应未平衡,并可结合合成氨反应特点判断正逆反应速率的相对大小。由表中数据即可判断哪种助剂效果最好,加入助剂能提高单位时间内乙烯产量的根本原因,从活化能的角度展开。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
