人教版 高化 选择性必修1 3.2 水的电离和溶液的pH 第1课时 同步练习(含解析)
文档属性
| 名称 | 人教版 高化 选择性必修1 3.2 水的电离和溶液的pH 第1课时 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 511.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-14 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
3.2 水的电离和溶液的pH 第1课时 同步练习(含解析)
一、单选题
1.下列说法错误的是( )
A.常温下,纯水中的c(H+)=c(OH-)=1×10-7mol·L-1
B.向水中加入NaCl,H+与Cl-结合生成HCl,使水的电离平衡向正反应方向移动
C.向水中加入HCl或者NaOH,水的电离平衡都向逆反应方向移动
D.改变温度,Kw也会发生改变
2.已知室温时0.1mol/L某一元酸HA在水中有0.1%发生电离,叙述错误的是( )
A.该溶液的pH=4
B.升高温度,溶液的Kw增大
C.此酸的电离平衡常数约为1×10-7
D.该溶液里不存在HA分子
3.常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近( )
A.1:1 B.1:102 C.102:1 D.1:103
4.常温下0.1 mol/L的下列物质的水溶液,加热到80℃,溶液的pH几乎不变的是( )
A.氢氧化钠 B.硫酸铵 C.氯化钠 D.硫酸
5.下列说法正确的是
A.为确定某酸H2A是强酸还是弱酸,可通过在常温下测NaHA溶液的pH,若pH>7,则H2A一定是弱酸
B.用NaOH标准溶液滴定CH3COOH溶液至中性时,CH3COOH溶液恰好被中和
C.向冰醋酸中不断加水,溶液的pH不断增大
D.25℃和40℃时,0.1 mol·L-1的氨水的pH不相等,而25℃和40℃时,0.1 mol·L-1的氢氧化钠溶液的pH相等
6.用0.1000mol L-1HCl溶液滴定未知浓度的NaOH溶液。有关该实验说法中,错误的是( )
A.本实验可选用酚酞作指示剂
B.用酸式滴定管盛装0.1000mol L-1HCl溶液
C.用未知浓度的NaOH溶液润洗锥形瓶2~3次
D.滴定结束时俯视酸式滴定管读数,测量结果偏低
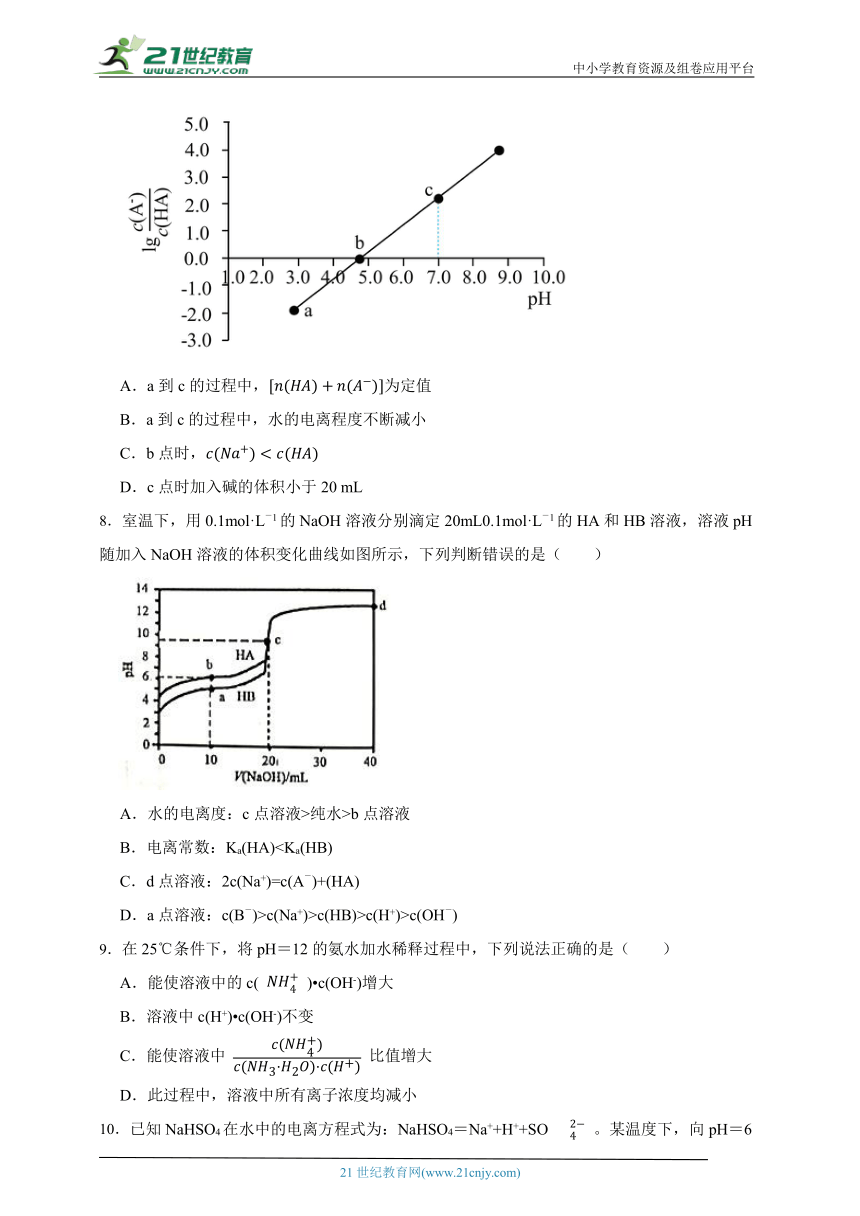
7.室温下,向20.0 mL 0.100 mol L 1的某弱酸HA的溶液中滴加同浓度的NaOH溶液,过程中随pH的变化关系如下图所示。下列说法错误的是
A.a到c的过程中,为定值
B.a到c的过程中,水的电离程度不断减小
C.b点时,
D.c点时加入碱的体积小于20 mL
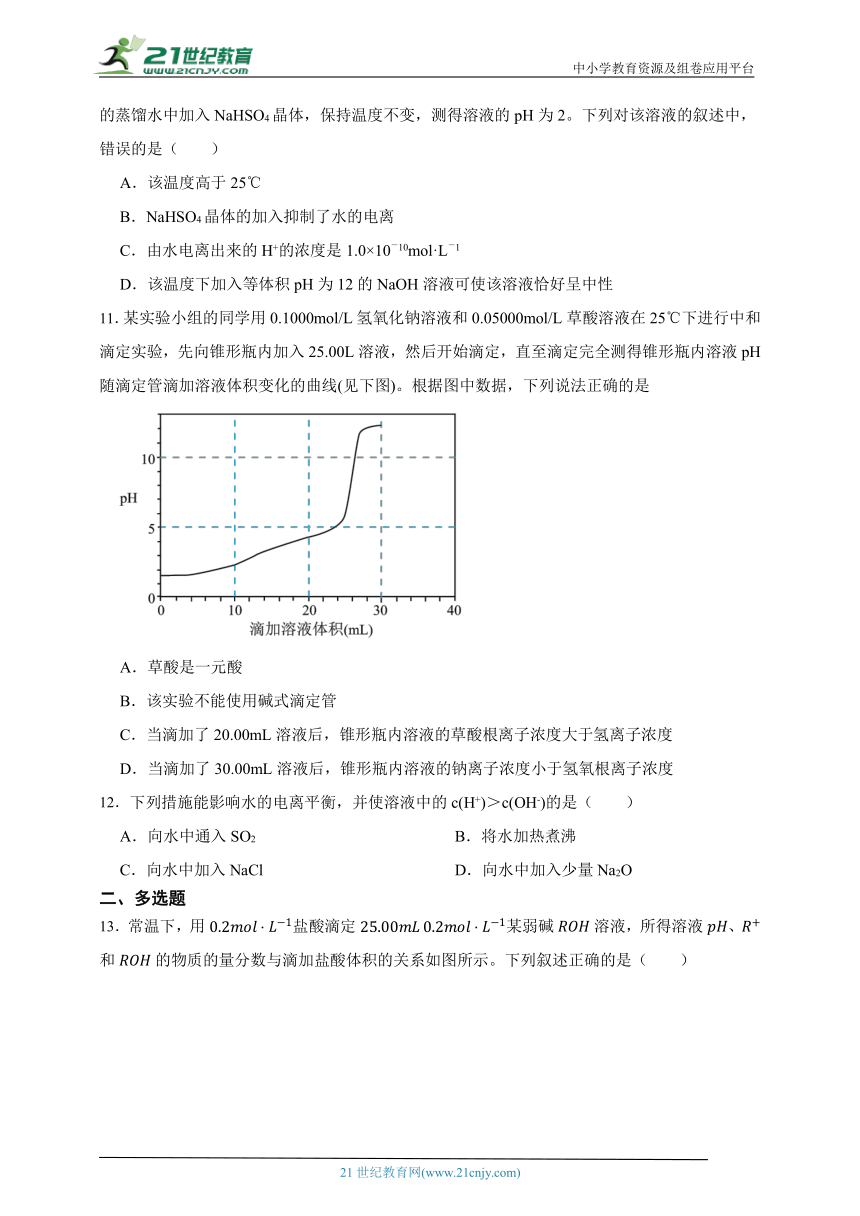
8.室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL0.1mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是( )
A.水的电离度:c点溶液>纯水>b点溶液
B.电离常数:Ka(HA)C.d点溶液:2c(Na+)=c(A-)+(HA)
D.a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
9.在25℃条件下,将pH=12的氨水加水稀释过程中,下列说法正确的是( )
A.能使溶液中的c( ) c(OH-)增大
B.溶液中c(H+) c(OH-)不变
C.能使溶液中 比值增大
D.此过程中,溶液中所有离子浓度均减小
10.已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,错误的是( )
A.该温度高于25℃
B.NaHSO4晶体的加入抑制了水的电离
C.由水电离出来的H+的浓度是1.0×10-10mol·L-1
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
11.某实验小组的同学用0.1000mol/L氢氧化钠溶液和0.05000mol/L草酸溶液在25℃下进行中和滴定实验,先向锥形瓶内加入25.00L溶液,然后开始滴定,直至滴定完全测得锥形瓶内溶液pH随滴定管滴加溶液体积变化的曲线(见下图)。根据图中数据,下列说法正确的是
A.草酸是一元酸
B.该实验不能使用碱式滴定管
C.当滴加了20.00mL溶液后,锥形瓶内溶液的草酸根离子浓度大于氢离子浓度
D.当滴加了30.00mL溶液后,锥形瓶内溶液的钠离子浓度小于氢氧根离子浓度
12.下列措施能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的是( )
A.向水中通入SO2 B.将水加热煮沸
C.向水中加入NaCl D.向水中加入少量Na2O
二、多选题
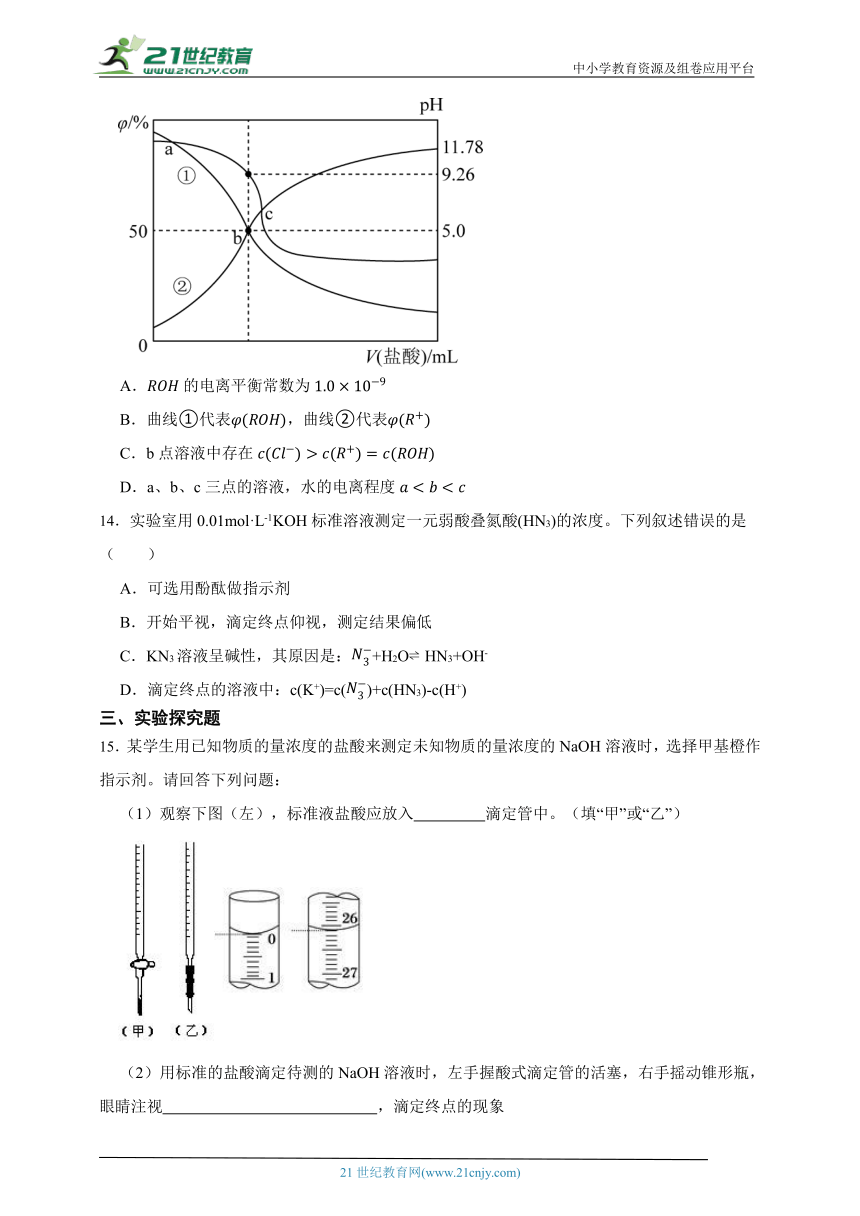
13.常温下,用盐酸滴定某弱碱溶液,所得溶液、和的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
A.的电离平衡常数为
B.曲线①代表,曲线②代表
C.b点溶液中存在
D.a、b、c三点的溶液,水的电离程度
14.实验室用0.01mol·L-1KOH标准溶液测定一元弱酸叠氮酸(HN3)的浓度。下列叙述错误的是( )
A.可选用酚酞做指示剂
B.开始平视,滴定终点仰视,测定结果偏低
C.KN3溶液呈碱性,其原因是:+H2O HN3+OH-
D.滴定终点的溶液中:c(K+)=c()+c(HN3)-c(H+)
三、实验探究题
15.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察下图(左),标准液盐酸应放入 滴定管中。(填“甲”或“乙”)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ,滴定终点的现象为 。
(3)若滴定开始和结束时,酸式滴定管中的液面如上图(右)所示,则起始读数为 mL,所用盐酸溶液的体积为 mL。
(4)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算该NaOH溶液的物质的量浓度 。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
四、综合题
16.25℃时,三种酸的电离平衡常数如下,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1=4.3×10-7;K2=5.6×10-11 3.0×10-8
(1)一般情况下,当温度升高时,Ka (填“增大”、“减小”或“不变”).
(2)下列四种离子结合H+能力由大到小的顺序是 (填序号);
a.CO b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是 (填序号)
a.CO +2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=CO2↑+H2O+2ClO-
d.HClO+CH3COO-=CH3COOH+ClO-
(4)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是 (填序号);
a. b.
c. d.
(5)体积均为10mL、c(H+)=10-2mol/L的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数 (填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来c(H+) 醋酸溶液中水电离出来的c(H+),理由是 。
答案解析部分
1.【答案】B
【解析】【解答】A.常温下,Kw= c(H+)×c(OH-)=1×10-14,所以纯水中的c(H+)=c(OH-)=1×10-7mol·L-1,A项不符合题意;
B.向水中加入NaCl,由于Na+与水电离出的OH-或Cl-与水电离出的H+均不形成弱电解质,则不会破坏水的电离平衡,B项符合题意;
C.向水中加入HCl或者NaOH,增大了H+或OH-的浓度,即增大了生成物浓度,平衡逆向移动,C项不符合题意;
D.水的电离为吸热反应,升高温度,平衡正向移动,Kw增大,反之,Kw减小,D项不符合题意;
故答案为:B。
【分析】A、常温下水的Kw= c(H+)×c(OH-)=1×10-14;
B、氯化氢为强酸,水中氢离子和氯离子无法结合;
C、氢离子和氢氧根会抑制水的电离;
D、化学平衡常数只受温度影响。
2.【答案】D
【解析】【解答】A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故A不符合题意;
B.Kw只随温度的变化而变化,温度升高促进水的电离,Kw增大,故B不符合题意;
C.HA电离平衡常数为K= ,HA电离出的c(H+)=c(A-)=10-4mol/L,所以K= 1×10-7,故C不符合题意;
D.HA在水中有0.1%发生电离,即HA部分电离,所以在溶液中存在HA分子,故D符合题意;
故答案为:D。
【分析】A.利用氢离子的浓度计算pH;
B.温度升高促进水的电离,KW增大;
C.根据电离度及离子的浓度计算电离平衡常数;
D.HA在水中只有0.1%发生电离,还有分子形式。
3.【答案】B
【解析】【解答】NaOH为强碱,则pH = 8的NaOH溶液中Na+浓度浓度等于氢氧根离子的浓度 = 1×10 6 mol/L;当溶液稀释1000倍后,氢氧根离子浓度只能无限接近中性即为1×10 7 mol/L,而钾离子浓度为:c(Na+) = 1×10 9 mol/L,因此稀释后所得溶液中c(Na+)与c(OH-)之比约为:(1×10 9)mol/L:(1×10 7)mol/L = 1:100,故B项符合题意,
故答案为:B。
【分析】将pH=8的NaOH溶液加水稀释1000倍,稀释后所得溶液中Na+浓度c(Na+)变为原来的千分之一,碱溶液稀释1000后,接近中性,pH 7,据此计算得出结论。
4.【答案】D
【解析】【解答】A.0.1 mol/L氢氧化钠溶液中氢氧根离子浓度为0.1 mol/L,溶液加热到80℃时,水的电离平衡向右移动,水的离子积常数增大,溶液中氢离子浓度减小,溶液pH增大,故A不符合题意;
B.硫酸铵是强酸弱碱盐,铵根离子在溶液中的水解反应是吸热反应,0.1 mol/L溶液加热到80℃时,水解平衡向正反应方向移动,溶液中氢离子浓度增大,溶液pH减小,故B不符合题意;
C.0.1 mol/L氯化钠溶液加热到80℃时,水的电离向右移动,水的离子积常数增大,溶液中氢氧根离子浓度增大,溶液pH增大,故C不符合题意;
D.0.1 mol/L硫酸溶液中氢离子浓度为0.1 mol/L,溶液加热到80℃时,溶液中氢离子浓度为依然为0.1 mol/L,溶液pH几乎不变,故D符合题意;
故答案为:D。
【分析】A、升高温度,水的电离平衡朝正向移动,加入氢氧化钠,氢氧根浓度增加,氢离子浓度减少,pH增大;
B、硫酸铵溶液中,铵根离子水解为氢离子,升高温度,pH减小;
C、氯化钠为中性,温度升高,中性溶液的pH减小;
D、硫酸为酸性,升高温度,氢离子浓度不变,pH不变。
5.【答案】A
【解析】【解答】A.常温下,若溶液的,则说明发生了水解,说明其为强碱弱酸盐,即为弱酸,故A符合题意;
B.为弱酸,刚好中和的产物为强碱弱酸盐,溶液显碱性,故B不符合题意;
C.纯醋酸不电离,向冰醋酸中不断加水,氢离子浓度先增大后减小,则溶液的pH先减小后增大,故C不符合题意;
D.25℃和40℃时,水的离子积不同,水的电离程度不同,40℃时水的离子积较大,相同浓度的NaOH溶液在40℃时溶液中的氢离子浓度较大,pH偏小,故D不符合题意;
故答案为:A。
【分析】A.依据盐类水解原理分析;
B.中和时生成强碱弱酸盐,溶液显碱性;
C.纯醋酸不电离,向冰醋酸中不断加水,氢离子浓度先增大后减小;
D.依据水的离子积常数不同分析。
6.【答案】C
【解析】【解答】A.用0.1000mol L-1HCl溶液滴定未知浓度的NaOH溶液,滴定终点时生成NaCl,溶液呈中性,酚酞变色范围为8.2~10,可选用酚酞作指示剂,A不符合题意;
B.HCl溶液呈酸性,中和滴定时,需要用酸式滴定管盛装0.1000mol L-1HCl溶液,B不符合题意;
C.用未知浓度的NaOH溶液润洗锥形瓶2~3次,导致锥形瓶中氢氧化钠的物质的量偏大,滴定时消耗标准液的体积偏大,测定结果偏高,所以锥形瓶不能润洗,C符合题意;
D.滴定结束时俯视酸式滴定管读数,读出的标准液体积偏小,导致测量结果偏低,D不符合题意;
故答案为:C。
【分析】A.滴定终点时溶液呈中性;
B.盐酸显酸性,应用酸式滴定管盛装;
D.滴定管从上到下刻度增大,俯视读数偏小。
7.【答案】B
【解析】【解答】A.根据物料守恒,a到c的过程中,为定值,故A不符合题意;
B.a到c的过程中,HA物质的量浓度不断减小,酸性不断减弱,抑制水的电离程度不断减弱,则水的电离程度不断增大,故B符合题意;
C.b点时,根据电荷守恒得到,溶液显酸性,则,b点时,则,故C不符合题意;
D.若HA恰好完全反应,加入碱的体积等于20 mL,则此时溶质为NaA,NaA溶液中由于A-水解使溶液显碱性,c点溶液显中性,说明c点时加入碱的体积小于20 mL,故D不符合题意。
故答案为:B。
【分析】A.根据物料守恒分析;
B.依据酸或碱抑制水的电离,含有弱根离子的盐促进水的电离;
C.根据电荷守恒分析;
D.依据盐类水解规律分析。
8.【答案】C
【解析】【解答】A. c点为完全中和生成的盐溶液,根据起始pH可知,两种酸均为弱酸,且HA的酸性更弱,故c点为强碱弱酸盐溶液,水解促进水的电离,b点不完全中和,酸过量,酸的电离抑制水的电离,水的电离程度减小,故水的电离度:c点溶液>纯水>b点溶液,选项A不符合题意;
B. 由图中曲线可知,HA的酸性更弱,则电离常数:Ka(HA)C. d点溶液为氢氧化钠与NaA溶液按1:1形成的溶液,根据物料守恒有:c(Na+)=2c(A-)+2 c (HA),选项C符合题意;
D. a点溶液以HB与NaB按1:1为溶质形成的溶液,溶液呈酸性,说明电离大于水解,则:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),选项D不符合题意。
故答案为:C。
【分析】0.1mol·L-1的HA和HB溶液pH均大于1,故两者均为弱酸,且HA的酸性更弱,据此分析解答。
9.【答案】B
【解析】【解答】A.加水稀释一水合氨,促进电离,但是一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c( )、c(OH-)均减小,则c( ) c(OH-)减小,故A不符合题意;
B.温度不变离子积常数不变,则c(H+) c(OH-)=Kw不变,故B符合题意;
C.温度不变离子积常数、电离平衡常数不变,则 =Kb/Kw不变,故C不符合题意;
D.加水稀释一水合氨,促进电离,但是一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)减小,温度不变水的离子积常数不变,则溶液中c(H+)增大,故D不符合题意;
故答案为:B。
【分析】A.加水稀释一水合氨,虽然促进了电离,但是溶液中c( )、c(OH-)均减小;
B.离子积常数只和温度相关;
C.只要温度不变,则离子积常数、电离平衡常数就不变Kb/Kw不变;
D.氨水加水稀释后,碱性减弱,则溶液中c(H+)增大。
10.【答案】D
【解析】【解答】A.25℃蒸馏水中c(H+)=1×10-7mol/L,pH=6的蒸馏水呈中性,c(H+)=c(OH-)=1×10-6mol/L>1×10-7mol/L,水的电离是吸热过程,升高温度促进水的电离,所以该温度高于25℃,A不符合题意;
B.NaHSO4电离出H+,c(H+)增大,抑制水的电离,B不符合题意;
C.该温度下水的离子积Kw=1×10-6×1×10-6=10-12,该溶液的pH=2,则该溶液中c(OH-)=10-12÷10-2=1×10-10(mol/L),该溶液中OH-全部来自水电离,则由水电离出的H+的浓度为1×10-10mol/L,C不符合题意;
D.NaHSO4溶液的pH=2,c(H+)=1×10-2mol/L,pH=12的NaOH溶液中c(OH-)=10-12÷10-12=1(mol/L),两者等体积混合充分反应后NaOH过量,溶液呈碱性,D符合题意;
故答案为:D。
【分析】A.此时pH=6的蒸馏水呈中性,c(H+)=c(OH-)=1×10-6mol/L>1×10-7mol/L,水的电离是吸热过程;
B.水电离生成氢离子和氢氧根离子,提高氢离子的浓度,抑制水的电离;
C.水电离出来的氢离子的浓度等于溶液中氢氧根离子的浓度;
D.纯水的pH=6,说明Kw=10-12,加入氢氧化钠溶液的物质的量应与氢离子的相等。
11.【答案】C
【解析】【解答】A.由分析知草酸是二元酸,A不符合题意;
B.盛装氢氧化钠溶液必须用碱式滴定管,量取草酸溶液必须用酸式滴定管,B不符合题意;
C.当滴加了20.00mL溶液时,根据方程式可计得锥形瓶内草酸钠有,草酸有,草酸钠完全电离,草酸微弱电离,因此溶液中草酸根离子浓度大于氢离子浓度。随着滴加的NaOH增多,生成的草酸钠更多,草酸根离子浓度变得更大,氢离子浓度变得更小,C符合题意;
D.当滴加了30.00mL溶液时,恰好完全中和,溶质只有草酸钠,草酸钠完全电离,氢氧根离子主要由草酸根离子水解产生,水解是微弱的,因此钠离子浓度大于氢氧根离子浓度。随着滴加的NaOH增多,增多的NaOH中,钠离子浓度等于氢氧根离子浓度,且NaOH还能抑制草酸根离子的水解,因此溶液中的钠离子浓度依然会大于氢氧根离子浓度,D不符合题意;
故答案为:C。
【分析】A.依据突变时酸碱的用量,草酸是二元酸;
B.依据药品性质选择滴定管,碱性溶液选择碱式滴定管,酸性、强氧化性试剂选择酸式滴定管;
C.草酸钠完全电离,草酸微弱电离,因此溶液中草酸根离子浓度大于氢离子浓度;
D.依据电离和水解原理分析。
12.【答案】A
【解析】【解答】A.向水中通入SO2,生成酸,溶液中的c(H+)>c(OH-),酸对水的电离起抑制作用,A符合题意;
B.加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,B不符合题意;
C.NaCl在水中电离出钠离子与氯离子,两者都不能结合水电离的氢离子或氢氧根离子,不能使氢离子或氢氧根离子浓度变化,平衡不移动,不影响水的电离,溶液呈中性,C不符合题意;
D.Na2O和水反应生成氢氧化钠,氢离子浓度降低,使水的电离向右移动,碱性增强,c(H+)<c(OH-),D不符合题意;
故答案为:A。
【分析】根据影响电离平衡移动的因素和酸性的实质分析;
13.【答案】B,D
【解析】【解答】A.b点溶液中存在,的电离平衡常数为,A不符合题意;
B.由分析知,B符合题意;
C.b点溶液中存在,由于溶液pH=9.26,氢离子浓度小于氢氧根浓度,根据电荷守恒得到,因此有,C不符合题意;
D.从a到b点不断加入盐酸,ROH逐渐转化为R+,由于R+水解促进水电离,故a、b、c三点的溶液,水的电离程度,D符合题意。
故答案为BD。
【分析】A.选择b点利用计算;
B.依据图像结合滴定反应中曲线变化判断;
C.根据电荷守恒分析;
D.依据酸或碱抑制水的电离,含有弱根离子的盐促进水的电离。
14.【答案】B,D
【解析】【解答】A.KN3是强碱弱酸盐,水溶液因水解呈显碱性,故可选用酚酞做指示剂,A不符合题意;
B. 开始平视,滴定终点仰视,导致标准溶液体积偏大,则测定结果偏高,B符合题意;
C. KN3溶液因水解呈碱性,其原因是:+H2O HN3+OH-,C不符合题意;
D. 滴定终点所得为KN3溶液:据电荷守恒则有:c(K+)+c(H+)=c(-)+c(OH-),根据物料守恒,则c()+c(HN3)= c(K+), D符合题意;
故答案为:BD。
【分析】B.碱式滴定管0刻度在上面,开始平视,终点仰视,相当于加入的 KOH标准溶液 体积变大,所以导致测定结果偏大
D.对终点结合电荷守恒列出等式,然后对N元素列出物理守恒列式,二者结合即可得到正确关系式。
15.【答案】(1)甲
(2)锥形瓶中溶液的颜色变化;当滴入最后一滴盐酸时,溶液刚好由黄色变为橙色且在半分钟内溶液颜色保持不变
(3)0.00;26.10
(4)0.1044 mol·L-1
(5)D
【解析】【解答】(1)甲是酸式滴定管、乙是碱式滴定管,酸性液体盛入酸式滴定管中,所以标准液盐酸应放入甲中;(2)用标准盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,滴定终点的现象为当滴入最后一滴盐酸时,溶液刚好由黄色变为橙色且在半分钟内溶液颜色保持不变。(3)滴定管的0刻度在上,由图可知:滴定前刻度0.00,滴定后刻度26.10,溶液体积26.10;(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积的平均值:V= (26.11+26.09)/2= 26.10 mL,根据c(酸)v(酸)=c(碱)v(碱),0.1mol/L 26.10 mL= c(NaOH) 25.00 mL,c(NaOH)=0.1044 mol/L;(5)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)= 可知,测定c(NaOH)偏大,故A不符合;B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)= 可知,测定c(NaOH)无影响,故B不符合;C选项酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= 可知,测定c(NaOH)偏大,故C不符合;D选项,读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)= 可知,测定c(NaOH)偏低,故D符合。
【分析】(1)酸性液体盛入酸式滴定管中;(2)眼睛观察的是锥形瓶内指示剂颜色的变化,而不是滴定管中液体的体积变化;判断滴定终点时,注意在指示剂颜色发生变化后,半分钟内不再复原,停止滴定;(3)滴定管的0刻度在上;(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积计算平均值,根据c(酸)v(酸)=c(碱)v(碱),计算NaOH溶液的物质的量浓度。(5)根据c(待测)= 分析误差。
16.【答案】(1)增大
(2)a>b>d>c
(3)c,d
(4)b
(5)大于;大于;稀释后,HX的pH大,酸性弱,对水抑制程度小,水电离程度大
【解析】【解答】(1)弱电解质的电离是吸热过程,升高温度促进弱电解质的电离,则当温度升高时,Ka增大;(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO> ,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO >ClO->HCO >CH3COO-,即a>b>d>c;(3)a.碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,反应CO +2CH3COOH=2CH3COO-+CO2↑+H2O能够发生,故a不选;
b.CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,反应ClO-+CH3COOH=CH3COO-+HClO能够发生,故b不选;
c.HClO的酸性小于碳酸,CO +2HClO=CO2↑+H2O+2ClO-不能发生,故c选;
d.由于酸性CH3COOH>HClO,弱酸不能制强酸,则HClO不能制CH3COOH,HClO+CH3COO-=CH3COOH+ClO-不能发生,故d选;
故答案为:c、d;(4)a.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以 = 的比值减小,故a不选;
b.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则 = 的比值增大,故b选;
c.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以 的比值减小,故c不选;
d.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大, 的比值减小,故d不选;
故答案为b;(5)根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于醋酸的电离平衡常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+);原因是酸溶液中氢离子浓度越小,对水的抑制程度越小,水的电离程度越大,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱。
【分析】弱电解电离过程是吸热的;酸越弱,电离平衡常数越小,对应的酸根离子越易水解;结合强酸制弱酸的原理分析;结合加水稀释时对电离平衡的影响分析,注意水的离子积常数只受温度影响。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.2 水的电离和溶液的pH 第1课时 同步练习(含解析)
一、单选题
1.下列说法错误的是( )
A.常温下,纯水中的c(H+)=c(OH-)=1×10-7mol·L-1
B.向水中加入NaCl,H+与Cl-结合生成HCl,使水的电离平衡向正反应方向移动
C.向水中加入HCl或者NaOH,水的电离平衡都向逆反应方向移动
D.改变温度,Kw也会发生改变
2.已知室温时0.1mol/L某一元酸HA在水中有0.1%发生电离,叙述错误的是( )
A.该溶液的pH=4
B.升高温度,溶液的Kw增大
C.此酸的电离平衡常数约为1×10-7
D.该溶液里不存在HA分子
3.常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近( )
A.1:1 B.1:102 C.102:1 D.1:103
4.常温下0.1 mol/L的下列物质的水溶液,加热到80℃,溶液的pH几乎不变的是( )
A.氢氧化钠 B.硫酸铵 C.氯化钠 D.硫酸
5.下列说法正确的是
A.为确定某酸H2A是强酸还是弱酸,可通过在常温下测NaHA溶液的pH,若pH>7,则H2A一定是弱酸
B.用NaOH标准溶液滴定CH3COOH溶液至中性时,CH3COOH溶液恰好被中和
C.向冰醋酸中不断加水,溶液的pH不断增大
D.25℃和40℃时,0.1 mol·L-1的氨水的pH不相等,而25℃和40℃时,0.1 mol·L-1的氢氧化钠溶液的pH相等
6.用0.1000mol L-1HCl溶液滴定未知浓度的NaOH溶液。有关该实验说法中,错误的是( )
A.本实验可选用酚酞作指示剂
B.用酸式滴定管盛装0.1000mol L-1HCl溶液
C.用未知浓度的NaOH溶液润洗锥形瓶2~3次
D.滴定结束时俯视酸式滴定管读数,测量结果偏低
7.室温下,向20.0 mL 0.100 mol L 1的某弱酸HA的溶液中滴加同浓度的NaOH溶液,过程中随pH的变化关系如下图所示。下列说法错误的是
A.a到c的过程中,为定值
B.a到c的过程中,水的电离程度不断减小
C.b点时,
D.c点时加入碱的体积小于20 mL
8.室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL0.1mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是( )
A.水的电离度:c点溶液>纯水>b点溶液
B.电离常数:Ka(HA)
D.a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
9.在25℃条件下,将pH=12的氨水加水稀释过程中,下列说法正确的是( )
A.能使溶液中的c( ) c(OH-)增大
B.溶液中c(H+) c(OH-)不变
C.能使溶液中 比值增大
D.此过程中,溶液中所有离子浓度均减小
10.已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,错误的是( )
A.该温度高于25℃
B.NaHSO4晶体的加入抑制了水的电离
C.由水电离出来的H+的浓度是1.0×10-10mol·L-1
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
11.某实验小组的同学用0.1000mol/L氢氧化钠溶液和0.05000mol/L草酸溶液在25℃下进行中和滴定实验,先向锥形瓶内加入25.00L溶液,然后开始滴定,直至滴定完全测得锥形瓶内溶液pH随滴定管滴加溶液体积变化的曲线(见下图)。根据图中数据,下列说法正确的是
A.草酸是一元酸
B.该实验不能使用碱式滴定管
C.当滴加了20.00mL溶液后,锥形瓶内溶液的草酸根离子浓度大于氢离子浓度
D.当滴加了30.00mL溶液后,锥形瓶内溶液的钠离子浓度小于氢氧根离子浓度
12.下列措施能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的是( )
A.向水中通入SO2 B.将水加热煮沸
C.向水中加入NaCl D.向水中加入少量Na2O
二、多选题
13.常温下,用盐酸滴定某弱碱溶液,所得溶液、和的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
A.的电离平衡常数为
B.曲线①代表,曲线②代表
C.b点溶液中存在
D.a、b、c三点的溶液,水的电离程度
14.实验室用0.01mol·L-1KOH标准溶液测定一元弱酸叠氮酸(HN3)的浓度。下列叙述错误的是( )
A.可选用酚酞做指示剂
B.开始平视,滴定终点仰视,测定结果偏低
C.KN3溶液呈碱性,其原因是:+H2O HN3+OH-
D.滴定终点的溶液中:c(K+)=c()+c(HN3)-c(H+)
三、实验探究题
15.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察下图(左),标准液盐酸应放入 滴定管中。(填“甲”或“乙”)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ,滴定终点的现象为 。
(3)若滴定开始和结束时,酸式滴定管中的液面如上图(右)所示,则起始读数为 mL,所用盐酸溶液的体积为 mL。
(4)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算该NaOH溶液的物质的量浓度 。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
四、综合题
16.25℃时,三种酸的电离平衡常数如下,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1=4.3×10-7;K2=5.6×10-11 3.0×10-8
(1)一般情况下,当温度升高时,Ka (填“增大”、“减小”或“不变”).
(2)下列四种离子结合H+能力由大到小的顺序是 (填序号);
a.CO b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是 (填序号)
a.CO +2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=CO2↑+H2O+2ClO-
d.HClO+CH3COO-=CH3COOH+ClO-
(4)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是 (填序号);
a. b.
c. d.
(5)体积均为10mL、c(H+)=10-2mol/L的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数 (填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来c(H+) 醋酸溶液中水电离出来的c(H+),理由是 。
答案解析部分
1.【答案】B
【解析】【解答】A.常温下,Kw= c(H+)×c(OH-)=1×10-14,所以纯水中的c(H+)=c(OH-)=1×10-7mol·L-1,A项不符合题意;
B.向水中加入NaCl,由于Na+与水电离出的OH-或Cl-与水电离出的H+均不形成弱电解质,则不会破坏水的电离平衡,B项符合题意;
C.向水中加入HCl或者NaOH,增大了H+或OH-的浓度,即增大了生成物浓度,平衡逆向移动,C项不符合题意;
D.水的电离为吸热反应,升高温度,平衡正向移动,Kw增大,反之,Kw减小,D项不符合题意;
故答案为:B。
【分析】A、常温下水的Kw= c(H+)×c(OH-)=1×10-14;
B、氯化氢为强酸,水中氢离子和氯离子无法结合;
C、氢离子和氢氧根会抑制水的电离;
D、化学平衡常数只受温度影响。
2.【答案】D
【解析】【解答】A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故A不符合题意;
B.Kw只随温度的变化而变化,温度升高促进水的电离,Kw增大,故B不符合题意;
C.HA电离平衡常数为K= ,HA电离出的c(H+)=c(A-)=10-4mol/L,所以K= 1×10-7,故C不符合题意;
D.HA在水中有0.1%发生电离,即HA部分电离,所以在溶液中存在HA分子,故D符合题意;
故答案为:D。
【分析】A.利用氢离子的浓度计算pH;
B.温度升高促进水的电离,KW增大;
C.根据电离度及离子的浓度计算电离平衡常数;
D.HA在水中只有0.1%发生电离,还有分子形式。
3.【答案】B
【解析】【解答】NaOH为强碱,则pH = 8的NaOH溶液中Na+浓度浓度等于氢氧根离子的浓度 = 1×10 6 mol/L;当溶液稀释1000倍后,氢氧根离子浓度只能无限接近中性即为1×10 7 mol/L,而钾离子浓度为:c(Na+) = 1×10 9 mol/L,因此稀释后所得溶液中c(Na+)与c(OH-)之比约为:(1×10 9)mol/L:(1×10 7)mol/L = 1:100,故B项符合题意,
故答案为:B。
【分析】将pH=8的NaOH溶液加水稀释1000倍,稀释后所得溶液中Na+浓度c(Na+)变为原来的千分之一,碱溶液稀释1000后,接近中性,pH 7,据此计算得出结论。
4.【答案】D
【解析】【解答】A.0.1 mol/L氢氧化钠溶液中氢氧根离子浓度为0.1 mol/L,溶液加热到80℃时,水的电离平衡向右移动,水的离子积常数增大,溶液中氢离子浓度减小,溶液pH增大,故A不符合题意;
B.硫酸铵是强酸弱碱盐,铵根离子在溶液中的水解反应是吸热反应,0.1 mol/L溶液加热到80℃时,水解平衡向正反应方向移动,溶液中氢离子浓度增大,溶液pH减小,故B不符合题意;
C.0.1 mol/L氯化钠溶液加热到80℃时,水的电离向右移动,水的离子积常数增大,溶液中氢氧根离子浓度增大,溶液pH增大,故C不符合题意;
D.0.1 mol/L硫酸溶液中氢离子浓度为0.1 mol/L,溶液加热到80℃时,溶液中氢离子浓度为依然为0.1 mol/L,溶液pH几乎不变,故D符合题意;
故答案为:D。
【分析】A、升高温度,水的电离平衡朝正向移动,加入氢氧化钠,氢氧根浓度增加,氢离子浓度减少,pH增大;
B、硫酸铵溶液中,铵根离子水解为氢离子,升高温度,pH减小;
C、氯化钠为中性,温度升高,中性溶液的pH减小;
D、硫酸为酸性,升高温度,氢离子浓度不变,pH不变。
5.【答案】A
【解析】【解答】A.常温下,若溶液的,则说明发生了水解,说明其为强碱弱酸盐,即为弱酸,故A符合题意;
B.为弱酸,刚好中和的产物为强碱弱酸盐,溶液显碱性,故B不符合题意;
C.纯醋酸不电离,向冰醋酸中不断加水,氢离子浓度先增大后减小,则溶液的pH先减小后增大,故C不符合题意;
D.25℃和40℃时,水的离子积不同,水的电离程度不同,40℃时水的离子积较大,相同浓度的NaOH溶液在40℃时溶液中的氢离子浓度较大,pH偏小,故D不符合题意;
故答案为:A。
【分析】A.依据盐类水解原理分析;
B.中和时生成强碱弱酸盐,溶液显碱性;
C.纯醋酸不电离,向冰醋酸中不断加水,氢离子浓度先增大后减小;
D.依据水的离子积常数不同分析。
6.【答案】C
【解析】【解答】A.用0.1000mol L-1HCl溶液滴定未知浓度的NaOH溶液,滴定终点时生成NaCl,溶液呈中性,酚酞变色范围为8.2~10,可选用酚酞作指示剂,A不符合题意;
B.HCl溶液呈酸性,中和滴定时,需要用酸式滴定管盛装0.1000mol L-1HCl溶液,B不符合题意;
C.用未知浓度的NaOH溶液润洗锥形瓶2~3次,导致锥形瓶中氢氧化钠的物质的量偏大,滴定时消耗标准液的体积偏大,测定结果偏高,所以锥形瓶不能润洗,C符合题意;
D.滴定结束时俯视酸式滴定管读数,读出的标准液体积偏小,导致测量结果偏低,D不符合题意;
故答案为:C。
【分析】A.滴定终点时溶液呈中性;
B.盐酸显酸性,应用酸式滴定管盛装;
D.滴定管从上到下刻度增大,俯视读数偏小。
7.【答案】B
【解析】【解答】A.根据物料守恒,a到c的过程中,为定值,故A不符合题意;
B.a到c的过程中,HA物质的量浓度不断减小,酸性不断减弱,抑制水的电离程度不断减弱,则水的电离程度不断增大,故B符合题意;
C.b点时,根据电荷守恒得到,溶液显酸性,则,b点时,则,故C不符合题意;
D.若HA恰好完全反应,加入碱的体积等于20 mL,则此时溶质为NaA,NaA溶液中由于A-水解使溶液显碱性,c点溶液显中性,说明c点时加入碱的体积小于20 mL,故D不符合题意。
故答案为:B。
【分析】A.根据物料守恒分析;
B.依据酸或碱抑制水的电离,含有弱根离子的盐促进水的电离;
C.根据电荷守恒分析;
D.依据盐类水解规律分析。
8.【答案】C
【解析】【解答】A. c点为完全中和生成的盐溶液,根据起始pH可知,两种酸均为弱酸,且HA的酸性更弱,故c点为强碱弱酸盐溶液,水解促进水的电离,b点不完全中和,酸过量,酸的电离抑制水的电离,水的电离程度减小,故水的电离度:c点溶液>纯水>b点溶液,选项A不符合题意;
B. 由图中曲线可知,HA的酸性更弱,则电离常数:Ka(HA)
D. a点溶液以HB与NaB按1:1为溶质形成的溶液,溶液呈酸性,说明电离大于水解,则:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),选项D不符合题意。
故答案为:C。
【分析】0.1mol·L-1的HA和HB溶液pH均大于1,故两者均为弱酸,且HA的酸性更弱,据此分析解答。
9.【答案】B
【解析】【解答】A.加水稀释一水合氨,促进电离,但是一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c( )、c(OH-)均减小,则c( ) c(OH-)减小,故A不符合题意;
B.温度不变离子积常数不变,则c(H+) c(OH-)=Kw不变,故B符合题意;
C.温度不变离子积常数、电离平衡常数不变,则 =Kb/Kw不变,故C不符合题意;
D.加水稀释一水合氨,促进电离,但是一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)减小,温度不变水的离子积常数不变,则溶液中c(H+)增大,故D不符合题意;
故答案为:B。
【分析】A.加水稀释一水合氨,虽然促进了电离,但是溶液中c( )、c(OH-)均减小;
B.离子积常数只和温度相关;
C.只要温度不变,则离子积常数、电离平衡常数就不变Kb/Kw不变;
D.氨水加水稀释后,碱性减弱,则溶液中c(H+)增大。
10.【答案】D
【解析】【解答】A.25℃蒸馏水中c(H+)=1×10-7mol/L,pH=6的蒸馏水呈中性,c(H+)=c(OH-)=1×10-6mol/L>1×10-7mol/L,水的电离是吸热过程,升高温度促进水的电离,所以该温度高于25℃,A不符合题意;
B.NaHSO4电离出H+,c(H+)增大,抑制水的电离,B不符合题意;
C.该温度下水的离子积Kw=1×10-6×1×10-6=10-12,该溶液的pH=2,则该溶液中c(OH-)=10-12÷10-2=1×10-10(mol/L),该溶液中OH-全部来自水电离,则由水电离出的H+的浓度为1×10-10mol/L,C不符合题意;
D.NaHSO4溶液的pH=2,c(H+)=1×10-2mol/L,pH=12的NaOH溶液中c(OH-)=10-12÷10-12=1(mol/L),两者等体积混合充分反应后NaOH过量,溶液呈碱性,D符合题意;
故答案为:D。
【分析】A.此时pH=6的蒸馏水呈中性,c(H+)=c(OH-)=1×10-6mol/L>1×10-7mol/L,水的电离是吸热过程;
B.水电离生成氢离子和氢氧根离子,提高氢离子的浓度,抑制水的电离;
C.水电离出来的氢离子的浓度等于溶液中氢氧根离子的浓度;
D.纯水的pH=6,说明Kw=10-12,加入氢氧化钠溶液的物质的量应与氢离子的相等。
11.【答案】C
【解析】【解答】A.由分析知草酸是二元酸,A不符合题意;
B.盛装氢氧化钠溶液必须用碱式滴定管,量取草酸溶液必须用酸式滴定管,B不符合题意;
C.当滴加了20.00mL溶液时,根据方程式可计得锥形瓶内草酸钠有,草酸有,草酸钠完全电离,草酸微弱电离,因此溶液中草酸根离子浓度大于氢离子浓度。随着滴加的NaOH增多,生成的草酸钠更多,草酸根离子浓度变得更大,氢离子浓度变得更小,C符合题意;
D.当滴加了30.00mL溶液时,恰好完全中和,溶质只有草酸钠,草酸钠完全电离,氢氧根离子主要由草酸根离子水解产生,水解是微弱的,因此钠离子浓度大于氢氧根离子浓度。随着滴加的NaOH增多,增多的NaOH中,钠离子浓度等于氢氧根离子浓度,且NaOH还能抑制草酸根离子的水解,因此溶液中的钠离子浓度依然会大于氢氧根离子浓度,D不符合题意;
故答案为:C。
【分析】A.依据突变时酸碱的用量,草酸是二元酸;
B.依据药品性质选择滴定管,碱性溶液选择碱式滴定管,酸性、强氧化性试剂选择酸式滴定管;
C.草酸钠完全电离,草酸微弱电离,因此溶液中草酸根离子浓度大于氢离子浓度;
D.依据电离和水解原理分析。
12.【答案】A
【解析】【解答】A.向水中通入SO2,生成酸,溶液中的c(H+)>c(OH-),酸对水的电离起抑制作用,A符合题意;
B.加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,B不符合题意;
C.NaCl在水中电离出钠离子与氯离子,两者都不能结合水电离的氢离子或氢氧根离子,不能使氢离子或氢氧根离子浓度变化,平衡不移动,不影响水的电离,溶液呈中性,C不符合题意;
D.Na2O和水反应生成氢氧化钠,氢离子浓度降低,使水的电离向右移动,碱性增强,c(H+)<c(OH-),D不符合题意;
故答案为:A。
【分析】根据影响电离平衡移动的因素和酸性的实质分析;
13.【答案】B,D
【解析】【解答】A.b点溶液中存在,的电离平衡常数为,A不符合题意;
B.由分析知,B符合题意;
C.b点溶液中存在,由于溶液pH=9.26,氢离子浓度小于氢氧根浓度,根据电荷守恒得到,因此有,C不符合题意;
D.从a到b点不断加入盐酸,ROH逐渐转化为R+,由于R+水解促进水电离,故a、b、c三点的溶液,水的电离程度,D符合题意。
故答案为BD。
【分析】A.选择b点利用计算;
B.依据图像结合滴定反应中曲线变化判断;
C.根据电荷守恒分析;
D.依据酸或碱抑制水的电离,含有弱根离子的盐促进水的电离。
14.【答案】B,D
【解析】【解答】A.KN3是强碱弱酸盐,水溶液因水解呈显碱性,故可选用酚酞做指示剂,A不符合题意;
B. 开始平视,滴定终点仰视,导致标准溶液体积偏大,则测定结果偏高,B符合题意;
C. KN3溶液因水解呈碱性,其原因是:+H2O HN3+OH-,C不符合题意;
D. 滴定终点所得为KN3溶液:据电荷守恒则有:c(K+)+c(H+)=c(-)+c(OH-),根据物料守恒,则c()+c(HN3)= c(K+), D符合题意;
故答案为:BD。
【分析】B.碱式滴定管0刻度在上面,开始平视,终点仰视,相当于加入的 KOH标准溶液 体积变大,所以导致测定结果偏大
D.对终点结合电荷守恒列出等式,然后对N元素列出物理守恒列式,二者结合即可得到正确关系式。
15.【答案】(1)甲
(2)锥形瓶中溶液的颜色变化;当滴入最后一滴盐酸时,溶液刚好由黄色变为橙色且在半分钟内溶液颜色保持不变
(3)0.00;26.10
(4)0.1044 mol·L-1
(5)D
【解析】【解答】(1)甲是酸式滴定管、乙是碱式滴定管,酸性液体盛入酸式滴定管中,所以标准液盐酸应放入甲中;(2)用标准盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,滴定终点的现象为当滴入最后一滴盐酸时,溶液刚好由黄色变为橙色且在半分钟内溶液颜色保持不变。(3)滴定管的0刻度在上,由图可知:滴定前刻度0.00,滴定后刻度26.10,溶液体积26.10;(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积的平均值:V= (26.11+26.09)/2= 26.10 mL,根据c(酸)v(酸)=c(碱)v(碱),0.1mol/L 26.10 mL= c(NaOH) 25.00 mL,c(NaOH)=0.1044 mol/L;(5)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)= 可知,测定c(NaOH)偏大,故A不符合;B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)= 可知,测定c(NaOH)无影响,故B不符合;C选项酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= 可知,测定c(NaOH)偏大,故C不符合;D选项,读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)= 可知,测定c(NaOH)偏低,故D符合。
【分析】(1)酸性液体盛入酸式滴定管中;(2)眼睛观察的是锥形瓶内指示剂颜色的变化,而不是滴定管中液体的体积变化;判断滴定终点时,注意在指示剂颜色发生变化后,半分钟内不再复原,停止滴定;(3)滴定管的0刻度在上;(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积计算平均值,根据c(酸)v(酸)=c(碱)v(碱),计算NaOH溶液的物质的量浓度。(5)根据c(待测)= 分析误差。
16.【答案】(1)增大
(2)a>b>d>c
(3)c,d
(4)b
(5)大于;大于;稀释后,HX的pH大,酸性弱,对水抑制程度小,水电离程度大
【解析】【解答】(1)弱电解质的电离是吸热过程,升高温度促进弱电解质的电离,则当温度升高时,Ka增大;(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO> ,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO >ClO->HCO >CH3COO-,即a>b>d>c;(3)a.碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,反应CO +2CH3COOH=2CH3COO-+CO2↑+H2O能够发生,故a不选;
b.CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,反应ClO-+CH3COOH=CH3COO-+HClO能够发生,故b不选;
c.HClO的酸性小于碳酸,CO +2HClO=CO2↑+H2O+2ClO-不能发生,故c选;
d.由于酸性CH3COOH>HClO,弱酸不能制强酸,则HClO不能制CH3COOH,HClO+CH3COO-=CH3COOH+ClO-不能发生,故d选;
故答案为:c、d;(4)a.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以 = 的比值减小,故a不选;
b.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则 = 的比值增大,故b选;
c.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以 的比值减小,故c不选;
d.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大, 的比值减小,故d不选;
故答案为b;(5)根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于醋酸的电离平衡常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+);原因是酸溶液中氢离子浓度越小,对水的抑制程度越小,水的电离程度越大,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱。
【分析】弱电解电离过程是吸热的;酸越弱,电离平衡常数越小,对应的酸根离子越易水解;结合强酸制弱酸的原理分析;结合加水稀释时对电离平衡的影响分析,注意水的离子积常数只受温度影响。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
