人教版 高化 选择性必修1 4.4 实验活动4 简单的电镀实验 同步练习(含解析)
文档属性
| 名称 | 人教版 高化 选择性必修1 4.4 实验活动4 简单的电镀实验 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 551.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 12:20:06 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
3.5 实验活动4 简单的电镀实验 同步练习(含解析)
一、单选题
1.我国现行流通的货币主要为第五套人民币,其中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做()
A.阴极 B.阳极 C.正极 D.负极
2.化学概念的理解需要从本质上进行分析,否则易产生不符合题意。下列有关“电”概念中,不需要通电即可进行的是( )
A.电泳 B.电离 C.电镀 D.电解
3.下列描述中,不符合生产实际的是( )
A.电解饱和食盐H2O制烧碱,用离子交换膜将阳极室与阴极室隔开
B.电解熔融的AlCl3制取金属铝,用石墨作阳极
C.电解法精炼粗铜,用纯铜作阴极
D.在Fe上镀银,用银作阳极
4.下列叙述不正确的是( )
A.NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成、
B.电解、电离、电镀均需要通电才可进行
C.CO2、N2O5、SO2均为酸性氧化物
D.水玻璃、淀粉溶液、胶体均为混合物
5.关于下列各装置图的叙述中,不正确的是( )
A.装置①中电镀铜,a极为纯铜,b极为锌,电解质溶液为CuSO4溶液
B.装置②为原电池,总反应是:Fe+2Fe3+=3Fe2+
C.图③所示柱状图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
6.欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Fe和AgNO3溶液 D.Pt和Ag2SO4溶液
7.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铜作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
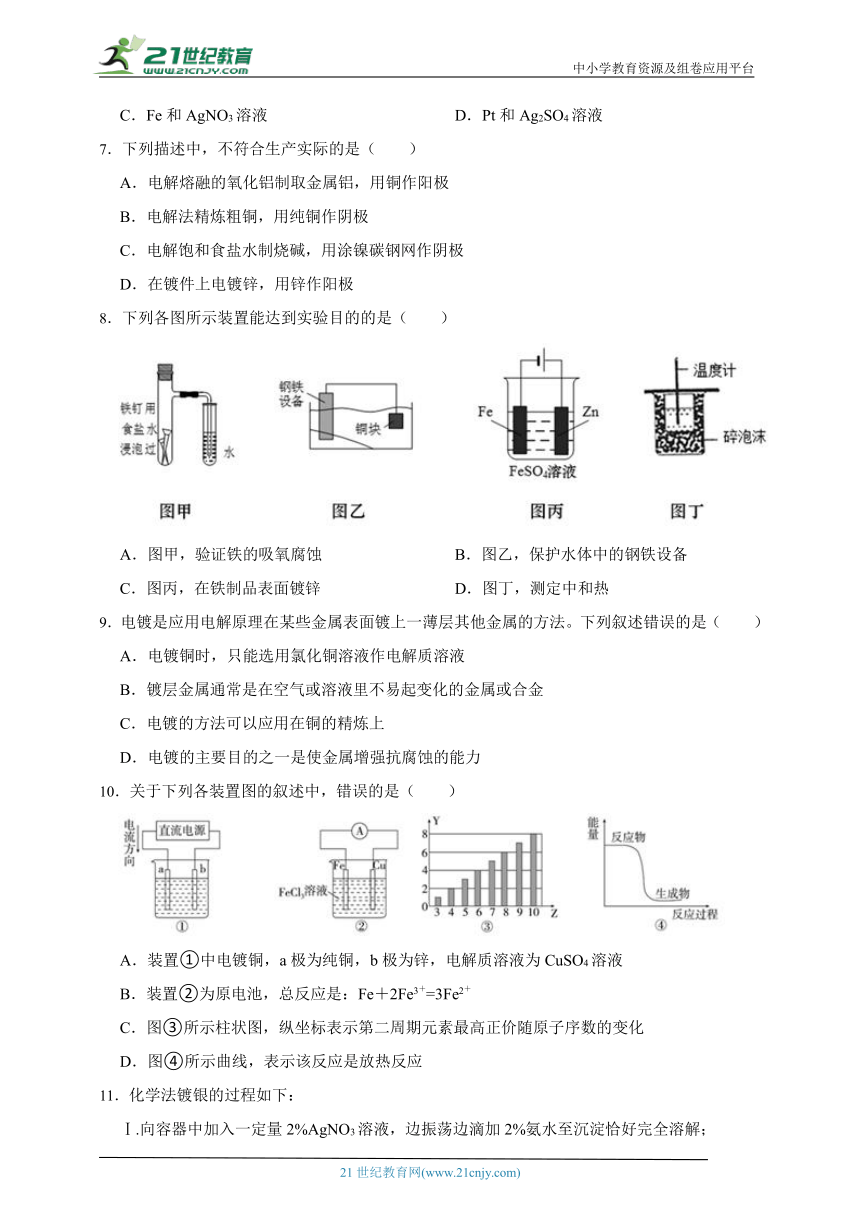
8.下列各图所示装置能达到实验目的的是( )
A.图甲,验证铁的吸氧腐蚀 B.图乙,保护水体中的钢铁设备
C.图丙,在铁制品表面镀锌 D.图丁,测定中和热
9.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法。下列叙述错误的是( )
A.电镀铜时,只能选用氯化铜溶液作电解质溶液
B.镀层金属通常是在空气或溶液里不易起变化的金属或合金
C.电镀的方法可以应用在铜的精炼上
D.电镀的主要目的之一是使金属增强抗腐蚀的能力
10.关于下列各装置图的叙述中,错误的是( )
A.装置①中电镀铜,a极为纯铜,b极为锌,电解质溶液为CuSO4溶液
B.装置②为原电池,总反应是:Fe+2Fe3+=3Fe2+
C.图③所示柱状图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
11.化学法镀银的过程如下:
Ⅰ.向容器中加入一定量2%AgNO3溶液,边振荡边滴加2%氨水至沉淀恰好完全溶解;
Ⅱ.加入10%葡萄糖溶液至充满容器,在60~70℃水浴中加热,片刻后容器内壁便镀上一层银。
下列说法正确的是( )
A.该实验证明葡萄糖与甲醛、乙醛等互为同系物
B.步骤Ⅰ后的溶液中大量存在Ag+、和
C.步骤Ⅱ可使用酒精灯直接加热以加快银的析出
D.可用硝酸洗涤除去容器壁上的银
12.下列过程不需要通电就能够实现的是
A.电离 B.电镀
C.电治金 D.电解饱和食盐水
13.电镀废液中 可通过下列反应转化成铬黄 : ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
A. B.
C. D.
14.下列有关实验的说法错误的是( )
A.加热2 mL 0.5 mol·L 1 CuCl2溶液,溶液颜色变为绿色
B.电镀实验中,错将铁制镀件与电源的正极相连,铁制镀件溶解
C.向NaOH溶液中加入适量饱和FeCl3溶液,加热制得Fe(OH)3胶体
D.向CH3COOH溶液中滴加适量Na2CO3溶液,出现无色气泡,说明Ka(CH3COOH)>Ka1(H2CO3)
15.下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2mole-,阳极溶解64g铜
B.可从阳极泥中提取金、银、锌等金属
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液需要不断更换
二、实验探究题
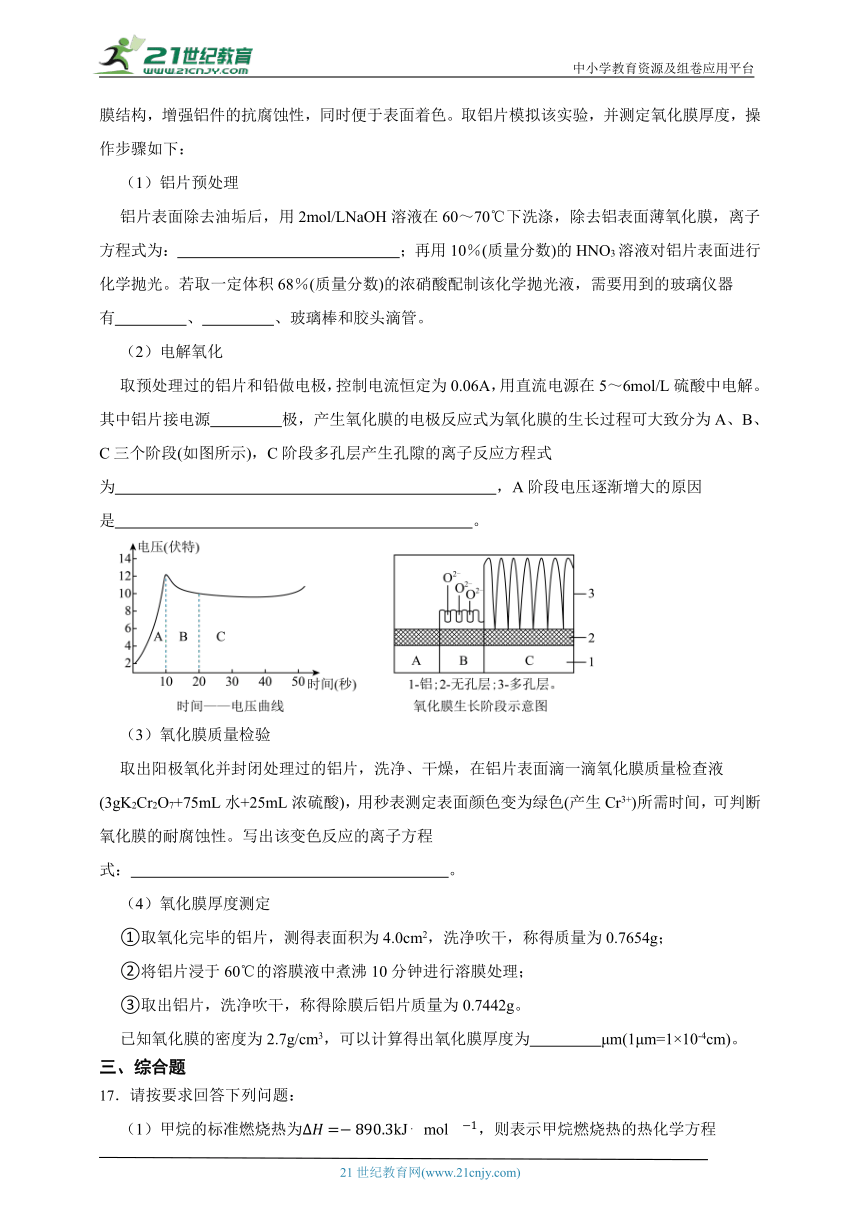
16.铝的阳极氧化是一种重要的表面处理技术,其原理是用电化学方法处理铝件表面,优化氧化膜结构,增强铝件的抗腐蚀性,同时便于表面着色。取铝片模拟该实验,并测定氧化膜厚度,操作步骤如下:
(1)铝片预处理
铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为: ;再用10%(质量分数)的HNO3溶液对铝片表面进行化学抛光。若取一定体积68%(质量分数)的浓硝酸配制该化学抛光液,需要用到的玻璃仪器有 、 、玻璃棒和胶头滴管。
(2)电解氧化
取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源 极,产生氧化膜的电极反应式为氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙的离子反应方程式为 ,A阶段电压逐渐增大的原因是 。
(3)氧化膜质量检验
取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式: 。
(4)氧化膜厚度测定
①取氧化完毕的铝片,测得表面积为4.0cm2,洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3,可以计算得出氧化膜厚度为 μm(1μm=1×10-4cm)。
三、综合题
17.请按要求回答下列问题:
(1)甲烷的标准燃烧热为kJ mol,则表示甲烷燃烧热的热化学方程式: 。
(2) kJ/mol
kJ/mol
写出与反应生成和水蒸气的热化学反应方程式 。
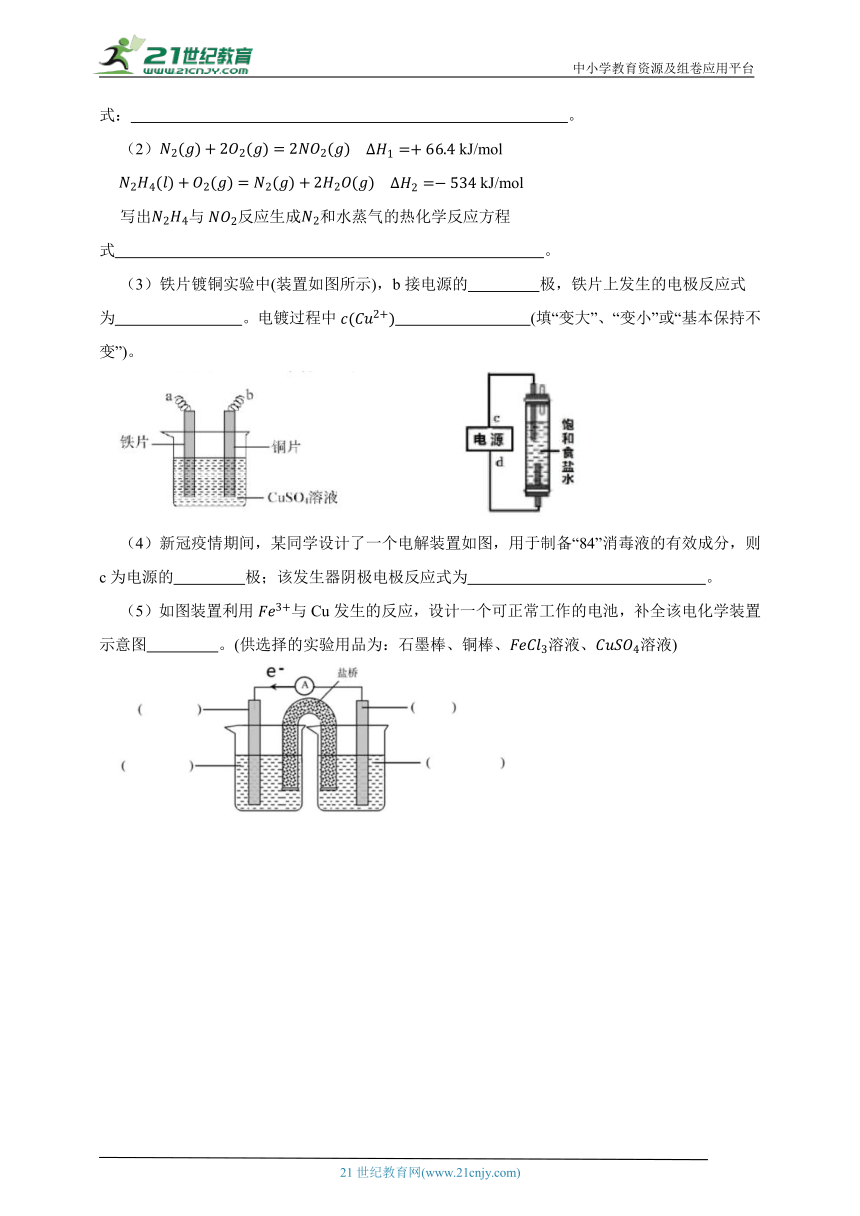
(3)铁片镀铜实验中(装置如图所示),b接电源的 极,铁片上发生的电极反应式为 。电镀过程中 (填“变大”、“变小”或“基本保持不变”)。
(4)新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的 极;该发生器阴极电极反应式为 。
(5)如图装置利用与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图 。(供选择的实验用品为:石墨棒、铜棒、溶液、溶液)
答案解析部分
1.【答案】A
【解析】【解答】钢芯镀镍时,根据电镀原理,镀件钢芯作阴极,镀层金属镍作阳极。
故答案为:A。
【分析】在电镀过程中要保证镀件被保护,镀层金属参加反应,在电解池中阴极被保护,阳极参与反应。
2.【答案】B
【解析】【解答】A.带电颗粒在电场作用下,向着与其电性相反的电极移动,称为电泳,故A不选;
B.电离是指电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程,不需要通电,故B选;
C.电镀就是利用电解原理在某些金属表面上镀上一薄层其它金属或合金的过程,故C不选;
D.电解是将电流通过电解质溶液或熔融态电解质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,故D不选;
故答案为:B。
【分析】电镀和电解是电解池原理,需要通电。而电离和电化学腐蚀不需要通电。
3.【答案】B
【解析】【解答】A.电解饱和食盐H2O制烧碱,阳极室产生氯气,阴极室得到氢气,防止出现事故,则用离子交换膜将阳极室与阴极室隔开,A符合实际生产;
B.AlCl3为共价化合物,通常用电解熔融的氧化铝制取金属铝,用石墨作阳极,B不符合实际生产;
C.电解法精炼粗铜,粗铜作阳极失电子生成铜离子,用纯铜作阴极,溶液中的铜离子得电子生成单质铜,C符合实际生产;
D.在Fe上镀银,Fe作阴极,溶液中的银离子得电子生成银,用银作阳极,银失电子生成银离子,D符合实际生产;
故答案为:B。
【分析】A.电解饱和食盐水时负极产生氢气,H2易燃易爆,采用离子交换膜进行隔离;
B.AlCl3不导电,无法电离;
C.电解精炼铜时粗铜做阳极,纯铜在阴极析出;
D.电镀时镀层金属做阳极;
4.【答案】B
【解析】【解答】A.Na2CO3与CO2、H2O反应生成NaHCO3 , Fe(OH)2、O2、H2O生成Fe(OH)3 , FeCl3与Fe反应生成FeCl2 , 所以NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成,故A不符合题意;
B.电离是指电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程;电解时将电流通过电解质溶液或熔融态电解质(电解液),在阴极和阳极上引起氧化还原反应的过程;电镀就是利用电解原理在某些金属表面上镀上一薄层其它金属或合金的过程,电离不需要通电,电解、电镀需要通电,故B符合题意;
C.和碱反应生成盐和水的氧化物属于酸性氧化物,CO2、N2O5、SO2均为酸性氧化物,故C不符合题意;
D.水玻璃是硅酸钠的水溶液,为混合物,淀粉溶液、胶体均含有两种物质,均为混合物,故D不符合题意;
故答案为:B。
【分析】A.两种或两种以上的物质发生反应生成一种物质的反应为化合反应;
B.电离是指电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程,电解时将电流通过电解质溶液或熔融态电解质(电解液),在阴极和阳极上引起氧化还原反应的过程,电镀是电解的应用;
C.和碱反应生成盐和水的氧化物属于酸性氧化物;
D.不同物质组成的为混合物,同种物质组成的为纯净物。
5.【答案】C
【解析】【解答】A.根据电流的方向可知a为电解池的阳极,则用来电镀铜时,a极为纯铜,电解质溶液为CuSO4溶液,A不符合题意;
B.Fe比Cu活泼,Fe为原电池的负极,发生的总反应为:Fe+2Fe3+=3Fe2+ , B不符合题意;
C.第二周期元素中O最高价为+2价,F无正价,C符合题意;
D.根据图象可知,反应物能量比生成物高,该反应为放热反应,D不符合题意;
故答案为:C。
【分析】A.根据电流的方向判断电源的正负极,精炼铜时粗铜做阳极;
B.铁比铜活泼,Fe为原电池的负极;
C.O、F元素无正价;
D.反应物能量比生成物高,反应放热。
6.【答案】B
【解析】【解答】欲在金属表面镀银,应把镀件挂在电镀池的阴极;选用的阳极金属为镀层金属,所以用银作阳极;电镀液应含有镀层金属离子,所以电镀液可以是AgNO3溶液,AgCl不溶于水,
故答案为:B。
【分析】欲在金属表面镀银,则阳极应为Ag,所用电解质溶液应为AgNO3溶液。
7.【答案】A
【解析】【解答】A.电解熔融的氧化铝制取金属铝,应该用惰性电极石墨作阳极,A符合题意;
B.电解法精炼粗铜,用粗铜作阳极,用纯铜作阴极,用含有Cu2+的溶液为电解质溶液,B不符合题意;
C.电解饱和食盐水制烧碱,用石墨作阳极,用涂镍碳钢网作阴极,C不符合题意;
D.在镀件上电镀锌,用锌作阳极,镀件作阴极,含有Zn2+的溶液为电解质溶液,D不符合题意;
故答案为:A。
【分析】A.电解时,用铜作阳极,铜会被氧化;
B.精炼铜时,纯铜作阴极,粗铜作阳极;
C.涂镍碳钢网作阴极可增强导电性;
D.电镀时镀层金属做阳极。
8.【答案】A
【解析】【解答】A.图甲,该图是中性条件,发生吸氧腐蚀,A能达到实验目的;
B.图乙,铁比铜活泼,形成原电池时,铁为负极发生氧化反应被腐蚀,故不能用此装置保护水体中的钢铁设备,B不能达到实验目的;
C.图丙,锌比铁活泼,Fe2+得电子能力比Zn2+强,则在阴极上,Fe2+得电子生成铁单质,无法在铁电极上镀锌,应使用硫酸锌做电解液,C不能达到实验目的;
D.图丁,缺少环形玻璃搅拌棒,D不能达到实验目的;
故答案为:A。
【分析】A.在酸性条件下铁发生析氢腐蚀,在中性或碱性条件下发生吸氧腐蚀,
B.应该找比铁活泼的金属
C.镀锌应该是锌离子得到电子
D.需要搅拌使反应充分进行
9.【答案】A
【解析】【解答】A.电镀铜时,可以选用可溶性铜盐作电解质溶液,不一定要选用氯化铜溶液,故A符合题意;
B.电镀的主要目的之一是使金属增强抗腐蚀的能力,镀层金属通常是在空气或溶液里不易起变化的金属或合金,故B不符合题意;
C.电镀和精炼铜都是电解原理的应用,都是在阴极上析出金属,故C不符合题意;
D.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,故D不符合题意;
故答案为:A。
【分析】A.电镀铜时粗铜作阳极,纯铜作阴极,含铜离子的盐溶液作电解质溶液;
B.镀层金属化学性质稳定,抗腐蚀性能强;
C.电镀和电解精炼铜都是应用的电解原理;
D.电镀是在容易被腐蚀的金属上镀上不易被腐蚀的金属,隔绝空气,防止易腐蚀的金属被腐蚀。
10.【答案】C
【解析】【解答】A.根据电流的方向可知a为电解池的阳极,则用来电镀铜时,a极为纯铜,电解质溶液为CuSO4溶液,A不符合题意;
B.Fe比Cu活泼,Fe为原电池的负极,发生的总反应为:Fe+2Fe3+=3Fe2+,B不符合题意;
C.第二周期元素中O最高价为+2价,F无正价,C符合题意;
D.根据图象可知,反应物能量比生成物高,该反应为放热反应,D不符合题意;
故答案为:C。
【分析】A.电镀铜时纯铜为阳极;
B.Fe为负极,正极反应物为Fe3+;
C.O最高价为+2价,F无正价;
D.放热反应中反应物能量比生成物高;
11.【答案】D
【解析】【解答】A.该实验只能证明葡萄糖分子中含有醛基,但不能证明其与甲醛、乙醛等互为同系物,A不符合题意;
B.步骤Ⅰ中,AgNO3与氨水反应生成AgOH和NH4NO3,AgOH再溶于氨水生成Ag(NH3)2OH,所以溶液中不存在大量的Ag+,B不符合题意;
C.步骤Ⅱ中,若使用酒精灯直接加热,则反应速率过快,生成的银在试管内壁附着不均匀,且易脱落,C不符合题意;
D.银能与硝酸反应从而发生溶解,所以可用硝酸洗涤容器壁上的银,D符合题意;
故答案为:D。
【分析】A.结构相似,在分子组成上相差一个或n个CH2的化合物互为同系物;
B.向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水至沉淀恰好完全溶解,得到氢氧化二铵和银络合物;
C.银镜反应要水浴加热。
12.【答案】A
【解析】【解答】电离是自发过程,电镀、电治金和电解饱和食盐水需要在通电条件下才能实现,
故答案为:A。
【分析】电离是指电解质溶解于水或受热熔化,离解成可自由移动的离子的过程。电镀、电治金和电解饱和食盐水均为电解法,需要通电。
13.【答案】A
【解析】【解答】A.该反应是放热反应,温度升高,平衡逆向移动,生成物的物质的量浓度减小,反应物的物质的量浓度增大,平衡常数随着温度的升高而减小,故A符合题意
B.pH增大,c(H+)减小,平衡向正反应方向移动,重铬酸根离子转化率增大,故B不符合题意
C.温度升高,正逆反应速率增大,故C不符合题意
D.增大反应物Pb2+的物质的量浓度,平衡正向移动,另一反应物重铬酸根离子的物质的量减小,故D不符合题意
故答案为:A
【分析】根据反应方程式 ΔH< 0 ,温度升高正逆速率均增大,且平衡逆向移动,因此平衡常数减小,当pH增大时促进正反应的发生,导致平衡右移,增加铅离子的浓度重铬酸根转化率增大,浓度降低
14.【答案】C
【解析】【解答】A.CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(绿色)+4H2O,加热2mL0.5mol·L 1CuCl2溶液,促进平衡正向移动,溶液颜色变为绿色,A不符合题意;
B.与正极相连的为阳极,阳极失电子;电镀实验中,错将铁制镀件与电源的正极相连,铁制镀件失电子生成亚铁离子,铁制镀件溶解,B不符合题意;
C.向NaOH溶液中加入适量饱和FeCl3溶液,加热制得的为氢氧化铁沉淀,不是氢氧化铁胶体,C符合题意;
D.向CH3COOH溶液中滴加适量Na2CO3溶液,出现无色气泡,说明醋酸的酸性比碳酸强,Ka(CH3COOH)>Ka1(H2CO3),D不符合题意;
故答案为:C。
【分析】A.升高温度[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(绿色)+4H2O的平衡正向移动;
B.电镀实验中,将铁制镀件与电源的正极相连,铁制镀件失电子生成亚铁离子,铁制镀件溶解;
D.电离平衡常数越大,酸性越强。
15.【答案】C
【解析】【解答】A. 电解精炼铜时,阳极为粗铜,其中的铁、锌等杂质金属也会失去电子,因此通过2 mol e-,阳极溶解铜的质量不一定为64 g,A不符合题意;
B. 电解精炼铜时,粗铜作阳极,其中的铁、锌等杂质金属也会失去电子,不活泼的金属沉淀下来成为阳极泥,故阳极泥中可提取金、银等比铜不活泼金属,B不符合题意;
C. 在铁制器皿上镀铝,铁制器皿放在阴极,铝作阳极,熔融氧化铝作电解质,C符合题意;
D. 电镀过程中电镀液的浓度几乎不变,因此不需要经常更换电镀液,D不符合题意;
故答案为:C。
【分析】A.注意阳极失去电子的有多种物质;
B.电解精炼铜时,粗铜作阳极,其中不活泼的金属不会放电,沉淀下来成为阳极泥;
C.镀层金属做阳极,镀件做阴极;
D.电镀过程电解质几乎不消耗。
16.【答案】(1)Al2O3+2OH-=2+H2O;烧杯;量筒
(2)正;2Al-6e-+3H2O=Al2O3+6H+、Al2O3+6H+=Al3++3H2O;电流不变时,氧化膜覆盖阳极表面,电阻增大
(3)2Al++14H+=2Cr3++2Al3++7H2O
(4)19.6
【解析】【解答】(1)铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,即Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2+H2O,用浓硝酸配制一定量的10%(质量分数)的HNO3溶液,需要的实验步骤为:计算、量取、稀释、装瓶,需要用到的玻璃仪器有量筒、烧杯、玻璃棒和胶头滴管,故答案为:Al2O3+2OH-=2+H2O;量筒;烧杯;
(2)本电解的目的是将铝片电解氧化生成致密的氧化物保护膜,电解池中阳极发生氧化反应,则其中铝片接电源正极,产生氧化膜的电极反应式为氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙即生成有Al2O3保护膜,同时又被生成的H+消耗掉一部分Al2O3,从而形成多孔层产生空隙,该过程的离子反应方程式为2Al-6e-+3H2O=Al2O3+6H+、Al2O3+6H+=Al3++3H2O,随着电解的进行氧化膜覆盖阳极表面厚度加厚,电阻增大,则为了保持电流不变,则A阶段电压需逐渐增大,故答案为:正;2Al-6e-+3H2O=Al2O3+6H+、Al2O3+6H+=Al3++3H2O;电流不变时,氧化膜覆盖阳极表面,电阻增大;
(3)该变色反应即K2Cr2O7转化为了Cr3+,被还原,即Al参与该反应转化为Al3+,根据氧化还原反应配平可得,该反应的离子方程式为:2Al++14H+=2Cr3++2Al3++7H2O,故答案为:2Al++14H+=2Cr3++2Al3++7H2O;
(4)由题干可知,氧化膜的质量为:0.7654g-0.7442g=0.0212g,则氧化膜的体积为:=0.00785cm3,则氧化膜的厚度为:=0.00196cm=19.6um,故答案为:19.6。
【分析】(2)在铝表面电镀氧化膜,所以铝做正极,电压增大是由于生成氧化膜,导致电阻增大,电压增大
(3)利用重铬酸根与铝发生反应,出现显色时间越晚,说明氧化膜耐腐蚀性越好
17.【答案】(1)CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) kJ mol
(2)
(3)正;;基本保持不变
(4)负;
(5)
【解析】【解答】(1)燃烧热是1mol可燃物完全燃烧生成指定氧化物放出的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) kJ mol;
(2)给热化学方程式编号:① kJ/mol;② kJ/mol;根据盖斯定律,②2-①得,即热化学方程式为;
(3)铁片镀铜实验中,铜片作阳极,与电源正极相连,即b接电源的正极,电极反应式为;待镀器件铁片作阴极,与电源负极相连,即a接电源的负极,电极反应式为;由阴阳极电极反应式可知,阳极生成的与阴极消耗的的量相等,则电镀过程中基本保持不变;
(4)由装置特点可知,为得到次氯酸钠,下端电极应生成氯气,上端电极生成NaOH,氯气向上扩散与上端生成的NaOH充分接触反应生成次氯酸钠,故c为电源的负极,d为电源的正极;该发生器阴极生成NaOH,与阳极生成的氯气反应生成NaClO,电极反应式为;
(5)利用Fe3+与Cu发生的反应,反应原理为:Cu+2Fe3+=Cu2++2Fe2+,故两个电极为:Cu和石墨棒,电解质溶液分别为CuSO4和FeCl3,电极反应分别为:Cu-2e-=Cu2+、Fe3++e-=Fe2+,并用KCl盐桥形成闭合回路,电池工作一段时间后的现象为CuSO4溶液蓝色加深,FeCl3溶液黄色变浅,甚至转化为浅绿色,铜片质量减少,根据电子的流向可知,右侧电极为铜电极,作负极,左侧电极为石墨电极,作正极,故原电池装置图为:,补全该电化学装置如图,四个括号中分别为:石墨棒、溶液、铜棒、溶液。
【分析】(1)燃烧热是101kP时,1mol可燃物完全燃烧生成稳定产物时的反应热;
(2)根据盖斯定律;
(3)依据电镀时,镀层作阳极,镀件作阴极,含镀层阳离子的溶液作电镀液判断。电镀也叫“金属搬家”;
(4)电解池中,与电源正极相连的电极是阳极,阳极失电子,发生氧化反应,与电源负极相连的电极是阴极,阴极上得电子,发生还原反应;
(5)原电池的构成条件是有活动性不同的两种金属(或一种是非金属)、有电解质溶液、形成闭合回路,必须是自发的氧化还原反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.5 实验活动4 简单的电镀实验 同步练习(含解析)
一、单选题
1.我国现行流通的货币主要为第五套人民币,其中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做()
A.阴极 B.阳极 C.正极 D.负极
2.化学概念的理解需要从本质上进行分析,否则易产生不符合题意。下列有关“电”概念中,不需要通电即可进行的是( )
A.电泳 B.电离 C.电镀 D.电解
3.下列描述中,不符合生产实际的是( )
A.电解饱和食盐H2O制烧碱,用离子交换膜将阳极室与阴极室隔开
B.电解熔融的AlCl3制取金属铝,用石墨作阳极
C.电解法精炼粗铜,用纯铜作阴极
D.在Fe上镀银,用银作阳极
4.下列叙述不正确的是( )
A.NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成、
B.电解、电离、电镀均需要通电才可进行
C.CO2、N2O5、SO2均为酸性氧化物
D.水玻璃、淀粉溶液、胶体均为混合物
5.关于下列各装置图的叙述中,不正确的是( )
A.装置①中电镀铜,a极为纯铜,b极为锌,电解质溶液为CuSO4溶液
B.装置②为原电池,总反应是:Fe+2Fe3+=3Fe2+
C.图③所示柱状图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
6.欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Fe和AgNO3溶液 D.Pt和Ag2SO4溶液
7.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铜作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
8.下列各图所示装置能达到实验目的的是( )
A.图甲,验证铁的吸氧腐蚀 B.图乙,保护水体中的钢铁设备
C.图丙,在铁制品表面镀锌 D.图丁,测定中和热
9.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法。下列叙述错误的是( )
A.电镀铜时,只能选用氯化铜溶液作电解质溶液
B.镀层金属通常是在空气或溶液里不易起变化的金属或合金
C.电镀的方法可以应用在铜的精炼上
D.电镀的主要目的之一是使金属增强抗腐蚀的能力
10.关于下列各装置图的叙述中,错误的是( )
A.装置①中电镀铜,a极为纯铜,b极为锌,电解质溶液为CuSO4溶液
B.装置②为原电池,总反应是:Fe+2Fe3+=3Fe2+
C.图③所示柱状图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
11.化学法镀银的过程如下:
Ⅰ.向容器中加入一定量2%AgNO3溶液,边振荡边滴加2%氨水至沉淀恰好完全溶解;
Ⅱ.加入10%葡萄糖溶液至充满容器,在60~70℃水浴中加热,片刻后容器内壁便镀上一层银。
下列说法正确的是( )
A.该实验证明葡萄糖与甲醛、乙醛等互为同系物
B.步骤Ⅰ后的溶液中大量存在Ag+、和
C.步骤Ⅱ可使用酒精灯直接加热以加快银的析出
D.可用硝酸洗涤除去容器壁上的银
12.下列过程不需要通电就能够实现的是
A.电离 B.电镀
C.电治金 D.电解饱和食盐水
13.电镀废液中 可通过下列反应转化成铬黄 : ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
A. B.
C. D.
14.下列有关实验的说法错误的是( )
A.加热2 mL 0.5 mol·L 1 CuCl2溶液,溶液颜色变为绿色
B.电镀实验中,错将铁制镀件与电源的正极相连,铁制镀件溶解
C.向NaOH溶液中加入适量饱和FeCl3溶液,加热制得Fe(OH)3胶体
D.向CH3COOH溶液中滴加适量Na2CO3溶液,出现无色气泡,说明Ka(CH3COOH)>Ka1(H2CO3)
15.下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2mole-,阳极溶解64g铜
B.可从阳极泥中提取金、银、锌等金属
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液需要不断更换
二、实验探究题
16.铝的阳极氧化是一种重要的表面处理技术,其原理是用电化学方法处理铝件表面,优化氧化膜结构,增强铝件的抗腐蚀性,同时便于表面着色。取铝片模拟该实验,并测定氧化膜厚度,操作步骤如下:
(1)铝片预处理
铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为: ;再用10%(质量分数)的HNO3溶液对铝片表面进行化学抛光。若取一定体积68%(质量分数)的浓硝酸配制该化学抛光液,需要用到的玻璃仪器有 、 、玻璃棒和胶头滴管。
(2)电解氧化
取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源 极,产生氧化膜的电极反应式为氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙的离子反应方程式为 ,A阶段电压逐渐增大的原因是 。
(3)氧化膜质量检验
取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式: 。
(4)氧化膜厚度测定
①取氧化完毕的铝片,测得表面积为4.0cm2,洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3,可以计算得出氧化膜厚度为 μm(1μm=1×10-4cm)。
三、综合题
17.请按要求回答下列问题:
(1)甲烷的标准燃烧热为kJ mol,则表示甲烷燃烧热的热化学方程式: 。
(2) kJ/mol
kJ/mol
写出与反应生成和水蒸气的热化学反应方程式 。
(3)铁片镀铜实验中(装置如图所示),b接电源的 极,铁片上发生的电极反应式为 。电镀过程中 (填“变大”、“变小”或“基本保持不变”)。
(4)新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的 极;该发生器阴极电极反应式为 。
(5)如图装置利用与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图 。(供选择的实验用品为:石墨棒、铜棒、溶液、溶液)
答案解析部分
1.【答案】A
【解析】【解答】钢芯镀镍时,根据电镀原理,镀件钢芯作阴极,镀层金属镍作阳极。
故答案为:A。
【分析】在电镀过程中要保证镀件被保护,镀层金属参加反应,在电解池中阴极被保护,阳极参与反应。
2.【答案】B
【解析】【解答】A.带电颗粒在电场作用下,向着与其电性相反的电极移动,称为电泳,故A不选;
B.电离是指电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程,不需要通电,故B选;
C.电镀就是利用电解原理在某些金属表面上镀上一薄层其它金属或合金的过程,故C不选;
D.电解是将电流通过电解质溶液或熔融态电解质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,故D不选;
故答案为:B。
【分析】电镀和电解是电解池原理,需要通电。而电离和电化学腐蚀不需要通电。
3.【答案】B
【解析】【解答】A.电解饱和食盐H2O制烧碱,阳极室产生氯气,阴极室得到氢气,防止出现事故,则用离子交换膜将阳极室与阴极室隔开,A符合实际生产;
B.AlCl3为共价化合物,通常用电解熔融的氧化铝制取金属铝,用石墨作阳极,B不符合实际生产;
C.电解法精炼粗铜,粗铜作阳极失电子生成铜离子,用纯铜作阴极,溶液中的铜离子得电子生成单质铜,C符合实际生产;
D.在Fe上镀银,Fe作阴极,溶液中的银离子得电子生成银,用银作阳极,银失电子生成银离子,D符合实际生产;
故答案为:B。
【分析】A.电解饱和食盐水时负极产生氢气,H2易燃易爆,采用离子交换膜进行隔离;
B.AlCl3不导电,无法电离;
C.电解精炼铜时粗铜做阳极,纯铜在阴极析出;
D.电镀时镀层金属做阳极;
4.【答案】B
【解析】【解答】A.Na2CO3与CO2、H2O反应生成NaHCO3 , Fe(OH)2、O2、H2O生成Fe(OH)3 , FeCl3与Fe反应生成FeCl2 , 所以NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成,故A不符合题意;
B.电离是指电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程;电解时将电流通过电解质溶液或熔融态电解质(电解液),在阴极和阳极上引起氧化还原反应的过程;电镀就是利用电解原理在某些金属表面上镀上一薄层其它金属或合金的过程,电离不需要通电,电解、电镀需要通电,故B符合题意;
C.和碱反应生成盐和水的氧化物属于酸性氧化物,CO2、N2O5、SO2均为酸性氧化物,故C不符合题意;
D.水玻璃是硅酸钠的水溶液,为混合物,淀粉溶液、胶体均含有两种物质,均为混合物,故D不符合题意;
故答案为:B。
【分析】A.两种或两种以上的物质发生反应生成一种物质的反应为化合反应;
B.电离是指电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程,电解时将电流通过电解质溶液或熔融态电解质(电解液),在阴极和阳极上引起氧化还原反应的过程,电镀是电解的应用;
C.和碱反应生成盐和水的氧化物属于酸性氧化物;
D.不同物质组成的为混合物,同种物质组成的为纯净物。
5.【答案】C
【解析】【解答】A.根据电流的方向可知a为电解池的阳极,则用来电镀铜时,a极为纯铜,电解质溶液为CuSO4溶液,A不符合题意;
B.Fe比Cu活泼,Fe为原电池的负极,发生的总反应为:Fe+2Fe3+=3Fe2+ , B不符合题意;
C.第二周期元素中O最高价为+2价,F无正价,C符合题意;
D.根据图象可知,反应物能量比生成物高,该反应为放热反应,D不符合题意;
故答案为:C。
【分析】A.根据电流的方向判断电源的正负极,精炼铜时粗铜做阳极;
B.铁比铜活泼,Fe为原电池的负极;
C.O、F元素无正价;
D.反应物能量比生成物高,反应放热。
6.【答案】B
【解析】【解答】欲在金属表面镀银,应把镀件挂在电镀池的阴极;选用的阳极金属为镀层金属,所以用银作阳极;电镀液应含有镀层金属离子,所以电镀液可以是AgNO3溶液,AgCl不溶于水,
故答案为:B。
【分析】欲在金属表面镀银,则阳极应为Ag,所用电解质溶液应为AgNO3溶液。
7.【答案】A
【解析】【解答】A.电解熔融的氧化铝制取金属铝,应该用惰性电极石墨作阳极,A符合题意;
B.电解法精炼粗铜,用粗铜作阳极,用纯铜作阴极,用含有Cu2+的溶液为电解质溶液,B不符合题意;
C.电解饱和食盐水制烧碱,用石墨作阳极,用涂镍碳钢网作阴极,C不符合题意;
D.在镀件上电镀锌,用锌作阳极,镀件作阴极,含有Zn2+的溶液为电解质溶液,D不符合题意;
故答案为:A。
【分析】A.电解时,用铜作阳极,铜会被氧化;
B.精炼铜时,纯铜作阴极,粗铜作阳极;
C.涂镍碳钢网作阴极可增强导电性;
D.电镀时镀层金属做阳极。
8.【答案】A
【解析】【解答】A.图甲,该图是中性条件,发生吸氧腐蚀,A能达到实验目的;
B.图乙,铁比铜活泼,形成原电池时,铁为负极发生氧化反应被腐蚀,故不能用此装置保护水体中的钢铁设备,B不能达到实验目的;
C.图丙,锌比铁活泼,Fe2+得电子能力比Zn2+强,则在阴极上,Fe2+得电子生成铁单质,无法在铁电极上镀锌,应使用硫酸锌做电解液,C不能达到实验目的;
D.图丁,缺少环形玻璃搅拌棒,D不能达到实验目的;
故答案为:A。
【分析】A.在酸性条件下铁发生析氢腐蚀,在中性或碱性条件下发生吸氧腐蚀,
B.应该找比铁活泼的金属
C.镀锌应该是锌离子得到电子
D.需要搅拌使反应充分进行
9.【答案】A
【解析】【解答】A.电镀铜时,可以选用可溶性铜盐作电解质溶液,不一定要选用氯化铜溶液,故A符合题意;
B.电镀的主要目的之一是使金属增强抗腐蚀的能力,镀层金属通常是在空气或溶液里不易起变化的金属或合金,故B不符合题意;
C.电镀和精炼铜都是电解原理的应用,都是在阴极上析出金属,故C不符合题意;
D.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,故D不符合题意;
故答案为:A。
【分析】A.电镀铜时粗铜作阳极,纯铜作阴极,含铜离子的盐溶液作电解质溶液;
B.镀层金属化学性质稳定,抗腐蚀性能强;
C.电镀和电解精炼铜都是应用的电解原理;
D.电镀是在容易被腐蚀的金属上镀上不易被腐蚀的金属,隔绝空气,防止易腐蚀的金属被腐蚀。
10.【答案】C
【解析】【解答】A.根据电流的方向可知a为电解池的阳极,则用来电镀铜时,a极为纯铜,电解质溶液为CuSO4溶液,A不符合题意;
B.Fe比Cu活泼,Fe为原电池的负极,发生的总反应为:Fe+2Fe3+=3Fe2+,B不符合题意;
C.第二周期元素中O最高价为+2价,F无正价,C符合题意;
D.根据图象可知,反应物能量比生成物高,该反应为放热反应,D不符合题意;
故答案为:C。
【分析】A.电镀铜时纯铜为阳极;
B.Fe为负极,正极反应物为Fe3+;
C.O最高价为+2价,F无正价;
D.放热反应中反应物能量比生成物高;
11.【答案】D
【解析】【解答】A.该实验只能证明葡萄糖分子中含有醛基,但不能证明其与甲醛、乙醛等互为同系物,A不符合题意;
B.步骤Ⅰ中,AgNO3与氨水反应生成AgOH和NH4NO3,AgOH再溶于氨水生成Ag(NH3)2OH,所以溶液中不存在大量的Ag+,B不符合题意;
C.步骤Ⅱ中,若使用酒精灯直接加热,则反应速率过快,生成的银在试管内壁附着不均匀,且易脱落,C不符合题意;
D.银能与硝酸反应从而发生溶解,所以可用硝酸洗涤容器壁上的银,D符合题意;
故答案为:D。
【分析】A.结构相似,在分子组成上相差一个或n个CH2的化合物互为同系物;
B.向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水至沉淀恰好完全溶解,得到氢氧化二铵和银络合物;
C.银镜反应要水浴加热。
12.【答案】A
【解析】【解答】电离是自发过程,电镀、电治金和电解饱和食盐水需要在通电条件下才能实现,
故答案为:A。
【分析】电离是指电解质溶解于水或受热熔化,离解成可自由移动的离子的过程。电镀、电治金和电解饱和食盐水均为电解法,需要通电。
13.【答案】A
【解析】【解答】A.该反应是放热反应,温度升高,平衡逆向移动,生成物的物质的量浓度减小,反应物的物质的量浓度增大,平衡常数随着温度的升高而减小,故A符合题意
B.pH增大,c(H+)减小,平衡向正反应方向移动,重铬酸根离子转化率增大,故B不符合题意
C.温度升高,正逆反应速率增大,故C不符合题意
D.增大反应物Pb2+的物质的量浓度,平衡正向移动,另一反应物重铬酸根离子的物质的量减小,故D不符合题意
故答案为:A
【分析】根据反应方程式 ΔH< 0 ,温度升高正逆速率均增大,且平衡逆向移动,因此平衡常数减小,当pH增大时促进正反应的发生,导致平衡右移,增加铅离子的浓度重铬酸根转化率增大,浓度降低
14.【答案】C
【解析】【解答】A.CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(绿色)+4H2O,加热2mL0.5mol·L 1CuCl2溶液,促进平衡正向移动,溶液颜色变为绿色,A不符合题意;
B.与正极相连的为阳极,阳极失电子;电镀实验中,错将铁制镀件与电源的正极相连,铁制镀件失电子生成亚铁离子,铁制镀件溶解,B不符合题意;
C.向NaOH溶液中加入适量饱和FeCl3溶液,加热制得的为氢氧化铁沉淀,不是氢氧化铁胶体,C符合题意;
D.向CH3COOH溶液中滴加适量Na2CO3溶液,出现无色气泡,说明醋酸的酸性比碳酸强,Ka(CH3COOH)>Ka1(H2CO3),D不符合题意;
故答案为:C。
【分析】A.升高温度[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(绿色)+4H2O的平衡正向移动;
B.电镀实验中,将铁制镀件与电源的正极相连,铁制镀件失电子生成亚铁离子,铁制镀件溶解;
D.电离平衡常数越大,酸性越强。
15.【答案】C
【解析】【解答】A. 电解精炼铜时,阳极为粗铜,其中的铁、锌等杂质金属也会失去电子,因此通过2 mol e-,阳极溶解铜的质量不一定为64 g,A不符合题意;
B. 电解精炼铜时,粗铜作阳极,其中的铁、锌等杂质金属也会失去电子,不活泼的金属沉淀下来成为阳极泥,故阳极泥中可提取金、银等比铜不活泼金属,B不符合题意;
C. 在铁制器皿上镀铝,铁制器皿放在阴极,铝作阳极,熔融氧化铝作电解质,C符合题意;
D. 电镀过程中电镀液的浓度几乎不变,因此不需要经常更换电镀液,D不符合题意;
故答案为:C。
【分析】A.注意阳极失去电子的有多种物质;
B.电解精炼铜时,粗铜作阳极,其中不活泼的金属不会放电,沉淀下来成为阳极泥;
C.镀层金属做阳极,镀件做阴极;
D.电镀过程电解质几乎不消耗。
16.【答案】(1)Al2O3+2OH-=2+H2O;烧杯;量筒
(2)正;2Al-6e-+3H2O=Al2O3+6H+、Al2O3+6H+=Al3++3H2O;电流不变时,氧化膜覆盖阳极表面,电阻增大
(3)2Al++14H+=2Cr3++2Al3++7H2O
(4)19.6
【解析】【解答】(1)铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,即Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2+H2O,用浓硝酸配制一定量的10%(质量分数)的HNO3溶液,需要的实验步骤为:计算、量取、稀释、装瓶,需要用到的玻璃仪器有量筒、烧杯、玻璃棒和胶头滴管,故答案为:Al2O3+2OH-=2+H2O;量筒;烧杯;
(2)本电解的目的是将铝片电解氧化生成致密的氧化物保护膜,电解池中阳极发生氧化反应,则其中铝片接电源正极,产生氧化膜的电极反应式为氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙即生成有Al2O3保护膜,同时又被生成的H+消耗掉一部分Al2O3,从而形成多孔层产生空隙,该过程的离子反应方程式为2Al-6e-+3H2O=Al2O3+6H+、Al2O3+6H+=Al3++3H2O,随着电解的进行氧化膜覆盖阳极表面厚度加厚,电阻增大,则为了保持电流不变,则A阶段电压需逐渐增大,故答案为:正;2Al-6e-+3H2O=Al2O3+6H+、Al2O3+6H+=Al3++3H2O;电流不变时,氧化膜覆盖阳极表面,电阻增大;
(3)该变色反应即K2Cr2O7转化为了Cr3+,被还原,即Al参与该反应转化为Al3+,根据氧化还原反应配平可得,该反应的离子方程式为:2Al++14H+=2Cr3++2Al3++7H2O,故答案为:2Al++14H+=2Cr3++2Al3++7H2O;
(4)由题干可知,氧化膜的质量为:0.7654g-0.7442g=0.0212g,则氧化膜的体积为:=0.00785cm3,则氧化膜的厚度为:=0.00196cm=19.6um,故答案为:19.6。
【分析】(2)在铝表面电镀氧化膜,所以铝做正极,电压增大是由于生成氧化膜,导致电阻增大,电压增大
(3)利用重铬酸根与铝发生反应,出现显色时间越晚,说明氧化膜耐腐蚀性越好
17.【答案】(1)CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) kJ mol
(2)
(3)正;;基本保持不变
(4)负;
(5)
【解析】【解答】(1)燃烧热是1mol可燃物完全燃烧生成指定氧化物放出的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) kJ mol;
(2)给热化学方程式编号:① kJ/mol;② kJ/mol;根据盖斯定律,②2-①得,即热化学方程式为;
(3)铁片镀铜实验中,铜片作阳极,与电源正极相连,即b接电源的正极,电极反应式为;待镀器件铁片作阴极,与电源负极相连,即a接电源的负极,电极反应式为;由阴阳极电极反应式可知,阳极生成的与阴极消耗的的量相等,则电镀过程中基本保持不变;
(4)由装置特点可知,为得到次氯酸钠,下端电极应生成氯气,上端电极生成NaOH,氯气向上扩散与上端生成的NaOH充分接触反应生成次氯酸钠,故c为电源的负极,d为电源的正极;该发生器阴极生成NaOH,与阳极生成的氯气反应生成NaClO,电极反应式为;
(5)利用Fe3+与Cu发生的反应,反应原理为:Cu+2Fe3+=Cu2++2Fe2+,故两个电极为:Cu和石墨棒,电解质溶液分别为CuSO4和FeCl3,电极反应分别为:Cu-2e-=Cu2+、Fe3++e-=Fe2+,并用KCl盐桥形成闭合回路,电池工作一段时间后的现象为CuSO4溶液蓝色加深,FeCl3溶液黄色变浅,甚至转化为浅绿色,铜片质量减少,根据电子的流向可知,右侧电极为铜电极,作负极,左侧电极为石墨电极,作正极,故原电池装置图为:,补全该电化学装置如图,四个括号中分别为:石墨棒、溶液、铜棒、溶液。
【分析】(1)燃烧热是101kP时,1mol可燃物完全燃烧生成稳定产物时的反应热;
(2)根据盖斯定律;
(3)依据电镀时,镀层作阳极,镀件作阴极,含镀层阳离子的溶液作电镀液判断。电镀也叫“金属搬家”;
(4)电解池中,与电源正极相连的电极是阳极,阳极失电子,发生氧化反应,与电源负极相连的电极是阴极,阴极上得电子,发生还原反应;
(5)原电池的构成条件是有活动性不同的两种金属(或一种是非金属)、有电解质溶液、形成闭合回路,必须是自发的氧化还原反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
