4.1 原子结构与元素周期表 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1 原子结构与元素周期表 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 93.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 00:00:00 | ||
图片预览


文档简介
4.1 原子结构与元素周期表 同步练习题
一、选择题
1.参阅下列有关元素E两种同位素的资料
同位素 同位素相对原子质量 原子个数的百分率
103 20%
105 80%
元素E的相对原子质量是
A.103.4 B.103.6 C.104.0 D.104.6
2.科学家以铬离子撞击锋靶,产生一种超重元素,可表示为:,有关说法正确的是
A.该过程属于化学变化 B.为质子
C.与互为同位素 D.属于主族元素
3.氯气是一种有强烈刺激性气味的有毒气体,易液化,溶于水可制氟水。工业上利用共与石灰乳反应制漂白粉,用浓氨水吸收残余氯气可生成。氯元素存在两种核素和,这两种核素含有不同的
A.中子数 B.电子数 C.质子数 D.核电荷数
4.钠原子与钠离子比较,相同的是
A.核外电子层数 B.最外层电子数 C.电子数 D.核电荷数
5.某些花岗岩含有放射性的氧(),会对人体造成伤害,该核素的中子数为
A.86 B.50 C.136 D.222
6.“嫦娥五号”探测器使用钚元素的同位素温差电池来提供稳定、持久的能源。下列关于的说法正确的是
A.和的质子数之差为2
B.和是两种不同的核素
C.的中子数与质子数之差为144
D.和的质量数相等
7.关于元素周期表的下列说法正确的是
A.原子序数之差为2的两种元素不可能位于同一主族
B.元素周期表中只有第二列元素原子的最外层电子数为2
C.核外有36个电子,则元素W位于第四周期IIA族
D.若某IIA族元素原子序数为x,那么IIIA族原子序数可能为
8.K35ClO3与足量的浓盐酸(H37Cl)在某温度下可发生反应:KClO3+6HCl(浓)=KCl+3C12↑+3H2O,下列说法正确的是
A.氧化产物与还原产物的物质的量之比为3:1 B.该反应生成的Cl2的平均相对分子质量约为73.3
C.该反应中HCl(浓)只体现了还原性 D.生成物KCl为食盐的主要成分
二、非选择题
9.周期:元素周期表共有 个横行,每一横行称为一个周期,故元素周期表共有 个周期
①周期序数与电子层数的关系:
②周期的分类
元素周期表中,我们把1、2、3周期称为 , 周期称为长周期。
10.现有下列5种与生产生活相关的物质:①氯化铁;②过氧化钠;③氧化铁;④;⑤碳酸氢钠。用序号填空:
(1)常用作油漆、涂料的红色颜料的是 。
(2)常用于蚀刻印刷电路铜板的“腐蚀液”的是 。
(3)考古时可用来测定文物年代的是 。
(4)在呼吸面具或潜水艇中用作供氧剂的是 。
(5)可用来治疗胃酸过多的是 。
11.下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。
(1)10种元素中,化学性质最不活泼的是 。
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是 。
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是 。
(4)元素⑦的氢化物的化学式为 ;该氢化物常温下和②单质反应的化学方程式是 ;若该氢化物和元素⑧的单质反应,则化学方程式为 。
(5)⑨的最高价氧化物对应水化物的化学式为 ;①和⑨两元素形成化合物的电子式为 ;该化合物灼烧时火焰颜色为 ;该化合物的溶液与元素⑧的单质反应的离子方程式为 。
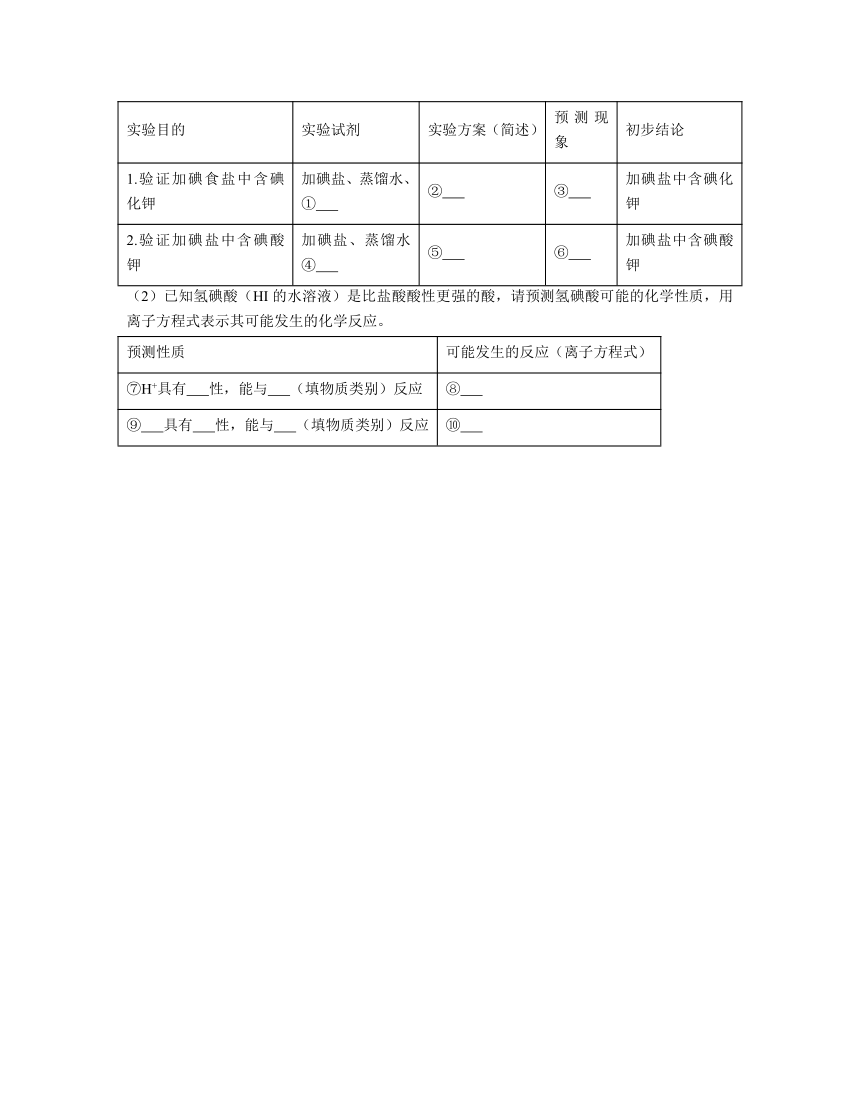
12.在食盐中加碘是预防碘缺乏症的有效方法。通常,在食盐中加碘有两种方法:一种是加入碘化钾(KI),另一种是加入碘酸钾(KIO3)。
(1)现有几种家中可找到的物质:月饼盒内的食品脱氧剂、食醋、食用淀粉、84消毒液,请设计实验方案验证某种含碘盐中加入的是碘化钾还是碘酸钾。根据实验目的和初步结论,推理完成表格的填空。
实验目的 实验试剂 实验方案(简述) 预测现象 初步结论
1.验证加碘食盐中含碘化钾 加碘盐、蒸馏水、 ① ② ③ 加碘盐中含碘化钾
2.验证加碘盐中含碘酸钾 加碘盐、蒸馏水④ ⑤ ⑥ 加碘盐中含碘酸钾
(2)已知氢碘酸(HI的水溶液)是比盐酸酸性更强的酸,请预测氢碘酸可能的化学性质,用离子方程式表示其可能发生的化学反应。
预测性质 可能发生的反应(离子方程式)
⑦H+具有 性,能与 (填物质类别)反应 ⑧
⑨ 具有 性,能与 (填物质类别)反应 ⑩
【参考答案】
一、选择题
1.D
解析:根据元素相对原子质量的计算公式可知元素E的相对原子质量=10320%+10580%=104.6,故选D。
2.C
解析:A.属于物理变化,A错误;
B.电荷数为0,质量数为1,为中子,B错误;
C.与质子数相同、中子数不同,互为同位素,C正确;
D.位于第七周期0族,不属于主族元素,D错误;
故选C。
3.A
解析:A.原子中核内质子数等于核外电子数等于原子序数,和质子数均为17,又原子中质量数等于质子数加上中子数,所以二者中子数分别为18和20,二者中子数不同,A正确;
B.原子中核内质子数等于核外电子数等于原子序数,所以和电子数均为17,B错误;
C.原子中核内质子数等于核外电子数等于原子序数,所以和质子数均为17,C错误;
D.原子中核电荷数等于原子序数,所以和核电荷数均为17,D错误;
故选A。
4.D
解析:A.钠原子核外电子层数为3,钠离子核外电子层数为2,A错误;
B.钠原子最外层电子数为1,钠离子最外层电子数为8,B错误;
C.钠原子电子数为11,钠离子电子数为10,C错误;
D.钠原子与钠离子的核电荷数均为11,D正确;
答案选D。
5.C
解析:中质子数为86,质量数为222,中子数=质量数-质子数=222-86=136;
答案选C。
6.B
【分析】的质子数为94,质量数为238,所以中子数=质量数-质子数=238-94=144,据此分析解答。
解析:A.和的质子数均为94,A错误;
B.和是质子数相同,中子数不同的两种不同的核素,B正确;
C.根据上述分析可知,的中子数与质子数之差为144-94=50,C错误;
D.和的质量数分别为238和240,D错误;
故选B。
7.D
解析:A.H、Li元素位于同一主族,故A错误;
B.0族的氦元素原子的最外层电子数为2,故B错误;
C.核外有36个电子,则元素W原子为38个电子,为38号元素锶元素,位于第五周期IIA族,故C错误;
D.若某IIA族元素原子序数为x,若为第六、第七周期的元素,则IIIA族原子序数可能为,故D正确;
故选D。
8.B
解析:A.反应中氯酸钾中氯元素化合价降低为氧化剂,发生还原反应生成氯气,HCl中氯元素化合价升高为还原剂,发生氧化反应生成氯气;3分子氯气中有1原子氯为还原产物、5原子氯为氧化产物,故氧化产物与还原产物的物质的量之比为5:1,A错误;
B.由A分析可知,该反应生成的Cl2的平均相对分子质量约为,B正确;
C.该反应中HCl(浓)和盐生成水,也体现了酸性,C错误;
D.食盐为氯化钠,生成物KCl不为食盐的主要成分,D错误;
故选B。
二、非选择题
9. 七 七 周期序数=核外电子层数 短周期 4、5、6、7
解析:周期:元素周期表共有七个横行,每一横行称为一个周期,故元素周期表共有七个周期;
①周期序数与电子层数的关系:周期序数=核外电子层数,原子有几个电子层就处于第几周期;
②元素周期表中,我们把1、2、3周期称为短周期,4、5、6、7周期称为长周期。
10.(1)③ (2)① (3)④ (4)② (5)⑤
解析:(1)氧化铁为红褐色固体,常用作油漆、涂料的红色颜料,故选③;
(2)氯化铁具有氧化性,能和铜生成氯化铜和氯化亚铁,常用于蚀刻印刷电路铜板的“腐蚀液”,故选①;
(3)在考古时可用来测定文物年代,故选④;
(4)过氧化钠能和水或二氧化碳生成氧气,故在呼吸面具或潜水艇中用作供氧剂,故选②;
(5)碳酸氢钠能和胃酸中盐酸反应,可用来治疗胃酸过多,故选⑤。
11.Ar NaOH H2O HBrO4 黄色
【分析】由元素在元素周期表位置可知,①为Na元素,②为K元素,③为Mg元素,④为Ca元素,⑤为Al元素,⑥为C元素,⑦为O元素,⑧为Cl元素,⑨为Br元素,⑩为Ar元素。
解析:(1)稀有气体Ar原子核外电子结构稳定,所以Ar的化学性质最不活泼;
(2)金属性:Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:;
(4)元素⑦的氢化物可以和K、Cl2反应,则该氢化物为H2O,常温下和K反应生成KOH和H2,化学方程式为:;H2O和Cl2反应生成HCl和HClO,化学方程式为:;
(5)Br元素的最高价氧化物对应水化物为HBrO4;Na元素和Br元素形成的化合物为NaBr,是离子化合物,电子式为;NaBr中含有Na元素,焰色反应为黄色;NaBr溶液和Cl2反应生成NaCl和Br2,离子方程式为:。
12.食用淀粉、84消毒液、食醋 往加碘盐溶液中加入几滴淀粉溶液,再加入食醋酸化的84消毒液 无色溶液变蓝色 食品脱氧剂、食醋 往醋酸亚铁溶液中加入足量的加碘盐溶液 产生黄色溶液 酸或氧化 碱/碱性氧化物或还原剂/活泼金属单质 2H++Cu(OH)2=Cu2++2H2O/2H++CuO=Cu2++H2O或Fe+2H+=Fe2++H2↑ I- 还原 氧化剂 2I-+2H++H2O2=2H2O+I2
解析:(1)1.食盐中含有碘化钾,需生成碘,用淀粉溶液验证,则加入84消毒液氧化碘离子为碘单质,则缺少试剂为食用淀粉、84消毒液、食醋;实验方案为往加碘盐溶液中加入几滴淀粉溶液,再加入食醋酸化的84消毒液;生成的碘单质,遇到淀粉,淀粉显蓝色;2.碘盐中含碘酸钾,碘酸钾具有氧化性,需加入还原剂,则缺少试剂为食品脱氧剂、食醋;实验方案为往醋酸亚铁溶液中加入足量的加碘盐溶液;亚铁离子变为铁离子,现象为产生黄色溶液;
(2)H+具有酸性,能与碱或碱性氧化物或金属反应;可能发生的反应为2H++Cu(OH)2=Cu2++2H2O/2H++CuO=Cu2++H2O或Fe+2H+=Fe2++H2↑;
I-为-1价,化合价只能升高,具有还原性;能与氧化剂反应,可能发生的反应为2I-+2H++H2O2=2H2O+I2
一、选择题
1.参阅下列有关元素E两种同位素的资料
同位素 同位素相对原子质量 原子个数的百分率
103 20%
105 80%
元素E的相对原子质量是
A.103.4 B.103.6 C.104.0 D.104.6
2.科学家以铬离子撞击锋靶,产生一种超重元素,可表示为:,有关说法正确的是
A.该过程属于化学变化 B.为质子
C.与互为同位素 D.属于主族元素
3.氯气是一种有强烈刺激性气味的有毒气体,易液化,溶于水可制氟水。工业上利用共与石灰乳反应制漂白粉,用浓氨水吸收残余氯气可生成。氯元素存在两种核素和,这两种核素含有不同的
A.中子数 B.电子数 C.质子数 D.核电荷数
4.钠原子与钠离子比较,相同的是
A.核外电子层数 B.最外层电子数 C.电子数 D.核电荷数
5.某些花岗岩含有放射性的氧(),会对人体造成伤害,该核素的中子数为
A.86 B.50 C.136 D.222
6.“嫦娥五号”探测器使用钚元素的同位素温差电池来提供稳定、持久的能源。下列关于的说法正确的是
A.和的质子数之差为2
B.和是两种不同的核素
C.的中子数与质子数之差为144
D.和的质量数相等
7.关于元素周期表的下列说法正确的是
A.原子序数之差为2的两种元素不可能位于同一主族
B.元素周期表中只有第二列元素原子的最外层电子数为2
C.核外有36个电子,则元素W位于第四周期IIA族
D.若某IIA族元素原子序数为x,那么IIIA族原子序数可能为
8.K35ClO3与足量的浓盐酸(H37Cl)在某温度下可发生反应:KClO3+6HCl(浓)=KCl+3C12↑+3H2O,下列说法正确的是
A.氧化产物与还原产物的物质的量之比为3:1 B.该反应生成的Cl2的平均相对分子质量约为73.3
C.该反应中HCl(浓)只体现了还原性 D.生成物KCl为食盐的主要成分
二、非选择题
9.周期:元素周期表共有 个横行,每一横行称为一个周期,故元素周期表共有 个周期
①周期序数与电子层数的关系:
②周期的分类
元素周期表中,我们把1、2、3周期称为 , 周期称为长周期。
10.现有下列5种与生产生活相关的物质:①氯化铁;②过氧化钠;③氧化铁;④;⑤碳酸氢钠。用序号填空:
(1)常用作油漆、涂料的红色颜料的是 。
(2)常用于蚀刻印刷电路铜板的“腐蚀液”的是 。
(3)考古时可用来测定文物年代的是 。
(4)在呼吸面具或潜水艇中用作供氧剂的是 。
(5)可用来治疗胃酸过多的是 。
11.下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。
(1)10种元素中,化学性质最不活泼的是 。
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是 。
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是 。
(4)元素⑦的氢化物的化学式为 ;该氢化物常温下和②单质反应的化学方程式是 ;若该氢化物和元素⑧的单质反应,则化学方程式为 。
(5)⑨的最高价氧化物对应水化物的化学式为 ;①和⑨两元素形成化合物的电子式为 ;该化合物灼烧时火焰颜色为 ;该化合物的溶液与元素⑧的单质反应的离子方程式为 。
12.在食盐中加碘是预防碘缺乏症的有效方法。通常,在食盐中加碘有两种方法:一种是加入碘化钾(KI),另一种是加入碘酸钾(KIO3)。
(1)现有几种家中可找到的物质:月饼盒内的食品脱氧剂、食醋、食用淀粉、84消毒液,请设计实验方案验证某种含碘盐中加入的是碘化钾还是碘酸钾。根据实验目的和初步结论,推理完成表格的填空。
实验目的 实验试剂 实验方案(简述) 预测现象 初步结论
1.验证加碘食盐中含碘化钾 加碘盐、蒸馏水、 ① ② ③ 加碘盐中含碘化钾
2.验证加碘盐中含碘酸钾 加碘盐、蒸馏水④ ⑤ ⑥ 加碘盐中含碘酸钾
(2)已知氢碘酸(HI的水溶液)是比盐酸酸性更强的酸,请预测氢碘酸可能的化学性质,用离子方程式表示其可能发生的化学反应。
预测性质 可能发生的反应(离子方程式)
⑦H+具有 性,能与 (填物质类别)反应 ⑧
⑨ 具有 性,能与 (填物质类别)反应 ⑩
【参考答案】
一、选择题
1.D
解析:根据元素相对原子质量的计算公式可知元素E的相对原子质量=10320%+10580%=104.6,故选D。
2.C
解析:A.属于物理变化,A错误;
B.电荷数为0,质量数为1,为中子,B错误;
C.与质子数相同、中子数不同,互为同位素,C正确;
D.位于第七周期0族,不属于主族元素,D错误;
故选C。
3.A
解析:A.原子中核内质子数等于核外电子数等于原子序数,和质子数均为17,又原子中质量数等于质子数加上中子数,所以二者中子数分别为18和20,二者中子数不同,A正确;
B.原子中核内质子数等于核外电子数等于原子序数,所以和电子数均为17,B错误;
C.原子中核内质子数等于核外电子数等于原子序数,所以和质子数均为17,C错误;
D.原子中核电荷数等于原子序数,所以和核电荷数均为17,D错误;
故选A。
4.D
解析:A.钠原子核外电子层数为3,钠离子核外电子层数为2,A错误;
B.钠原子最外层电子数为1,钠离子最外层电子数为8,B错误;
C.钠原子电子数为11,钠离子电子数为10,C错误;
D.钠原子与钠离子的核电荷数均为11,D正确;
答案选D。
5.C
解析:中质子数为86,质量数为222,中子数=质量数-质子数=222-86=136;
答案选C。
6.B
【分析】的质子数为94,质量数为238,所以中子数=质量数-质子数=238-94=144,据此分析解答。
解析:A.和的质子数均为94,A错误;
B.和是质子数相同,中子数不同的两种不同的核素,B正确;
C.根据上述分析可知,的中子数与质子数之差为144-94=50,C错误;
D.和的质量数分别为238和240,D错误;
故选B。
7.D
解析:A.H、Li元素位于同一主族,故A错误;
B.0族的氦元素原子的最外层电子数为2,故B错误;
C.核外有36个电子,则元素W原子为38个电子,为38号元素锶元素,位于第五周期IIA族,故C错误;
D.若某IIA族元素原子序数为x,若为第六、第七周期的元素,则IIIA族原子序数可能为,故D正确;
故选D。
8.B
解析:A.反应中氯酸钾中氯元素化合价降低为氧化剂,发生还原反应生成氯气,HCl中氯元素化合价升高为还原剂,发生氧化反应生成氯气;3分子氯气中有1原子氯为还原产物、5原子氯为氧化产物,故氧化产物与还原产物的物质的量之比为5:1,A错误;
B.由A分析可知,该反应生成的Cl2的平均相对分子质量约为,B正确;
C.该反应中HCl(浓)和盐生成水,也体现了酸性,C错误;
D.食盐为氯化钠,生成物KCl不为食盐的主要成分,D错误;
故选B。
二、非选择题
9. 七 七 周期序数=核外电子层数 短周期 4、5、6、7
解析:周期:元素周期表共有七个横行,每一横行称为一个周期,故元素周期表共有七个周期;
①周期序数与电子层数的关系:周期序数=核外电子层数,原子有几个电子层就处于第几周期;
②元素周期表中,我们把1、2、3周期称为短周期,4、5、6、7周期称为长周期。
10.(1)③ (2)① (3)④ (4)② (5)⑤
解析:(1)氧化铁为红褐色固体,常用作油漆、涂料的红色颜料,故选③;
(2)氯化铁具有氧化性,能和铜生成氯化铜和氯化亚铁,常用于蚀刻印刷电路铜板的“腐蚀液”,故选①;
(3)在考古时可用来测定文物年代,故选④;
(4)过氧化钠能和水或二氧化碳生成氧气,故在呼吸面具或潜水艇中用作供氧剂,故选②;
(5)碳酸氢钠能和胃酸中盐酸反应,可用来治疗胃酸过多,故选⑤。
11.Ar NaOH H2O HBrO4 黄色
【分析】由元素在元素周期表位置可知,①为Na元素,②为K元素,③为Mg元素,④为Ca元素,⑤为Al元素,⑥为C元素,⑦为O元素,⑧为Cl元素,⑨为Br元素,⑩为Ar元素。
解析:(1)稀有气体Ar原子核外电子结构稳定,所以Ar的化学性质最不活泼;
(2)金属性:Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:;
(4)元素⑦的氢化物可以和K、Cl2反应,则该氢化物为H2O,常温下和K反应生成KOH和H2,化学方程式为:;H2O和Cl2反应生成HCl和HClO,化学方程式为:;
(5)Br元素的最高价氧化物对应水化物为HBrO4;Na元素和Br元素形成的化合物为NaBr,是离子化合物,电子式为;NaBr中含有Na元素,焰色反应为黄色;NaBr溶液和Cl2反应生成NaCl和Br2,离子方程式为:。
12.食用淀粉、84消毒液、食醋 往加碘盐溶液中加入几滴淀粉溶液,再加入食醋酸化的84消毒液 无色溶液变蓝色 食品脱氧剂、食醋 往醋酸亚铁溶液中加入足量的加碘盐溶液 产生黄色溶液 酸或氧化 碱/碱性氧化物或还原剂/活泼金属单质 2H++Cu(OH)2=Cu2++2H2O/2H++CuO=Cu2++H2O或Fe+2H+=Fe2++H2↑ I- 还原 氧化剂 2I-+2H++H2O2=2H2O+I2
解析:(1)1.食盐中含有碘化钾,需生成碘,用淀粉溶液验证,则加入84消毒液氧化碘离子为碘单质,则缺少试剂为食用淀粉、84消毒液、食醋;实验方案为往加碘盐溶液中加入几滴淀粉溶液,再加入食醋酸化的84消毒液;生成的碘单质,遇到淀粉,淀粉显蓝色;2.碘盐中含碘酸钾,碘酸钾具有氧化性,需加入还原剂,则缺少试剂为食品脱氧剂、食醋;实验方案为往醋酸亚铁溶液中加入足量的加碘盐溶液;亚铁离子变为铁离子,现象为产生黄色溶液;
(2)H+具有酸性,能与碱或碱性氧化物或金属反应;可能发生的反应为2H++Cu(OH)2=Cu2++2H2O/2H++CuO=Cu2++H2O或Fe+2H+=Fe2++H2↑;
I-为-1价,化合价只能升高,具有还原性;能与氧化剂反应,可能发生的反应为2I-+2H++H2O2=2H2O+I2
