2.1 钠及其化合物 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1 钠及其化合物 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 114.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 00:00:00 | ||
图片预览


文档简介
2.1 钠及其化合物 同步练习题
一、选择题
1.下列有关碳酸钠和碳酸氢钠的叙述正确的是
A.二者均不稳定,易分解生成气体
B.等浓度等体积二份溶液都滴入2滴酚酞,溶液颜色深
C.碳酸氢钠的溶解度大于碳酸钠
D.等质量的二种固体分别与足量盐酸反应,产生气体多
2.下列物质不能通过化合反应生成的是
A.FeCl2 B.Cu C. D.NaHCO3
3.下列物质的俗称不正确的是
A. 熟石灰 B. 苏打
C. 烧碱 D. 醋酸
4.下列关于钠的叙述中,不正确的是
A.钠燃烧时发出黄色的火焰 B.钠具有很强的还原性
C.钠燃烧时生成氧化钠 D.钠通常保存在煤油中
5.在下列实验过程中,出现的“异常”现象的解释,不正确的是
A.金属钠投入到硫酸铜溶液中,生成黑色沉淀物,是因为金属钠置换出金属铜
B.过氧化钠加入到含有酚酞的水中,溶液变红再变无色,可能有强氧化性物质生成
C.过量的二氧化碳通入澄清石灰水中,溶液变浑浊再变澄清,说明最终生成可以溶于水的盐
D.在氯化亚铁的溶液中,滴加氢氧化钠溶液,先有白色沉淀,随后变灰绿色再变红褐色,说明氢氧化亚铁易被空气中的氧气氧化
6.下列关于金属钠及其化合物的说法不正确的是
A.钠切开后,光亮的表面迅速变暗,是因为生成了Na2O
B.向饱和Na2CO3溶液中通入足量二氧化碳有碳酸氢钠晶体析出
C.石蕊试液中加入过氧化钠粉末溶液先变蓝后褪色
D.氧化钠与过氧化钠都能与水反应生成碱,因此他们都是碱性氧化物
7.表示下列反应的离子方程式错误的是
A.Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑
B.FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O
C.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH+SO+H2O
D.Cl2和水反应:Cl2+H2O=H++C1-+HClO
8.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠溶液可用于治疗胃病 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2CO3溶液中滴入酚酞变红色 纯碱(Na2CO3)是一种碱 Ⅰ对,Ⅱ对,有
C 金属钠保存在煤油中,以隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用于航天员的供氧剂 Na2O2能和CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有
A.A B.B C.C D.D
二、非选择题
9.碳酸钠(Na2CO3)
(1)碳酸钠是白色固体,俗称_______,_______于水;电离方程式_______。
(2)实验探究-Na2CO3的性质
实验 现象 结论(或化学方程式)
将澄清石灰水加入碳酸钠溶液中 _______ _______
将氯化钙溶液加入碳酸钠溶液中 _______ _______
测碳酸钠溶液pH pH_______7 碳酸钠溶液呈_______
将沾有油污的铜片放入热的碳酸钠溶液中 _______ 碳酸钠溶液具有_______能力
(3)Na2CO3溶液与酸的反应
①与足量盐酸反应:_______
②通入足量CO2:_______
10.钠:_______色,锂:_______色,钙:_______色,钡:_______色,铜:_______色,钾:_______色(观察时透过蓝色钴玻璃,防止钠焰色的干扰。)
11.将一块表面已部分被氧化成氧化纳、质量为的钠放入水中后,收集到。根据上述数据计算。
(1)金属钠表面氧化钠的质量是_______。
(2)所得溶液中的溶质质量分数是_______。
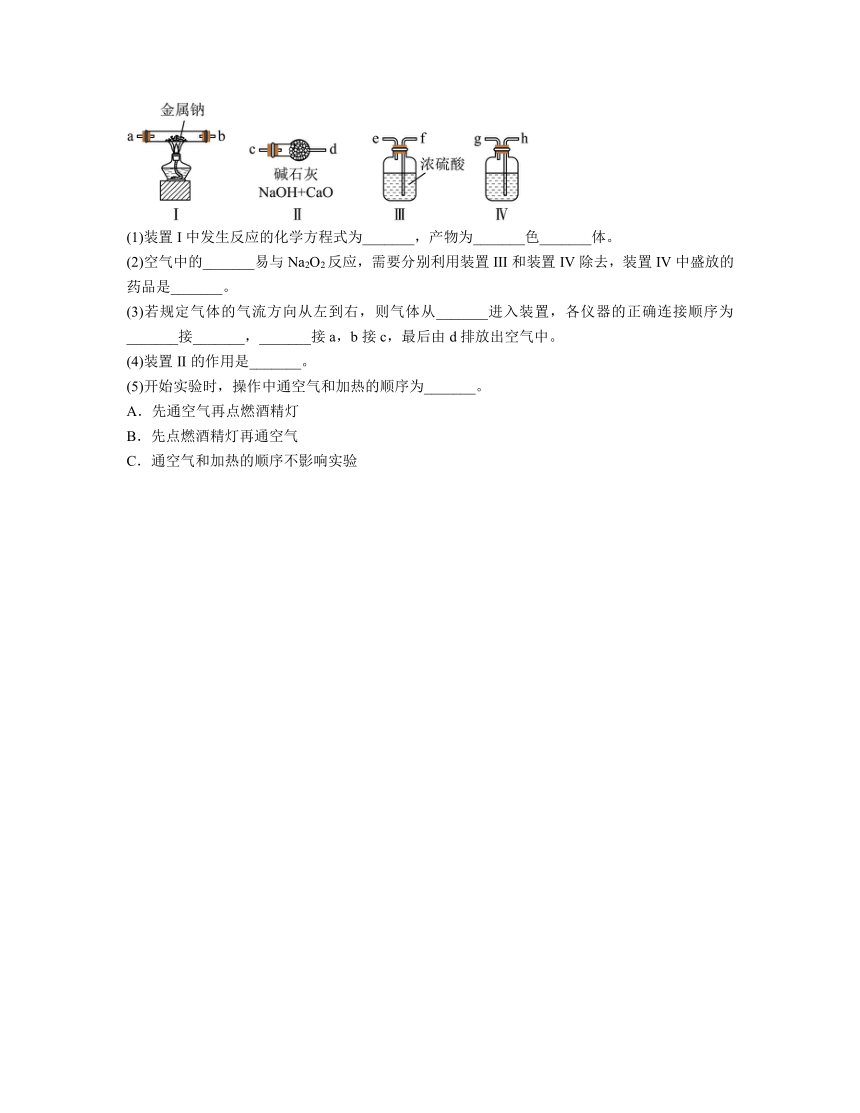
12.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下,回答下列问题:
(1)装置I中发生反应的化学方程式为_______,产物为_______色_______体。
(2)空气中的_______易与Na2O2反应,需要分别利用装置III和装置IV除去,装置IV中盛放的药品是_______。
(3)若规定气体的气流方向从左到右,则气体从_______进入装置,各仪器的正确连接顺序为_______接_______,_______接a,b接c,最后由d排放出空气中。
(4)装置II的作用是_______。
(5)开始实验时,操作中通空气和加热的顺序为_______。
A.先通空气再点燃酒精灯
B.先点燃酒精灯再通空气
C.通空气和加热的顺序不影响实验
【参考答案】
一、选择题
1.D
解析:A.加热时,碳酸氢钠分解生成碳酸钠而碳酸钠不分解,故A错误;
B.碳酸氢钠和碳酸钠都是强碱弱酸盐,水解而使其溶液都呈碱性,碳酸钠溶液的碱性更强,颜色深,故B错误;
C.常温下相同的溶剂时,Na2CO3较NaHCO3易溶,碳酸氢钠的溶解度小于碳酸钠,故C错误;
D.M(Na2CO3)=106g/mol,M(NaHCO3)=84g/mol,等质量的Na2CO3和NaHCO3,n(NaHCO3)>n(Na2CO3),与盐酸反应时,分别发生Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,则NaHCO3产生的气体多,故D正确;
故选D。
2.B
解析:A.由反应2FeCl3+Fe=3FeCl2可知,FeCl2可通过化合反应制备,A不符合题意;
B.铜为单质,不能由化合反应生成,B符合题意;
C.Fe(OH)3可由反应4Fe(OH)2+O2+2H2O=4Fe(OH)3制得,C不符合题意;
D.NaHCO3可由Na2CO3+CO2+H2O=2NaHCO3反应制得,D不符合题意;
故选B。
3.B
解析:A.Ca(OH)2的俗名是熟石灰、消石灰,A正确;
B.NaHCO3的俗名是小苏打,Na2CO3的俗名是苏打,B错误;
C.NaOH的俗名是烧碱、火碱、苛性钠,C正确;
D.CH3COOH的俗名是醋酸,D正确;
故选B。
4.C
解析:A.钠的焰色为黄色,燃烧时发出黄色火焰,A正确;
B.钠原子最外层只有1个电子,很容易失去,钠具有很强的还原性,B正确;
C.钠放在空气中与氧气反应生成氧化钠,燃烧时生成过氧化钠,C错误;
D.钠与空气中的氧气、水反应,通常保存在煤油或石蜡油中,D正确;
答案选C。
5.A
解析:A.氢氧化铜为蓝色沉淀,金属钠投入到硫酸铜溶液中,生成黑色沉淀物不是生成氢氧化铜,应为氧化铜,故A错误;
B.过氧化钠和水反应生成氢氧化钠是强碱,遇到酚酞变红色,同时生成氧气氧化有色物质为无色,所以出现溶液变红再变无色,故B正确;
C.过量二氧化碳通入澄清石灰水中反应生成碳酸钙沉淀变浑浊,后继续通入二氧化碳变澄清,生成溶于水的碳酸氢钙,说明最终生成可以溶于水的盐,故C正确;
D.氯化亚铁和氢氧化钠反应生成的氢氧化亚铁,先有白色沉淀,随后变灰绿色再变红褐色,是因为乙被空气中氧气氧化生成氢氧化铁,故D正确;
故答案选A。
【点睛】本题考查了物质性质的分析判断,主要是混合物性质和反应现象的理解应用,掌握基础是关键,题目难度中等。
6.D
解析:A.钠的性质活泼,易被氧化,光亮的表面迅速变暗,是因为生成了Na2O,A正确;
B.向饱和Na2CO3溶液中通入足量二氧化碳会生成碳酸氢钠,而碳酸氢钠的溶解度较小,故有碳酸氢钠晶体析出,B正确;
C.过氧化钠与水反应,生成氢氧化钠和氧气,氢氧化钠令紫色石蕊试液变蓝;同时,过氧化钠的强氧化性与水生成过氧化氢,过氧化氢具有强氧化性,将变蓝的石蕊试剂漂白,C正确;
D.碱性氧化物与水反应只生成盐和水,过氧化钠都能与水反应生成碱和氧气,过氧化钠不是碱性氧化物,D错误;
答案选D。
7.A
解析:A.Na2O2与水反应时,Na2O2既是氧化剂,又是还原剂,水中的氧元素不变价,O2分子中不含18O,18O应该在OH 中,正确的离子方程式为:2H218O+2Na2O2═2OH +218OH +4Na++O2↑,故A错误;
B.FeSO4酸性溶液中加入H2O2,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故B正确;
C.用过量氨水吸收工业尾气中的SO2,离子方程式为:2NH3 H2O+SO2=2++H2O,故C正确;
D.Cl2和水反应,离子方程式为:Cl2+H2O=H++Cl +HClO,故D正确;
故答案选A。
【点睛】本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确等。
8.D
解析:A.碳酸钠能够与盐酸反应,陈述Ⅱ对,但是碳酸钠碱性较强,具有腐蚀性,不能用于治疗胃酸过多,陈述I错误,A错误;
B.纯碱(Na2CO3)是一种盐,陈述Ⅱ错误,B错误;
C.常温下,金属钠在空气中会生成氧化钠,陈述Ⅱ错误,C错误;
D.Na2O2能和人体呼出的CO2、H2O反应生成O2,故可用于航天员的供氧,陈述正确,存在因果关系,D正确;
故选D。
二、非选择题
9.(1)纯碱或苏打 易溶 Na2CO3=2Na++CO
(2)产生白色沉淀 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 产生白色沉淀 CaCl2+Na2CO3=CaCO3↓+2NaCl > 碱性 铜片表面变光亮,油污消失 去污
(3) Na2CO3+2HCl=2NaCl+CO2↑+H2O Na2CO3+CO2+H2O=2NaHCO3
解析:略
10.黄 紫红 砖红 黄绿 绿 紫
解析:钠的焰色为黄色;锂的焰色为紫红色;钙的焰色为砖红色;钡的焰色为黄绿色;铜的焰色为绿色;钾的焰色为紫色。
11.(1)6.2g
(2)40%
解析:(1)收集到0.2gH2,则钠与水反应产生H2的物质的量为=0.1mol,根据2Na+2H2O=2NaOH+H2↑可知,Na的物质的量为0.2mol,质量为0.2mol×23g/mol=4.6g,则金属钠表面氧化钠的质量是10.8g-4.6g=6.2g;
(2)根据(1)可知金属钠表面氧化钠(Na2O)的物质的量为=0.1mol,Na、Na2O与水反应得到的溶液溶质均为NaOH,则根据钠原子守恒可知n(NaOH)= 0.1mol×2+0.2mol=0.4mol,溶质NaOH的质量为0.4mol×40g/mol=16g,溶液质量为10.8g+29.4g-0.2g=40g,溶质质量分数=×100%=40%。
12.(1) 淡黄 固体
(2)水蒸气、CO2 NaOH溶液
(3) h g f e
(4)防止空气中的CO2和水蒸气进入装置I
(5)A
【分析】由于Na2O2容易与CO2、H2O反应,所以要制备纯度较高的Na2O2,要防止CO2、H2O进入反应装置中,据此进行分析。
解析:(1)装置I制取Na2O2,发生反应的化学方程式为;Na2O2为淡黄色固体。
(2)空气中的CO2、H2O易与Na2O2反应,Ⅲ装置中的浓硫酸除水,Ⅳ装置除CO2,故Ⅳ装置中盛放的药品是NaOH溶液。
(3)应先用NaOH溶液除去CO2,再用浓硫酸除水,故气体从h进入装置,g出来,f进e出,然后接abc,最后由d排出。
(4)碱石灰可吸收CO2、H2O,故装置Ⅱ的作用是防止空气中的CO2和水蒸气进入装置I。
(5)实验开始时,应先通入处理过的空气,排出装置中原有的空气,再进行加热,防止CO2、H2O与Na2O2反应,故选A
一、选择题
1.下列有关碳酸钠和碳酸氢钠的叙述正确的是
A.二者均不稳定,易分解生成气体
B.等浓度等体积二份溶液都滴入2滴酚酞,溶液颜色深
C.碳酸氢钠的溶解度大于碳酸钠
D.等质量的二种固体分别与足量盐酸反应,产生气体多
2.下列物质不能通过化合反应生成的是
A.FeCl2 B.Cu C. D.NaHCO3
3.下列物质的俗称不正确的是
A. 熟石灰 B. 苏打
C. 烧碱 D. 醋酸
4.下列关于钠的叙述中,不正确的是
A.钠燃烧时发出黄色的火焰 B.钠具有很强的还原性
C.钠燃烧时生成氧化钠 D.钠通常保存在煤油中
5.在下列实验过程中,出现的“异常”现象的解释,不正确的是
A.金属钠投入到硫酸铜溶液中,生成黑色沉淀物,是因为金属钠置换出金属铜
B.过氧化钠加入到含有酚酞的水中,溶液变红再变无色,可能有强氧化性物质生成
C.过量的二氧化碳通入澄清石灰水中,溶液变浑浊再变澄清,说明最终生成可以溶于水的盐
D.在氯化亚铁的溶液中,滴加氢氧化钠溶液,先有白色沉淀,随后变灰绿色再变红褐色,说明氢氧化亚铁易被空气中的氧气氧化
6.下列关于金属钠及其化合物的说法不正确的是
A.钠切开后,光亮的表面迅速变暗,是因为生成了Na2O
B.向饱和Na2CO3溶液中通入足量二氧化碳有碳酸氢钠晶体析出
C.石蕊试液中加入过氧化钠粉末溶液先变蓝后褪色
D.氧化钠与过氧化钠都能与水反应生成碱,因此他们都是碱性氧化物
7.表示下列反应的离子方程式错误的是
A.Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑
B.FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O
C.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH+SO+H2O
D.Cl2和水反应:Cl2+H2O=H++C1-+HClO
8.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠溶液可用于治疗胃病 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2CO3溶液中滴入酚酞变红色 纯碱(Na2CO3)是一种碱 Ⅰ对,Ⅱ对,有
C 金属钠保存在煤油中,以隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用于航天员的供氧剂 Na2O2能和CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有
A.A B.B C.C D.D
二、非选择题
9.碳酸钠(Na2CO3)
(1)碳酸钠是白色固体,俗称_______,_______于水;电离方程式_______。
(2)实验探究-Na2CO3的性质
实验 现象 结论(或化学方程式)
将澄清石灰水加入碳酸钠溶液中 _______ _______
将氯化钙溶液加入碳酸钠溶液中 _______ _______
测碳酸钠溶液pH pH_______7 碳酸钠溶液呈_______
将沾有油污的铜片放入热的碳酸钠溶液中 _______ 碳酸钠溶液具有_______能力
(3)Na2CO3溶液与酸的反应
①与足量盐酸反应:_______
②通入足量CO2:_______
10.钠:_______色,锂:_______色,钙:_______色,钡:_______色,铜:_______色,钾:_______色(观察时透过蓝色钴玻璃,防止钠焰色的干扰。)
11.将一块表面已部分被氧化成氧化纳、质量为的钠放入水中后,收集到。根据上述数据计算。
(1)金属钠表面氧化钠的质量是_______。
(2)所得溶液中的溶质质量分数是_______。
12.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下,回答下列问题:
(1)装置I中发生反应的化学方程式为_______,产物为_______色_______体。
(2)空气中的_______易与Na2O2反应,需要分别利用装置III和装置IV除去,装置IV中盛放的药品是_______。
(3)若规定气体的气流方向从左到右,则气体从_______进入装置,各仪器的正确连接顺序为_______接_______,_______接a,b接c,最后由d排放出空气中。
(4)装置II的作用是_______。
(5)开始实验时,操作中通空气和加热的顺序为_______。
A.先通空气再点燃酒精灯
B.先点燃酒精灯再通空气
C.通空气和加热的顺序不影响实验
【参考答案】
一、选择题
1.D
解析:A.加热时,碳酸氢钠分解生成碳酸钠而碳酸钠不分解,故A错误;
B.碳酸氢钠和碳酸钠都是强碱弱酸盐,水解而使其溶液都呈碱性,碳酸钠溶液的碱性更强,颜色深,故B错误;
C.常温下相同的溶剂时,Na2CO3较NaHCO3易溶,碳酸氢钠的溶解度小于碳酸钠,故C错误;
D.M(Na2CO3)=106g/mol,M(NaHCO3)=84g/mol,等质量的Na2CO3和NaHCO3,n(NaHCO3)>n(Na2CO3),与盐酸反应时,分别发生Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,则NaHCO3产生的气体多,故D正确;
故选D。
2.B
解析:A.由反应2FeCl3+Fe=3FeCl2可知,FeCl2可通过化合反应制备,A不符合题意;
B.铜为单质,不能由化合反应生成,B符合题意;
C.Fe(OH)3可由反应4Fe(OH)2+O2+2H2O=4Fe(OH)3制得,C不符合题意;
D.NaHCO3可由Na2CO3+CO2+H2O=2NaHCO3反应制得,D不符合题意;
故选B。
3.B
解析:A.Ca(OH)2的俗名是熟石灰、消石灰,A正确;
B.NaHCO3的俗名是小苏打,Na2CO3的俗名是苏打,B错误;
C.NaOH的俗名是烧碱、火碱、苛性钠,C正确;
D.CH3COOH的俗名是醋酸,D正确;
故选B。
4.C
解析:A.钠的焰色为黄色,燃烧时发出黄色火焰,A正确;
B.钠原子最外层只有1个电子,很容易失去,钠具有很强的还原性,B正确;
C.钠放在空气中与氧气反应生成氧化钠,燃烧时生成过氧化钠,C错误;
D.钠与空气中的氧气、水反应,通常保存在煤油或石蜡油中,D正确;
答案选C。
5.A
解析:A.氢氧化铜为蓝色沉淀,金属钠投入到硫酸铜溶液中,生成黑色沉淀物不是生成氢氧化铜,应为氧化铜,故A错误;
B.过氧化钠和水反应生成氢氧化钠是强碱,遇到酚酞变红色,同时生成氧气氧化有色物质为无色,所以出现溶液变红再变无色,故B正确;
C.过量二氧化碳通入澄清石灰水中反应生成碳酸钙沉淀变浑浊,后继续通入二氧化碳变澄清,生成溶于水的碳酸氢钙,说明最终生成可以溶于水的盐,故C正确;
D.氯化亚铁和氢氧化钠反应生成的氢氧化亚铁,先有白色沉淀,随后变灰绿色再变红褐色,是因为乙被空气中氧气氧化生成氢氧化铁,故D正确;
故答案选A。
【点睛】本题考查了物质性质的分析判断,主要是混合物性质和反应现象的理解应用,掌握基础是关键,题目难度中等。
6.D
解析:A.钠的性质活泼,易被氧化,光亮的表面迅速变暗,是因为生成了Na2O,A正确;
B.向饱和Na2CO3溶液中通入足量二氧化碳会生成碳酸氢钠,而碳酸氢钠的溶解度较小,故有碳酸氢钠晶体析出,B正确;
C.过氧化钠与水反应,生成氢氧化钠和氧气,氢氧化钠令紫色石蕊试液变蓝;同时,过氧化钠的强氧化性与水生成过氧化氢,过氧化氢具有强氧化性,将变蓝的石蕊试剂漂白,C正确;
D.碱性氧化物与水反应只生成盐和水,过氧化钠都能与水反应生成碱和氧气,过氧化钠不是碱性氧化物,D错误;
答案选D。
7.A
解析:A.Na2O2与水反应时,Na2O2既是氧化剂,又是还原剂,水中的氧元素不变价,O2分子中不含18O,18O应该在OH 中,正确的离子方程式为:2H218O+2Na2O2═2OH +218OH +4Na++O2↑,故A错误;
B.FeSO4酸性溶液中加入H2O2,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故B正确;
C.用过量氨水吸收工业尾气中的SO2,离子方程式为:2NH3 H2O+SO2=2++H2O,故C正确;
D.Cl2和水反应,离子方程式为:Cl2+H2O=H++Cl +HClO,故D正确;
故答案选A。
【点睛】本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确等。
8.D
解析:A.碳酸钠能够与盐酸反应,陈述Ⅱ对,但是碳酸钠碱性较强,具有腐蚀性,不能用于治疗胃酸过多,陈述I错误,A错误;
B.纯碱(Na2CO3)是一种盐,陈述Ⅱ错误,B错误;
C.常温下,金属钠在空气中会生成氧化钠,陈述Ⅱ错误,C错误;
D.Na2O2能和人体呼出的CO2、H2O反应生成O2,故可用于航天员的供氧,陈述正确,存在因果关系,D正确;
故选D。
二、非选择题
9.(1)纯碱或苏打 易溶 Na2CO3=2Na++CO
(2)产生白色沉淀 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 产生白色沉淀 CaCl2+Na2CO3=CaCO3↓+2NaCl > 碱性 铜片表面变光亮,油污消失 去污
(3) Na2CO3+2HCl=2NaCl+CO2↑+H2O Na2CO3+CO2+H2O=2NaHCO3
解析:略
10.黄 紫红 砖红 黄绿 绿 紫
解析:钠的焰色为黄色;锂的焰色为紫红色;钙的焰色为砖红色;钡的焰色为黄绿色;铜的焰色为绿色;钾的焰色为紫色。
11.(1)6.2g
(2)40%
解析:(1)收集到0.2gH2,则钠与水反应产生H2的物质的量为=0.1mol,根据2Na+2H2O=2NaOH+H2↑可知,Na的物质的量为0.2mol,质量为0.2mol×23g/mol=4.6g,则金属钠表面氧化钠的质量是10.8g-4.6g=6.2g;
(2)根据(1)可知金属钠表面氧化钠(Na2O)的物质的量为=0.1mol,Na、Na2O与水反应得到的溶液溶质均为NaOH,则根据钠原子守恒可知n(NaOH)= 0.1mol×2+0.2mol=0.4mol,溶质NaOH的质量为0.4mol×40g/mol=16g,溶液质量为10.8g+29.4g-0.2g=40g,溶质质量分数=×100%=40%。
12.(1) 淡黄 固体
(2)水蒸气、CO2 NaOH溶液
(3) h g f e
(4)防止空气中的CO2和水蒸气进入装置I
(5)A
【分析】由于Na2O2容易与CO2、H2O反应,所以要制备纯度较高的Na2O2,要防止CO2、H2O进入反应装置中,据此进行分析。
解析:(1)装置I制取Na2O2,发生反应的化学方程式为;Na2O2为淡黄色固体。
(2)空气中的CO2、H2O易与Na2O2反应,Ⅲ装置中的浓硫酸除水,Ⅳ装置除CO2,故Ⅳ装置中盛放的药品是NaOH溶液。
(3)应先用NaOH溶液除去CO2,再用浓硫酸除水,故气体从h进入装置,g出来,f进e出,然后接abc,最后由d排出。
(4)碱石灰可吸收CO2、H2O,故装置Ⅱ的作用是防止空气中的CO2和水蒸气进入装置I。
(5)实验开始时,应先通入处理过的空气,排出装置中原有的空气,再进行加热,防止CO2、H2O与Na2O2反应,故选A
