1.1.2 热化学方程式 燃烧热课件(共29张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 1.1.2 热化学方程式 燃烧热课件(共29张PPT) 2023-2024学年高二化学人教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
第一章
第一节 第2课时 热化学方程式 燃烧热
素养 目标
1.知道内能受温度、压强、物质的聚集状态的影响,培养宏观辨识与微观探析的化学核心素养。
2.能用热化学方程式表示反应中的能量变化,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、热化学方程式
1.定义
表明反应所 的化学方程式。
2.意义
如热化学方程式H2(g)+ O2(g) ===H2O(l) ΔH=-285.8 kJ·mol-1,表示:在
25 ℃和101 kPa下,1 mol气态H2与 反应生成
时, 285.8 kJ的热量。
释放或吸收的热量
0.5 mol气态O2
1 mol液态H2O
放出
3.书写热化学方程式的注意事项
(1)需注明反应时的 。但常用的ΔH的数据,一般都是
时的数据,可不特别注明。
(2)需注明反应物和生成物的 。气态、液态、固态和水溶液需注明的符号分别为g、l、 、 。
(3)热化学方程式中各物质前的化学计量数可以是 ,也可以是 。
热化学方程式中化学计量数只表示物质的量
温度和压强
25 ℃和101 kPa
聚集状态
s
aq
整数
分数
(4)用ΔH表示反应热,ΔH必须与化学方程式一一对应,注意“+”“-”和单位kJ·mol-1。
吸热反应ΔH为正值,放热反应ΔH为负值
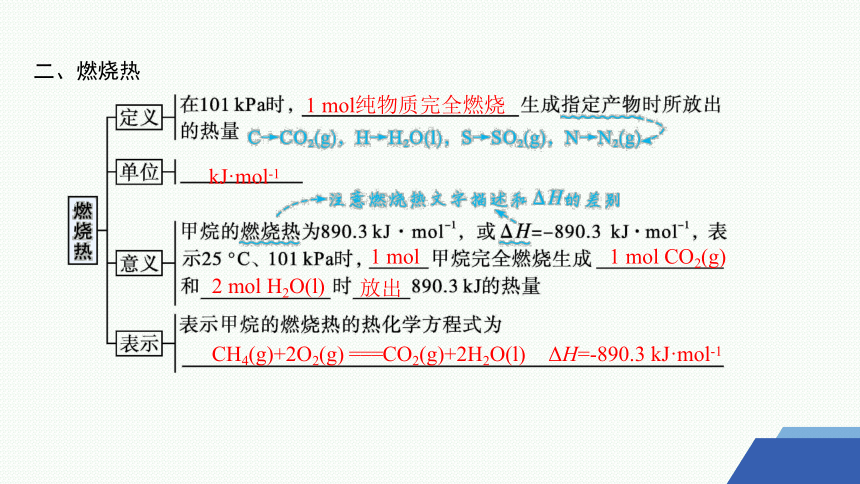
二、燃烧热
1 mol纯物质完全燃烧
kJ·mol-1
1 mol
1 mol CO2(g)
2 mol H2O(l)
放出
CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
易错辨析1
(1)热化学方程式中各物质化学式前的化学计量数只代表物质的量,不表示分子数。( )
(2)H2(g)+ O2(g) ===H2O(l)和2H2(g)+O2(g) ===2H2O(l)的ΔH不同。( )
(3)CH4(g)+2O2(g) ===CO2(g)+2H2O(g) ΔH=-890.3 kJ。( )
(4)S(s)+O2(g) ===SO2(g) ΔH=+296.8 kJ·mol-1。( )
√
√
×
提示 ΔH的单位是 kJ·mol-1。
提示 硫的燃烧反应为放热反应,ΔH为负值。
×
易错辨析2
(1)在101 kPa下,1 mol纯物质完全燃烧所放出的热量就是其燃烧热。( )
(2)1 mol硫完全燃烧生成SO3所放出的热量为硫的燃烧热。( )
(3)所有物质的燃烧热其ΔH均小于0。( )
(4)表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1。( )
×
提示 燃烧热是指在101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,如H2燃烧生成的是液态水,而不是水蒸气,碳燃烧生成的是CO2而不是CO。
×
提示 硫的燃烧热中硫燃烧生成的是SO2气体,不是SO3。
√
×
提示 燃烧热中,氢元素变为H2O(l),不是H2O(g)。
重难探究·能力素养全提升
探究一 热化学方程式
方法突破
“五步”突破热化学方程式的书写
名师点拨 热化学方程式易错点
(1)可逆反应的热效应
可逆反应中的“ΔH”表示的是完全反应时对应的焓变。若按该反应的化学计量数投料进行反应,由于可逆反应不能进行彻底,那么吸收或放出的热量一定比该值小。
(2)热化学方程式中的物质必须指明聚集状态。
(3)ΔH的单位为kJ·mol-1。
(4)“===”上方可不写反应条件,但应注明发生反应的温度和压强,若温度为25 ℃、压强为101 kPa时可不注明。
应用体验
视角1热化学方程式的正误判断
1.甲烷是一种高效清洁的新能源,0.25 mol甲烷完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g) ===2CO2(g)+4H2O(l) ΔH=+1 780 kJ·mol-1
B.CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D.2CH4(g)+4O2(g) ===2CO2(g)+4H2O(l) ΔH=-890 kJ·mol-1
C
解析 0.25 mol CH4完全燃烧放出222.5 kJ的热量,则1 mol CH4完全燃烧放出890 kJ的热量,2 mol CH4完全燃烧放出1 780 kJ的热量。
归纳总结 “五审”法突破热化学方程式的正误判断
视角2热化学方程式的书写
2.[基础热化学方程式的书写]实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160 g固体铁红放出130 kJ热量,写出该反应的热化学方程式: 。
4FeCO3(s)+O2(g) ===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1
3.[根据反应历程书写热化学方程式]根据如下能量关系示意图,书写C(s)燃烧生成CO(g)的热化学方程式:
,
C(s)燃烧生成CO2(g)的热化学方程式:
。
2C(s)+O2(g) ===2CO(g) ΔH=-221.2 kJ·mol-1
C(s)+O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1
4.[根据键能书写热化学方程式]通常人们把断裂1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
化学键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436.0 242.7 431.8
则H2(g)在Cl2(g)中燃烧生成HCl(g)的热化学方程式为 。
H2(g)+Cl2(g) ===2HCl(g) ΔH=-184.9 kJ·mol-1
探究二 燃烧热
情境探究
已知25 ℃、101 kPa时,甲醇燃烧的热化学方程式可表示为
①CH3OH(l)+ O2(g) ===CO2(g)+2H2O(l)
ΔH=-725.76 kJ·mol-1
②CH3OH(l)+ O2(g) ===CO2(g)+2H2O(g)
ΔH=-637.76 kJ·mol-1
③2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(l)
ΔH=-1 451.52 kJ·mol-1
(1)根据上面三个热化学方程式,哪一个可表示甲醇燃烧热的热化学方程式 甲醇的燃烧热是多少
(2)还可以根据哪个反应计算甲醇的燃烧热 试写出计算甲醇燃烧热ΔH的过程。
(3)根据上面甲醇燃烧的热化学方程式,可以得到反应热的数值与化学计量数 (填“有关”或“无关”,下同),与状态 ,燃烧热的数值与化学计量数 。
提示 反应①可表示甲醇燃烧热的热化学方程式,甲醇的燃烧热为725.76 kJ·mol-1。
提示 还可根据反应③计算。甲醇燃烧热的ΔH= =-725.76 kJ·mol-1。
有关
有关
无关
方法突破
应用体验
视角1燃烧热概念理解
1.下列热化学方程式书写不正确的是( )
选项 已知条件 热化学方程式
A H2的燃烧热为a kJ·mol-1 H2(g)+ O2(g) ===H2O(l) ΔH=-a kJ·mol-1
B 密闭容器中SO2(g)与O2(g)完全反应生成1 mol SO3(g),放出热量98 kJ SO2(g)+ O2(g) SO3(g) ΔH=-98 kJ·mol-1
选项 已知条件 热化学方程式
C H+(aq)+OH-(aq) ===H2O(l) ΔH=-57.3 kJ·mol-1 H2SO4(aq)+Ba(OH)2(aq) ===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D 31 g白磷比31 g红磷能量多b kJ P4(s) ===4P(s) ΔH=-4b kJ·mol-1
答案 C
解析 H2的燃烧热是指1 mol H2(g)完全燃烧生成H2O(l)放出的热量,A中符合燃烧热的概念要求,而且热化学方程式正确,A正确;SO2与O2的反应为可逆反应,SO2(g)+ O2(g) SO3(g) ΔH=-98 kJ·mol-1表示1 mol SO2(g)与0.5 mol O2(g)完全反应生成1 mol SO3(g)时,放出热量98 kJ,B正确;反应过程中除了H+和OH-反应放热,硫酸钡沉淀的生成也伴随有热量的变化,C错误;31 g白磷的物质的量为 =0.25 mol,比31 g红磷能量多b kJ,则1 mol白磷(P4)生成红磷(P),放出4b kJ热量,所以热化学方程式为P4(s) ===4P(s) ΔH=-4b kJ·mol-1,D正确。
【变式设问】
结合B项已知条件,若密闭容器中1 mol SO2(g)、0.5 mol O2(g)充分反应生成SO3(g),放出热量39.2 kJ,则SO2的转化率是多少
视角2分清“燃烧的热化学方程式”和“燃烧热的热化学方程式”
2.氢气的燃烧热为285.8 kJ·mol-1,写出其燃烧热的热化学方程式: 。
答案 H2(g)+ O2(g) ===H2O(l) ΔH=-285.8 kJ·mol-1
解析 注意表示燃烧热的热化学方程式中,可燃物的物质的量为1 mol。
视角3有关燃烧热的计算
3.已知:2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol-1;CO(g)+ O2(g) ===CO2(g) ΔH=-282.9 kJ·mol-1。
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )
A.2∶1 B.1∶2
C.1∶1 D.2∶3
C
本 课 结 束
第一章
第一节 第2课时 热化学方程式 燃烧热
素养 目标
1.知道内能受温度、压强、物质的聚集状态的影响,培养宏观辨识与微观探析的化学核心素养。
2.能用热化学方程式表示反应中的能量变化,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、热化学方程式
1.定义
表明反应所 的化学方程式。
2.意义
如热化学方程式H2(g)+ O2(g) ===H2O(l) ΔH=-285.8 kJ·mol-1,表示:在
25 ℃和101 kPa下,1 mol气态H2与 反应生成
时, 285.8 kJ的热量。
释放或吸收的热量
0.5 mol气态O2
1 mol液态H2O
放出
3.书写热化学方程式的注意事项
(1)需注明反应时的 。但常用的ΔH的数据,一般都是
时的数据,可不特别注明。
(2)需注明反应物和生成物的 。气态、液态、固态和水溶液需注明的符号分别为g、l、 、 。
(3)热化学方程式中各物质前的化学计量数可以是 ,也可以是 。
热化学方程式中化学计量数只表示物质的量
温度和压强
25 ℃和101 kPa
聚集状态
s
aq
整数
分数
(4)用ΔH表示反应热,ΔH必须与化学方程式一一对应,注意“+”“-”和单位kJ·mol-1。
吸热反应ΔH为正值,放热反应ΔH为负值
二、燃烧热
1 mol纯物质完全燃烧
kJ·mol-1
1 mol
1 mol CO2(g)
2 mol H2O(l)
放出
CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
易错辨析1
(1)热化学方程式中各物质化学式前的化学计量数只代表物质的量,不表示分子数。( )
(2)H2(g)+ O2(g) ===H2O(l)和2H2(g)+O2(g) ===2H2O(l)的ΔH不同。( )
(3)CH4(g)+2O2(g) ===CO2(g)+2H2O(g) ΔH=-890.3 kJ。( )
(4)S(s)+O2(g) ===SO2(g) ΔH=+296.8 kJ·mol-1。( )
√
√
×
提示 ΔH的单位是 kJ·mol-1。
提示 硫的燃烧反应为放热反应,ΔH为负值。
×
易错辨析2
(1)在101 kPa下,1 mol纯物质完全燃烧所放出的热量就是其燃烧热。( )
(2)1 mol硫完全燃烧生成SO3所放出的热量为硫的燃烧热。( )
(3)所有物质的燃烧热其ΔH均小于0。( )
(4)表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1。( )
×
提示 燃烧热是指在101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,如H2燃烧生成的是液态水,而不是水蒸气,碳燃烧生成的是CO2而不是CO。
×
提示 硫的燃烧热中硫燃烧生成的是SO2气体,不是SO3。
√
×
提示 燃烧热中,氢元素变为H2O(l),不是H2O(g)。
重难探究·能力素养全提升
探究一 热化学方程式
方法突破
“五步”突破热化学方程式的书写
名师点拨 热化学方程式易错点
(1)可逆反应的热效应
可逆反应中的“ΔH”表示的是完全反应时对应的焓变。若按该反应的化学计量数投料进行反应,由于可逆反应不能进行彻底,那么吸收或放出的热量一定比该值小。
(2)热化学方程式中的物质必须指明聚集状态。
(3)ΔH的单位为kJ·mol-1。
(4)“===”上方可不写反应条件,但应注明发生反应的温度和压强,若温度为25 ℃、压强为101 kPa时可不注明。
应用体验
视角1热化学方程式的正误判断
1.甲烷是一种高效清洁的新能源,0.25 mol甲烷完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g) ===2CO2(g)+4H2O(l) ΔH=+1 780 kJ·mol-1
B.CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D.2CH4(g)+4O2(g) ===2CO2(g)+4H2O(l) ΔH=-890 kJ·mol-1
C
解析 0.25 mol CH4完全燃烧放出222.5 kJ的热量,则1 mol CH4完全燃烧放出890 kJ的热量,2 mol CH4完全燃烧放出1 780 kJ的热量。
归纳总结 “五审”法突破热化学方程式的正误判断
视角2热化学方程式的书写
2.[基础热化学方程式的书写]实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160 g固体铁红放出130 kJ热量,写出该反应的热化学方程式: 。
4FeCO3(s)+O2(g) ===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1
3.[根据反应历程书写热化学方程式]根据如下能量关系示意图,书写C(s)燃烧生成CO(g)的热化学方程式:
,
C(s)燃烧生成CO2(g)的热化学方程式:
。
2C(s)+O2(g) ===2CO(g) ΔH=-221.2 kJ·mol-1
C(s)+O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1
4.[根据键能书写热化学方程式]通常人们把断裂1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
化学键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436.0 242.7 431.8
则H2(g)在Cl2(g)中燃烧生成HCl(g)的热化学方程式为 。
H2(g)+Cl2(g) ===2HCl(g) ΔH=-184.9 kJ·mol-1
探究二 燃烧热
情境探究
已知25 ℃、101 kPa时,甲醇燃烧的热化学方程式可表示为
①CH3OH(l)+ O2(g) ===CO2(g)+2H2O(l)
ΔH=-725.76 kJ·mol-1
②CH3OH(l)+ O2(g) ===CO2(g)+2H2O(g)
ΔH=-637.76 kJ·mol-1
③2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(l)
ΔH=-1 451.52 kJ·mol-1
(1)根据上面三个热化学方程式,哪一个可表示甲醇燃烧热的热化学方程式 甲醇的燃烧热是多少
(2)还可以根据哪个反应计算甲醇的燃烧热 试写出计算甲醇燃烧热ΔH的过程。
(3)根据上面甲醇燃烧的热化学方程式,可以得到反应热的数值与化学计量数 (填“有关”或“无关”,下同),与状态 ,燃烧热的数值与化学计量数 。
提示 反应①可表示甲醇燃烧热的热化学方程式,甲醇的燃烧热为725.76 kJ·mol-1。
提示 还可根据反应③计算。甲醇燃烧热的ΔH= =-725.76 kJ·mol-1。
有关
有关
无关
方法突破
应用体验
视角1燃烧热概念理解
1.下列热化学方程式书写不正确的是( )
选项 已知条件 热化学方程式
A H2的燃烧热为a kJ·mol-1 H2(g)+ O2(g) ===H2O(l) ΔH=-a kJ·mol-1
B 密闭容器中SO2(g)与O2(g)完全反应生成1 mol SO3(g),放出热量98 kJ SO2(g)+ O2(g) SO3(g) ΔH=-98 kJ·mol-1
选项 已知条件 热化学方程式
C H+(aq)+OH-(aq) ===H2O(l) ΔH=-57.3 kJ·mol-1 H2SO4(aq)+Ba(OH)2(aq) ===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D 31 g白磷比31 g红磷能量多b kJ P4(s) ===4P(s) ΔH=-4b kJ·mol-1
答案 C
解析 H2的燃烧热是指1 mol H2(g)完全燃烧生成H2O(l)放出的热量,A中符合燃烧热的概念要求,而且热化学方程式正确,A正确;SO2与O2的反应为可逆反应,SO2(g)+ O2(g) SO3(g) ΔH=-98 kJ·mol-1表示1 mol SO2(g)与0.5 mol O2(g)完全反应生成1 mol SO3(g)时,放出热量98 kJ,B正确;反应过程中除了H+和OH-反应放热,硫酸钡沉淀的生成也伴随有热量的变化,C错误;31 g白磷的物质的量为 =0.25 mol,比31 g红磷能量多b kJ,则1 mol白磷(P4)生成红磷(P),放出4b kJ热量,所以热化学方程式为P4(s) ===4P(s) ΔH=-4b kJ·mol-1,D正确。
【变式设问】
结合B项已知条件,若密闭容器中1 mol SO2(g)、0.5 mol O2(g)充分反应生成SO3(g),放出热量39.2 kJ,则SO2的转化率是多少
视角2分清“燃烧的热化学方程式”和“燃烧热的热化学方程式”
2.氢气的燃烧热为285.8 kJ·mol-1,写出其燃烧热的热化学方程式: 。
答案 H2(g)+ O2(g) ===H2O(l) ΔH=-285.8 kJ·mol-1
解析 注意表示燃烧热的热化学方程式中,可燃物的物质的量为1 mol。
视角3有关燃烧热的计算
3.已知:2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol-1;CO(g)+ O2(g) ===CO2(g) ΔH=-282.9 kJ·mol-1。
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )
A.2∶1 B.1∶2
C.1∶1 D.2∶3
C
本 课 结 束
