1.2 反应热的计算课件 (共43张PPT)2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 1.2 反应热的计算课件 (共43张PPT)2023-2024学年高二化学人教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:29:15 | ||
图片预览










文档简介
(共43张PPT)
第一章
第二节 反应热的计算
素养 目标
1.了解盖斯定律及其简单应用,培养科学探究与创新意识的化学核心素养。
2.能进行反应焓变的简单计算,能运用反应焓变合理选择和利用化学反应,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、盖斯定律
1.内容:不管化学反应是一步完成或分几步完成,其反应热是 的。换句话说,化学反应的反应热只与反应体系的 和 有关,而与反应的 无关。
2.意义:对于进行得很慢的反应、不容易直接发生的反应、产品不纯(即有副反应发生)的反应,测定其反应热比较困难,如果应用 ,就可以间接地把它们的反应热计算出来。
相同
始态
终态
途径
盖斯定律
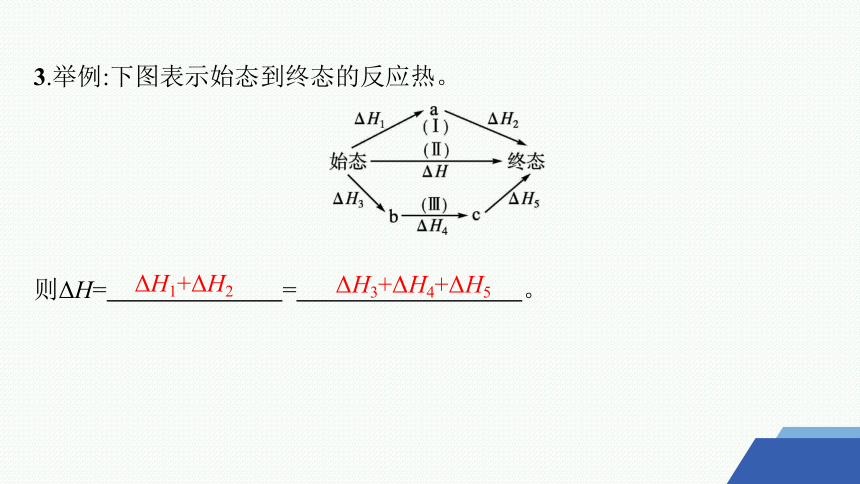
3.举例:下图表示始态到终态的反应热。
则ΔH= = 。
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
二、反应热的计算
1.根据热化学方程式计算
热化学方程式与数学上的方程式相似,物质可以左右移项,同时改变反应热的正、负号,各物质前的化学计量数及ΔH的数值可以同时扩大或缩小相同的数。
2.根据盖斯定律计算
根据盖斯定律,我们可以利用已知反应的反应热来计算未知反应的反应热。例如,若某个化学反应的ΔH=+a kJ·mol-1,则其逆反应的ΔH= kJ·mol-1;若某个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的反应热可以由另外几个反应的反应热 而得到。
-a
相加减
易错辨析1
(1)在25 ℃和101 kPa时,反应H2(g)+Cl2(g) ===2HCl(g)在光照和点燃条件下反应,ΔH相等。( )
(2)相同条件下,等质量的S(s)和S(g)完全燃烧释放的热量不同。( )
(3) 中,存在关系式:ΔH1=ΔH2+ΔH3。( )
√
√
×
提示 ΔH3=ΔH1+ΔH2。
易错辨析2
(1)在101 kPa时,32 g CH4完全燃烧生成CO2和液态H2O,放出的热量为1 780 kJ,则甲烷的燃烧热为890 kJ·mol-1。( )
(2)1 g硫粉在氧气中充分燃烧放出9.36 kJ热量,则硫燃烧的热化学方程式为S(s)+O2(g) ===SO2(g) ΔH=-299.52 kJ·mol-1。( )
√
√
重难探究·能力素养全提升
探究一 盖斯定律
情境探究
炭在火炉中燃烧很旺时,再往炉膛内红热的炭上喷洒少量水的瞬间,炉子内火会更旺。
炭作为燃料可通过下列两种途径燃烧:
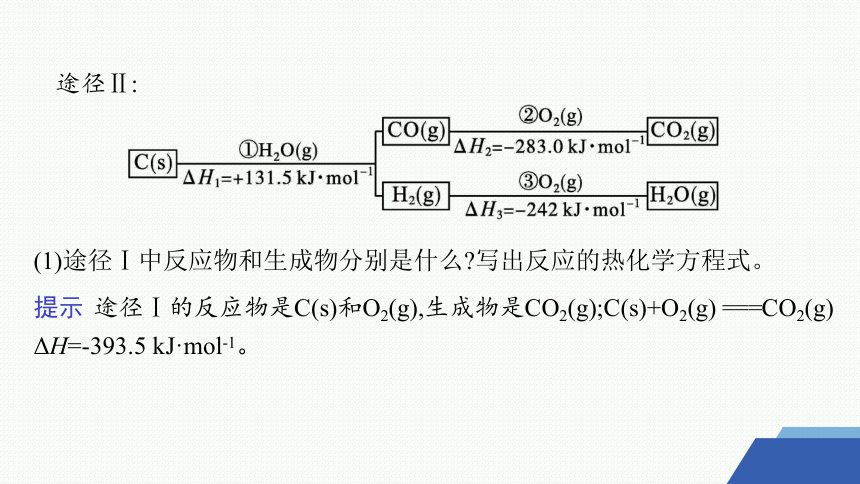
途径Ⅱ:
(1)途径Ⅰ中反应物和生成物分别是什么 写出反应的热化学方程式。
提示 途径Ⅰ的反应物是C(s)和O2(g),生成物是CO2(g);C(s)+O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1。
(2)途径Ⅱ中最初的反应物和最终的生成物是什么 分别写出步骤①②③的热化学方程式。
提示 将三个步骤中的化学方程式相加可得C(s)+O2(g) ===CO2(g),故最初的反应物是C(s)和O2(g),最终的生成物是CO2(g)。
①C(s)+H2O(g) ===CO(g)+H2(g) ΔH1=+131.5 kJ·mol-1
②CO(g)+ O2(g) ===CO2(g) ΔH2=-283.0 kJ·mol-1
③H2(g)+ O2(g) ===H2O(g) ΔH3=-242 kJ·mol-1
(3)将途径Ⅱ中三个热化学方程式相加(即①+②+③)得到的热化学方程式是什么 判断途径Ⅰ和途径Ⅱ中相同质量的炭完全燃烧放出的热量有何关系
(4)找出途径Ⅰ(ΔH)与途径Ⅱ(ΔH1、ΔH2、ΔH3)中反应热之间有何关系 由此你得出的结论是什么
提示 将途径Ⅱ中的三个热化学方程式相加得到的热化学方程式为C(s)+O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1;途径Ⅰ与途径Ⅱ中相同质量的炭完全燃烧放出的热量相等。
提示 ΔH=ΔH1+ΔH2+ΔH3。
化学反应中能量的变化只与反应物的多少和反应物、生成物的最终状态有关,与中间过程无关。
方法突破
应用盖斯定律计算ΔH的方法
(1)“虚拟路径”法
(2)加和法
名师点拨 有关反应热的计算,加和法是最重要的考查方法。遵循的原则是:“同边(即等号同一边)相加,异边相减”。利用加和法除了进行反应热的计算外,还可以进行某些反应中反应热大小的比较。
应用体验
视角1虚拟路径法
1.[设计路径寻找关系式]已知胆矾溶于水时温度降低,室温时将1 mol无水硫酸铜制成溶液时放出的热量为Q1 kJ,又知胆矾分解的热化学方程式为CuSO4·5H2O(s) ===CuSO4(s)+5H2O(l) ΔH=Q2 kJ·mol-1,则Q1和Q2的关系为( )
A.Q1Q2
C.Q1=Q2 D.无法确定
A
解析 根据题意,可把胆矾溶于水看成2个过程:
过程①吸收热量,1 mol CuSO4·5H2O(s)分解吸收的热量为Q2 kJ;过程②放出热量,1 mol无水硫酸铜制成溶液时放出热量Q1 kJ,但整个过程要使溶液温度降低,说明ΔH>0,则Q2-Q1=ΔH>0,因此Q2>Q1,故答案选A。
归纳总结 依据路径寻找关系式的注意点
(1)依据路径寻找关系式时,应注意箭头的方向,若箭头方向相反,则代入关系式的应为-ΔH。
(2)解题时,不同同学设置的始态和终态可能不同,但解题结果不受影响,因此不必纠结到底该设置哪个位置为始态或终态。
视角2加和法
2.[2023广东广州高二期末]在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
2S(g) ===S2(g) ΔH4
则ΔH4的正确表达式为( )
答案 A
解析 将四个热化学方程式分别标为①、②、③、④,根据目标反应2S(g) ===S2(g),S(g)和S2(g)在已知反应中只出现一次,而O2(g)和SO2(g)均出现两次,则根据S(g)和S2(g)调整③和②,然后根据O2(g)或SO2(g)调整①,消去
归纳总结 (1)确定目标反应,(2)根据目标反应调整已知反应中某种相同物质的化学计量数和位置,(3)抓住已知反应中只出现过一次的物质,逐步消去目标反应中不存在的物质,(4)把ΔH也做类似处理,得到答案。
视角3根据盖斯定律书写热化学方程式
3.处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g) ===CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g) ===SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是
。
2CO(g)+SO2(g) ===S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1
解析 ①CO(g)+ O2(g) ===CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g) ===SO2(g) ΔH=-296.0 kJ·mol-1
将①×2-②得2CO(g)+SO2(g) ===S(s)+2CO2(g),则ΔH=(-283.0 kJ·mol-1)×2-(-296.0 kJ·mol-1)=-270.0 kJ·mol-1,所以其热化学方程式为2CO(g)+SO2(g) ===S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1。
探究二 反应热的计算
情境探究
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
已知反应中相关的化学键键能数据如下:
化学键 H—H C—O C≡O H—O C—H
E/( kJ·mol-1) 436.0 351 1 076 462.8 413.4
(1)根据上述化学键键能数据计算ΔH1。
(2)根据上述数据能否计算CO2中C==O的键能
(3)计算ΔH3。
提示 ΔH1=1 076 kJ·mol-1+2×436.0 kJ·mol-1-(3×413.4 kJ·mol-1+351 kJ·mol-1+462.8 kJ·mol-1)=-106 kJ·mol-1。
提示 能。利用反应Ⅱ,根据ΔH=反应物键能和-生成物键能和,其中只有CO2中C==O的键能未知,可以计算。
提示 反应Ⅲ=反应Ⅱ-反应Ⅰ,因此ΔH3=-58 kJ·mol-1-(-106 kJ·mol-1)=+48 kJ·mol-1。
方法突破
反应热计算“四法”
应用体验
视角1根据热化学方程式计算
1.按要求完成以下填空:
(1)实验测得,1 g甲醇(CH3OH,常温下为液态)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧热的热化学方程式:
。
(2)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供。反应过程中生成的气体可参与大气循环。测得当反应过程中有1 mol水蒸气生成时放出161 kJ的热量。试写出反应过程中的热化学方程式: 。
CH3OH(l)+ O2(g) ===CO2(g)+2H2O(l) ΔH=-726.4 kJ·mol-1
N2H4(g)+2H2O2(l) ===N2(g)+4H2O(g) ΔH=-644 kJ·mol-1
(3)硅与氯两元素的单质反应生成1 mol相应硅的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式: 。
Si(s)+2Cl2(g) ===SiCl4(l) ΔH=-687 kJ·mol-1
解析 (1)1 g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,1 mol CH3OH的质量为32 g,则燃烧放热为22.7 kJ×32=726.4 kJ,则甲醇燃烧热的热化学方程式:CH3OH(l)+ O2(g) ===CO2(g)+2H2O(l) ΔH=-726.4 kJ·mol-1。
(2)联氨与H2O2反应的化学方程式为N2H4+2H2O2===N2+4H2O,当有1 mol H2O(g)生成时放出161 kJ的热量,根据化学方程式,则生成4 mol H2O(g)时放热161 kJ×4=644 kJ,热化学方程式:N2H4(g)+2H2O2(l) ===N2(g)+4H2O(g) ΔH=-644 kJ·mol-1。
(3)硅与氯两元素的单质反应生成硅的最高价化合物为SiCl4,根据SiCl4的熔、沸点可得25 ℃时,SiCl4为液态。硅与氯气反应生成1 mol SiCl4(l),放热687 kJ,则热化学方程式:Si(s)+2Cl2(g) ===SiCl4(l) ΔH=-687 kJ·mol-1。
【变式设问】
(1)根据上述题(1)中热化学方程式,若甲醇燃烧放出181.6 kJ的热量,计算所需要甲醇的物质的量。
(2)根据上述题(3)中热化学方程式,计算7.1 g Cl2与Si完全反应放出的热量。
提示 1 mol CH3OH完全燃烧放出726.4 kJ的热量,则放出181.6 kJ的热量,需要CH3OH的物质的量为 =0.25 mol。
提示 7.1 g Cl2的物质的量为0.1 mol,反应放出的热量为 ×0.1 mol=34.35 kJ。
视角2根据物质的燃烧热计算
2.已知氢气的燃烧热为286.0 kJ·mol-1,已知丙烷的燃烧热为2 220.0 kJ·mol-1,室温下将8.96 L(已折算为标准状况下体积)H2和C3H8的混合气体完全燃烧,共放出307.8 kJ热量,则该混合气体中H2和C3H8的体积比为 。
3∶1
解析 8.96 L混合气体的物质的量为0.4 mol,完全燃烧共放出307.8 kJ热量。设H2物质的量为x,C3H8的物质的量为y,则有
解得x=0.3 mol,y=0.1 mol,所以H2和C3H8的体积比为3∶1。
探究三 反应热的大小比较
情境探究
下面是H2燃烧的热化学方程式:
H2(g)+ O2(g) ===H2O(g) ΔH1=-a kJ·mol-1,
2H2(g)+O2(g) ===2H2O(g) ΔH2=-b kJ·mol-1,
2H2(g)+O2(g) ===2H2O(l) ΔH3=-c kJ·mol-1。
(1)比较a和b的大小,ΔH1和ΔH2的大小。
提示 aΔH2。
(2)写出a、b的等量关系。
(3)比较ΔH2和ΔH3的大小。
提示 b=2a。
提示 ΔH2>ΔH3。
方法突破
1.反应热大小比较的三种类型
(1)同一反应,反应物或生成物状态不同,如固体硫和硫蒸气的燃烧。
(2)反应物晶体类型不同或互为同分异构体,产物相同的反应,如石墨和金刚石的燃烧、丁烷和异丁烷的燃烧。
(3)反应进行的程度不同的反应,如碳燃烧生成CO或CO2。
2.反应热大小比较的两种方法
应用体验
视角1图像法
1.已知正丁烷燃烧可发生如下反应:
上述反应中,属于正丁烷燃烧热的热化学方程式为 (填序号),
ΔH1~ΔH5最大的是 、最小的是 。
解析 根据题意,可绘制题述反应中反应物和生成物的相对能量大小,如图所示:
反应⑤放出的热量最多,则ΔH5最小;反应③放出的热量最少,则ΔH3最大。
⑤
ΔH3
ΔH5
解题技巧 运用图像法比较反应热的大小,比较直观,若比较多个反应的焓变大小,会更加实用。
(1)绘图时要注意同种物质不同能量的高低顺序:气体>液体>固体。
(2)根据吸热反应和放热反应,确定反应物和生成物能量的高低。
(3)注意放热反应中,反应放出热量越多,ΔH越小。
视角2综合运用
2.下列各组热化学方程式中,化学反应的ΔH前者小于后者的是( )
④2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(浓) ===
K2SO4(aq)+2H2O(l)
⑤NaOH(aq)+HCl(aq) === NaCl(aq)+H2O(l);NaOH(aq)+CH3COOH(aq) ===
CH3COONa(aq)+H2O(l)
A.①⑤ B.②④⑤ C.②③④ D.①②③
A
解析 ①反应都是放热反应,ΔH<0,前者是完全反应,放出热量多,因此前者ΔH小于后者,故①符合题意;②中第一个反应为吸热反应,ΔH>0,第二个反应是放热反应,ΔH<0,则ΔH前者大于后者,故②不符合题意;③反应都是放热反应,ΔH<0,消耗的氢气越多,放出的热量越多,ΔH前者大于后者,故③不符合题意;④反应都是放热反应,ΔH<0,浓硫酸稀释放出热量,ΔH前者大于后者,故④不符合题意;⑤反应都是放热反应,CH3COOH为弱酸,电离是吸热过程,后者放出热量少,ΔH前者小于后者,故⑤符合题意;故答案选A。
归纳总结 反应热大小比较的注意事项
(1)注意比较的是ΔH还是热量数值,比较ΔH时不要忽略“+”“-”号。
(2)吸热反应的ΔH为“+”,放热反应的ΔH为“-”,因此吸热反应的ΔH一定大于放热反应的ΔH。
(3)放热反应放热越多,ΔH越小。
本 课 结 束
第一章
第二节 反应热的计算
素养 目标
1.了解盖斯定律及其简单应用,培养科学探究与创新意识的化学核心素养。
2.能进行反应焓变的简单计算,能运用反应焓变合理选择和利用化学反应,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、盖斯定律
1.内容:不管化学反应是一步完成或分几步完成,其反应热是 的。换句话说,化学反应的反应热只与反应体系的 和 有关,而与反应的 无关。
2.意义:对于进行得很慢的反应、不容易直接发生的反应、产品不纯(即有副反应发生)的反应,测定其反应热比较困难,如果应用 ,就可以间接地把它们的反应热计算出来。
相同
始态
终态
途径
盖斯定律
3.举例:下图表示始态到终态的反应热。
则ΔH= = 。
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
二、反应热的计算
1.根据热化学方程式计算
热化学方程式与数学上的方程式相似,物质可以左右移项,同时改变反应热的正、负号,各物质前的化学计量数及ΔH的数值可以同时扩大或缩小相同的数。
2.根据盖斯定律计算
根据盖斯定律,我们可以利用已知反应的反应热来计算未知反应的反应热。例如,若某个化学反应的ΔH=+a kJ·mol-1,则其逆反应的ΔH= kJ·mol-1;若某个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的反应热可以由另外几个反应的反应热 而得到。
-a
相加减
易错辨析1
(1)在25 ℃和101 kPa时,反应H2(g)+Cl2(g) ===2HCl(g)在光照和点燃条件下反应,ΔH相等。( )
(2)相同条件下,等质量的S(s)和S(g)完全燃烧释放的热量不同。( )
(3) 中,存在关系式:ΔH1=ΔH2+ΔH3。( )
√
√
×
提示 ΔH3=ΔH1+ΔH2。
易错辨析2
(1)在101 kPa时,32 g CH4完全燃烧生成CO2和液态H2O,放出的热量为1 780 kJ,则甲烷的燃烧热为890 kJ·mol-1。( )
(2)1 g硫粉在氧气中充分燃烧放出9.36 kJ热量,则硫燃烧的热化学方程式为S(s)+O2(g) ===SO2(g) ΔH=-299.52 kJ·mol-1。( )
√
√
重难探究·能力素养全提升
探究一 盖斯定律
情境探究
炭在火炉中燃烧很旺时,再往炉膛内红热的炭上喷洒少量水的瞬间,炉子内火会更旺。
炭作为燃料可通过下列两种途径燃烧:
途径Ⅱ:
(1)途径Ⅰ中反应物和生成物分别是什么 写出反应的热化学方程式。
提示 途径Ⅰ的反应物是C(s)和O2(g),生成物是CO2(g);C(s)+O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1。
(2)途径Ⅱ中最初的反应物和最终的生成物是什么 分别写出步骤①②③的热化学方程式。
提示 将三个步骤中的化学方程式相加可得C(s)+O2(g) ===CO2(g),故最初的反应物是C(s)和O2(g),最终的生成物是CO2(g)。
①C(s)+H2O(g) ===CO(g)+H2(g) ΔH1=+131.5 kJ·mol-1
②CO(g)+ O2(g) ===CO2(g) ΔH2=-283.0 kJ·mol-1
③H2(g)+ O2(g) ===H2O(g) ΔH3=-242 kJ·mol-1
(3)将途径Ⅱ中三个热化学方程式相加(即①+②+③)得到的热化学方程式是什么 判断途径Ⅰ和途径Ⅱ中相同质量的炭完全燃烧放出的热量有何关系
(4)找出途径Ⅰ(ΔH)与途径Ⅱ(ΔH1、ΔH2、ΔH3)中反应热之间有何关系 由此你得出的结论是什么
提示 将途径Ⅱ中的三个热化学方程式相加得到的热化学方程式为C(s)+O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1;途径Ⅰ与途径Ⅱ中相同质量的炭完全燃烧放出的热量相等。
提示 ΔH=ΔH1+ΔH2+ΔH3。
化学反应中能量的变化只与反应物的多少和反应物、生成物的最终状态有关,与中间过程无关。
方法突破
应用盖斯定律计算ΔH的方法
(1)“虚拟路径”法
(2)加和法
名师点拨 有关反应热的计算,加和法是最重要的考查方法。遵循的原则是:“同边(即等号同一边)相加,异边相减”。利用加和法除了进行反应热的计算外,还可以进行某些反应中反应热大小的比较。
应用体验
视角1虚拟路径法
1.[设计路径寻找关系式]已知胆矾溶于水时温度降低,室温时将1 mol无水硫酸铜制成溶液时放出的热量为Q1 kJ,又知胆矾分解的热化学方程式为CuSO4·5H2O(s) ===CuSO4(s)+5H2O(l) ΔH=Q2 kJ·mol-1,则Q1和Q2的关系为( )
A.Q1
C.Q1=Q2 D.无法确定
A
解析 根据题意,可把胆矾溶于水看成2个过程:
过程①吸收热量,1 mol CuSO4·5H2O(s)分解吸收的热量为Q2 kJ;过程②放出热量,1 mol无水硫酸铜制成溶液时放出热量Q1 kJ,但整个过程要使溶液温度降低,说明ΔH>0,则Q2-Q1=ΔH>0,因此Q2>Q1,故答案选A。
归纳总结 依据路径寻找关系式的注意点
(1)依据路径寻找关系式时,应注意箭头的方向,若箭头方向相反,则代入关系式的应为-ΔH。
(2)解题时,不同同学设置的始态和终态可能不同,但解题结果不受影响,因此不必纠结到底该设置哪个位置为始态或终态。
视角2加和法
2.[2023广东广州高二期末]在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
2S(g) ===S2(g) ΔH4
则ΔH4的正确表达式为( )
答案 A
解析 将四个热化学方程式分别标为①、②、③、④,根据目标反应2S(g) ===S2(g),S(g)和S2(g)在已知反应中只出现一次,而O2(g)和SO2(g)均出现两次,则根据S(g)和S2(g)调整③和②,然后根据O2(g)或SO2(g)调整①,消去
归纳总结 (1)确定目标反应,(2)根据目标反应调整已知反应中某种相同物质的化学计量数和位置,(3)抓住已知反应中只出现过一次的物质,逐步消去目标反应中不存在的物质,(4)把ΔH也做类似处理,得到答案。
视角3根据盖斯定律书写热化学方程式
3.处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g) ===CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g) ===SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是
。
2CO(g)+SO2(g) ===S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1
解析 ①CO(g)+ O2(g) ===CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g) ===SO2(g) ΔH=-296.0 kJ·mol-1
将①×2-②得2CO(g)+SO2(g) ===S(s)+2CO2(g),则ΔH=(-283.0 kJ·mol-1)×2-(-296.0 kJ·mol-1)=-270.0 kJ·mol-1,所以其热化学方程式为2CO(g)+SO2(g) ===S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1。
探究二 反应热的计算
情境探究
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
已知反应中相关的化学键键能数据如下:
化学键 H—H C—O C≡O H—O C—H
E/( kJ·mol-1) 436.0 351 1 076 462.8 413.4
(1)根据上述化学键键能数据计算ΔH1。
(2)根据上述数据能否计算CO2中C==O的键能
(3)计算ΔH3。
提示 ΔH1=1 076 kJ·mol-1+2×436.0 kJ·mol-1-(3×413.4 kJ·mol-1+351 kJ·mol-1+462.8 kJ·mol-1)=-106 kJ·mol-1。
提示 能。利用反应Ⅱ,根据ΔH=反应物键能和-生成物键能和,其中只有CO2中C==O的键能未知,可以计算。
提示 反应Ⅲ=反应Ⅱ-反应Ⅰ,因此ΔH3=-58 kJ·mol-1-(-106 kJ·mol-1)=+48 kJ·mol-1。
方法突破
反应热计算“四法”
应用体验
视角1根据热化学方程式计算
1.按要求完成以下填空:
(1)实验测得,1 g甲醇(CH3OH,常温下为液态)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧热的热化学方程式:
。
(2)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供。反应过程中生成的气体可参与大气循环。测得当反应过程中有1 mol水蒸气生成时放出161 kJ的热量。试写出反应过程中的热化学方程式: 。
CH3OH(l)+ O2(g) ===CO2(g)+2H2O(l) ΔH=-726.4 kJ·mol-1
N2H4(g)+2H2O2(l) ===N2(g)+4H2O(g) ΔH=-644 kJ·mol-1
(3)硅与氯两元素的单质反应生成1 mol相应硅的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式: 。
Si(s)+2Cl2(g) ===SiCl4(l) ΔH=-687 kJ·mol-1
解析 (1)1 g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,1 mol CH3OH的质量为32 g,则燃烧放热为22.7 kJ×32=726.4 kJ,则甲醇燃烧热的热化学方程式:CH3OH(l)+ O2(g) ===CO2(g)+2H2O(l) ΔH=-726.4 kJ·mol-1。
(2)联氨与H2O2反应的化学方程式为N2H4+2H2O2===N2+4H2O,当有1 mol H2O(g)生成时放出161 kJ的热量,根据化学方程式,则生成4 mol H2O(g)时放热161 kJ×4=644 kJ,热化学方程式:N2H4(g)+2H2O2(l) ===N2(g)+4H2O(g) ΔH=-644 kJ·mol-1。
(3)硅与氯两元素的单质反应生成硅的最高价化合物为SiCl4,根据SiCl4的熔、沸点可得25 ℃时,SiCl4为液态。硅与氯气反应生成1 mol SiCl4(l),放热687 kJ,则热化学方程式:Si(s)+2Cl2(g) ===SiCl4(l) ΔH=-687 kJ·mol-1。
【变式设问】
(1)根据上述题(1)中热化学方程式,若甲醇燃烧放出181.6 kJ的热量,计算所需要甲醇的物质的量。
(2)根据上述题(3)中热化学方程式,计算7.1 g Cl2与Si完全反应放出的热量。
提示 1 mol CH3OH完全燃烧放出726.4 kJ的热量,则放出181.6 kJ的热量,需要CH3OH的物质的量为 =0.25 mol。
提示 7.1 g Cl2的物质的量为0.1 mol,反应放出的热量为 ×0.1 mol=34.35 kJ。
视角2根据物质的燃烧热计算
2.已知氢气的燃烧热为286.0 kJ·mol-1,已知丙烷的燃烧热为2 220.0 kJ·mol-1,室温下将8.96 L(已折算为标准状况下体积)H2和C3H8的混合气体完全燃烧,共放出307.8 kJ热量,则该混合气体中H2和C3H8的体积比为 。
3∶1
解析 8.96 L混合气体的物质的量为0.4 mol,完全燃烧共放出307.8 kJ热量。设H2物质的量为x,C3H8的物质的量为y,则有
解得x=0.3 mol,y=0.1 mol,所以H2和C3H8的体积比为3∶1。
探究三 反应热的大小比较
情境探究
下面是H2燃烧的热化学方程式:
H2(g)+ O2(g) ===H2O(g) ΔH1=-a kJ·mol-1,
2H2(g)+O2(g) ===2H2O(g) ΔH2=-b kJ·mol-1,
2H2(g)+O2(g) ===2H2O(l) ΔH3=-c kJ·mol-1。
(1)比较a和b的大小,ΔH1和ΔH2的大小。
提示 a
(2)写出a、b的等量关系。
(3)比较ΔH2和ΔH3的大小。
提示 b=2a。
提示 ΔH2>ΔH3。
方法突破
1.反应热大小比较的三种类型
(1)同一反应,反应物或生成物状态不同,如固体硫和硫蒸气的燃烧。
(2)反应物晶体类型不同或互为同分异构体,产物相同的反应,如石墨和金刚石的燃烧、丁烷和异丁烷的燃烧。
(3)反应进行的程度不同的反应,如碳燃烧生成CO或CO2。
2.反应热大小比较的两种方法
应用体验
视角1图像法
1.已知正丁烷燃烧可发生如下反应:
上述反应中,属于正丁烷燃烧热的热化学方程式为 (填序号),
ΔH1~ΔH5最大的是 、最小的是 。
解析 根据题意,可绘制题述反应中反应物和生成物的相对能量大小,如图所示:
反应⑤放出的热量最多,则ΔH5最小;反应③放出的热量最少,则ΔH3最大。
⑤
ΔH3
ΔH5
解题技巧 运用图像法比较反应热的大小,比较直观,若比较多个反应的焓变大小,会更加实用。
(1)绘图时要注意同种物质不同能量的高低顺序:气体>液体>固体。
(2)根据吸热反应和放热反应,确定反应物和生成物能量的高低。
(3)注意放热反应中,反应放出热量越多,ΔH越小。
视角2综合运用
2.下列各组热化学方程式中,化学反应的ΔH前者小于后者的是( )
④2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(浓) ===
K2SO4(aq)+2H2O(l)
⑤NaOH(aq)+HCl(aq) === NaCl(aq)+H2O(l);NaOH(aq)+CH3COOH(aq) ===
CH3COONa(aq)+H2O(l)
A.①⑤ B.②④⑤ C.②③④ D.①②③
A
解析 ①反应都是放热反应,ΔH<0,前者是完全反应,放出热量多,因此前者ΔH小于后者,故①符合题意;②中第一个反应为吸热反应,ΔH>0,第二个反应是放热反应,ΔH<0,则ΔH前者大于后者,故②不符合题意;③反应都是放热反应,ΔH<0,消耗的氢气越多,放出的热量越多,ΔH前者大于后者,故③不符合题意;④反应都是放热反应,ΔH<0,浓硫酸稀释放出热量,ΔH前者大于后者,故④不符合题意;⑤反应都是放热反应,CH3COOH为弱酸,电离是吸热过程,后者放出热量少,ΔH前者小于后者,故⑤符合题意;故答案选A。
归纳总结 反应热大小比较的注意事项
(1)注意比较的是ΔH还是热量数值,比较ΔH时不要忽略“+”“-”号。
(2)吸热反应的ΔH为“+”,放热反应的ΔH为“-”,因此吸热反应的ΔH一定大于放热反应的ΔH。
(3)放热反应放热越多,ΔH越小。
本 课 结 束
