2.1.2 影响化学反应速率的因素 活化能 课件(共41张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 2.1.2 影响化学反应速率的因素 活化能 课件(共41张PPT) 2023-2024学年高二化学人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:30:50 | ||
图片预览











文档简介
(共41张PPT)
第二章
第一节 第2课时 影响化学反应速率的因素 活化能
素养 目标
1.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响,能通过实验探究分析不同组分浓度改变对化学反应速率的影响,能用一定的理论模型说明外界条件改变对化学反应速率的影响,培养变化观念与平衡思想的化学核心素养。
2.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、影响化学反应速率的因素
1.内因(决定性因素)
在相同条件下,不同的化学反应会有不同的速率,这表明反应速率首先是由反应物的组成、结构和性质等因素决定的。
2.外界条件(其他条件不变,只改变一个条件)
增大
减小
增大
减小
2~4
改变
二、活化能
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中____________ 都称为基元反应。如2HI=== H2+I2的2个基元反应为2HI→H2+2I·、2I·→I2。
2.反应机理
先后进行的 反映了化学反应的反应历程,反应历程又称 。
反应历程中,反应最慢的基元反应决定反应速率,称为决速步
每一步反应
基元反应
反应机理
3.基元反应发生的先决条件
反应物的分子必须发生 ,但是并不是每一次碰撞都能发生化学反应。
4.有效碰撞
碰撞
越快
5.活化能和活化分子
6.反应物、生成物的能量与活化能的关系图
平均能量
活化能
放出的能量
逆反应
反应热
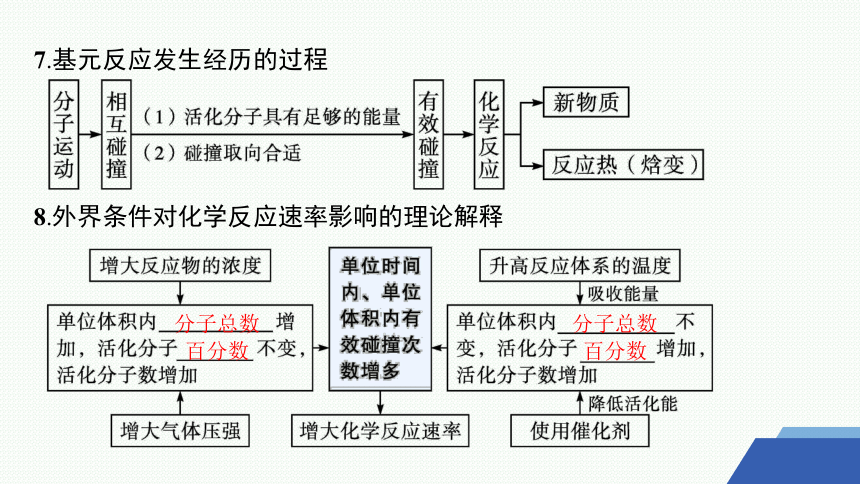
7.基元反应发生经历的过程
8.外界条件对化学反应速率影响的理论解释
分子总数
百分数
分子总数
百分数
微思考1
阅读教材“在一般情况下,当其他条件相同时”一段。思考:
对于反应C(s)+CO2(g) === 2CO(g)在一定温度和容积的密闭容器中反应,若只增加少量的炭,反应速率如何改变 若把块状的炭改为炭的粉末呢
提示 只增加少量的炭,反应速率不变,炭为固体,增加少量固体,反应速率不变。
把块状的炭改为炭的粉末,反应速率加快,因为块状的炭变为炭的粉末,接触面积增大,反应速率加快。
易错辨析1
(1)锌与硫酸反应时,硫酸的浓度越大,产生H2的速率越大。( )
(2)可用下图装置测定过氧化氢分解的化学反应速率。( )
×
提示 若把稀硫酸改为浓硫酸,与锌反应不能放出H2。
×
提示 通过长颈漏斗加入H2O2,反应产生的气体会从长颈漏斗口逸出,注射器中无法收集到气体。
(3)向H2O2溶液中加入MnO2,可以使生成O2的速率增大,是因为MnO2的催化作用。( )
(4)向两试管各加入5 mL 0.1 mol·L-1 Na2S2O3溶液,同时分别滴入5 mL 0.1 mol·L-1硫酸溶液和盐酸,两支试管同时变浑浊。( )
√
×
提示 Na2S2O3与稀盐酸或稀硫酸反应的实质都是 +2H+===
S↓+SO2↑+H2O,由于两试管分别滴入5 mL 0.1 mol·L-1硫酸溶液和盐酸,两试管中H+浓度不同,则两试管不能同时变浑浊,滴加硫酸的试管中应该首先变浑浊。
微思考2
自学教材“目前,科学家普遍认为”一段和图2-4。思考:
为什么催化剂可以加快化学反应的速率 使用催化剂能否改变化学反应的反应热
提示 催化剂可以降低化学反应的活化能,使更多的反应物分子成为活化分子,增大了单位体积内反应物分子中活化分子的数目,从而增大了化学反应速率。
使用催化剂不能改变化学反应的反应热。
易错辨析2
(1)活化能大的反应一定是吸热反应。( )
(2)发生有效碰撞的分子一定是活化分子。( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化。( )
(4)只要条件合适,普通分子之间的碰撞也可能是有效碰撞。( )
×
提示 吸热反应和放热反应取决于反应物和生成物的相对能量大小,与反应过程中的活化能大小无关。
√
×
提示 催化剂不能改变ΔH。
×
提示 普通分子能量较低,它们之间的碰撞都是无效的。
重难探究·能力素养全提升
探究一 外界条件对化学反应速率的影响
情境探究
以下是投篮球的三种情况:第一种,能量不够;第二种,方向不合适;第三种,足够的能量和合适的方向。化学反应也有类似的情况,碰撞理论认为改变外界条件可使单位体积内的活化分子数改变,从而使反应速率改变。
(1)为什么增大反应物的浓度会影响化学反应速率呢
(2)对于有气体参加的反应,增大压强一定能增大反应速率吗 为什么 如何理解“改变体系压强可改变反应速率”
提示 其他条件不变,当增大反应物的浓度时,单位体积中活化分子的数量增加,有效碰撞的频率增大,导致化学反应速率增大。
提示 其他条件不变时,有气体参加的反应,增大压强不一定增大反应物的浓度,如保持容器容积不变充入惰性气体,单位体积中活化分子的数量不变,有效碰撞的频率不变,则反应速率不变。如果通过缩小容器容积来增大压强,则单位体积中活化分子的数量增加,有效碰撞的频率增大,导致化学反应速率增大。
所以,只有改变了压强,导致反应物浓度改变时,才能改变化学反应速率。
(3)为什么温度的变化会影响化学反应速率
(4)一般情况下催化剂可加快化学反应速率,为什么使用催化剂会加快化学反应速率
提示 在其他条件不变时,升高温度,可以使反应物分子能量增大,一部分原来能量较低的普通分子变成活化分子,使活化分子百分数增加,有效碰撞次数增多,化学反应速率增大。
提示 在其他条件不变时,使用催化剂可以降低反应的活化能,使一部分能量较高的普通分子变成活化分子,使活化分子百分数增加,有效碰撞次数增多,化学反应速率增大。
方法突破
外界条件对化学反应速率的影响
名师点拨 外界条件对化学反应速率影响的易错点
(1)有固体参与的反应,增加少量固体,一般不考虑接触面积的改变,反应速率不变;但把块状固体粉碎、搅拌等可增大接触面积,加快反应速率。
(2)只有有气体参与的反应,改变压强才会引起反应速率的改变。
(3)压强对化学反应速率的影响是因为压强的改变引起了气体浓度的改变,导致反应速率发生改变,如果压强改变没有引起反应物浓度的改变,则反应速率不变。
应用体验
视角1碰撞理论与化学反应速率
1.下列说法正确的是( )
A.增大反应物浓度,可增加单位体积内活化分子的百分数,使有效碰撞次数增加
B.有气体参加的化学反应,若压缩容器容积来增大压强,可增加活化分子的百分数,从而使反应速率加快
C.升高温度能使化学反应速率加快,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,但能增加单位体积内活化分子百分数,加快反应速率
C
解析 增大反应物的浓度,单位体积内活化分子的个数增加,使有效碰撞次数增加,但活化分子的百分数不变,A错误;若压缩容器容积来增大压强,单位体积内活化分子的个数增加,使有效碰撞次数增加,反应速率加快,但活化分子的百分数不变,B错误;升高温度,增加了活化分子百分数,使有效碰撞次数增加,反应速率加快,C正确;催化剂能降低反应的活化能,增加活化分子百分数,使有效碰撞次数增加,反应速率加快,D错误。
视角2影响化学反应速率的因素
2.某温度下,在容积一定的密闭容器中进行如下反应:2X(g)+Y(g) Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.向容器中充入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的容积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
A
解析 向恒容密闭容器中充入氩气,各反应组分的浓度不变,反应速率不变,A项正确;W为固态,加入少量W,反应速率不变,B项错误;升高温度,正、逆反应速率均增大,C项错误;将容器的容积压缩,可增大单位体积内活化分子数和有效碰撞次数,但活化分子百分数不变,D项错误。
视角3化学反应速率图像比较
3.下列表格中的各种情况,可以用对应选项中的图像表示的是( )
选项 反应 甲 乙
A 外形、大小相近的金属和水反应 Na K
B 4 mL 0.01 mol·L-1 KMnO4溶液分别和不同浓度的2 mL H2C2O4(草酸)溶液反应 0.1 mol·L-1的 H2C2O4溶液 0.2 mol·L-1的
H2C2O4溶液
C 5 mL 0.1 mol·L-1 Na2S2O3溶液和5 mL 0.1 mol·L-1 H2SO4溶液反应 热水 冷水
D 5 mL 4%的过氧化氢溶液分解放出O2 无MnO2粉末 加MnO2粉末
C
解析 由于K比Na活泼,故大小相同的金属K和Na与水反应,K的反应速率更快,又由于Na、K与H2O反应均为放热反应,随着反应的进行,放出大量的热,反应速率逐渐加快,A项不正确;由于起始时乙中H2C2O4浓度大,故其反应速率比甲中快,B项不正确;由于甲反应是在热水中进行的,温度高,故甲的反应速率大于乙,随着反应的进行,反应物浓度逐渐减小,故甲、乙中反应速率逐渐减小,C项正确;MnO2在H2O2的分解过程中起催化作用,故乙的反应速率大于甲,D项不正确。
视角4影响化学反应速率因素的综合考查
4.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4=== Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
D
解析 当有多个外界条件时,要对比找出其相同条件和不同条件,然后通过比较进行判断。影响化学反应速率的因素很多,本题从浓度和温度两个因素考查,结合选项知混合溶液体积都为20 mL,混合液中稀硫酸浓度相等,Na2S2O3的浓度B=D>A=C,根据浓度越大、温度越高,反应速率越大,可以推知D选项正确。
易错提醒 比较反应速率大小时,注意浓度指的是混合液中反应物的浓度,而不是开始时所取的原反应物的浓度。混合液中物质浓度的计算方法:
探究二 实验探究影响化学反应速率的外界因素
情境探究
某化学课外小组探究外界条件对实验室用锌和稀硫酸反应制取H2时反应速率的影响:
实验要求:测量收集10 mL H2所需时间。
实验方案:设计如下表。
实验编号 T/K 锌的规格 H2SO4溶液的浓度
① 298 锌粒 1 mol·L-1 H2SO4溶液
② 298 锌粒 4 mol·L-1 H2SO4溶液
③ 298 锌粉 1 mol·L-1 H2SO4溶液
④ 298 锌粒 1 mol·L-1 H2SO4与少量CuSO4混合液
⑤ 348 锌粒 1 mol·L-1 H2SO4溶液
注意事项:(1)锌粒的质量和表面积力求相同。(2)每次实验取用20 mL H2SO4溶液。
(1)该实验方案主要探究哪些外界条件对化学反应速率的影响
(2)该实验方案中哪一方面最难做到
提示 浓度、温度、固体反应物的表面积、Zn-Cu原电池。
提示 锌粒的表面积相同。
(3)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,请从装置的缺陷的角度分析可能的原因,并帮助设计改进措施。
提示 原因:忽视加入硫酸排出气体的体积。
方法突破
“控制变量法”解答化学反应速率问题
应用体验
视角1“控制变量法规律”的确定
1.用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度(c)与时间(t)关系如图所示,下列说法不正确的是( )
实验编号 温度/℃ pH
① 25 1
② 45 1
③ 25 7
④ 25 1
A.实验①在0~15 min内M的降解速率为1.33×10-5 mol·L-1·min-1
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越大,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越大
答案 D
解析 由题图可知,实验①0~15 min内M的浓度变化量为(0.30-0.10)×10-3 mol·L-1=2.00×10-4 mol·L-1,则v(M)= ≈1.33×10-5
mol·L-1·min-1,A项正确;由题图中曲线变化可看出实验②相对于实验①,M的降解速率增大,由表中数据可知,其他条件相同,实验②的温度高于实验①,说明升高温度,M的降解速率增大,B项正确;由题图中曲线变化可看出实验①相对于实验③,M的降解速率增大,由表中数据可知,其他条件相同,实验③的pH大于实验①的pH,说明pH越大,越不利于M的降解,C项正确;根据图示可看出,M的起始浓度越小,降解速率越小,D项错误。
视角2“控制变量法规律”的设置方法
2.某同学做浓度对化学反应速率影响的实验时,将3支试管分别编号为①、②、③,并按下表中物质的量进行实验,记录数据如下表。
试管编号 加3% Na2S2O3溶液 加H2O 加H2SO4溶液(1∶5) 出现浑浊时间
① 3 mL 3 mL 5滴 33 s
② a mL 2 mL 5滴 28 s
③ 5 mL b mL 5滴 16 s
下列叙述不正确的是( )
A.该实验反应的化学方程式:Na2S2O3+H2SO4=== Na2SO4+S↓+SO2↑+H2O
B.Na2S2O3浓度越大,反应速率越快
C.a=4
D.b=2
D
解析 Na2S2O3中S的化合价为+2价,处于中间价态,既具有氧化性又具有还原性,在酸性条件下可发生氧化还原反应,化学方程式为Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,A项正确;根据表中信息可知在其他条件不变时,反应物的浓度越大,反应速率越快,B项正确;研究浓度对化学反应速率的影响,反应溶液的总体积应保持一致,②中加入水的体积为2 mL,根据①可知②中加入Na2S2O3溶液的体积应为4 mL,即a=4,C项正确;③中加入Na2S2O3溶液的体积是5 mL,所以加入水的体积应是6 mL-5 mL=1 mL,即b=1,D项错误。
本 课 结 束
第二章
第一节 第2课时 影响化学反应速率的因素 活化能
素养 目标
1.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响,能通过实验探究分析不同组分浓度改变对化学反应速率的影响,能用一定的理论模型说明外界条件改变对化学反应速率的影响,培养变化观念与平衡思想的化学核心素养。
2.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、影响化学反应速率的因素
1.内因(决定性因素)
在相同条件下,不同的化学反应会有不同的速率,这表明反应速率首先是由反应物的组成、结构和性质等因素决定的。
2.外界条件(其他条件不变,只改变一个条件)
增大
减小
增大
减小
2~4
改变
二、活化能
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中____________ 都称为基元反应。如2HI=== H2+I2的2个基元反应为2HI→H2+2I·、2I·→I2。
2.反应机理
先后进行的 反映了化学反应的反应历程,反应历程又称 。
反应历程中,反应最慢的基元反应决定反应速率,称为决速步
每一步反应
基元反应
反应机理
3.基元反应发生的先决条件
反应物的分子必须发生 ,但是并不是每一次碰撞都能发生化学反应。
4.有效碰撞
碰撞
越快
5.活化能和活化分子
6.反应物、生成物的能量与活化能的关系图
平均能量
活化能
放出的能量
逆反应
反应热
7.基元反应发生经历的过程
8.外界条件对化学反应速率影响的理论解释
分子总数
百分数
分子总数
百分数
微思考1
阅读教材“在一般情况下,当其他条件相同时”一段。思考:
对于反应C(s)+CO2(g) === 2CO(g)在一定温度和容积的密闭容器中反应,若只增加少量的炭,反应速率如何改变 若把块状的炭改为炭的粉末呢
提示 只增加少量的炭,反应速率不变,炭为固体,增加少量固体,反应速率不变。
把块状的炭改为炭的粉末,反应速率加快,因为块状的炭变为炭的粉末,接触面积增大,反应速率加快。
易错辨析1
(1)锌与硫酸反应时,硫酸的浓度越大,产生H2的速率越大。( )
(2)可用下图装置测定过氧化氢分解的化学反应速率。( )
×
提示 若把稀硫酸改为浓硫酸,与锌反应不能放出H2。
×
提示 通过长颈漏斗加入H2O2,反应产生的气体会从长颈漏斗口逸出,注射器中无法收集到气体。
(3)向H2O2溶液中加入MnO2,可以使生成O2的速率增大,是因为MnO2的催化作用。( )
(4)向两试管各加入5 mL 0.1 mol·L-1 Na2S2O3溶液,同时分别滴入5 mL 0.1 mol·L-1硫酸溶液和盐酸,两支试管同时变浑浊。( )
√
×
提示 Na2S2O3与稀盐酸或稀硫酸反应的实质都是 +2H+===
S↓+SO2↑+H2O,由于两试管分别滴入5 mL 0.1 mol·L-1硫酸溶液和盐酸,两试管中H+浓度不同,则两试管不能同时变浑浊,滴加硫酸的试管中应该首先变浑浊。
微思考2
自学教材“目前,科学家普遍认为”一段和图2-4。思考:
为什么催化剂可以加快化学反应的速率 使用催化剂能否改变化学反应的反应热
提示 催化剂可以降低化学反应的活化能,使更多的反应物分子成为活化分子,增大了单位体积内反应物分子中活化分子的数目,从而增大了化学反应速率。
使用催化剂不能改变化学反应的反应热。
易错辨析2
(1)活化能大的反应一定是吸热反应。( )
(2)发生有效碰撞的分子一定是活化分子。( )
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化。( )
(4)只要条件合适,普通分子之间的碰撞也可能是有效碰撞。( )
×
提示 吸热反应和放热反应取决于反应物和生成物的相对能量大小,与反应过程中的活化能大小无关。
√
×
提示 催化剂不能改变ΔH。
×
提示 普通分子能量较低,它们之间的碰撞都是无效的。
重难探究·能力素养全提升
探究一 外界条件对化学反应速率的影响
情境探究
以下是投篮球的三种情况:第一种,能量不够;第二种,方向不合适;第三种,足够的能量和合适的方向。化学反应也有类似的情况,碰撞理论认为改变外界条件可使单位体积内的活化分子数改变,从而使反应速率改变。
(1)为什么增大反应物的浓度会影响化学反应速率呢
(2)对于有气体参加的反应,增大压强一定能增大反应速率吗 为什么 如何理解“改变体系压强可改变反应速率”
提示 其他条件不变,当增大反应物的浓度时,单位体积中活化分子的数量增加,有效碰撞的频率增大,导致化学反应速率增大。
提示 其他条件不变时,有气体参加的反应,增大压强不一定增大反应物的浓度,如保持容器容积不变充入惰性气体,单位体积中活化分子的数量不变,有效碰撞的频率不变,则反应速率不变。如果通过缩小容器容积来增大压强,则单位体积中活化分子的数量增加,有效碰撞的频率增大,导致化学反应速率增大。
所以,只有改变了压强,导致反应物浓度改变时,才能改变化学反应速率。
(3)为什么温度的变化会影响化学反应速率
(4)一般情况下催化剂可加快化学反应速率,为什么使用催化剂会加快化学反应速率
提示 在其他条件不变时,升高温度,可以使反应物分子能量增大,一部分原来能量较低的普通分子变成活化分子,使活化分子百分数增加,有效碰撞次数增多,化学反应速率增大。
提示 在其他条件不变时,使用催化剂可以降低反应的活化能,使一部分能量较高的普通分子变成活化分子,使活化分子百分数增加,有效碰撞次数增多,化学反应速率增大。
方法突破
外界条件对化学反应速率的影响
名师点拨 外界条件对化学反应速率影响的易错点
(1)有固体参与的反应,增加少量固体,一般不考虑接触面积的改变,反应速率不变;但把块状固体粉碎、搅拌等可增大接触面积,加快反应速率。
(2)只有有气体参与的反应,改变压强才会引起反应速率的改变。
(3)压强对化学反应速率的影响是因为压强的改变引起了气体浓度的改变,导致反应速率发生改变,如果压强改变没有引起反应物浓度的改变,则反应速率不变。
应用体验
视角1碰撞理论与化学反应速率
1.下列说法正确的是( )
A.增大反应物浓度,可增加单位体积内活化分子的百分数,使有效碰撞次数增加
B.有气体参加的化学反应,若压缩容器容积来增大压强,可增加活化分子的百分数,从而使反应速率加快
C.升高温度能使化学反应速率加快,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,但能增加单位体积内活化分子百分数,加快反应速率
C
解析 增大反应物的浓度,单位体积内活化分子的个数增加,使有效碰撞次数增加,但活化分子的百分数不变,A错误;若压缩容器容积来增大压强,单位体积内活化分子的个数增加,使有效碰撞次数增加,反应速率加快,但活化分子的百分数不变,B错误;升高温度,增加了活化分子百分数,使有效碰撞次数增加,反应速率加快,C正确;催化剂能降低反应的活化能,增加活化分子百分数,使有效碰撞次数增加,反应速率加快,D错误。
视角2影响化学反应速率的因素
2.某温度下,在容积一定的密闭容器中进行如下反应:2X(g)+Y(g) Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.向容器中充入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的容积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
A
解析 向恒容密闭容器中充入氩气,各反应组分的浓度不变,反应速率不变,A项正确;W为固态,加入少量W,反应速率不变,B项错误;升高温度,正、逆反应速率均增大,C项错误;将容器的容积压缩,可增大单位体积内活化分子数和有效碰撞次数,但活化分子百分数不变,D项错误。
视角3化学反应速率图像比较
3.下列表格中的各种情况,可以用对应选项中的图像表示的是( )
选项 反应 甲 乙
A 外形、大小相近的金属和水反应 Na K
B 4 mL 0.01 mol·L-1 KMnO4溶液分别和不同浓度的2 mL H2C2O4(草酸)溶液反应 0.1 mol·L-1的 H2C2O4溶液 0.2 mol·L-1的
H2C2O4溶液
C 5 mL 0.1 mol·L-1 Na2S2O3溶液和5 mL 0.1 mol·L-1 H2SO4溶液反应 热水 冷水
D 5 mL 4%的过氧化氢溶液分解放出O2 无MnO2粉末 加MnO2粉末
C
解析 由于K比Na活泼,故大小相同的金属K和Na与水反应,K的反应速率更快,又由于Na、K与H2O反应均为放热反应,随着反应的进行,放出大量的热,反应速率逐渐加快,A项不正确;由于起始时乙中H2C2O4浓度大,故其反应速率比甲中快,B项不正确;由于甲反应是在热水中进行的,温度高,故甲的反应速率大于乙,随着反应的进行,反应物浓度逐渐减小,故甲、乙中反应速率逐渐减小,C项正确;MnO2在H2O2的分解过程中起催化作用,故乙的反应速率大于甲,D项不正确。
视角4影响化学反应速率因素的综合考查
4.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4=== Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
D
解析 当有多个外界条件时,要对比找出其相同条件和不同条件,然后通过比较进行判断。影响化学反应速率的因素很多,本题从浓度和温度两个因素考查,结合选项知混合溶液体积都为20 mL,混合液中稀硫酸浓度相等,Na2S2O3的浓度B=D>A=C,根据浓度越大、温度越高,反应速率越大,可以推知D选项正确。
易错提醒 比较反应速率大小时,注意浓度指的是混合液中反应物的浓度,而不是开始时所取的原反应物的浓度。混合液中物质浓度的计算方法:
探究二 实验探究影响化学反应速率的外界因素
情境探究
某化学课外小组探究外界条件对实验室用锌和稀硫酸反应制取H2时反应速率的影响:
实验要求:测量收集10 mL H2所需时间。
实验方案:设计如下表。
实验编号 T/K 锌的规格 H2SO4溶液的浓度
① 298 锌粒 1 mol·L-1 H2SO4溶液
② 298 锌粒 4 mol·L-1 H2SO4溶液
③ 298 锌粉 1 mol·L-1 H2SO4溶液
④ 298 锌粒 1 mol·L-1 H2SO4与少量CuSO4混合液
⑤ 348 锌粒 1 mol·L-1 H2SO4溶液
注意事项:(1)锌粒的质量和表面积力求相同。(2)每次实验取用20 mL H2SO4溶液。
(1)该实验方案主要探究哪些外界条件对化学反应速率的影响
(2)该实验方案中哪一方面最难做到
提示 浓度、温度、固体反应物的表面积、Zn-Cu原电池。
提示 锌粒的表面积相同。
(3)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,请从装置的缺陷的角度分析可能的原因,并帮助设计改进措施。
提示 原因:忽视加入硫酸排出气体的体积。
方法突破
“控制变量法”解答化学反应速率问题
应用体验
视角1“控制变量法规律”的确定
1.用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度(c)与时间(t)关系如图所示,下列说法不正确的是( )
实验编号 温度/℃ pH
① 25 1
② 45 1
③ 25 7
④ 25 1
A.实验①在0~15 min内M的降解速率为1.33×10-5 mol·L-1·min-1
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越大,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越大
答案 D
解析 由题图可知,实验①0~15 min内M的浓度变化量为(0.30-0.10)×10-3 mol·L-1=2.00×10-4 mol·L-1,则v(M)= ≈1.33×10-5
mol·L-1·min-1,A项正确;由题图中曲线变化可看出实验②相对于实验①,M的降解速率增大,由表中数据可知,其他条件相同,实验②的温度高于实验①,说明升高温度,M的降解速率增大,B项正确;由题图中曲线变化可看出实验①相对于实验③,M的降解速率增大,由表中数据可知,其他条件相同,实验③的pH大于实验①的pH,说明pH越大,越不利于M的降解,C项正确;根据图示可看出,M的起始浓度越小,降解速率越小,D项错误。
视角2“控制变量法规律”的设置方法
2.某同学做浓度对化学反应速率影响的实验时,将3支试管分别编号为①、②、③,并按下表中物质的量进行实验,记录数据如下表。
试管编号 加3% Na2S2O3溶液 加H2O 加H2SO4溶液(1∶5) 出现浑浊时间
① 3 mL 3 mL 5滴 33 s
② a mL 2 mL 5滴 28 s
③ 5 mL b mL 5滴 16 s
下列叙述不正确的是( )
A.该实验反应的化学方程式:Na2S2O3+H2SO4=== Na2SO4+S↓+SO2↑+H2O
B.Na2S2O3浓度越大,反应速率越快
C.a=4
D.b=2
D
解析 Na2S2O3中S的化合价为+2价,处于中间价态,既具有氧化性又具有还原性,在酸性条件下可发生氧化还原反应,化学方程式为Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,A项正确;根据表中信息可知在其他条件不变时,反应物的浓度越大,反应速率越快,B项正确;研究浓度对化学反应速率的影响,反应溶液的总体积应保持一致,②中加入水的体积为2 mL,根据①可知②中加入Na2S2O3溶液的体积应为4 mL,即a=4,C项正确;③中加入Na2S2O3溶液的体积是5 mL,所以加入水的体积应是6 mL-5 mL=1 mL,即b=1,D项错误。
本 课 结 束
