3.1.1 强电解质和弱电解质 弱电解质的电离平衡 课件(共38张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 3.1.1 强电解质和弱电解质 弱电解质的电离平衡 课件(共38张PPT) 2023-2024学年高二化学人教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:34:43 | ||
图片预览








文档简介
(共38张PPT)
第三章
第一节 第1课时 强电解质和弱电解质 弱电解质的电离平衡
素养 目标
1.能准确判断强电解质和弱电解质,认识电解质在水溶液中存在电离平衡,能正确书写弱电解质的电离方程式,培养宏观辨识与微观探析、变化观念与平衡思想的化学核心素养。
2.能从电离、离子反应、化学平衡的角度分析溶液的性质,如导电性等,培养变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、强电解质和弱电解质
1.盐酸和醋酸的比较
(1)实验(pH:填写“大”或“小”;导电能力:填写“强”或“弱”)
酸溶液 0.1 mol·L-1盐酸 0.1 mol·L-1醋酸
pH
导电能力
与镁条反 应的现象 反应 反应
小
大
强
弱
剧烈
不剧烈
(2)实验结论
①盐酸中c(H+) 醋酸中c(H+),即盐酸中HCl的电离程度比醋酸中CH3COOH的电离程度 ;
②相同浓度的盐酸与醋酸比较,HCl 电离,CH3COOH 电离。
大于
大
全部
部分
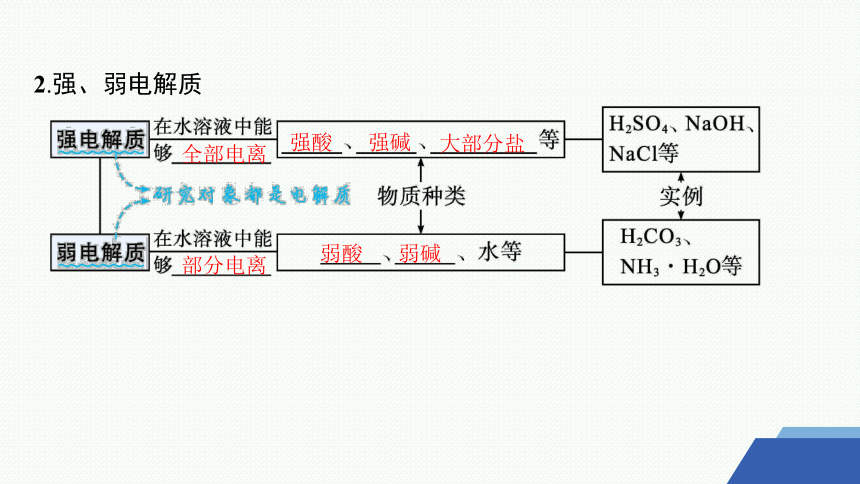
2.强、弱电解质
全部电离
强酸
强碱
大部分盐
部分电离
弱酸
弱碱
二、弱电解质的电离平衡
1.电离方程式的书写
(1)强电解质
完全电离,在写电离方程式时,用“===”。如NaCl的电离方程式为NaCl=== Na++Cl-。
(2)弱电解质
部分电离,在写电离方程式时,用“ ”。
①一元弱酸、弱碱一步电离。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
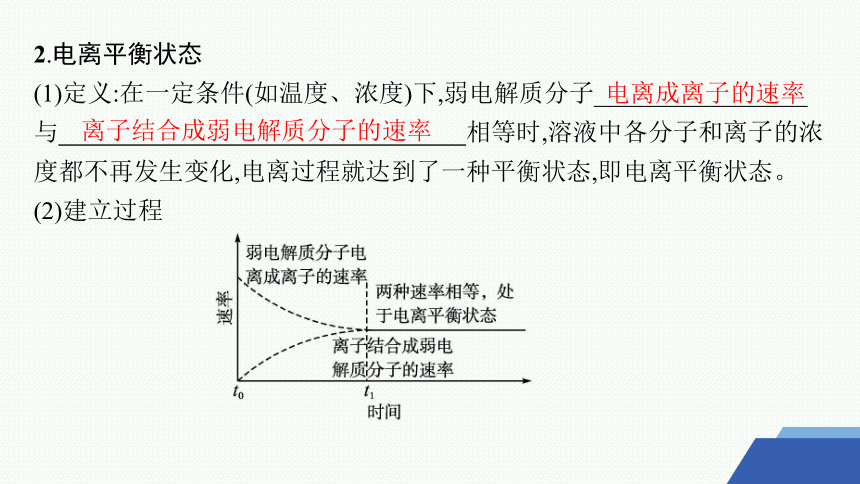
2.电离平衡状态
(1)定义:在一定条件(如温度、浓度)下,弱电解质分子_________________ 与 相等时,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了一种平衡状态,即电离平衡状态。
(2)建立过程
电离成离子的速率
离子结合成弱电解质分子的速率
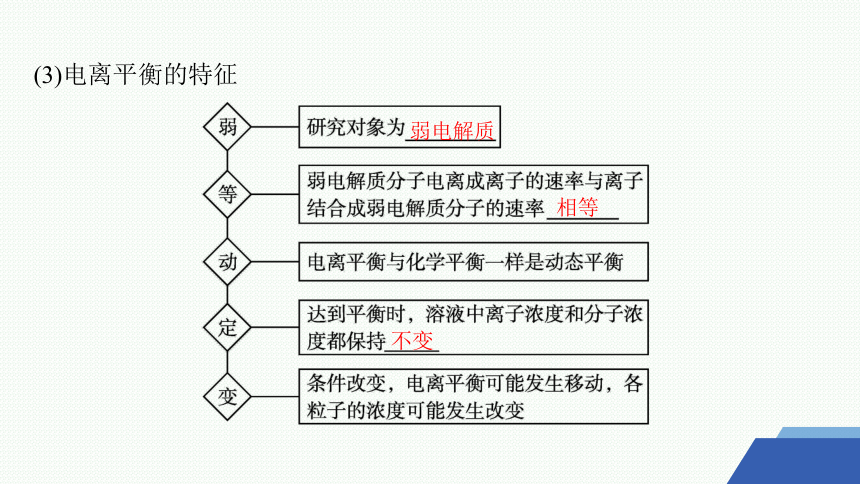
(3)电离平衡的特征
弱电解质
相等
不变
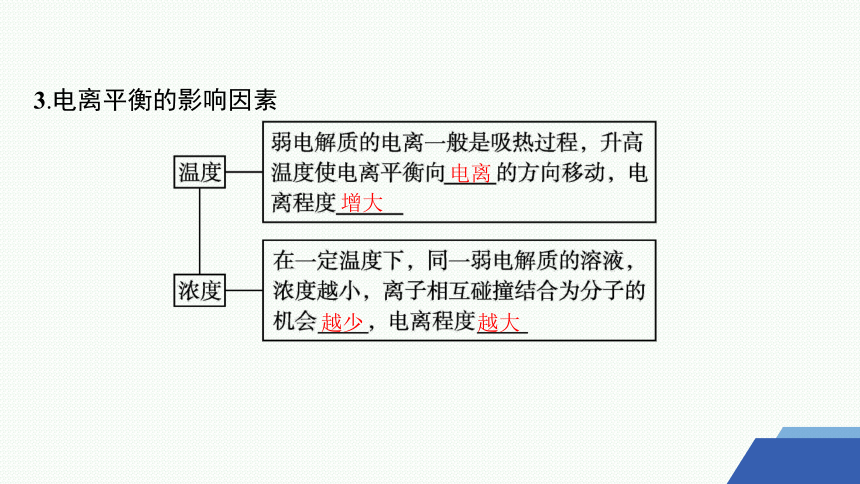
3.电离平衡的影响因素
电离
增大
越少
越大
微思考1
阅读教材图3-1、3-2。思考:两种溶液中有无溶质分子 判断HCl、CH3COOH分别是强电解质还是弱电解质
提示 HCl在水中完全电离,溶液中无HCl分子,HCl为强电解质;CH3COOH在水中部分电离,溶液中有醋酸分子,CH3COOH为弱电解质。
易错辨析1
(1)NaCl溶液能导电,所以NaCl溶液是电解质。( )
(2)BaSO4难溶于水,其水溶液导电性很差,所以BaSO4是弱电解质。( )
(3)NH3溶于水能导电,所以NH3是电解质。( )
(4)强电解质在水溶液中不存在溶质分子,而弱电解质在水溶液中存在溶质分子。( )
×
提示 NaCl溶液是混合物,不是电解质,NaCl溶液中的NaCl是电解质。
×
提示 BaSO4难溶于水,但溶解的部分是完全电离的,因此BaSO4是强电解质。
×
提示 NH3溶于水导电是因为NH3与水反应生成NH3·H2O发生电离,产生的
和OH-能导电;液态的NH3不能导电,因此NH3不是电解质。
√
微思考2
自学教材“二、弱电解质的电离平衡”最后一段。思考:在稀醋酸中加入少量水,醋酸的电离平衡如何移动 溶液中CH3COOH、H+、CH3COO-的物质的量以及物质的量浓度如何变化
提示 CH3COOH在溶液中存在电离平衡:CH3COOH CH3COO-+H+,加水稀释时,平衡正向移动,CH3COOH的物质的量减少,H+和CH3COO-的物质的量增加;由于加水稀释,溶液体积增大,导致CH3COOH、H+、CH3COO-的物质的量浓度均减少。
知识拓展
(1)电解质在熔融状态下的电离,一般只断裂离子键,共价键不能断裂。例
(3)含氧酸分子中氢原子数与酸的元数不一定相等,如H3PO2(次磷酸,结构式为 ),分子中虽然含有3个H,但只有一个—OH能发生电离,故属于一元酸。
易错辨析2
(1)电离平衡右移,弱电解质分子的浓度一定减小,离子浓度不一定增大。
( )
(2)电离平衡向右移动,弱电解质的电离程度一定增大。( )
×
×
提示 向稀醋酸中加入少量浓醋酸,醋酸的电离平衡向右移动,但醋酸的电离程度减小。
×
√
重难探究·能力素养全提升
探究一 电解质的分类与电离
情境探究
某化学课外活动小组设计实验探究溶液导电性与离子浓度的关系。实验装置如图所示,根据所学知识回答下列问题。
(1)两溶液为什么能导电
(2)接通电源后a、b两个灯泡哪个更亮 试分析原因。
(3)向烧杯①中加入适量NaOH(s)与CH3COOH恰好完全反应,能看到什么现象 试分析原因。
提示 溶液中存在自由移动的离子。
提示 b灯泡更亮。CH3COOH是弱电解质,HCl是强电解质。相同浓度的盐酸和醋酸中,盐酸中离子浓度更大,溶液导电性更强。
提示 a灯泡变亮。CH3COOH+NaOH===CH3COONa+H2O,原溶液中CH3COOH为弱电解质,部分电离,恰好完全反应后生成CH3COONa,CH3COONa为强电解质,使烧杯①的溶液中离子浓度增大,溶液导电性增强。
方法突破
1.强、弱电解质的比较
2.电离方程式的书写
应用体验
视角1强、弱电解质的判断
1.下列各组物质中都是弱电解质的是( )
A.NH4Cl、HCl、CaCO3
B.HF、NH3·H2O、H2S
C.NaOH、Ca(OH)2、Ba(OH)2
D.HClO、NH4F、Na2SO3
B
解析 NH4Cl、HCl、CaCO3均为强电解质,故A不符合题意;HF、NH3·H2O、H2S均为弱电解质,故B符合题意;NaOH、Ca(OH)2、Ba(OH)2都是强碱,是强电解质,故C不符合题意;HClO是弱电解质,NH4F、Na2SO3是强电解质,故D不符合题意。
视角2电解质溶液的组成及其导电性
2.下列说法正确的是( )
A.强电解质溶液的导电性一定比弱电解质溶液的强
B.活泼金属氧化物属于电解质是因为熔融状态下可以导电
C.强酸属于强电解质,所以它们在熔融状态也可以导电
D.BaSO4饱和溶液几乎不导电,因此BaSO4不是电解质
B
解析 溶液的导电性与离子浓度有关,强电解质溶液的导电性不一定比弱电解质溶液的强,故A错误;活泼金属氧化物在熔融状态下可以导电,所以活泼金属氧化物属于电解质,故B正确;酸是共价化合物,在熔融状态下不能电离,酸在熔融状态下不导电,故C错误;BaSO4在熔融状态下能导电,因此BaSO4是电解质,故D错误。
易错提醒 (1)电解质的强弱与电解质的溶解性无关,像CaCO3、BaSO4等难溶于水,但在水溶液中溶解的部分完全电离,因此属于强电解质。
(2)电解质溶液的导电性与电解质的强弱没有直接关系,电解质溶液的导电性与溶液中离子的浓度有关,因此浓度很小的强电解质溶液,离子浓度很小,则导电性很弱。
视角3电离方程式的书写
3.下列电离方程式的书写正确的是( )
C
探究二 电离平衡的影响因素
情境探究
弱电解质电离过程中正、逆方向速率随时间的变化:
(1)根据上图及化学平衡理论,写出一元弱酸(HA)和一元弱碱(BOH)的电离方程式。
(2)升高温度对弱酸的电离平衡有何影响 为什么
提示 升温能促进弱酸的电离,因为弱电解质的电离一般是吸热的,因此升高温度时电离平衡向电离的方向移动,弱电解质的电离程度将增大。
(3)若在t1时刻升高到一定温度,画出再次达到平衡时的v-t图像。
提示
方法突破
电离平衡移动(符合勒夏特列原理)
以CH3COOH CH3COO-+H+为例:当外界条件(如浓度、温度等)发生变化时,电离平衡就会发生移动。弱电解质的电离平衡移动遵循化学平衡移动原理。
影响因素 平衡移动方向 n(H+) c(H+) c(CH3COO-) 导电能力
升温(不考虑挥发) 右 增大 增大 增大 增强
加冰醋酸 右 增大 增大 增大 增强
加入 其他 物质 CH3COONa固体 左 减小 减小 增大 增强
通HCl气体 左 增大 增大 减小 增强
NaOH固体 右 减小 减小 增大 增强
加水稀释 右 增大 减小 减小 减弱
应用体验
视角1弱电解质的电离平衡
A.加水稀释后,溶液中n(OH-)增大
B.加入少量浓盐酸,电离平衡正向移动,溶液中c(OH-)增大
C.加入少量浓NaOH溶液,电离平衡正向移动
D.加入少量NH4Cl固体,溶液中c( )减小
A
解析 向氨水中加入水,促进了NH3·H2O的电离,所以溶液中n(OH-)增大,A正确;向氨水中加入少量浓盐酸,H+与OH-反应,导致溶液中c(OH-)减小,B错误;向氨水中加入少量浓NaOH溶液,OH-浓度增大,则NH3·H2O的电离平衡逆向移动,C错误;向氨水中加入少量NH4Cl固体,溶液中c( )增大,D错误。
2.一定条件下,给冰醋酸加水稀释过程中溶液的导电能力如图所示,下列说法正确的是( )
A.最开始导电能力为0,说明冰醋酸不能导电,是非电解质
B.a、b、c三点对应的溶液中,电离程度最大的是c
C.a、b、c三点对应的溶液中,pH最大的是b
D.b→c的过程中,c(H+)在增大
B
解析 CH3COOH是弱电解质,冰醋酸中只存在分子,不存在离子,所以最开始导电能力为0,故A错误;CH3COOH是弱电解质,在溶液中部分电离出醋酸根离子和氢离子,醋酸浓度越小,电离程度越大,由图可知,c点醋酸浓度最小,电离程度最大,故B正确;CH3COOH溶液的导电能力越强,溶液中氢离子浓度越大,溶液pH越小,由图可知,b点导电能力最强,溶液中氢离子浓度最大,溶液pH最小,故C错误;b→c的过程中,溶液导电能力减弱,溶液中氢离子浓度减小,故D错误。
易错提醒 弱电解质溶液在稀释过程中,弱电解质电离程度增大,即“越稀越电离”;相反,向弱电解质稀溶液中加入该弱电解质或其浓溶液,平衡向电离方向移动,但电离程度减小。
视角2判断弱电解质的方法
3.能说明CH3COOH是弱电解质的事实是( )
A.醋酸的导电性比盐酸弱
B.0.1 mol·L-1的醋酸中H+浓度约为0.001 mol·L-1
C.醋酸用水稀释后,溶液的pH增大
D.醋酸与碳酸钙反应,缓慢放出二氧化碳
B
解析 溶液的导电性与浓度有关,未说明浓度的相对大小,A不符合题意;0.1 mol·L-1的醋酸中H+浓度约为0.001 mol·L-1,说明CH3COOH未完全电离,即说明CH3COOH是弱电解质,B符合题意;强酸、弱酸加水稀释后溶液的酸性都会减弱,C不符合题意;醋酸与碳酸钙反应,缓慢放出二氧化碳说明CH3COOH的酸性比H2CO3酸性强,不能说明CH3COOH是弱酸,即不能说明CH3COOH是弱电解质,D不符合题意。
本 课 结 束
第三章
第一节 第1课时 强电解质和弱电解质 弱电解质的电离平衡
素养 目标
1.能准确判断强电解质和弱电解质,认识电解质在水溶液中存在电离平衡,能正确书写弱电解质的电离方程式,培养宏观辨识与微观探析、变化观念与平衡思想的化学核心素养。
2.能从电离、离子反应、化学平衡的角度分析溶液的性质,如导电性等,培养变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、强电解质和弱电解质
1.盐酸和醋酸的比较
(1)实验(pH:填写“大”或“小”;导电能力:填写“强”或“弱”)
酸溶液 0.1 mol·L-1盐酸 0.1 mol·L-1醋酸
pH
导电能力
与镁条反 应的现象 反应 反应
小
大
强
弱
剧烈
不剧烈
(2)实验结论
①盐酸中c(H+) 醋酸中c(H+),即盐酸中HCl的电离程度比醋酸中CH3COOH的电离程度 ;
②相同浓度的盐酸与醋酸比较,HCl 电离,CH3COOH 电离。
大于
大
全部
部分
2.强、弱电解质
全部电离
强酸
强碱
大部分盐
部分电离
弱酸
弱碱
二、弱电解质的电离平衡
1.电离方程式的书写
(1)强电解质
完全电离,在写电离方程式时,用“===”。如NaCl的电离方程式为NaCl=== Na++Cl-。
(2)弱电解质
部分电离,在写电离方程式时,用“ ”。
①一元弱酸、弱碱一步电离。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
2.电离平衡状态
(1)定义:在一定条件(如温度、浓度)下,弱电解质分子_________________ 与 相等时,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了一种平衡状态,即电离平衡状态。
(2)建立过程
电离成离子的速率
离子结合成弱电解质分子的速率
(3)电离平衡的特征
弱电解质
相等
不变
3.电离平衡的影响因素
电离
增大
越少
越大
微思考1
阅读教材图3-1、3-2。思考:两种溶液中有无溶质分子 判断HCl、CH3COOH分别是强电解质还是弱电解质
提示 HCl在水中完全电离,溶液中无HCl分子,HCl为强电解质;CH3COOH在水中部分电离,溶液中有醋酸分子,CH3COOH为弱电解质。
易错辨析1
(1)NaCl溶液能导电,所以NaCl溶液是电解质。( )
(2)BaSO4难溶于水,其水溶液导电性很差,所以BaSO4是弱电解质。( )
(3)NH3溶于水能导电,所以NH3是电解质。( )
(4)强电解质在水溶液中不存在溶质分子,而弱电解质在水溶液中存在溶质分子。( )
×
提示 NaCl溶液是混合物,不是电解质,NaCl溶液中的NaCl是电解质。
×
提示 BaSO4难溶于水,但溶解的部分是完全电离的,因此BaSO4是强电解质。
×
提示 NH3溶于水导电是因为NH3与水反应生成NH3·H2O发生电离,产生的
和OH-能导电;液态的NH3不能导电,因此NH3不是电解质。
√
微思考2
自学教材“二、弱电解质的电离平衡”最后一段。思考:在稀醋酸中加入少量水,醋酸的电离平衡如何移动 溶液中CH3COOH、H+、CH3COO-的物质的量以及物质的量浓度如何变化
提示 CH3COOH在溶液中存在电离平衡:CH3COOH CH3COO-+H+,加水稀释时,平衡正向移动,CH3COOH的物质的量减少,H+和CH3COO-的物质的量增加;由于加水稀释,溶液体积增大,导致CH3COOH、H+、CH3COO-的物质的量浓度均减少。
知识拓展
(1)电解质在熔融状态下的电离,一般只断裂离子键,共价键不能断裂。例
(3)含氧酸分子中氢原子数与酸的元数不一定相等,如H3PO2(次磷酸,结构式为 ),分子中虽然含有3个H,但只有一个—OH能发生电离,故属于一元酸。
易错辨析2
(1)电离平衡右移,弱电解质分子的浓度一定减小,离子浓度不一定增大。
( )
(2)电离平衡向右移动,弱电解质的电离程度一定增大。( )
×
×
提示 向稀醋酸中加入少量浓醋酸,醋酸的电离平衡向右移动,但醋酸的电离程度减小。
×
√
重难探究·能力素养全提升
探究一 电解质的分类与电离
情境探究
某化学课外活动小组设计实验探究溶液导电性与离子浓度的关系。实验装置如图所示,根据所学知识回答下列问题。
(1)两溶液为什么能导电
(2)接通电源后a、b两个灯泡哪个更亮 试分析原因。
(3)向烧杯①中加入适量NaOH(s)与CH3COOH恰好完全反应,能看到什么现象 试分析原因。
提示 溶液中存在自由移动的离子。
提示 b灯泡更亮。CH3COOH是弱电解质,HCl是强电解质。相同浓度的盐酸和醋酸中,盐酸中离子浓度更大,溶液导电性更强。
提示 a灯泡变亮。CH3COOH+NaOH===CH3COONa+H2O,原溶液中CH3COOH为弱电解质,部分电离,恰好完全反应后生成CH3COONa,CH3COONa为强电解质,使烧杯①的溶液中离子浓度增大,溶液导电性增强。
方法突破
1.强、弱电解质的比较
2.电离方程式的书写
应用体验
视角1强、弱电解质的判断
1.下列各组物质中都是弱电解质的是( )
A.NH4Cl、HCl、CaCO3
B.HF、NH3·H2O、H2S
C.NaOH、Ca(OH)2、Ba(OH)2
D.HClO、NH4F、Na2SO3
B
解析 NH4Cl、HCl、CaCO3均为强电解质,故A不符合题意;HF、NH3·H2O、H2S均为弱电解质,故B符合题意;NaOH、Ca(OH)2、Ba(OH)2都是强碱,是强电解质,故C不符合题意;HClO是弱电解质,NH4F、Na2SO3是强电解质,故D不符合题意。
视角2电解质溶液的组成及其导电性
2.下列说法正确的是( )
A.强电解质溶液的导电性一定比弱电解质溶液的强
B.活泼金属氧化物属于电解质是因为熔融状态下可以导电
C.强酸属于强电解质,所以它们在熔融状态也可以导电
D.BaSO4饱和溶液几乎不导电,因此BaSO4不是电解质
B
解析 溶液的导电性与离子浓度有关,强电解质溶液的导电性不一定比弱电解质溶液的强,故A错误;活泼金属氧化物在熔融状态下可以导电,所以活泼金属氧化物属于电解质,故B正确;酸是共价化合物,在熔融状态下不能电离,酸在熔融状态下不导电,故C错误;BaSO4在熔融状态下能导电,因此BaSO4是电解质,故D错误。
易错提醒 (1)电解质的强弱与电解质的溶解性无关,像CaCO3、BaSO4等难溶于水,但在水溶液中溶解的部分完全电离,因此属于强电解质。
(2)电解质溶液的导电性与电解质的强弱没有直接关系,电解质溶液的导电性与溶液中离子的浓度有关,因此浓度很小的强电解质溶液,离子浓度很小,则导电性很弱。
视角3电离方程式的书写
3.下列电离方程式的书写正确的是( )
C
探究二 电离平衡的影响因素
情境探究
弱电解质电离过程中正、逆方向速率随时间的变化:
(1)根据上图及化学平衡理论,写出一元弱酸(HA)和一元弱碱(BOH)的电离方程式。
(2)升高温度对弱酸的电离平衡有何影响 为什么
提示 升温能促进弱酸的电离,因为弱电解质的电离一般是吸热的,因此升高温度时电离平衡向电离的方向移动,弱电解质的电离程度将增大。
(3)若在t1时刻升高到一定温度,画出再次达到平衡时的v-t图像。
提示
方法突破
电离平衡移动(符合勒夏特列原理)
以CH3COOH CH3COO-+H+为例:当外界条件(如浓度、温度等)发生变化时,电离平衡就会发生移动。弱电解质的电离平衡移动遵循化学平衡移动原理。
影响因素 平衡移动方向 n(H+) c(H+) c(CH3COO-) 导电能力
升温(不考虑挥发) 右 增大 增大 增大 增强
加冰醋酸 右 增大 增大 增大 增强
加入 其他 物质 CH3COONa固体 左 减小 减小 增大 增强
通HCl气体 左 增大 增大 减小 增强
NaOH固体 右 减小 减小 增大 增强
加水稀释 右 增大 减小 减小 减弱
应用体验
视角1弱电解质的电离平衡
A.加水稀释后,溶液中n(OH-)增大
B.加入少量浓盐酸,电离平衡正向移动,溶液中c(OH-)增大
C.加入少量浓NaOH溶液,电离平衡正向移动
D.加入少量NH4Cl固体,溶液中c( )减小
A
解析 向氨水中加入水,促进了NH3·H2O的电离,所以溶液中n(OH-)增大,A正确;向氨水中加入少量浓盐酸,H+与OH-反应,导致溶液中c(OH-)减小,B错误;向氨水中加入少量浓NaOH溶液,OH-浓度增大,则NH3·H2O的电离平衡逆向移动,C错误;向氨水中加入少量NH4Cl固体,溶液中c( )增大,D错误。
2.一定条件下,给冰醋酸加水稀释过程中溶液的导电能力如图所示,下列说法正确的是( )
A.最开始导电能力为0,说明冰醋酸不能导电,是非电解质
B.a、b、c三点对应的溶液中,电离程度最大的是c
C.a、b、c三点对应的溶液中,pH最大的是b
D.b→c的过程中,c(H+)在增大
B
解析 CH3COOH是弱电解质,冰醋酸中只存在分子,不存在离子,所以最开始导电能力为0,故A错误;CH3COOH是弱电解质,在溶液中部分电离出醋酸根离子和氢离子,醋酸浓度越小,电离程度越大,由图可知,c点醋酸浓度最小,电离程度最大,故B正确;CH3COOH溶液的导电能力越强,溶液中氢离子浓度越大,溶液pH越小,由图可知,b点导电能力最强,溶液中氢离子浓度最大,溶液pH最小,故C错误;b→c的过程中,溶液导电能力减弱,溶液中氢离子浓度减小,故D错误。
易错提醒 弱电解质溶液在稀释过程中,弱电解质电离程度增大,即“越稀越电离”;相反,向弱电解质稀溶液中加入该弱电解质或其浓溶液,平衡向电离方向移动,但电离程度减小。
视角2判断弱电解质的方法
3.能说明CH3COOH是弱电解质的事实是( )
A.醋酸的导电性比盐酸弱
B.0.1 mol·L-1的醋酸中H+浓度约为0.001 mol·L-1
C.醋酸用水稀释后,溶液的pH增大
D.醋酸与碳酸钙反应,缓慢放出二氧化碳
B
解析 溶液的导电性与浓度有关,未说明浓度的相对大小,A不符合题意;0.1 mol·L-1的醋酸中H+浓度约为0.001 mol·L-1,说明CH3COOH未完全电离,即说明CH3COOH是弱电解质,B符合题意;强酸、弱酸加水稀释后溶液的酸性都会减弱,C不符合题意;醋酸与碳酸钙反应,缓慢放出二氧化碳说明CH3COOH的酸性比H2CO3酸性强,不能说明CH3COOH是弱酸,即不能说明CH3COOH是弱电解质,D不符合题意。
本 课 结 束
