3.2.2 酸碱中和滴定 课件(共44张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 3.2.2 酸碱中和滴定 课件(共44张PPT) 2023-2024学年高二化学人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:36:21 | ||
图片预览











文档简介
(共44张PPT)
第三章
第一节 第2课时 酸碱中和滴定
素养 目标
1.了解酸碱中和滴定的原理,熟记酸碱中和滴定的主要仪器的名称及用途,培养科学探究与创新意识的化学核心素养。
2.掌握酸碱中和滴定的实验操作、计算方法和误差分析,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
酸碱中和滴定
1.定义
依据 ,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
2.原理
在中和反应中,酸提供的H+与碱提供的OH-的 相等,即:c(H+)·V酸
中和反应
物质的量
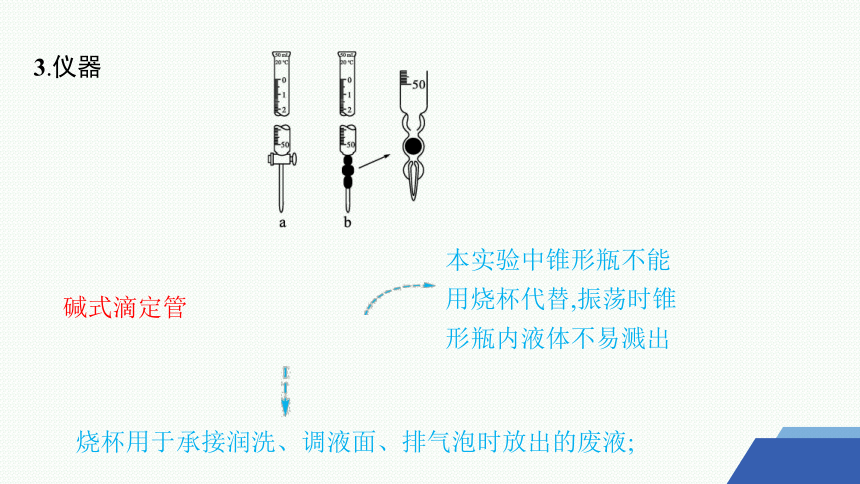
3.仪器
烧杯用于承接润洗、调液面、排气泡时放出的废液;
本实验中锥形瓶不能用烧杯代替,振荡时锥形瓶内液体不易溅出
碱式滴定管
4.酸碱中和滴定曲线
例如,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的HCl溶液。开始时HCl溶液的浓度较大,加入少量的NaOH溶液,对其pH影响 ,当接近滴定终点时,很少量的碱会引起溶液的pH ,此时指示剂的颜色 变化。
不大
突变
明显
5.实验数据的处理(以用标准盐酸滴定NaOH溶液为例)
重复实验2~3次,计算出每一次实验中消耗盐酸的平均体积,然后根据
微思考
阅读教材“酸碱中和滴定”和“实验活动2 强酸与强碱的中和滴定”。思考:在酸碱中和滴定实验中,需要测定哪些实验数据
提示 酸溶液的体积和碱溶液的体积。以用标准盐酸滴定未知浓度的NaOH溶液为例,用碱式滴定管量取一定体积的NaOH溶液放在锥形瓶中,用标准盐酸进行滴定,根据盐酸起始读数和滴定终点读数,确定所用标准盐酸的体积。
知识拓展
滴定管的选用
(1)酸式滴定管只能盛装酸性溶液或氧化性溶液,不能用于盛装碱性溶液,因为碱性溶液易腐蚀玻璃,导致玻璃旋塞无法旋开。
(2)碱式滴定管用于盛装碱性溶液,不能用于盛装酸性溶液或氧化性溶液,因为酸性溶液或氧化性溶液会腐蚀橡皮管。
(3)见光易分解的溶液应盛装在棕色滴定管中。
易错辨析
(1)任何酸、碱反应的离子方程式都可写作H++OH-=== H2O。( )
(2)酸式滴定管可用于量取酸性溶液,碱式滴定管可用于量取碱性溶液。
( )
(3)酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差。( )
(4)在进行中和滴定时,需要重复2~3次实验,取平均值进行计算。( )
×
提示 酸碱反应的离子方程式中,弱酸、弱碱应写成分子的形式,而且强酸、强碱反应的离子方程式也可能不是H++OH-===H2O形式,如稀硫酸与Ba(OH)2溶液反应。
√
×
提示 锥形瓶不能用待滴定溶液润洗。
√
重难探究·能力素养全提升
探究一 酸碱中和滴定实验的关键及重要操作
情境探究
根据酸式滴定管和碱式滴定管的结构可知,酸式滴定管下部是磨砂玻璃塞,碱式滴定管下部是一段乳胶管,内有玻璃球。
(1)滴定管的最小刻度是多少 mL 与量筒相比较其刻度值分布有何特点
提示 滴定管最小刻度为0.1 mL,读数时应估读到0.01 mL。量筒的刻度值分布是从下往上逐渐增大,滴定管的刻度值分布是从上往下逐渐增大。
(2)根据酸式滴定管和碱式滴定管的结构分析,为什么两种滴定管不能交换使用 在实验室中若要准确量取5.00 mL KMnO4溶液和5.00 mL苯,应分别选用哪种滴定管
(3)某一50.00 mL的酸式滴定管液面的读数是25.00 mL,若将溶液全部放完,则放出溶液的体积是25.00 mL吗
提示 因为酸式滴定管有磨砂的玻璃活塞,容易被碱液腐蚀,把滴定管和活塞粘在一起;碱式滴定管有乳胶管,容易被酸性溶液腐蚀,因此酸式滴定管不能用来量取碱性溶液,碱式滴定管不能用来量取酸性溶液。
都应选用酸式滴定管。因为KMnO4为强氧化剂,会腐蚀乳胶管;苯为有机溶剂,会溶解乳胶管,因此不能使用碱式滴定管。
提示 不是。要大于25.00 mL,因为酸式滴定管最大刻度线下面有一定量的液体,所以放出溶液的体积大于25.00 mL。
方法突破
名师点拨 滴定管排气泡的方法
除去酸式滴定管中的气泡:旋转活塞,迅速放液,使尖嘴部分充满溶液。
除去碱式滴定管中的气泡:弯曲乳胶管,轻轻挤压玻璃球,使尖嘴部分充满溶液,如下图所示:
应用体验
视角1中和滴定的实验仪器的使用
1.[2023浙江衢州高二校期末联考]酸碱中和滴定实验中不需要的仪器是
( )
A
解析 进行酸碱中和滴定实验时需使用的仪器有铁架台、碱式滴定管、酸式滴定管、滴定管夹、锥形瓶,不使用量筒,答案选A。
视角2中和滴定实验的基本操作
2.用0.100 0 mol·L-1 HCl溶液滴定未知浓度的KOH溶液。有关该实验说法正确的是( )
A.用图中的a滴定管盛装0.100 0 mol·L-1 HCl溶液
B.滴定前,需用未知浓度的KOH溶液润洗锥形瓶2~3次
C.滴定时,眼睛要注视滴定管中液面的变化
D.滴定过程中,若滴定管漏液,测量结果偏高
D
解析 盐酸需要用酸式滴定管盛装,即用图中的b滴定管盛装,故A错误;用未知浓度的KOH溶液润洗锥形瓶2~3次,导致锥形瓶中KOH的物质的量偏大,测定结果偏高,所以锥形瓶不能润洗,故B错误;滴定时,眼睛要注视锥形瓶内溶液颜色的变化,不是注视滴定管中液面的变化,滴定完之后,再读取滴定管中溶液体积,故C错误;滴定过程中,若滴定管漏液,则消耗盐酸的体积
3.[2023广东佛山高二期末统考]用NaOH标准溶液滴定未知浓度的盐酸,滴定曲线如图1实线所示。下列说法正确的是( )
A.若使用酚酞作为指示剂,滴定终点pH=7
B.图1中虚线可表示该NaOH标准溶液滴定与盐酸浓度相同的醋酸
C.向锥形瓶中加入少量蒸馏水,对测量结果没有影响
D.图2为碱式滴定管,读数是28.20 mL
图1
图2
C
解析 酚酞的变色范围是8.2~10,若使用酚酞作为指示剂,滴定终点pH略大于7,A错误;醋酸为弱酸,与盐酸浓度相同的醋酸的初始pH大于盐酸,B错误;向锥形瓶中加入少量蒸馏水,不影响标准溶液用量,对测量结果没有影响,C正确;用NaOH标准溶液滴定未知浓度的盐酸,则图2中滴定管读数为29.80 mL,D错误。
视角3中和滴定实验的数据处理
4.工业用亚硝酸钠中通常含有Na2CO3,某工业杂志报道,对NaNO2含量的测定可以先测量出样品中Na2CO3的含量,再计算出NaNO2的纯
度。实验步骤如下:
第一步,称取5.300 g工业用亚硝酸钠样品,配制成100.00 mL
溶液。
第二步,用碱式滴定管取上述待测溶液25.00 mL置于锥形瓶中,然后加入2~3滴酚酞溶液,用0.050 0 mol·L-1的HCl标准溶液滴定至红色刚好褪去且半分钟内不变化,消耗HCl标准溶液的体积为V mL,再重复滴定两次。
滴定过程中发生的反应为Na2CO3+HCl=== NaCl+NaHCO3,某次滴定前后,HCl标准溶液的液面如下图,则消耗HCl标准溶液的体积V= ;若平均消耗标准溶液的体积与本次消耗标准溶液的体积相等,则杂质Na2CO3的质量分数为 (小数点后保留两位)。
20.00 mL
8.00%
解析 滴定前滴定管读数为0.60 mL,滴定结束后滴定管读数为20.60 mL,则消耗HCl标准溶液的体积为20.00 mL。根据反应方程式,
n(Na2CO3)=n(HCl)=0.050 0 mol·L-1×0.020 0 L=1.000×10-3 mol,100.00 mL
视角4滴定曲线分析
5.室温下,向20.00 mL 0.100 0 mol·L-1盐酸中滴加0.100 0 mol·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg 5=0.7。下列说法不正确的是( )
A.NaOH与盐酸恰好完全反应时,溶液pH=7
B.选择变色范围在pH突变范围内的指示剂,可减
小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.V(NaOH溶液)=30.00 mL时,pH=12.3
C
解析 NaOH与盐酸恰好完全反应时溶液中的溶质为NaCl,呈中性,室温下pH=7,故A正确;选择变色范围在pH突变范围内的指示剂,可减小实验误差,甲基红的变色范围在pH突变范围内,误差比甲基橙小,B正确,C错误;V(NaOH溶液)=30.00 mL时,溶液中的溶质为NaCl和NaOH,且
视角5中和滴定实验的综合考查
6.阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液的浓度,实验如下:用1.00 mL待测硫酸溶液配制100 mL稀硫酸;以0.14 mol·L-1的NaOH溶液滴定上述稀硫酸25.00 mL,滴定到终点时消耗NaOH溶液15.00 mL。
(1)该学生用0.14 mol·L-1 NaOH标准溶液滴定稀硫酸的实验操作如下:
A.用酸式滴定管取稀硫酸25.00 mL,注入锥形瓶中,加入指示剂
B.用待测液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取碱式滴定管用标准NaOH溶液润洗后,将标准溶液注入碱式滴定管“0”刻度以上2~3 mL处,再把碱式滴定管固定好,调节液面至“0”刻度
E.检查滴定管是否漏液
F.另取锥形瓶,再重复操作两次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是 (用序号填写);
②该滴定操作中应选用的指示剂是 ;
③在G操作中判断滴定终点的现象是_______________________________
。
(2)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用 mol·L-1的NaOH溶液,原因是 。
ECDBAGF
酚酞(或甲基橙)
当滴入半滴NaOH溶液后,溶液由无色变为浅红色(或粉红色),且半分钟内不褪色
0.1
溶液浓度越小,误差就越小
解析 (1)①中和滴定实验的步骤为检漏→洗涤→润洗→加液→滴定,故操作顺序为ECDBAGF。②指示剂可以使用酚酞或甲基橙,但不能选用石蕊。③选用酚酞:当滴入半滴NaOH溶液后,溶液由无色变为浅红色(或粉红色),且半分钟内不褪色,说明达到滴定终点;选用甲基橙:当滴入半滴NaOH溶液后,溶液由橙色变为黄色,且半分钟内不再恢复原来颜色,说明达到滴定终点。
(2)进行滴定时,所用标准溶液浓度越小,误差就越小,故可选用0.1 mol·L-1氢氧化钠溶液。
【变式设问】
(1)滴定实验中在锥形瓶下面垫一张白纸,有什么作用
(2)滴定实验中,滴定管的尖嘴部分能否接触锥形瓶的内壁
提示 便于观察滴定时锥形瓶内溶液颜色的变化。
提示 可以。如向锥形瓶中滴加半滴溶液的操作:当滴定管尖嘴处的液滴悬而未滴时,让滴定管的尖嘴部分轻触滴定管内壁,让尖嘴处的液滴流入锥形瓶,可加入半滴溶液。
探究二 酸碱中和滴定误差分析
情境探究
在酸碱中和滴定实验中,“二管二洗”——酸式滴定管、碱式滴定管先用蒸馏水洗,再用待装液润洗;“一瓶一洗”——锥形瓶只用蒸馏水洗,不能用待装液润洗,以减小实验误差。
(1)以用标准盐酸滴定未知浓度的NaOH溶液为例,若酸式滴定管或碱式滴定管未用待装液润洗,会使测得的NaOH溶液浓度偏大还是偏小
提示 酸式滴定管未用标准盐酸润洗,会使测得的NaOH溶液浓度偏大;碱式滴定管未用待测NaOH溶液润洗,会使测得的NaOH溶液浓度偏小。
(2)若锥形瓶用待测NaOH溶液润洗,会使测得的NaOH溶液浓度偏大还是偏小
(3)在滴定实验中,由于锥形瓶中加入的待测NaOH溶液体积较小,为使溶液振荡时容易混合均匀,加入少量蒸馏水,对测得的NaOH溶液浓度有何影响
提示 会使测得的NaOH溶液浓度偏大。
提示 对测得的NaOH溶液浓度无影响。
方法突破
1.误差分析依据(以一元强酸滴定一元强碱为例)
2.常见的误差分析
以标准盐酸滴定待测氢氧化钠溶液为例(标准溶液在滴定管中):
可能情况 操作及读数 V标准 c待测
洗涤 或 润洗 未用标准溶液润洗滴定管 变大 偏高
未用待测液润洗所用的滴定管 变小 偏低
用待测液润洗锥形瓶 变大 偏高
洗涤后锥形瓶未干燥 不变 无影响
液体 溅落 标准溶液滴在锥形瓶外一滴 变大 偏高
待测液溅出锥形瓶外一滴 变小 偏低
可能情况 操作及读数 V标准 c待测
气泡 处理 滴定前有气泡,滴定后无气泡 变大 偏高
滴定前无气泡,滴定后有气泡 变小 偏低
读数 错误 滴定前仰视,滴定后平视 变小 偏低
滴定前读数正确,滴定后俯视读数(或前仰后俯) 变小 偏低
滴定前读数正确,滴定后仰视读数(或前俯后仰) 变大 偏高
达终点后,滴定管尖嘴处悬一滴标准液 变大 偏高
应用体验
视角1中和滴定实验的误差分析
1.称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。用A.偏高、B.偏低、C.无影响、D.无法判断填写下列各项操作会给实验造成的误差:
(1)称量固体NaOH时,未调节天平的零点。( )
(2)将NaOH放入锥形瓶中加水溶解时,加入水的体积不准确。( )
(3)滴定管装入盐酸前未用盐酸润洗。( )
(4)开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出。( )
D
C
B
B
(5)滴定前未将液面调至刻度“0”或“0”以下,最后初读数按0计算。( )
(6)在滴定过程中活塞处漏液。( )
(7)摇动锥形瓶时,因用力过大,使少量溶液溅出。( )
(8)滴定前读数时仰视,滴定完毕读数时俯视。( )
A
B
A
A
解析 (1)称量固体NaOH时,未调节天平零点,无法判断称量结果。
(2)锥形瓶内是否含水或加多少水并不影响NaOH的物质的量,因此不会影响所消耗的HCl溶液的体积,也就不会影响盐酸的浓度。
液稀释,n(NaOH)不变,V待测(HCl)偏大,导致测得盐酸浓度偏低。
(4)滴定前有气泡,滴定后无气泡,相当于V待测(HCl)比实际增大,导致测得盐酸浓度偏低。
(5)读出的V待测(HCl)比实际值小,导致测得盐酸浓度偏大。
(6)滴定过程中漏液使读出的V待测(HCl)比实际消耗量大,导致测得盐酸浓度偏低。
(7)摇动锥形瓶时,用力过大,使少量液体溅出,致使一部分NaOH未被中和,消耗V待测(HCl)减小,使测得盐酸浓度偏高。
(8)读出的V待测(HCl)比实际值偏小,使测得盐酸浓度偏高。
思维建模 通过图示实例理解仰视和俯视问题,以前仰后俯为例:
视角2通过计算过程分析实验误差
2.[2020山东卷节选]某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀硫酸溶解,水浴加热至75 ℃。用c mol·L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30 s内不褪色,消耗KMnO4溶液V1 mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀硫酸酸化后,在75 ℃继续用KMnO4溶液滴定至溶液出现粉红色且30 s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4·2H2O(M=126 g·mol-1)的质量分数表达式为
。
下列关于样品组成分析的说法,正确的是 (填字母)。
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
BD
正确;步骤Ⅰ中KMnO4溶液不足,并不影响步骤Ⅱ中氧化Fe2+消耗KMnO4的量,则对于测得Fe元素的含量无影响,C错误;若KMnO4溶液浓度偏低,则消耗KMnO4溶液的体积V1、V2均偏大,则测得样品中Fe元素含量偏高,D正确。
本 课 结 束
第三章
第一节 第2课时 酸碱中和滴定
素养 目标
1.了解酸碱中和滴定的原理,熟记酸碱中和滴定的主要仪器的名称及用途,培养科学探究与创新意识的化学核心素养。
2.掌握酸碱中和滴定的实验操作、计算方法和误差分析,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
酸碱中和滴定
1.定义
依据 ,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
2.原理
在中和反应中,酸提供的H+与碱提供的OH-的 相等,即:c(H+)·V酸
中和反应
物质的量
3.仪器
烧杯用于承接润洗、调液面、排气泡时放出的废液;
本实验中锥形瓶不能用烧杯代替,振荡时锥形瓶内液体不易溅出
碱式滴定管
4.酸碱中和滴定曲线
例如,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的HCl溶液。开始时HCl溶液的浓度较大,加入少量的NaOH溶液,对其pH影响 ,当接近滴定终点时,很少量的碱会引起溶液的pH ,此时指示剂的颜色 变化。
不大
突变
明显
5.实验数据的处理(以用标准盐酸滴定NaOH溶液为例)
重复实验2~3次,计算出每一次实验中消耗盐酸的平均体积,然后根据
微思考
阅读教材“酸碱中和滴定”和“实验活动2 强酸与强碱的中和滴定”。思考:在酸碱中和滴定实验中,需要测定哪些实验数据
提示 酸溶液的体积和碱溶液的体积。以用标准盐酸滴定未知浓度的NaOH溶液为例,用碱式滴定管量取一定体积的NaOH溶液放在锥形瓶中,用标准盐酸进行滴定,根据盐酸起始读数和滴定终点读数,确定所用标准盐酸的体积。
知识拓展
滴定管的选用
(1)酸式滴定管只能盛装酸性溶液或氧化性溶液,不能用于盛装碱性溶液,因为碱性溶液易腐蚀玻璃,导致玻璃旋塞无法旋开。
(2)碱式滴定管用于盛装碱性溶液,不能用于盛装酸性溶液或氧化性溶液,因为酸性溶液或氧化性溶液会腐蚀橡皮管。
(3)见光易分解的溶液应盛装在棕色滴定管中。
易错辨析
(1)任何酸、碱反应的离子方程式都可写作H++OH-=== H2O。( )
(2)酸式滴定管可用于量取酸性溶液,碱式滴定管可用于量取碱性溶液。
( )
(3)酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差。( )
(4)在进行中和滴定时,需要重复2~3次实验,取平均值进行计算。( )
×
提示 酸碱反应的离子方程式中,弱酸、弱碱应写成分子的形式,而且强酸、强碱反应的离子方程式也可能不是H++OH-===H2O形式,如稀硫酸与Ba(OH)2溶液反应。
√
×
提示 锥形瓶不能用待滴定溶液润洗。
√
重难探究·能力素养全提升
探究一 酸碱中和滴定实验的关键及重要操作
情境探究
根据酸式滴定管和碱式滴定管的结构可知,酸式滴定管下部是磨砂玻璃塞,碱式滴定管下部是一段乳胶管,内有玻璃球。
(1)滴定管的最小刻度是多少 mL 与量筒相比较其刻度值分布有何特点
提示 滴定管最小刻度为0.1 mL,读数时应估读到0.01 mL。量筒的刻度值分布是从下往上逐渐增大,滴定管的刻度值分布是从上往下逐渐增大。
(2)根据酸式滴定管和碱式滴定管的结构分析,为什么两种滴定管不能交换使用 在实验室中若要准确量取5.00 mL KMnO4溶液和5.00 mL苯,应分别选用哪种滴定管
(3)某一50.00 mL的酸式滴定管液面的读数是25.00 mL,若将溶液全部放完,则放出溶液的体积是25.00 mL吗
提示 因为酸式滴定管有磨砂的玻璃活塞,容易被碱液腐蚀,把滴定管和活塞粘在一起;碱式滴定管有乳胶管,容易被酸性溶液腐蚀,因此酸式滴定管不能用来量取碱性溶液,碱式滴定管不能用来量取酸性溶液。
都应选用酸式滴定管。因为KMnO4为强氧化剂,会腐蚀乳胶管;苯为有机溶剂,会溶解乳胶管,因此不能使用碱式滴定管。
提示 不是。要大于25.00 mL,因为酸式滴定管最大刻度线下面有一定量的液体,所以放出溶液的体积大于25.00 mL。
方法突破
名师点拨 滴定管排气泡的方法
除去酸式滴定管中的气泡:旋转活塞,迅速放液,使尖嘴部分充满溶液。
除去碱式滴定管中的气泡:弯曲乳胶管,轻轻挤压玻璃球,使尖嘴部分充满溶液,如下图所示:
应用体验
视角1中和滴定的实验仪器的使用
1.[2023浙江衢州高二校期末联考]酸碱中和滴定实验中不需要的仪器是
( )
A
解析 进行酸碱中和滴定实验时需使用的仪器有铁架台、碱式滴定管、酸式滴定管、滴定管夹、锥形瓶,不使用量筒,答案选A。
视角2中和滴定实验的基本操作
2.用0.100 0 mol·L-1 HCl溶液滴定未知浓度的KOH溶液。有关该实验说法正确的是( )
A.用图中的a滴定管盛装0.100 0 mol·L-1 HCl溶液
B.滴定前,需用未知浓度的KOH溶液润洗锥形瓶2~3次
C.滴定时,眼睛要注视滴定管中液面的变化
D.滴定过程中,若滴定管漏液,测量结果偏高
D
解析 盐酸需要用酸式滴定管盛装,即用图中的b滴定管盛装,故A错误;用未知浓度的KOH溶液润洗锥形瓶2~3次,导致锥形瓶中KOH的物质的量偏大,测定结果偏高,所以锥形瓶不能润洗,故B错误;滴定时,眼睛要注视锥形瓶内溶液颜色的变化,不是注视滴定管中液面的变化,滴定完之后,再读取滴定管中溶液体积,故C错误;滴定过程中,若滴定管漏液,则消耗盐酸的体积
3.[2023广东佛山高二期末统考]用NaOH标准溶液滴定未知浓度的盐酸,滴定曲线如图1实线所示。下列说法正确的是( )
A.若使用酚酞作为指示剂,滴定终点pH=7
B.图1中虚线可表示该NaOH标准溶液滴定与盐酸浓度相同的醋酸
C.向锥形瓶中加入少量蒸馏水,对测量结果没有影响
D.图2为碱式滴定管,读数是28.20 mL
图1
图2
C
解析 酚酞的变色范围是8.2~10,若使用酚酞作为指示剂,滴定终点pH略大于7,A错误;醋酸为弱酸,与盐酸浓度相同的醋酸的初始pH大于盐酸,B错误;向锥形瓶中加入少量蒸馏水,不影响标准溶液用量,对测量结果没有影响,C正确;用NaOH标准溶液滴定未知浓度的盐酸,则图2中滴定管读数为29.80 mL,D错误。
视角3中和滴定实验的数据处理
4.工业用亚硝酸钠中通常含有Na2CO3,某工业杂志报道,对NaNO2含量的测定可以先测量出样品中Na2CO3的含量,再计算出NaNO2的纯
度。实验步骤如下:
第一步,称取5.300 g工业用亚硝酸钠样品,配制成100.00 mL
溶液。
第二步,用碱式滴定管取上述待测溶液25.00 mL置于锥形瓶中,然后加入2~3滴酚酞溶液,用0.050 0 mol·L-1的HCl标准溶液滴定至红色刚好褪去且半分钟内不变化,消耗HCl标准溶液的体积为V mL,再重复滴定两次。
滴定过程中发生的反应为Na2CO3+HCl=== NaCl+NaHCO3,某次滴定前后,HCl标准溶液的液面如下图,则消耗HCl标准溶液的体积V= ;若平均消耗标准溶液的体积与本次消耗标准溶液的体积相等,则杂质Na2CO3的质量分数为 (小数点后保留两位)。
20.00 mL
8.00%
解析 滴定前滴定管读数为0.60 mL,滴定结束后滴定管读数为20.60 mL,则消耗HCl标准溶液的体积为20.00 mL。根据反应方程式,
n(Na2CO3)=n(HCl)=0.050 0 mol·L-1×0.020 0 L=1.000×10-3 mol,100.00 mL
视角4滴定曲线分析
5.室温下,向20.00 mL 0.100 0 mol·L-1盐酸中滴加0.100 0 mol·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg 5=0.7。下列说法不正确的是( )
A.NaOH与盐酸恰好完全反应时,溶液pH=7
B.选择变色范围在pH突变范围内的指示剂,可减
小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.V(NaOH溶液)=30.00 mL时,pH=12.3
C
解析 NaOH与盐酸恰好完全反应时溶液中的溶质为NaCl,呈中性,室温下pH=7,故A正确;选择变色范围在pH突变范围内的指示剂,可减小实验误差,甲基红的变色范围在pH突变范围内,误差比甲基橙小,B正确,C错误;V(NaOH溶液)=30.00 mL时,溶液中的溶质为NaCl和NaOH,且
视角5中和滴定实验的综合考查
6.阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液的浓度,实验如下:用1.00 mL待测硫酸溶液配制100 mL稀硫酸;以0.14 mol·L-1的NaOH溶液滴定上述稀硫酸25.00 mL,滴定到终点时消耗NaOH溶液15.00 mL。
(1)该学生用0.14 mol·L-1 NaOH标准溶液滴定稀硫酸的实验操作如下:
A.用酸式滴定管取稀硫酸25.00 mL,注入锥形瓶中,加入指示剂
B.用待测液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取碱式滴定管用标准NaOH溶液润洗后,将标准溶液注入碱式滴定管“0”刻度以上2~3 mL处,再把碱式滴定管固定好,调节液面至“0”刻度
E.检查滴定管是否漏液
F.另取锥形瓶,再重复操作两次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是 (用序号填写);
②该滴定操作中应选用的指示剂是 ;
③在G操作中判断滴定终点的现象是_______________________________
。
(2)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用 mol·L-1的NaOH溶液,原因是 。
ECDBAGF
酚酞(或甲基橙)
当滴入半滴NaOH溶液后,溶液由无色变为浅红色(或粉红色),且半分钟内不褪色
0.1
溶液浓度越小,误差就越小
解析 (1)①中和滴定实验的步骤为检漏→洗涤→润洗→加液→滴定,故操作顺序为ECDBAGF。②指示剂可以使用酚酞或甲基橙,但不能选用石蕊。③选用酚酞:当滴入半滴NaOH溶液后,溶液由无色变为浅红色(或粉红色),且半分钟内不褪色,说明达到滴定终点;选用甲基橙:当滴入半滴NaOH溶液后,溶液由橙色变为黄色,且半分钟内不再恢复原来颜色,说明达到滴定终点。
(2)进行滴定时,所用标准溶液浓度越小,误差就越小,故可选用0.1 mol·L-1氢氧化钠溶液。
【变式设问】
(1)滴定实验中在锥形瓶下面垫一张白纸,有什么作用
(2)滴定实验中,滴定管的尖嘴部分能否接触锥形瓶的内壁
提示 便于观察滴定时锥形瓶内溶液颜色的变化。
提示 可以。如向锥形瓶中滴加半滴溶液的操作:当滴定管尖嘴处的液滴悬而未滴时,让滴定管的尖嘴部分轻触滴定管内壁,让尖嘴处的液滴流入锥形瓶,可加入半滴溶液。
探究二 酸碱中和滴定误差分析
情境探究
在酸碱中和滴定实验中,“二管二洗”——酸式滴定管、碱式滴定管先用蒸馏水洗,再用待装液润洗;“一瓶一洗”——锥形瓶只用蒸馏水洗,不能用待装液润洗,以减小实验误差。
(1)以用标准盐酸滴定未知浓度的NaOH溶液为例,若酸式滴定管或碱式滴定管未用待装液润洗,会使测得的NaOH溶液浓度偏大还是偏小
提示 酸式滴定管未用标准盐酸润洗,会使测得的NaOH溶液浓度偏大;碱式滴定管未用待测NaOH溶液润洗,会使测得的NaOH溶液浓度偏小。
(2)若锥形瓶用待测NaOH溶液润洗,会使测得的NaOH溶液浓度偏大还是偏小
(3)在滴定实验中,由于锥形瓶中加入的待测NaOH溶液体积较小,为使溶液振荡时容易混合均匀,加入少量蒸馏水,对测得的NaOH溶液浓度有何影响
提示 会使测得的NaOH溶液浓度偏大。
提示 对测得的NaOH溶液浓度无影响。
方法突破
1.误差分析依据(以一元强酸滴定一元强碱为例)
2.常见的误差分析
以标准盐酸滴定待测氢氧化钠溶液为例(标准溶液在滴定管中):
可能情况 操作及读数 V标准 c待测
洗涤 或 润洗 未用标准溶液润洗滴定管 变大 偏高
未用待测液润洗所用的滴定管 变小 偏低
用待测液润洗锥形瓶 变大 偏高
洗涤后锥形瓶未干燥 不变 无影响
液体 溅落 标准溶液滴在锥形瓶外一滴 变大 偏高
待测液溅出锥形瓶外一滴 变小 偏低
可能情况 操作及读数 V标准 c待测
气泡 处理 滴定前有气泡,滴定后无气泡 变大 偏高
滴定前无气泡,滴定后有气泡 变小 偏低
读数 错误 滴定前仰视,滴定后平视 变小 偏低
滴定前读数正确,滴定后俯视读数(或前仰后俯) 变小 偏低
滴定前读数正确,滴定后仰视读数(或前俯后仰) 变大 偏高
达终点后,滴定管尖嘴处悬一滴标准液 变大 偏高
应用体验
视角1中和滴定实验的误差分析
1.称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。用A.偏高、B.偏低、C.无影响、D.无法判断填写下列各项操作会给实验造成的误差:
(1)称量固体NaOH时,未调节天平的零点。( )
(2)将NaOH放入锥形瓶中加水溶解时,加入水的体积不准确。( )
(3)滴定管装入盐酸前未用盐酸润洗。( )
(4)开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出。( )
D
C
B
B
(5)滴定前未将液面调至刻度“0”或“0”以下,最后初读数按0计算。( )
(6)在滴定过程中活塞处漏液。( )
(7)摇动锥形瓶时,因用力过大,使少量溶液溅出。( )
(8)滴定前读数时仰视,滴定完毕读数时俯视。( )
A
B
A
A
解析 (1)称量固体NaOH时,未调节天平零点,无法判断称量结果。
(2)锥形瓶内是否含水或加多少水并不影响NaOH的物质的量,因此不会影响所消耗的HCl溶液的体积,也就不会影响盐酸的浓度。
液稀释,n(NaOH)不变,V待测(HCl)偏大,导致测得盐酸浓度偏低。
(4)滴定前有气泡,滴定后无气泡,相当于V待测(HCl)比实际增大,导致测得盐酸浓度偏低。
(5)读出的V待测(HCl)比实际值小,导致测得盐酸浓度偏大。
(6)滴定过程中漏液使读出的V待测(HCl)比实际消耗量大,导致测得盐酸浓度偏低。
(7)摇动锥形瓶时,用力过大,使少量液体溅出,致使一部分NaOH未被中和,消耗V待测(HCl)减小,使测得盐酸浓度偏高。
(8)读出的V待测(HCl)比实际值偏小,使测得盐酸浓度偏高。
思维建模 通过图示实例理解仰视和俯视问题,以前仰后俯为例:
视角2通过计算过程分析实验误差
2.[2020山东卷节选]某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀硫酸溶解,水浴加热至75 ℃。用c mol·L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30 s内不褪色,消耗KMnO4溶液V1 mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀硫酸酸化后,在75 ℃继续用KMnO4溶液滴定至溶液出现粉红色且30 s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4·2H2O(M=126 g·mol-1)的质量分数表达式为
。
下列关于样品组成分析的说法,正确的是 (填字母)。
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
BD
正确;步骤Ⅰ中KMnO4溶液不足,并不影响步骤Ⅱ中氧化Fe2+消耗KMnO4的量,则对于测得Fe元素的含量无影响,C错误;若KMnO4溶液浓度偏低,则消耗KMnO4溶液的体积V1、V2均偏大,则测得样品中Fe元素含量偏高,D正确。
本 课 结 束
