3.3 微专题5 粒子浓度大小比较图像 课件(共33张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 3.3 微专题5 粒子浓度大小比较图像 课件(共33张PPT) 2023-2024学年高二化学人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:36:53 | ||
图片预览











文档简介
(共33张PPT)
第三章
微专题5 粒子浓度大小比较图像
探究一 中和滴定曲线
方法突破
1.中和滴定曲线中的“5点”
解决酸碱中和滴定曲线类问题的关键是巧抓“5点”,即曲线的起点、恰好完全反应点、中性点、反应一半点和过量点,先判断出各个点溶液中的溶质及溶液的酸碱性,以室温时用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1 HA溶液为例(如图),总结如何抓住滴定曲线的5个关键点:
关键点 粒子浓度关系
起点 (点①) 起点为HA的单一溶液,根据该点的pH可定性判断HA酸性强弱。0.1 mol·L-1 HA溶液pH>1说明HA是弱酸;溶液中粒子浓度:
c(HA)>c(H+)>c(A-)>c(OH-);若已知0.1 mol·L-1 HA溶液的pH=a,可定量计算Ka(HA)=101-2a
反应一 半点 (点②) 此时溶液为等物质的量的NaA和HA的混合溶液,电荷守恒:
c(Na+)+c(H+)=c(OH-)+c(A-);元素守恒:2c(Na+)=c(HA)+c(A-);质子守恒:2c(H+)+c(HA)=2c(OH-)+c(A-)。
此时溶液pH<7,说明HA的电离程度大于A-的水解程度,粒子浓度:
c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
关键点 粒子浓度关系
中性点 (点③) 此时溶液pH=7,溶液显中性,酸没有完全被中和,电荷守恒同点②,离子浓度:c(Na+)=c(A-)>c(H+)=c(OH-)
恰好完 全反应 点(点④) 此时二者恰好完全反应生成NaA,为强碱弱酸盐,溶液呈碱性。电荷守恒同点②,元素守恒:c(Na+)=c(HA)+c(A-);质子守恒:
c(H+)+c(HA)=c(OH-)。
粒子浓度:c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+)
过量点 (点⑤) 此时,NaOH溶液过量,在点⑤得到NaA与NaOH等物质的量的混合溶液,溶液显碱性。电荷守恒同点②,元素守恒:
c(Na+)=2c(HA)+2c(A-);质子守恒:c(H+)+2c(HA)+c(A-)=c(OH-)。离子浓度:c(Na+)>c(OH-)>c(A-)>c(H+)
2.酸碱中和滴定曲线图示
用氢氧化钠溶液滴定等浓度等体积的盐酸、醋酸的滴定曲线 用盐酸滴定等浓度等体积的氢氧化钠溶液、氨水的滴定曲线
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)
室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸(强酸与弱碱)反应时,终点不是pH=7(强碱与弱酸反应终点是pH>7,强酸与弱碱反应终点是pH<7)
应用体验
视角1一元酸碱的滴定曲线
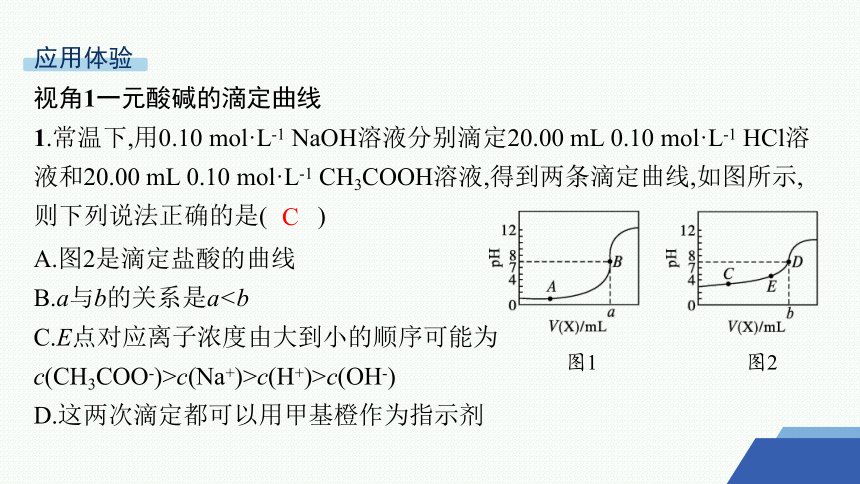
1.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是( )
A.图2是滴定盐酸的曲线
B.a与b的关系是aC.E点对应离子浓度由大到小的顺序可能为
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂
图1
图2
C
解析 如果是HCl溶液,则0.10 mol·L-1 HCl溶液的pH为1,则图1为滴定盐酸的曲线,故A错误。根据图1知,a处氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;向醋酸中滴入氢氧化钠溶液至恰好完全反应,醋酸钠溶液呈碱性,所以b处氢氧化钠溶液的体积小于20.00 mL,即a>b,故B错误。E点溶液的成分为CH3COONa和CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于CH3COONa的水解程度,盐类水解程度较小,则溶液中离子浓度可能为c(CH3COO-)
>c(Na+)>c(H+)>c(OH-),故C正确。氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞作为指示剂;氢氧化钠和醋酸恰好反应生成醋酸钠,溶液呈碱性,只能选择酚酞,故D错误。
2.室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(OH-)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
D
解析 a点时NaOH与HA恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生水解反应,则溶液中粒子浓度:c(Na+)>c(A-)>c(OH-)>c(H+),A错误;a点NaA发生水解反应,促进了水的电离,b点时为等物质的量的NaA和HA的混合溶液,溶液显酸性,则HA抑制了水的电离,所以a点水的电离程度大于b点,B错误;根据电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),pH=7,则c(H+)=c(OH-),所以c(Na+)=c(A-),C错误;b点HA过量,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),D正确。
方法点拨 滴定曲线分析的方法
(1)分析步骤:首先看纵坐标,搞清楚是酸入碱中,还是碱入酸中;其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一倍点等),分析酸、碱过量的情况。
(2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②元素守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系。
视角2多元弱酸的滴定曲线
3.[2023江西丰城中学高二期中]室温下,H2B的电离平衡常数 =5.9×10-2,
=6.4×10-5,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H2B溶液的曲线如图所示(体积变化忽略不计)。下列说法正确的是( )
A.滴定过程中,当pH=4时,存在c(H+)+c(Na+)=c(OH-)+
c(B2-)+c(HB-)
B.点①、③、④所示溶液中,点③所示溶液水的电离
程度最大
C.在整个滴定过程中,c(Na+)+c(B2-)+c(HB-)+c(H2B)保持不变
D.滴定过程中可能出现:c(Na+)>c(B2-)=c(HB-)>c(OH-)>c(H+)
C
解析 滴定过程中,始终存在电荷守恒c(H+)+c(Na+)=c(OH-)+2c(B2-)+c(HB-),选项A错误;点①为NaHB溶液、点③为NaHB和少量Na2B形成的中性溶液,Na2B的水解程度大于NaHB,对水的电离促进程度较大,点④为Na2B溶液,故点④所示溶液水的电离程度最大,选项B错误;在滴定过程中,设滴加的NaOH溶液的体积为V mL,则c(Na+)+c(B2-)+c(HB-)+c(H2B)=
c(Na+)+c(B2-)+c(HB-)+c(H2B)保持不变,选项C正确;滴定过程中当c(B2-)
=c(HB-)时,NaOH溶液的体积接近于30.00 mL,溶液呈酸性,c(H+)>c(OH-),选项D错误。
探究二 分布系数图像
方法突破
分布系数图像简称分布曲线,一般是指以pH为横坐标,以分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。同一pH条件下可以存在多种溶质微粒。根据在一定pH时的分布系数和总浓度,就可以计算出各成分在该pH时的平衡浓度。
举例 一元弱酸(以CH3COOH为例) 二元酸(以草酸为例) 三元酸(以H3PO4为例)
弱电解质 分布系数图
应用体验
视角1一元弱酸分布系数图像
1.25 ℃,某浓度的醋酸中CH3COOH、CH3COO-的分布系数δ与pH的关系如图。其中,δ(CH3COO-)=
A.曲线2代表δ(CH3COO-)
B.25 ℃,CH3COOH的电离常数Ka=10-4.76
D.pH=3.76时,溶液中存在:c(H+)=c(CH3COO-)+c(OH-)
D
Ka=10-4.76,B正确;在溶液pH增大的过程中,溶液中一定是加入了碱性物质(如NaOH),因此pH=3.76时,溶液中除H+外还含有金属阳离子,若加NaOH,则有c(H+)+c(Na+)=c(CH3COO-)+c(OH-),D错误。
视角2二元弱酸分布系数图像
2.H2X为二元弱酸,常温下,有c(H2X)+c(HX-)+c(X2-)=0.01 mol·L-1的溶液,在不同pH环境下,不同形态的粒子(H2X、HX-、X2-)的组成分数(平衡时某种含X元素微粒的物质的量占含X元素微粒物质的量之和的分数)如图所示,其中b、c点对应的pH分别为9.3、11。下列说法中正确的是( )
A.c点对应的溶液中存在c(H+)=c(HX-)+2c(X2-)+c(OH-)
B.在NaHX溶液中存在c(H+)>c(OH-)
C.室温下,将Na2X与NaHX按物质的量1∶1混合加入纯水中,此时pH=11
D.室温下,a、b、c三点对应的溶液中,由水电离的c(H+)水与c(OH-)水的乘积c(H+)水·c(OH-)水数值由大到小顺序:c>b>a
答案 D
解析 假设加入NaOH来调节溶液的pH,则随着NaOH的加入,c(H2X)逐渐减小,c(HX-)先增大后减小,在c(HX-)逐渐减小时,c(X2-)逐渐增大。根据电荷守恒可知,c点对应的溶液中存在c(H+)+c(Na+)=c(HX-)+2c(X2-)+c(OH-),A错误;b点对应的溶液中HX-最大,pH=9.3,所以NaHX溶液显碱性,即在NaHX溶液中存在c(H+)≠c(X2-),即此时溶液的pH≠11,C错误;a→b→c过程中,溶液的酸性逐渐减弱,对水电离的抑制程度也逐渐减弱,同时HX-、X2-的浓度增大,HX-、X2-的水解又促进水的电离,故室温下,a、b、c三点对应的溶液中,水的电离程度增大,即由水电离的c(H+)水与c(OH-)水的乘积c(H+)水·c(OH-)水数值由大到小顺序:c>b>a,D正确。
【变式设问】
当pH=7时,请写出溶液中含X元素微粒浓度由大到小的顺序。
提示 c(H2X)>c(HX-)>c(X2-)。
探究三 对数图像
方法突破
1.负对数图像
pH图像 给溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小
pOH图像 给溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图像中是c(OH-)越大,则pOH越小
pC图像 给溶液中某一粒子的浓度[如c(A)]或某些粒子浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A)越大,则pC越小
2.对数图像
应用体验
视角1负对数图像
1.常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与
A.Ka(HA)的数量级为10-5
C.m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D.n点所示溶液中:c(Na+)=c(A-)+c(HA)
D
确;由电荷守恒可知,m点所示溶液中:c(H+)+c(Na+)=c(A-)+c(OH-),该点时c(A-)=c(HA),则c(H+)=c(HA)+c(OH-)-c(Na+),C项正确;关系式c(Na+)=c(A-)
+c(HA)应是NaA溶液中的元素质量守恒关系式,HA为弱酸,则NaA溶液呈碱性,而n点溶液呈酸性,故不可能有c(Na+)=c(A-)+c(HA),D项错误。
视角2对数图像
2.常温下将NaOH溶液滴加到己二酸(用H2X表示)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>
c(X2-)>c(OH-)=c(H+)
D
pH<5.4,呈酸性,故NaHX溶液中c(H+)>c(OH-),C项正确;电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),中性溶液中存在c(H+)=c(OH-),故有
c(X2-)>c(HX-),因此离子浓度关系为c(Na+)>c(X2-)>c(HX-)>c(OH-)=c(H+),D项错误。
本 课 结 束
第三章
微专题5 粒子浓度大小比较图像
探究一 中和滴定曲线
方法突破
1.中和滴定曲线中的“5点”
解决酸碱中和滴定曲线类问题的关键是巧抓“5点”,即曲线的起点、恰好完全反应点、中性点、反应一半点和过量点,先判断出各个点溶液中的溶质及溶液的酸碱性,以室温时用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1 HA溶液为例(如图),总结如何抓住滴定曲线的5个关键点:
关键点 粒子浓度关系
起点 (点①) 起点为HA的单一溶液,根据该点的pH可定性判断HA酸性强弱。0.1 mol·L-1 HA溶液pH>1说明HA是弱酸;溶液中粒子浓度:
c(HA)>c(H+)>c(A-)>c(OH-);若已知0.1 mol·L-1 HA溶液的pH=a,可定量计算Ka(HA)=101-2a
反应一 半点 (点②) 此时溶液为等物质的量的NaA和HA的混合溶液,电荷守恒:
c(Na+)+c(H+)=c(OH-)+c(A-);元素守恒:2c(Na+)=c(HA)+c(A-);质子守恒:2c(H+)+c(HA)=2c(OH-)+c(A-)。
此时溶液pH<7,说明HA的电离程度大于A-的水解程度,粒子浓度:
c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
关键点 粒子浓度关系
中性点 (点③) 此时溶液pH=7,溶液显中性,酸没有完全被中和,电荷守恒同点②,离子浓度:c(Na+)=c(A-)>c(H+)=c(OH-)
恰好完 全反应 点(点④) 此时二者恰好完全反应生成NaA,为强碱弱酸盐,溶液呈碱性。电荷守恒同点②,元素守恒:c(Na+)=c(HA)+c(A-);质子守恒:
c(H+)+c(HA)=c(OH-)。
粒子浓度:c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+)
过量点 (点⑤) 此时,NaOH溶液过量,在点⑤得到NaA与NaOH等物质的量的混合溶液,溶液显碱性。电荷守恒同点②,元素守恒:
c(Na+)=2c(HA)+2c(A-);质子守恒:c(H+)+2c(HA)+c(A-)=c(OH-)。离子浓度:c(Na+)>c(OH-)>c(A-)>c(H+)
2.酸碱中和滴定曲线图示
用氢氧化钠溶液滴定等浓度等体积的盐酸、醋酸的滴定曲线 用盐酸滴定等浓度等体积的氢氧化钠溶液、氨水的滴定曲线
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)
室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸(强酸与弱碱)反应时,终点不是pH=7(强碱与弱酸反应终点是pH>7,强酸与弱碱反应终点是pH<7)
应用体验
视角1一元酸碱的滴定曲线
1.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是( )
A.图2是滴定盐酸的曲线
B.a与b的关系是a
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂
图1
图2
C
解析 如果是HCl溶液,则0.10 mol·L-1 HCl溶液的pH为1,则图1为滴定盐酸的曲线,故A错误。根据图1知,a处氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;向醋酸中滴入氢氧化钠溶液至恰好完全反应,醋酸钠溶液呈碱性,所以b处氢氧化钠溶液的体积小于20.00 mL,即a>b,故B错误。E点溶液的成分为CH3COONa和CH3COOH,溶液呈酸性,说明CH3COOH的电离程度大于CH3COONa的水解程度,盐类水解程度较小,则溶液中离子浓度可能为c(CH3COO-)
>c(Na+)>c(H+)>c(OH-),故C正确。氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞作为指示剂;氢氧化钠和醋酸恰好反应生成醋酸钠,溶液呈碱性,只能选择酚酞,故D错误。
2.室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(OH-)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
D
解析 a点时NaOH与HA恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生水解反应,则溶液中粒子浓度:c(Na+)>c(A-)>c(OH-)>c(H+),A错误;a点NaA发生水解反应,促进了水的电离,b点时为等物质的量的NaA和HA的混合溶液,溶液显酸性,则HA抑制了水的电离,所以a点水的电离程度大于b点,B错误;根据电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),pH=7,则c(H+)=c(OH-),所以c(Na+)=c(A-),C错误;b点HA过量,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),D正确。
方法点拨 滴定曲线分析的方法
(1)分析步骤:首先看纵坐标,搞清楚是酸入碱中,还是碱入酸中;其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一倍点等),分析酸、碱过量的情况。
(2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②元素守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系。
视角2多元弱酸的滴定曲线
3.[2023江西丰城中学高二期中]室温下,H2B的电离平衡常数 =5.9×10-2,
=6.4×10-5,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H2B溶液的曲线如图所示(体积变化忽略不计)。下列说法正确的是( )
A.滴定过程中,当pH=4时,存在c(H+)+c(Na+)=c(OH-)+
c(B2-)+c(HB-)
B.点①、③、④所示溶液中,点③所示溶液水的电离
程度最大
C.在整个滴定过程中,c(Na+)+c(B2-)+c(HB-)+c(H2B)保持不变
D.滴定过程中可能出现:c(Na+)>c(B2-)=c(HB-)>c(OH-)>c(H+)
C
解析 滴定过程中,始终存在电荷守恒c(H+)+c(Na+)=c(OH-)+2c(B2-)+c(HB-),选项A错误;点①为NaHB溶液、点③为NaHB和少量Na2B形成的中性溶液,Na2B的水解程度大于NaHB,对水的电离促进程度较大,点④为Na2B溶液,故点④所示溶液水的电离程度最大,选项B错误;在滴定过程中,设滴加的NaOH溶液的体积为V mL,则c(Na+)+c(B2-)+c(HB-)+c(H2B)=
c(Na+)+c(B2-)+c(HB-)+c(H2B)保持不变,选项C正确;滴定过程中当c(B2-)
=c(HB-)时,NaOH溶液的体积接近于30.00 mL,溶液呈酸性,c(H+)>c(OH-),选项D错误。
探究二 分布系数图像
方法突破
分布系数图像简称分布曲线,一般是指以pH为横坐标,以分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。同一pH条件下可以存在多种溶质微粒。根据在一定pH时的分布系数和总浓度,就可以计算出各成分在该pH时的平衡浓度。
举例 一元弱酸(以CH3COOH为例) 二元酸(以草酸为例) 三元酸(以H3PO4为例)
弱电解质 分布系数图
应用体验
视角1一元弱酸分布系数图像
1.25 ℃,某浓度的醋酸中CH3COOH、CH3COO-的分布系数δ与pH的关系如图。其中,δ(CH3COO-)=
A.曲线2代表δ(CH3COO-)
B.25 ℃,CH3COOH的电离常数Ka=10-4.76
D.pH=3.76时,溶液中存在:c(H+)=c(CH3COO-)+c(OH-)
D
Ka=10-4.76,B正确;在溶液pH增大的过程中,溶液中一定是加入了碱性物质(如NaOH),因此pH=3.76时,溶液中除H+外还含有金属阳离子,若加NaOH,则有c(H+)+c(Na+)=c(CH3COO-)+c(OH-),D错误。
视角2二元弱酸分布系数图像
2.H2X为二元弱酸,常温下,有c(H2X)+c(HX-)+c(X2-)=0.01 mol·L-1的溶液,在不同pH环境下,不同形态的粒子(H2X、HX-、X2-)的组成分数(平衡时某种含X元素微粒的物质的量占含X元素微粒物质的量之和的分数)如图所示,其中b、c点对应的pH分别为9.3、11。下列说法中正确的是( )
A.c点对应的溶液中存在c(H+)=c(HX-)+2c(X2-)+c(OH-)
B.在NaHX溶液中存在c(H+)>c(OH-)
C.室温下,将Na2X与NaHX按物质的量1∶1混合加入纯水中,此时pH=11
D.室温下,a、b、c三点对应的溶液中,由水电离的c(H+)水与c(OH-)水的乘积c(H+)水·c(OH-)水数值由大到小顺序:c>b>a
答案 D
解析 假设加入NaOH来调节溶液的pH,则随着NaOH的加入,c(H2X)逐渐减小,c(HX-)先增大后减小,在c(HX-)逐渐减小时,c(X2-)逐渐增大。根据电荷守恒可知,c点对应的溶液中存在c(H+)+c(Na+)=c(HX-)+2c(X2-)+c(OH-),A错误;b点对应的溶液中HX-最大,pH=9.3,所以NaHX溶液显碱性,即在NaHX溶液中存在c(H+)
【变式设问】
当pH=7时,请写出溶液中含X元素微粒浓度由大到小的顺序。
提示 c(H2X)>c(HX-)>c(X2-)。
探究三 对数图像
方法突破
1.负对数图像
pH图像 给溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,则pH越小
pOH图像 给溶液中c(OH-)取负对数,即pOH=-lg c(OH-),反映到图像中是c(OH-)越大,则pOH越小
pC图像 给溶液中某一粒子的浓度[如c(A)]或某些粒子浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A)越大,则pC越小
2.对数图像
应用体验
视角1负对数图像
1.常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与
A.Ka(HA)的数量级为10-5
C.m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D.n点所示溶液中:c(Na+)=c(A-)+c(HA)
D
确;由电荷守恒可知,m点所示溶液中:c(H+)+c(Na+)=c(A-)+c(OH-),该点时c(A-)=c(HA),则c(H+)=c(HA)+c(OH-)-c(Na+),C项正确;关系式c(Na+)=c(A-)
+c(HA)应是NaA溶液中的元素质量守恒关系式,HA为弱酸,则NaA溶液呈碱性,而n点溶液呈酸性,故不可能有c(Na+)=c(A-)+c(HA),D项错误。
视角2对数图像
2.常温下将NaOH溶液滴加到己二酸(用H2X表示)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>
c(X2-)>c(OH-)=c(H+)
D
pH<5.4,呈酸性,故NaHX溶液中c(H+)>c(OH-),C项正确;电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),中性溶液中存在c(H+)=c(OH-),故有
c(X2-)>c(HX-),因此离子浓度关系为c(Na+)>c(X2-)>c(HX-)>c(OH-)=c(H+),D项错误。
本 课 结 束
