3.3.1 盐类的水解 课件(共54张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 3.3.1 盐类的水解 课件(共54张PPT) 2023-2024学年高二化学人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:37:22 | ||
图片预览









文档简介
(共54张PPT)
第三章
第三节 第1课时 盐类的水解
素养 目标
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,从盐的构成上探究盐溶液呈现不同酸碱性的原因,总结其规律,培养科学探究与创新意识、宏观辨识与微观探析的核心素养。
2.熟练掌握盐类水解的表示方法——水解离子方程式的书写,培养变化观念与平衡思想的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、盐类的水解
1.盐溶液的酸碱性
常温下用pH计测定下列溶液的pH与7的关系,按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类完成下表。
盐溶液 pH 盐类型 酸碱性
NaCl pH=7 _______________ _______________
KNO3 pH=7
Na2CO3 pH>7 _______________ _______________
CH3COONa pH>7
NH4Cl pH<7 _______________ _______________
(NH4)2SO4 pH<7
强酸强碱盐
中性
强碱弱酸盐
碱性
强酸弱碱盐
酸性
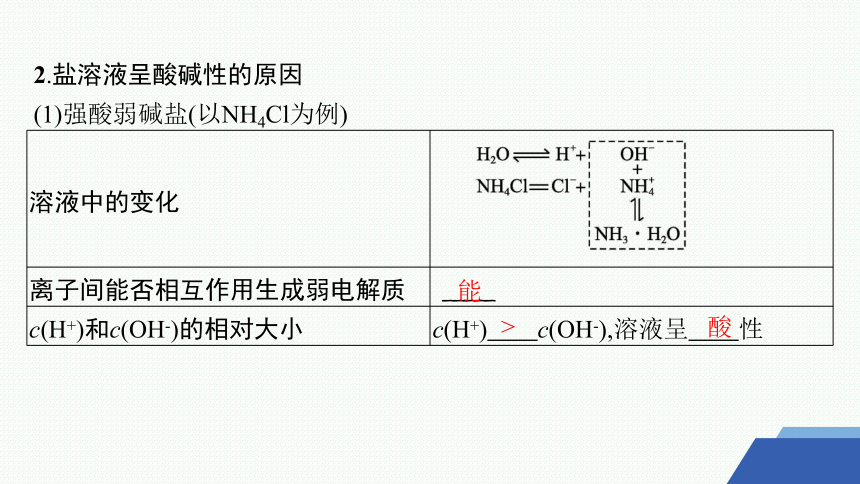
2.盐溶液呈酸碱性的原因
(1)强酸弱碱盐(以NH4Cl为例)
溶液中的变化
离子间能否相互作用生成弱电解质 _____
c(H+)和c(OH-)的相对大小 c(H+) c(OH-),溶液呈 性
能
>
酸
理论解释 与水电离出来的OH-结合生成弱电解质——NH3·H2O,破坏了水的电离平衡,使水的电离平衡向右移动。当达到新的平衡时,溶液中c(H+)
c(OH-)
总反应离子方程式 +H2O NH3·H2O+H+
>
(2)强碱弱酸盐(以CH3COONa为例)
溶液中的变化
离子间能否相互作用生成弱电解质
c(H+)和c(OH-)的相对大小 c(H+) c(OH-),溶液呈 性
能
<
碱
理论解释 CH3COO-与水电离出来的H+结合,生成弱电解质——
,破坏了水的电离平衡,使水的电离平衡向右移动,当达到新平衡时,溶液中c(H+) c(OH-)
总反应离子方程式
多元弱酸盐分步水解,如Na2CO3水解的离子方程式为 , 。
CH3COOH
<
CH3COO-+H2O CH3COOH+OH-
(3)强酸强碱盐(以NaCl为例)
溶液中存在H2O和NaCl的电离:H2O H++OH-,NaCl=== Na++Cl-,由于两种物质的离子间不能结合为弱电解质,因此溶液中c(H+)=c(OH-),溶液呈中性,水的电离平衡不发生移动。
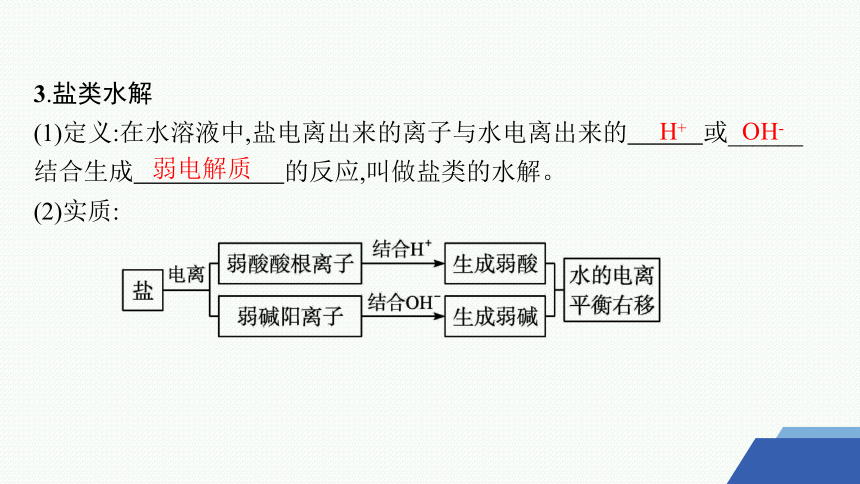
3.盐类水解
(1)定义:在水溶液中,盐电离出来的离子与水电离出来的 或______ 结合生成 的反应,叫做盐类的水解。
(2)实质:
弱电解质
H+
OH-
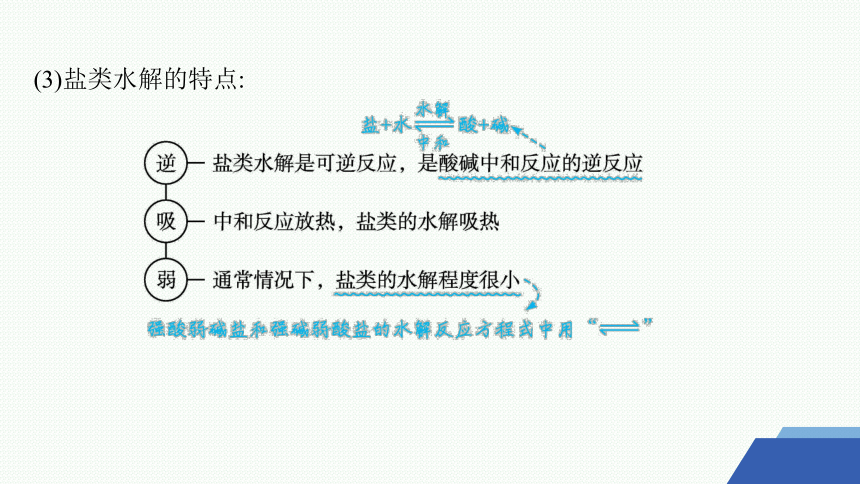
(3)盐类水解的特点:
二、电解质溶液中的电荷守恒与元素守恒
1.电荷守恒
(1)内容:电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等,即电荷守恒,溶液呈 性。
(2)实例:
碳酸钠溶液中的电荷守恒式为 。
2.元素守恒
(1)内容:在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化,离子所含的某种元素在变化前后是 的,即元素守恒。
电中
守恒
(2)实例:
0.1 mol·L-1
微思考1
阅读教材有关NH4Cl水解的内容。思考:NH4Cl溶液中的H+来自哪种物质的电离 常温下pH均为5的NH4Cl溶液和稀盐酸中由水电离产生的c(H+)水之比是多少
提示 pH=5的NH4Cl溶液中由水电离产生的c(H+)水=10-5 mol·L-1;pH=5的稀盐酸中盐酸电离产生的c(H+)=10-5 mol·L-1,由水电离产生的c(H+)水=c(OH-)
=10-9 mol·L-1,因此两溶液中由水电离产生的c(H+)水之比为
知识拓展
酸式盐溶液的酸碱性
(1)强酸的酸式盐:强酸的酸式酸根离子在溶液中完全电离,因此盐溶液呈酸性。如NaHSO4在溶液中完全电离:NaHSO4=== Na++H++ 。
(2)多元弱酸的酸式盐:由于多元弱酸的酸式酸根离子在溶液中既可以发生水解,又可以发生电离,因此该盐溶液的酸碱性取决于酸式酸根离子电离程度和水解程度的相对大小。若电离程度小于水解程度,则溶液呈碱性,如
微思考2
盐溶液呈中性,该盐一定不水解吗
提示 仅根据盐溶液呈中性,不能判断该盐是否水解。如:NaCl溶液呈中性,是因为NaCl是强酸强碱盐,不水解;而CH3COONH4溶液呈中性是因为CH3COO-和 的水解程度相同,水解后溶液中的H+和OH-浓度仍然相等。
易错辨析1
(1)盐类的水解过程对水的电离无影响。( )
(3)CuSO4溶液呈碱性。( )
提示 盐类的水解过程促进水的电离。
提示 由于Cu2+水解:Cu2++2H2O Cu(OH)2+2H+,故CuSO4溶液显酸性。
×
×
×
微思考3
自学教材“方法导引:电解质溶液中的电荷守恒与元素守恒”。
思考:试写出NH4Cl溶液中的电荷守恒和元素守恒关系,结合溶液的酸碱性,比较NH4Cl溶液中离子浓度的大小。
易错辨析2
(2)Na2S溶液中的电荷守恒关系式为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)。
( )
×
√
重难探究·能力素养全提升
探究一 盐类水解的规律
情境探究
已知常温下HCOOH的电离常数Ka=1.8×10-4,CH3COOH的电离常数Ka=1.75×10-5。
(1)等浓度的HCOOH和CH3COOH溶液中哪种酸的电离程度大
提示 HCOOH的电离程度大。
(2)写出HCOOH和CH3COOH的电离方程式,分析HCOO-和CH3COO-结合H+的能力有何关系
(3)分析常温下等浓度的HCOONa和CH3COONa溶液的pH大小关系。
提示 电离方程式:HCOOH H++HCOO-,CH3COOH H++CH3COO-。由于HCOOH的电离程度大,则HCOO-结合H+的能力弱,即CH3COO-结合H+的能力比HCOO-强。
提示 CH3COONa溶液的pH大于HCOONa溶液。
方法突破
1.盐类水解的规律
(1)“有弱才水解,无弱不水解”——盐中有弱酸酸根离子或弱碱阳离子才发生水解,若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”——弱酸酸根离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸酸根离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
2.酸式盐溶液酸碱性的判断
应用体验
视角1判断盐溶液的酸碱性
1.已知常温下,Ka(HCN)=6.2×10-10,Ka(HF)=6.3×10-4,
Ka(CH3COOH)=1.75×10-5,Ka(HNO2)=5.6×10-4。物质的量浓度均为0.1 mol·L-1的下列溶液,pH由大到小的顺序正确的是( )
A.NaCN>NaNO2>CH3COONa>NaF
B.NaF>NaNO2>CH3COONa>NaCN
C.NaCN>CH3COONa>NaNO2>NaF
D.NaCN>CH3COONa>NaF>NaNO2
C
解析 由Ka(HF)>Ka(HNO2)>Ka(CH3COOH)>Ka(HCN)可知,酸性:HF>HNO2>CH3COOH>HCN,则水解能力:CN->CH3COO-> >F-,弱酸酸根离子的水解能力越强,相同条件下对应盐溶液的碱性越强,pH越大。
【变式设问】
(1)向NaF和NaCN混合溶液中加入适量CH3COOH,可发生怎样的反应 试写出反应的离子方程式。
提示 NaF与CH3COOH不能反应,NaCN可与CH3COOH反应,离子方程式为CH3COOH+CN-===CH3COO-+HCN。
归纳总结 比较等浓度盐溶液酸碱性强弱的步骤
(1)首先根据盐的种类,对盐溶液按照酸性、中性、碱性进行分组。
(2)呈酸性的强酸弱碱盐溶液,需比较相应的弱碱碱性强弱,根据越弱越水解,则成盐的弱碱越弱,则水解后酸性越强;呈碱性的强碱弱酸盐溶液,需比较相应的弱酸酸性强弱,根据越弱越水解,则成盐的弱酸越弱,则水解后碱性越强。
视角2根据盐溶液的酸碱性判断弱酸、弱碱的强弱
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸的钠盐溶液的pH可推知,碱性越强则对应的酸越弱,因此酸性由强到弱的顺序为HX>HY>HZ,答案选B。
视角3根据酸性强弱和水解程度判断发生的复分解反应
3.已知25 ℃,几种酸的电离平衡常数如下表,下列叙述正确的是( )
酸 醋酸 次氯酸 碳酸 亚硫酸
电离平 衡常数 Ka=1.75×10-5 Ka=4.0×10-8 =4.5×10-7 =4.7×10-11 =1.4×10-2
=6.0×10-8
A.将0.1 mol·L-1的醋酸加水不断稀释,溶液中所有离子浓度均减小
C.少量SO2通入Ca(ClO)2溶液中反应的离子方程式:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式:CO2+2ClO-+H2O===
答案 B
解析 将0.1 mol·L-1的醋酸加水不断稀释,CH3COOH电离产生的CH3COO-、H+浓度减小,由于溶液中KW=c(H+)·c(OH-)不变,则c(OH-)增大,选项A错误;
B正确;HClO具有强氧化性,SO2具有还原性,二者在溶液中会发生氧化还原反应产生CaSO4、HCl,故反应的离子方程式为SO2+H2O+ClO-+Ca2+
归纳总结 根据Ka判断强酸制备弱酸的方法
(1)根据弱酸的Ka,确定酸性由强到弱的顺序,如根据H2CO3和H2SO3的电离
(3)酸性强的粒子和碱性强(水解程度大)的粒子首先反应,如图所示,即“左上右下可反应”。如少量SO2通入Na2CO3溶液先发生反应
视角4盐类水解对水的电离的影响
4.[定性理解盐类水解过程]在下列各微粒中,能使水的电离平衡向电离的方向移动,且使溶液的pH>7的是( )
B
解析 A项中微粒是Al3+,D项中微粒是Fe3+,Al3+、Fe3+能结合水电离出的OH-,使水的电离平衡向电离的方向移动,但溶液显酸性,pH<7,选项A和D不符合题意;B项中微粒为CH3COO-,CH3COO-与H2O电离出来的H+结合为CH3COOH,使水的电离平衡向电离的方向移动,并且使溶液呈碱性,选项B符合题意; 能完全电离,为溶液提供H+,使水的电离平衡向离子结合成分子的方向移动,使溶液呈酸性,选项C不符合题意。
5.[定量理解盐类水解对水电离的影响]25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,由水电离的H+的物质的量之比是( )
A.1∶10∶1010∶109
B.1∶5∶(5×109)∶(5×108)
C.1∶20∶1010∶109
D.1∶10∶104∶109
A
解析 25 ℃时,pH=0的H2SO4溶液中由水电离出的c(H+)=10-14 mol·L-1;0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.05 mol·L-1×2=0.1 mol·L-1,根据KW=c(H+)·c(OH-)可得,由水电离出的c(H+)=10-13 mol·L-1;pH=10的Na2S溶液中由水电离出的c(H+)=10-4 mol·L-1;pH=5的NH4NO3溶液中由水电离出的c(H+)=10-5 mol·L-1,故等体积四种溶液中水电离的H+的物质的量之比为
10-14∶10-13∶10-4∶10-5=1∶10∶1010∶109,故选项A正确。
解题技巧 判断溶液中由水电离产生的H+或OH-浓度的方法
(1)酸、碱抑制水的电离,酸溶液中的OH-来自水的电离,则水电离产生的H+的浓度等于溶液中OH-的浓度;碱溶液中的H+来自水的电离,则水电离产生的OH-的浓度等于溶液中H+的浓度。
(2)水解的盐促进水的电离,强酸弱碱盐水解显酸性,溶液中的H+来自水的电离,由水电离产生的OH-浓度等于溶液中H+的浓度;强碱弱酸盐水解显碱性,溶液中的OH-来自水的电离,由水电离产生的H+浓度等于溶液中OH-的浓度。
(3)强酸强碱的正盐不水解,溶液呈中性,常温下,由水电离产生的H+、OH-浓度均为10-7 mol·L-1。
6.[定量理解盐类水解对水电离的影响]常温下,某溶液中由水电离出的c(H+)=1×10-5 mol·L-1,该溶液可能是( )
A.NaHSO3溶液 B.Na2S溶液
C.氨水 D.NaCl溶液
B
解析 常温下,某溶液中由水电离出的c(H+)=1×10-5 mol·L-1,说明水的电离被促进,则溶液中溶质应为水解的盐,氨水中的NH3·H2O电离出的OH-会抑制水的电离,C错误;氯化钠溶液中的Na+和Cl-对水的电离没有影响,D错误;NaHSO3溶液显酸性, 的电离程度大于水解程度,其电离出的H+会抑制水的电离,A错误;Na2S溶液中的S2-可以水解,水解会促进水的电离,B正确。
视角5根据盐类水解判断弱电解质
7.下列事实不能说明NH3·H2O是弱电解质的是( )
A.常温下,0.1 mol·L-1 NaOH溶液的pH比0.1 mol·L-1氨水的pH大
B.常温下,相同物质的量浓度的氨水导电性比NaOH弱
C.氯化铵溶液呈酸性
D.10 mL 1 mol·L-1盐酸恰好与10 mL 1 mol·L-1氨水完全反应
D
解析 常温下,0.1 mol·L-1 NaOH溶液的pH比0.1 mol·L-1氨水的pH大,说明NaOH溶液中c(OH-)比氨水中大,从而可证明NH3·H2O是弱电解质,A不符合题意;常温下,相同物质的量浓度的氨水导电性比NaOH弱,说明自由移动的离子浓度NaOH比氨水多,从而可证明NH3·H2O是弱电解质,B不符合题意;NH4Cl溶液呈酸性,说明在溶液中 发生了水解反应,消耗了水电离产生的OH-,使水的电离平衡正向移动,最终达到平衡时溶液中c(H+)>c(OH-),使溶液显酸性,故可以证明NH3·H2O是弱电解质,C不符合题意;10 mL 1 mol·L-1盐酸恰好与10 mL 1 mol·L-1氨水完全反应,说明溶质的物质的量相等,不能说明NH3·H2O是弱电解质,D符合题意。
解题技巧 判断弱电解质的方法
(1)根据弱电解质在溶液中不完全电离,如常温下0.1 mol·L-1的CH3COOH溶液的pH约为3。
(2)根据弱电解质溶液中存在电离平衡,如pH=3的CH3COOH溶液稀释到体积为原来的100倍,pH小于5。
(3)借助盐类水解判断,如CH3COONa溶液呈碱性,说明CH3COOH为弱酸,即可说明CH3COOH是弱电解质。
探究二 盐类水解离子方程式的书写
方法突破
1.盐类水解离子方程式的书写
(1)单一离子水解
水解程度较小,水解离子方程式一般应用“ ”连接,水解生成的弱电解质的浓度很小,一般不生成沉淀或气体,一般不标“↓”或“↑”符号。
多元弱酸分步电离,多元弱酸酸根离子分步水解
②多元弱碱阳离子水解一般一步写出,如Fe3+水解离子方程式为Fe3++3H2O
Fe(OH)3+3H+。
(2)弱酸弱碱盐水解:阴、阳离子水解相互促进
2.区分盐的电离方程式与盐类水解的离子方程式
如HS-+H2O S2-+H3O+是HS-的电离方程式,而HS-+H2O H2S+OH-是HS-水解的离子方程式。
应用体验
视角1水解离子方程式的书写和正误判断
1.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
A.AlCl3:Al3++3H2O=== Al(OH)3+3H+
B
易错点拨 单一离子水解要用“ ”连接;多元弱酸酸根离子水解分步进行,弱碱阳离子水解一步写出;要注意区分弱酸酸式酸根离子的水解和电离过程。
视角2离子共存问题
2.常温下,下列各组离子在溶液中因相互促进水解而不能大量共存的是
( )
D
本 课 结 束
第三章
第三节 第1课时 盐类的水解
素养 目标
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,从盐的构成上探究盐溶液呈现不同酸碱性的原因,总结其规律,培养科学探究与创新意识、宏观辨识与微观探析的核心素养。
2.熟练掌握盐类水解的表示方法——水解离子方程式的书写,培养变化观念与平衡思想的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、盐类的水解
1.盐溶液的酸碱性
常温下用pH计测定下列溶液的pH与7的关系,按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类完成下表。
盐溶液 pH 盐类型 酸碱性
NaCl pH=7 _______________ _______________
KNO3 pH=7
Na2CO3 pH>7 _______________ _______________
CH3COONa pH>7
NH4Cl pH<7 _______________ _______________
(NH4)2SO4 pH<7
强酸强碱盐
中性
强碱弱酸盐
碱性
强酸弱碱盐
酸性
2.盐溶液呈酸碱性的原因
(1)强酸弱碱盐(以NH4Cl为例)
溶液中的变化
离子间能否相互作用生成弱电解质 _____
c(H+)和c(OH-)的相对大小 c(H+) c(OH-),溶液呈 性
能
>
酸
理论解释 与水电离出来的OH-结合生成弱电解质——NH3·H2O,破坏了水的电离平衡,使水的电离平衡向右移动。当达到新的平衡时,溶液中c(H+)
c(OH-)
总反应离子方程式 +H2O NH3·H2O+H+
>
(2)强碱弱酸盐(以CH3COONa为例)
溶液中的变化
离子间能否相互作用生成弱电解质
c(H+)和c(OH-)的相对大小 c(H+) c(OH-),溶液呈 性
能
<
碱
理论解释 CH3COO-与水电离出来的H+结合,生成弱电解质——
,破坏了水的电离平衡,使水的电离平衡向右移动,当达到新平衡时,溶液中c(H+) c(OH-)
总反应离子方程式
多元弱酸盐分步水解,如Na2CO3水解的离子方程式为 , 。
CH3COOH
<
CH3COO-+H2O CH3COOH+OH-
(3)强酸强碱盐(以NaCl为例)
溶液中存在H2O和NaCl的电离:H2O H++OH-,NaCl=== Na++Cl-,由于两种物质的离子间不能结合为弱电解质,因此溶液中c(H+)=c(OH-),溶液呈中性,水的电离平衡不发生移动。
3.盐类水解
(1)定义:在水溶液中,盐电离出来的离子与水电离出来的 或______ 结合生成 的反应,叫做盐类的水解。
(2)实质:
弱电解质
H+
OH-
(3)盐类水解的特点:
二、电解质溶液中的电荷守恒与元素守恒
1.电荷守恒
(1)内容:电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等,即电荷守恒,溶液呈 性。
(2)实例:
碳酸钠溶液中的电荷守恒式为 。
2.元素守恒
(1)内容:在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化,离子所含的某种元素在变化前后是 的,即元素守恒。
电中
守恒
(2)实例:
0.1 mol·L-1
微思考1
阅读教材有关NH4Cl水解的内容。思考:NH4Cl溶液中的H+来自哪种物质的电离 常温下pH均为5的NH4Cl溶液和稀盐酸中由水电离产生的c(H+)水之比是多少
提示 pH=5的NH4Cl溶液中由水电离产生的c(H+)水=10-5 mol·L-1;pH=5的稀盐酸中盐酸电离产生的c(H+)=10-5 mol·L-1,由水电离产生的c(H+)水=c(OH-)
=10-9 mol·L-1,因此两溶液中由水电离产生的c(H+)水之比为
知识拓展
酸式盐溶液的酸碱性
(1)强酸的酸式盐:强酸的酸式酸根离子在溶液中完全电离,因此盐溶液呈酸性。如NaHSO4在溶液中完全电离:NaHSO4=== Na++H++ 。
(2)多元弱酸的酸式盐:由于多元弱酸的酸式酸根离子在溶液中既可以发生水解,又可以发生电离,因此该盐溶液的酸碱性取决于酸式酸根离子电离程度和水解程度的相对大小。若电离程度小于水解程度,则溶液呈碱性,如
微思考2
盐溶液呈中性,该盐一定不水解吗
提示 仅根据盐溶液呈中性,不能判断该盐是否水解。如:NaCl溶液呈中性,是因为NaCl是强酸强碱盐,不水解;而CH3COONH4溶液呈中性是因为CH3COO-和 的水解程度相同,水解后溶液中的H+和OH-浓度仍然相等。
易错辨析1
(1)盐类的水解过程对水的电离无影响。( )
(3)CuSO4溶液呈碱性。( )
提示 盐类的水解过程促进水的电离。
提示 由于Cu2+水解:Cu2++2H2O Cu(OH)2+2H+,故CuSO4溶液显酸性。
×
×
×
微思考3
自学教材“方法导引:电解质溶液中的电荷守恒与元素守恒”。
思考:试写出NH4Cl溶液中的电荷守恒和元素守恒关系,结合溶液的酸碱性,比较NH4Cl溶液中离子浓度的大小。
易错辨析2
(2)Na2S溶液中的电荷守恒关系式为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)。
( )
×
√
重难探究·能力素养全提升
探究一 盐类水解的规律
情境探究
已知常温下HCOOH的电离常数Ka=1.8×10-4,CH3COOH的电离常数Ka=1.75×10-5。
(1)等浓度的HCOOH和CH3COOH溶液中哪种酸的电离程度大
提示 HCOOH的电离程度大。
(2)写出HCOOH和CH3COOH的电离方程式,分析HCOO-和CH3COO-结合H+的能力有何关系
(3)分析常温下等浓度的HCOONa和CH3COONa溶液的pH大小关系。
提示 电离方程式:HCOOH H++HCOO-,CH3COOH H++CH3COO-。由于HCOOH的电离程度大,则HCOO-结合H+的能力弱,即CH3COO-结合H+的能力比HCOO-强。
提示 CH3COONa溶液的pH大于HCOONa溶液。
方法突破
1.盐类水解的规律
(1)“有弱才水解,无弱不水解”——盐中有弱酸酸根离子或弱碱阳离子才发生水解,若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”——弱酸酸根离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸酸根离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
2.酸式盐溶液酸碱性的判断
应用体验
视角1判断盐溶液的酸碱性
1.已知常温下,Ka(HCN)=6.2×10-10,Ka(HF)=6.3×10-4,
Ka(CH3COOH)=1.75×10-5,Ka(HNO2)=5.6×10-4。物质的量浓度均为0.1 mol·L-1的下列溶液,pH由大到小的顺序正确的是( )
A.NaCN>NaNO2>CH3COONa>NaF
B.NaF>NaNO2>CH3COONa>NaCN
C.NaCN>CH3COONa>NaNO2>NaF
D.NaCN>CH3COONa>NaF>NaNO2
C
解析 由Ka(HF)>Ka(HNO2)>Ka(CH3COOH)>Ka(HCN)可知,酸性:HF>HNO2>CH3COOH>HCN,则水解能力:CN->CH3COO-> >F-,弱酸酸根离子的水解能力越强,相同条件下对应盐溶液的碱性越强,pH越大。
【变式设问】
(1)向NaF和NaCN混合溶液中加入适量CH3COOH,可发生怎样的反应 试写出反应的离子方程式。
提示 NaF与CH3COOH不能反应,NaCN可与CH3COOH反应,离子方程式为CH3COOH+CN-===CH3COO-+HCN。
归纳总结 比较等浓度盐溶液酸碱性强弱的步骤
(1)首先根据盐的种类,对盐溶液按照酸性、中性、碱性进行分组。
(2)呈酸性的强酸弱碱盐溶液,需比较相应的弱碱碱性强弱,根据越弱越水解,则成盐的弱碱越弱,则水解后酸性越强;呈碱性的强碱弱酸盐溶液,需比较相应的弱酸酸性强弱,根据越弱越水解,则成盐的弱酸越弱,则水解后碱性越强。
视角2根据盐溶液的酸碱性判断弱酸、弱碱的强弱
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸的钠盐溶液的pH可推知,碱性越强则对应的酸越弱,因此酸性由强到弱的顺序为HX>HY>HZ,答案选B。
视角3根据酸性强弱和水解程度判断发生的复分解反应
3.已知25 ℃,几种酸的电离平衡常数如下表,下列叙述正确的是( )
酸 醋酸 次氯酸 碳酸 亚硫酸
电离平 衡常数 Ka=1.75×10-5 Ka=4.0×10-8 =4.5×10-7 =4.7×10-11 =1.4×10-2
=6.0×10-8
A.将0.1 mol·L-1的醋酸加水不断稀释,溶液中所有离子浓度均减小
C.少量SO2通入Ca(ClO)2溶液中反应的离子方程式:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式:CO2+2ClO-+H2O===
答案 B
解析 将0.1 mol·L-1的醋酸加水不断稀释,CH3COOH电离产生的CH3COO-、H+浓度减小,由于溶液中KW=c(H+)·c(OH-)不变,则c(OH-)增大,选项A错误;
B正确;HClO具有强氧化性,SO2具有还原性,二者在溶液中会发生氧化还原反应产生CaSO4、HCl,故反应的离子方程式为SO2+H2O+ClO-+Ca2+
归纳总结 根据Ka判断强酸制备弱酸的方法
(1)根据弱酸的Ka,确定酸性由强到弱的顺序,如根据H2CO3和H2SO3的电离
(3)酸性强的粒子和碱性强(水解程度大)的粒子首先反应,如图所示,即“左上右下可反应”。如少量SO2通入Na2CO3溶液先发生反应
视角4盐类水解对水的电离的影响
4.[定性理解盐类水解过程]在下列各微粒中,能使水的电离平衡向电离的方向移动,且使溶液的pH>7的是( )
B
解析 A项中微粒是Al3+,D项中微粒是Fe3+,Al3+、Fe3+能结合水电离出的OH-,使水的电离平衡向电离的方向移动,但溶液显酸性,pH<7,选项A和D不符合题意;B项中微粒为CH3COO-,CH3COO-与H2O电离出来的H+结合为CH3COOH,使水的电离平衡向电离的方向移动,并且使溶液呈碱性,选项B符合题意; 能完全电离,为溶液提供H+,使水的电离平衡向离子结合成分子的方向移动,使溶液呈酸性,选项C不符合题意。
5.[定量理解盐类水解对水电离的影响]25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,由水电离的H+的物质的量之比是( )
A.1∶10∶1010∶109
B.1∶5∶(5×109)∶(5×108)
C.1∶20∶1010∶109
D.1∶10∶104∶109
A
解析 25 ℃时,pH=0的H2SO4溶液中由水电离出的c(H+)=10-14 mol·L-1;0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.05 mol·L-1×2=0.1 mol·L-1,根据KW=c(H+)·c(OH-)可得,由水电离出的c(H+)=10-13 mol·L-1;pH=10的Na2S溶液中由水电离出的c(H+)=10-4 mol·L-1;pH=5的NH4NO3溶液中由水电离出的c(H+)=10-5 mol·L-1,故等体积四种溶液中水电离的H+的物质的量之比为
10-14∶10-13∶10-4∶10-5=1∶10∶1010∶109,故选项A正确。
解题技巧 判断溶液中由水电离产生的H+或OH-浓度的方法
(1)酸、碱抑制水的电离,酸溶液中的OH-来自水的电离,则水电离产生的H+的浓度等于溶液中OH-的浓度;碱溶液中的H+来自水的电离,则水电离产生的OH-的浓度等于溶液中H+的浓度。
(2)水解的盐促进水的电离,强酸弱碱盐水解显酸性,溶液中的H+来自水的电离,由水电离产生的OH-浓度等于溶液中H+的浓度;强碱弱酸盐水解显碱性,溶液中的OH-来自水的电离,由水电离产生的H+浓度等于溶液中OH-的浓度。
(3)强酸强碱的正盐不水解,溶液呈中性,常温下,由水电离产生的H+、OH-浓度均为10-7 mol·L-1。
6.[定量理解盐类水解对水电离的影响]常温下,某溶液中由水电离出的c(H+)=1×10-5 mol·L-1,该溶液可能是( )
A.NaHSO3溶液 B.Na2S溶液
C.氨水 D.NaCl溶液
B
解析 常温下,某溶液中由水电离出的c(H+)=1×10-5 mol·L-1,说明水的电离被促进,则溶液中溶质应为水解的盐,氨水中的NH3·H2O电离出的OH-会抑制水的电离,C错误;氯化钠溶液中的Na+和Cl-对水的电离没有影响,D错误;NaHSO3溶液显酸性, 的电离程度大于水解程度,其电离出的H+会抑制水的电离,A错误;Na2S溶液中的S2-可以水解,水解会促进水的电离,B正确。
视角5根据盐类水解判断弱电解质
7.下列事实不能说明NH3·H2O是弱电解质的是( )
A.常温下,0.1 mol·L-1 NaOH溶液的pH比0.1 mol·L-1氨水的pH大
B.常温下,相同物质的量浓度的氨水导电性比NaOH弱
C.氯化铵溶液呈酸性
D.10 mL 1 mol·L-1盐酸恰好与10 mL 1 mol·L-1氨水完全反应
D
解析 常温下,0.1 mol·L-1 NaOH溶液的pH比0.1 mol·L-1氨水的pH大,说明NaOH溶液中c(OH-)比氨水中大,从而可证明NH3·H2O是弱电解质,A不符合题意;常温下,相同物质的量浓度的氨水导电性比NaOH弱,说明自由移动的离子浓度NaOH比氨水多,从而可证明NH3·H2O是弱电解质,B不符合题意;NH4Cl溶液呈酸性,说明在溶液中 发生了水解反应,消耗了水电离产生的OH-,使水的电离平衡正向移动,最终达到平衡时溶液中c(H+)>c(OH-),使溶液显酸性,故可以证明NH3·H2O是弱电解质,C不符合题意;10 mL 1 mol·L-1盐酸恰好与10 mL 1 mol·L-1氨水完全反应,说明溶质的物质的量相等,不能说明NH3·H2O是弱电解质,D符合题意。
解题技巧 判断弱电解质的方法
(1)根据弱电解质在溶液中不完全电离,如常温下0.1 mol·L-1的CH3COOH溶液的pH约为3。
(2)根据弱电解质溶液中存在电离平衡,如pH=3的CH3COOH溶液稀释到体积为原来的100倍,pH小于5。
(3)借助盐类水解判断,如CH3COONa溶液呈碱性,说明CH3COOH为弱酸,即可说明CH3COOH是弱电解质。
探究二 盐类水解离子方程式的书写
方法突破
1.盐类水解离子方程式的书写
(1)单一离子水解
水解程度较小,水解离子方程式一般应用“ ”连接,水解生成的弱电解质的浓度很小,一般不生成沉淀或气体,一般不标“↓”或“↑”符号。
多元弱酸分步电离,多元弱酸酸根离子分步水解
②多元弱碱阳离子水解一般一步写出,如Fe3+水解离子方程式为Fe3++3H2O
Fe(OH)3+3H+。
(2)弱酸弱碱盐水解:阴、阳离子水解相互促进
2.区分盐的电离方程式与盐类水解的离子方程式
如HS-+H2O S2-+H3O+是HS-的电离方程式,而HS-+H2O H2S+OH-是HS-水解的离子方程式。
应用体验
视角1水解离子方程式的书写和正误判断
1.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
A.AlCl3:Al3++3H2O=== Al(OH)3+3H+
B
易错点拨 单一离子水解要用“ ”连接;多元弱酸酸根离子水解分步进行,弱碱阳离子水解一步写出;要注意区分弱酸酸式酸根离子的水解和电离过程。
视角2离子共存问题
2.常温下,下列各组离子在溶液中因相互促进水解而不能大量共存的是
( )
D
本 课 结 束
