4.1.1 原电池的工作原理 课件(共37张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 4.1.1 原电池的工作原理 课件(共37张PPT) 2023-2024学年高二化学人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:38:38 | ||
图片预览










文档简介
(共37张PPT)
第四章
第一节 第1课时 原电池的工作原理
素养 目标
1.以锌铜原电池为例,从宏观和微观的角度,分析理解原电池的工作原理,掌握原电池装置的构造及形成条件,培养宏观辨识与微观探析的化学核心素养。
2.通过实验,认识双液原电池相比普通原电池的优点,特别是盐桥的作用,培养宏观辨识与微观探析、变化观念与平衡思想的化学核心素养。
3.依据带盐桥的锌铜原电池装置,学会分析电子和阴、阳离子的移动方向,并以电极反应式的形式表达出来,培养证据推理与模型认知、变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
原电池的工作原理
1.原电池的构成条件
(1)定义:能把 转化为 的装置。
(2)构成条件:
化学能
电能
活泼性不同
电解质
闭合
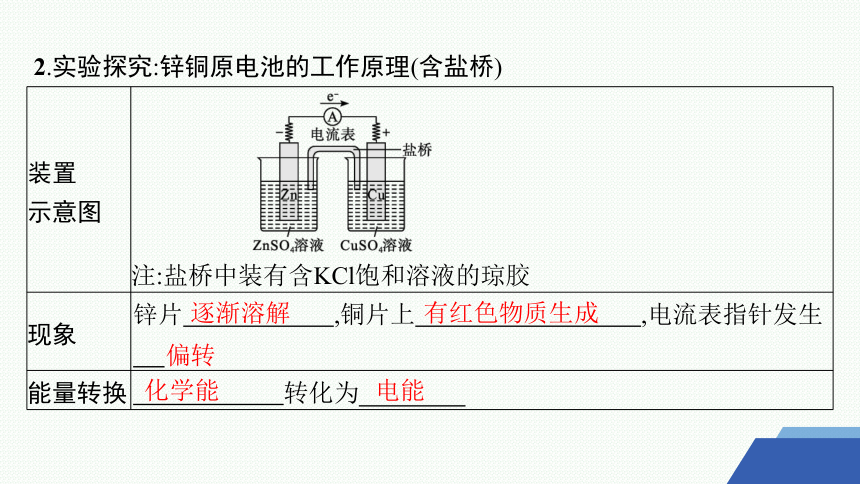
2.实验探究:锌铜原电池的工作原理(含盐桥)
装置 示意图
注:盐桥中装有含KCl饱和溶液的琼胶
现象 锌片 ,铜片上 ,电流表指针发生
能量转换 转化为
逐渐溶解
有红色物质生成
偏转
化学能
电能
微观 探析 在硫酸锌溶液中,负极一端的 失去电子形成 进入溶液
在硫酸铜溶液中,正极一端的 获得电子变成 沉积在铜片上
电子或 离子移 动方向 电子:负极流向正极
外电路中由电子的定向移动产生电流,“电子只走旱路,不走水路”
盐桥: 移向ZnSO4溶液, 移向CuSO4溶液
工作 原理 负极:Zn-2e-=== Zn2+( 反应)
正极:Cu2++2e-=== Cu( 反应)
总反应:Zn+Cu2+=== Zn2++Cu
Zn
Zn2+
Cu2+
Cu
Cl-
K+
氧化
还原
深化理解
单液原电池的缺陷(以铜锌原电池原理为例)
(1)Zn与CuSO4溶液反应,断开电路后,并不能彻底终止反应。
(2)电池工作过程中,由于Zn直接与CuSO4溶液接触,很难避免Zn与CuSO4直接反应,生成的Cu附着在Zn的表面,在Zn的表面构成微小原电池,既加快了Zn的腐蚀,又减小了向外输出电流,能量转化率低。
易错辨析
(1)原电池是把化学能转化为电能的一种装置。( )
(2)原电池正极发生氧化反应,负极发生还原反应。( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。( )
(4)反应Cu+2Ag+=== 2Ag+Cu2+能以原电池的形式来实现。( )
√
×
提示 原电池负极发生氧化反应,正极发生还原反应。
×
提示 只有自发进行的氧化还原反应才能设计成原电池。
√
深化理解
(1)盐桥作用:离子通道,形成闭合回路;避免电极与电解质溶液直接反应,减少电流的衰减。
(2)原电池输出电能的能力,取决于组成原电池的反应物的氧化还原能力。
重难探究·能力素养全提升
探究一 原电池工作原理
方法突破
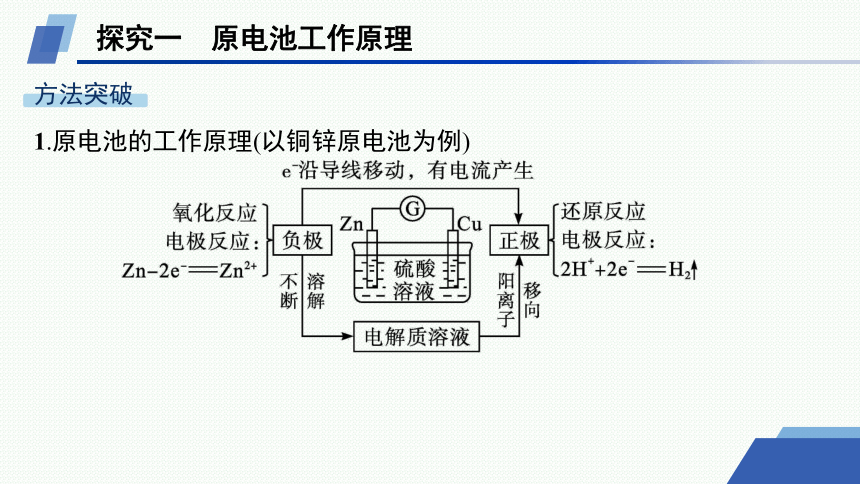
1.原电池的工作原理(以铜锌原电池为例)
2.原电池正负极的判断
名师点拨 分析原电池工作原理的两条线索
(1)负极→还原剂→失电子(电子流出,电流流入)→元素化合价升高→被氧化→发生氧化反应→生成阳离子→溶液中阴离子向此极移动。
(2)正极→氧化剂→得电子(电子流入,电流流出)→元素化合价降低→被还原→发生还原反应→生成阴离子→溶液中阳离子向此极移动。
应用体验
视角1含盐桥原电池的工作原理
1.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=== 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
A.b电极上发生氧化反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中 移向乙烧杯
D.a电极上发生的电极反应为 +8H++5e-=== Mn2++4H2O
B
归纳总结 根据氧化还原反应中化合价的升降判断氧化反应和还原反应,一般根据氧化反应确定负极材料,根据还原反应确定溶液中含有的离子。
解析 首先把化学方程式改为离子方程式:2 +10Fe2++16H+===2Mn2+
+10Fe3++8H2O,依据离子反应:Fe2+→Fe3+,b电极上发生氧化反应,A正确;a电极上发生还原反应,得到电子,为正极,电子流向从b到a,B错误;正极电极反应为 +8H++5e-===Mn2++4H2O,D正确;盐桥中阴离子移向负极,因此盐桥中 移向乙烧杯,C正确。
视角2原电池正、负极判断和电极反应的书写
2.[根据电子流向或电流方向判断]如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向图中已标出,关于该装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Fe和石墨棒,则X上的电极反应为
Fe-3e-=== Fe3+
C.电解质溶液中H+移向Y极
D.X极上发生的是还原反应,Y极上发生的是氧化反应
C
解析 根据图示可知该装置是原电池,外电路中电子从X电极流向Y电极,故X为负极,Y为正极,电流方向与电子流向相反,即电流方向为Y→外电路→X,选项A错误;该原电池中X为负极,应为Fe电极,由于总反应为Fe+2H+===Fe2++H2↑,则X电极的电极反应为Fe-2e-===Fe2+,选项B错误;原电池工作时,阳离子向正极移动,选项C正确;X是负极,负极上发生氧化反应,Y是正极,正极上发生还原反应,选项D错误。
解题技巧 书写原电池电极反应时应注意的问题
(1)电极反应常用“===”而不用“ ”连接。
(2)电极反应中若有气体生成,需加“↑”,弱电解质或难溶物均以化学式表示。
(3)必须遵循质量守恒、电荷守恒及正、负两极得失电子数相等的规律,为此在电极反应中可根据需要和溶液的酸碱性添加H+、OH-或H2O。
(4)原电池正、负两极的电极反应在得失电子数相等的情况下加和即得总反应(合二为一);反之,用总反应减去其中的一极反应可得另一极反应(一分为二)。
3.[根据某一极物质的转化判断]如图所示装置可构成原电池(盐桥中装有含琼脂的饱和K2SO4溶液),已知反应中 转化为Cr3+,下列叙述错误的是( )
A.a为原电池的负极,b为原电池的正极
B.电池工作时,盐桥中的 移向甲烧杯
C.a极的电极反应为Fe2+-e-=== Fe3+
D.工作一段时间后,乙烧杯中溶液的pH减小(忽略溶液体积变化)
D
解题技巧 根据总反应判断原电池中电极反应的方法
(1)分析总反应中化合价的变化,确定发生氧化反应和还原反应的物质,发生氧化反应的物质为负极反应物,发生还原反应的物质为正极反应物,据此可判断原电池的两极。
(2)根据正负极反应物,结合溶液中存在的离子书写电极反应。
探究二 原电池工作原理的应用
情境探究
用金属Mg和Al为电极材料,分别插入稀硫酸和NaOH溶液中构成原电池,如图所示。
(1)甲、乙两原电池中Al电极都是正极吗 各有什么现象呢
提示 甲池中Al为正极,Al表面产生气泡。乙池中Al为负极,Al逐渐溶解。
(2)请你写出甲、乙两原电池内发生的电池反应及Al电极的反应。
(3)判断原电池正、负极的最根本依据是什么
提示 甲池反应:Mg+2H+===Mg2++H2↑;Al电极反应:2H++2e-===H2↑。
提示 原电池原理从本质讲是氧化还原反应,故判断正、负极的根本依据:发生氧化反应(失去电子)的一极是负极;发生还原反应(得到电子)的一极是正极。
方法突破
1.比较金属活动性强弱
2.加快化学反应速率
构成原电池时负极的反应速率比直接接触时的反应速率快。如实验室制H2时,粗锌比纯锌与稀硫酸反应快,或向溶液中滴入几滴CuSO4溶液,锌(负极)电极反应加快。
3.设计原电池
应用体验
视角1原电池的形成条件
1.下列装置属于原电池的是( )
C
解析 蔗糖溶液不导电,不能形成原电池,选项A错误;没有自发的氧化还原反应发生,不能形成原电池,选项B错误;两电极材料不同,铁较活泼,能与硫酸铜溶液反应,形成闭合回路,所以能形成原电池,选项C正确;不能形成闭合回路,不能形成原电池,选项D错误。
视角2原电池的设计
2.原电池可设计为单液原电池和双液原电池,如图Ⅱ中各组物质中,能构成原电池且反应原理与Ⅰ相同的是( )
选项 a X Y
A Fe 硫酸铜 氯化铁
B Zn 氯化铁 硫酸铜
C C 硫酸铜 氯化铁
D Pt 氯化铁 硫酸铜
C
解析 对于单液原电池Ⅰ,负极反应为Cu-2e-===Cu2+,正极反应为Fe3++e-===Fe2+,总反应为Cu+2Fe3+===Cu2++2Fe2+;对于双液原电池Ⅱ,负极(Cu)对应电解质溶液为负极金属对应阳离子的盐(CuSO4)溶液;正极可选用比负极活动性弱的金属(Pt)或导电非金属(C),正极对应的电解质溶液为与负极发生氧化还原反应的电解质(FeCl3)溶液。据此分析可知,C项符合题意。
视角3根据原电池原理判断金属活动性
3.a、b、c、d四种金属电极,反应装置及反应现象如表,由此可判断四种金属的活动性顺序为( )
实验装置
部分实验现象 a极质量减小,b极质量增加 b有气体产生,c无变化
实验装置
部分实验现象 d极溶解,c极有气体产生 导线中电流从a极流向d极
A.a>b>c>d B.d>a>c>b
C.d>a>b>c D.b>c>d>a
答案 C
解析 a、b电极和硫酸铜溶液构成的原电池中,a极质量减小、b极质量增加,则a被氧化溶解,b上析出Cu,金属活动性:a>b;b、c没有形成闭合回路,不能构成原电池,b极有气体产生,c极无变化,则金属活动性:b>c;c、d和稀硫酸构成的原电池中,d极溶解、c极有气体产生,则d发生氧化反应,c极上H+放电产生H2,金属活动性:d>c;a、d和稀硫酸构成的原电池中,电流从a极流向d极,则a作正极、d作负极,金属活动性d>a;综上可知,金属活动性强弱顺序是d>a>b>c。
视角4利用原电池原理加快反应速率
4.探究化学反应中的能量转化,实验装置(装置中的试剂及用量完全相同)及实验数据如下(注:50 mL注射器用于收集气体并读取气体体积)。
装置① 装置②
气体体 积/mL 溶液温 度/℃ 气体体 积/mL 溶液温
度/℃
0 0 22.0 0 22.0
8.5 30 24.8 50 23.8
10.5 50 26.0 — —
下列说法不正确的是( )
A.装置②中的Cu表面有气泡产生,而装置①中的Cu表面无气泡
B.装置①和②中发生反应的离子方程式都为Zn+2H+=== Zn2++H2↑
C.原电池反应能加快化学反应速率,导致装置①中反应的平均速率比装置②中的小
D.由实验数据可知,原电池的化学能全部转化为电能
答案 D
解析 装置①为锌与稀硫酸发生化学反应,装置②为Zn、Cu与稀硫酸形成的原电池。装置②中Cu表面有气泡产生,是原电池的正极,而装置①中Cu表面无气泡,仅是化学反应,Zn表面有气泡,故A正确;装置①和装置②中反应的离子方程式均为Zn+2H+===Zn2++H2↑,故B正确;根据表格数据可知,收集相同体积的气体装置②需要的时间更短,故原电池反应能加快化学反应速率,故C正确;形成原电池时,化学能有一部分转化为了热能,而不是全部转化为电能,表现在溶液的温度升高,故D错误。
本 课 结 束
第四章
第一节 第1课时 原电池的工作原理
素养 目标
1.以锌铜原电池为例,从宏观和微观的角度,分析理解原电池的工作原理,掌握原电池装置的构造及形成条件,培养宏观辨识与微观探析的化学核心素养。
2.通过实验,认识双液原电池相比普通原电池的优点,特别是盐桥的作用,培养宏观辨识与微观探析、变化观念与平衡思想的化学核心素养。
3.依据带盐桥的锌铜原电池装置,学会分析电子和阴、阳离子的移动方向,并以电极反应式的形式表达出来,培养证据推理与模型认知、变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
原电池的工作原理
1.原电池的构成条件
(1)定义:能把 转化为 的装置。
(2)构成条件:
化学能
电能
活泼性不同
电解质
闭合
2.实验探究:锌铜原电池的工作原理(含盐桥)
装置 示意图
注:盐桥中装有含KCl饱和溶液的琼胶
现象 锌片 ,铜片上 ,电流表指针发生
能量转换 转化为
逐渐溶解
有红色物质生成
偏转
化学能
电能
微观 探析 在硫酸锌溶液中,负极一端的 失去电子形成 进入溶液
在硫酸铜溶液中,正极一端的 获得电子变成 沉积在铜片上
电子或 离子移 动方向 电子:负极流向正极
外电路中由电子的定向移动产生电流,“电子只走旱路,不走水路”
盐桥: 移向ZnSO4溶液, 移向CuSO4溶液
工作 原理 负极:Zn-2e-=== Zn2+( 反应)
正极:Cu2++2e-=== Cu( 反应)
总反应:Zn+Cu2+=== Zn2++Cu
Zn
Zn2+
Cu2+
Cu
Cl-
K+
氧化
还原
深化理解
单液原电池的缺陷(以铜锌原电池原理为例)
(1)Zn与CuSO4溶液反应,断开电路后,并不能彻底终止反应。
(2)电池工作过程中,由于Zn直接与CuSO4溶液接触,很难避免Zn与CuSO4直接反应,生成的Cu附着在Zn的表面,在Zn的表面构成微小原电池,既加快了Zn的腐蚀,又减小了向外输出电流,能量转化率低。
易错辨析
(1)原电池是把化学能转化为电能的一种装置。( )
(2)原电池正极发生氧化反应,负极发生还原反应。( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。( )
(4)反应Cu+2Ag+=== 2Ag+Cu2+能以原电池的形式来实现。( )
√
×
提示 原电池负极发生氧化反应,正极发生还原反应。
×
提示 只有自发进行的氧化还原反应才能设计成原电池。
√
深化理解
(1)盐桥作用:离子通道,形成闭合回路;避免电极与电解质溶液直接反应,减少电流的衰减。
(2)原电池输出电能的能力,取决于组成原电池的反应物的氧化还原能力。
重难探究·能力素养全提升
探究一 原电池工作原理
方法突破
1.原电池的工作原理(以铜锌原电池为例)
2.原电池正负极的判断
名师点拨 分析原电池工作原理的两条线索
(1)负极→还原剂→失电子(电子流出,电流流入)→元素化合价升高→被氧化→发生氧化反应→生成阳离子→溶液中阴离子向此极移动。
(2)正极→氧化剂→得电子(电子流入,电流流出)→元素化合价降低→被还原→发生还原反应→生成阴离子→溶液中阳离子向此极移动。
应用体验
视角1含盐桥原电池的工作原理
1.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=== 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
A.b电极上发生氧化反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中 移向乙烧杯
D.a电极上发生的电极反应为 +8H++5e-=== Mn2++4H2O
B
归纳总结 根据氧化还原反应中化合价的升降判断氧化反应和还原反应,一般根据氧化反应确定负极材料,根据还原反应确定溶液中含有的离子。
解析 首先把化学方程式改为离子方程式:2 +10Fe2++16H+===2Mn2+
+10Fe3++8H2O,依据离子反应:Fe2+→Fe3+,b电极上发生氧化反应,A正确;a电极上发生还原反应,得到电子,为正极,电子流向从b到a,B错误;正极电极反应为 +8H++5e-===Mn2++4H2O,D正确;盐桥中阴离子移向负极,因此盐桥中 移向乙烧杯,C正确。
视角2原电池正、负极判断和电极反应的书写
2.[根据电子流向或电流方向判断]如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向图中已标出,关于该装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Fe和石墨棒,则X上的电极反应为
Fe-3e-=== Fe3+
C.电解质溶液中H+移向Y极
D.X极上发生的是还原反应,Y极上发生的是氧化反应
C
解析 根据图示可知该装置是原电池,外电路中电子从X电极流向Y电极,故X为负极,Y为正极,电流方向与电子流向相反,即电流方向为Y→外电路→X,选项A错误;该原电池中X为负极,应为Fe电极,由于总反应为Fe+2H+===Fe2++H2↑,则X电极的电极反应为Fe-2e-===Fe2+,选项B错误;原电池工作时,阳离子向正极移动,选项C正确;X是负极,负极上发生氧化反应,Y是正极,正极上发生还原反应,选项D错误。
解题技巧 书写原电池电极反应时应注意的问题
(1)电极反应常用“===”而不用“ ”连接。
(2)电极反应中若有气体生成,需加“↑”,弱电解质或难溶物均以化学式表示。
(3)必须遵循质量守恒、电荷守恒及正、负两极得失电子数相等的规律,为此在电极反应中可根据需要和溶液的酸碱性添加H+、OH-或H2O。
(4)原电池正、负两极的电极反应在得失电子数相等的情况下加和即得总反应(合二为一);反之,用总反应减去其中的一极反应可得另一极反应(一分为二)。
3.[根据某一极物质的转化判断]如图所示装置可构成原电池(盐桥中装有含琼脂的饱和K2SO4溶液),已知反应中 转化为Cr3+,下列叙述错误的是( )
A.a为原电池的负极,b为原电池的正极
B.电池工作时,盐桥中的 移向甲烧杯
C.a极的电极反应为Fe2+-e-=== Fe3+
D.工作一段时间后,乙烧杯中溶液的pH减小(忽略溶液体积变化)
D
解题技巧 根据总反应判断原电池中电极反应的方法
(1)分析总反应中化合价的变化,确定发生氧化反应和还原反应的物质,发生氧化反应的物质为负极反应物,发生还原反应的物质为正极反应物,据此可判断原电池的两极。
(2)根据正负极反应物,结合溶液中存在的离子书写电极反应。
探究二 原电池工作原理的应用
情境探究
用金属Mg和Al为电极材料,分别插入稀硫酸和NaOH溶液中构成原电池,如图所示。
(1)甲、乙两原电池中Al电极都是正极吗 各有什么现象呢
提示 甲池中Al为正极,Al表面产生气泡。乙池中Al为负极,Al逐渐溶解。
(2)请你写出甲、乙两原电池内发生的电池反应及Al电极的反应。
(3)判断原电池正、负极的最根本依据是什么
提示 甲池反应:Mg+2H+===Mg2++H2↑;Al电极反应:2H++2e-===H2↑。
提示 原电池原理从本质讲是氧化还原反应,故判断正、负极的根本依据:发生氧化反应(失去电子)的一极是负极;发生还原反应(得到电子)的一极是正极。
方法突破
1.比较金属活动性强弱
2.加快化学反应速率
构成原电池时负极的反应速率比直接接触时的反应速率快。如实验室制H2时,粗锌比纯锌与稀硫酸反应快,或向溶液中滴入几滴CuSO4溶液,锌(负极)电极反应加快。
3.设计原电池
应用体验
视角1原电池的形成条件
1.下列装置属于原电池的是( )
C
解析 蔗糖溶液不导电,不能形成原电池,选项A错误;没有自发的氧化还原反应发生,不能形成原电池,选项B错误;两电极材料不同,铁较活泼,能与硫酸铜溶液反应,形成闭合回路,所以能形成原电池,选项C正确;不能形成闭合回路,不能形成原电池,选项D错误。
视角2原电池的设计
2.原电池可设计为单液原电池和双液原电池,如图Ⅱ中各组物质中,能构成原电池且反应原理与Ⅰ相同的是( )
选项 a X Y
A Fe 硫酸铜 氯化铁
B Zn 氯化铁 硫酸铜
C C 硫酸铜 氯化铁
D Pt 氯化铁 硫酸铜
C
解析 对于单液原电池Ⅰ,负极反应为Cu-2e-===Cu2+,正极反应为Fe3++e-===Fe2+,总反应为Cu+2Fe3+===Cu2++2Fe2+;对于双液原电池Ⅱ,负极(Cu)对应电解质溶液为负极金属对应阳离子的盐(CuSO4)溶液;正极可选用比负极活动性弱的金属(Pt)或导电非金属(C),正极对应的电解质溶液为与负极发生氧化还原反应的电解质(FeCl3)溶液。据此分析可知,C项符合题意。
视角3根据原电池原理判断金属活动性
3.a、b、c、d四种金属电极,反应装置及反应现象如表,由此可判断四种金属的活动性顺序为( )
实验装置
部分实验现象 a极质量减小,b极质量增加 b有气体产生,c无变化
实验装置
部分实验现象 d极溶解,c极有气体产生 导线中电流从a极流向d极
A.a>b>c>d B.d>a>c>b
C.d>a>b>c D.b>c>d>a
答案 C
解析 a、b电极和硫酸铜溶液构成的原电池中,a极质量减小、b极质量增加,则a被氧化溶解,b上析出Cu,金属活动性:a>b;b、c没有形成闭合回路,不能构成原电池,b极有气体产生,c极无变化,则金属活动性:b>c;c、d和稀硫酸构成的原电池中,d极溶解、c极有气体产生,则d发生氧化反应,c极上H+放电产生H2,金属活动性:d>c;a、d和稀硫酸构成的原电池中,电流从a极流向d极,则a作正极、d作负极,金属活动性d>a;综上可知,金属活动性强弱顺序是d>a>b>c。
视角4利用原电池原理加快反应速率
4.探究化学反应中的能量转化,实验装置(装置中的试剂及用量完全相同)及实验数据如下(注:50 mL注射器用于收集气体并读取气体体积)。
装置① 装置②
气体体 积/mL 溶液温 度/℃ 气体体 积/mL 溶液温
度/℃
0 0 22.0 0 22.0
8.5 30 24.8 50 23.8
10.5 50 26.0 — —
下列说法不正确的是( )
A.装置②中的Cu表面有气泡产生,而装置①中的Cu表面无气泡
B.装置①和②中发生反应的离子方程式都为Zn+2H+=== Zn2++H2↑
C.原电池反应能加快化学反应速率,导致装置①中反应的平均速率比装置②中的小
D.由实验数据可知,原电池的化学能全部转化为电能
答案 D
解析 装置①为锌与稀硫酸发生化学反应,装置②为Zn、Cu与稀硫酸形成的原电池。装置②中Cu表面有气泡产生,是原电池的正极,而装置①中Cu表面无气泡,仅是化学反应,Zn表面有气泡,故A正确;装置①和装置②中反应的离子方程式均为Zn+2H+===Zn2++H2↑,故B正确;根据表格数据可知,收集相同体积的气体装置②需要的时间更短,故原电池反应能加快化学反应速率,故C正确;形成原电池时,化学能有一部分转化为了热能,而不是全部转化为电能,表现在溶液的温度升高,故D错误。
本 课 结 束
