4.2.1 电解原理 课件(共32张PPT) 2023-2024学年高二化学人教版选择性必修1
文档属性
| 名称 | 4.2.1 电解原理 课件(共32张PPT) 2023-2024学年高二化学人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:39:05 | ||
图片预览









文档简介
(共32张PPT)
第四章
第二节 第1课时 电解原理
素养 目标
1.理解电解池中电子的移动、阴离子和阳离子的移动、阴极和阳极上的反应及其变化、电流形成的过程和原理,培养宏观辨识与微观探析的化学核心素养。
2.建立电解过程的思维模型,理解电解的规律,判断电解的产物,书写电解的电极反应式和总反应式,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
电解原理
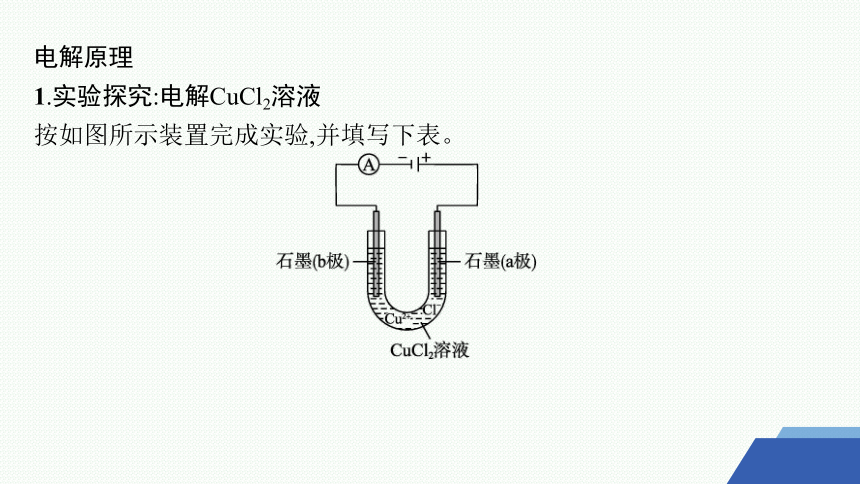
1.实验探究:电解CuCl2溶液
按如图所示装置完成实验,并填写下表。
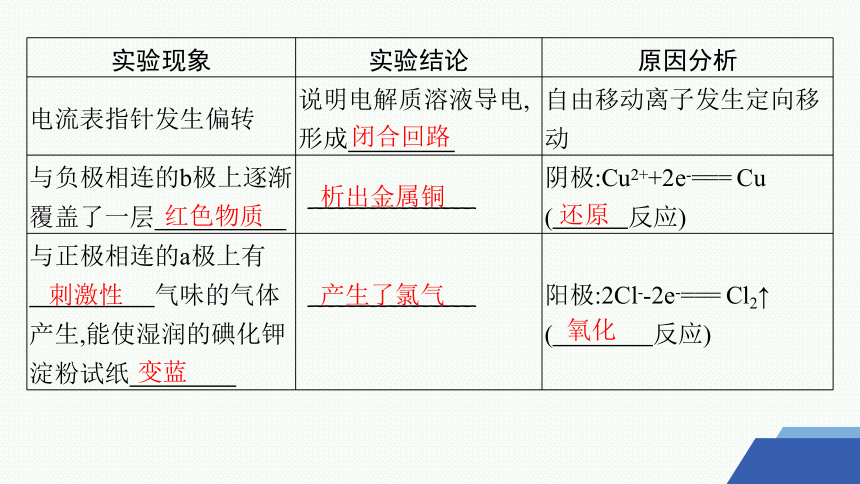
实验现象 实验结论 原因分析
电流表指针发生偏转 说明电解质溶液导电,形成 自由移动离子发生定向移动
与负极相连的b极上逐渐覆盖了一层 ________________ 阴极:Cu2++2e-=== Cu
( 反应)
与正极相连的a极上有 气味的气体产生,能使湿润的碘化钾淀粉试纸 ________________ 阳极:2Cl--2e-=== Cl2↑
( 反应)
闭合回路
红色物质
析出金属铜
还原
刺激性
变蓝
产生了氯气
氧化
2.电解和电解池
(1)电解:使电流通过 而在阳极、阴极引起 反应的过程。
(2)电解池:将 转化为 的装置(也称 )。
(3)电解池的构成条件
①直流电源;②两个电极;③电解质溶液或熔融电解质;④形成闭合回路。
电解质溶液(或熔融电解质)
氧化还原
电能
化学能
电解槽
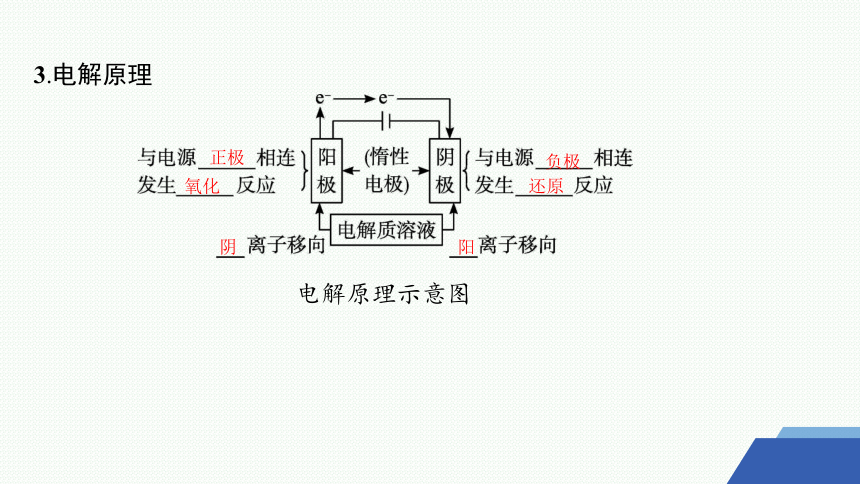
3.电解原理
电解原理示意图
正极
氧化
负极
还原
阴
阳
微思考
阅读教材电解CuCl2溶液的内容。思考:CuCl2溶液中含有哪些离子 分析开始在两电极上放电的离子分别是哪种离子
提示 CuCl2溶液中含有Cu2+、Cl-、H+和OH-;氧化性Cu2+>H+,还原性Cl->OH-,因此两电极上开始时放电的离子为Cu2+和Cl-。
深化理解
(1)原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置;原电池无外接电源,电解池有外接直流电源。
(2)电解时必须使用直流电源,不能使用交流电源。
(3)电解质水溶液或熔融电解质均可被电解,因为其中均含有可移动的阴、阳离子。
(4)电解是一种强氧化还原手段,可以实现非自发的氧化还原反应。
(5)金属导电为物理变化,电解质溶液导电为化学变化。
易错辨析
(1)电解池能将电能转化为化学能。( )
(2)电解质溶液导电属于化学变化。( )
(3)电解池的阳极与电源的负极相连。( )
√
√
×
提示 电解池的阳极与电源的正极相连。
重难探究·能力素养全提升
探究一 电极产物的判断 电极反应的书写
情境探究
1807年,英国化学家戴维将铂电极插入熔融的氢氧化钾中并接通直流电源时,奇迹发生了,在阴极附近产生一种银白色的金属,随即形成紫色火焰;在阳极产生一种无色气体和水蒸气。这就是发现钾元素的主要过程,在当时社会上引起轰动。
(1)通电过程中能量的转化形式是什么
提示 通电过程中电能转化为化学能。
(2)通电过程中阴极发生反应的类型是什么 阳极发生反应的类型是什么 试写出电解过程的电极反应。
(3)若将“熔融的氢氧化钾”换成KOH溶液,还能制得金属钾吗 试分析溶液中存在的离子并进行解释,写出两极的电极反应。
提示 阴极钾元素的化合价降低,发生还原反应,则阳极发生氧化反应。阴极反应:4K++4e-===4K,阳极反应:4OH--4e-===O2↑+2H2O。
提示 不能。溶液中含有KOH电离产生的K+和OH-,还有水电离产生的少量H+和OH-,故溶液中含有K+、H+和OH-,H+的放电顺序优先于K+,因此不能制得金属钾。阴极的电极反应为2H++2e-===H2↑,阳极的电极反应为4OH--4e-===O2↑+2H2O。
方法突破
电解池电极产物的判断
名师点拨 电解池中电极名称的判断
应用体验
视角1根据电源判断电解池的两极和反应
1.如图所示,下列有关实验现象的描述正确的是( )
选项 a电极 b电极 X溶液 实验现象
A 石墨 石墨 CuCl2 溶液 a极质量增加,b极放出无色气体
B Fe 石墨 KNO3 溶液 a极质量增加,b极放出无色气体
C Fe 石墨 CuSO4 溶液 a极质量增加,b极放出无色气体
D 石墨 石墨 HCl溶液 a极放出无色气体,b极放出无色气体
C
解析 a电极为阴极,得到电子,发生还原反应,b电极为阳极,失去电子,发生氧化反应。A项,a电极上有铜生成,质量增加,b电极上有黄绿色的氯气生成,错误;B项,a电极上有氢气生成,质量不变,b电极上有无色的氧气生成,错误;C项,a电极上有铜生成,质量增加,b电极上有无色的氧气生成,正确;D项,a电极上有无色的氢气生成,b电极上有黄绿色的氯气生成,错误。
归纳总结 根据化学电源确定电解池的两极,对于阳极首先观察是活性电极还是惰性电极,若为活性电极,电极本身反应;若为惰性电极,需分析溶液中存在的离子,确定在两极上发生反应的离子,正确书写电极反应。
视角2根据外电路电子移动方向或电流方向判断电解池的两极和反应
2.某同学将电解池工作时电子、离子移动方向及电极种类等信息表示在图中,下列有关分析完全正确的是( )
选项 A B C D
a电极 阳极 阴极 阳极 阴极
d电极 正极 正极 负极 负极
Q离子 阳离子 阳离子 阴离子 阴离子
B
解析 根据电子移动方向可知,c是电源负极,d是电源正极,a是阴极,b是阳极,电解时,电解质溶液中阳离子向阴极移动,阴离子向阳极移动,则Q离子是阳离子,P离子是阴离子,故B正确。
视角3根据离子移动方向判断电解池的两极和反应
3.有一款高压无阳极配置可充电钠电池,其充电过程的原理如图所示。下列说法正确的是( )
A.b为正极,电极c上发生氧化反应
B.用此电池做电解水实验,当消耗0.9 g水时,理论上c极消耗钠2.3 g
C.放电时,Na+由3A沸石分子筛膜的右侧向左侧迁移
D.充电时,d为阳极,发生还原反应
B
解析 充电时,钠电池相当于电解池,Na+从右往左移动,因此c为阴极,d为阳极,a为电源负极,b为电源正极,c为阴极发生还原反应,d为阳极发生氧化反应,A、D错误;用此电池做电解水实验时,则c为负极,电极反应为Na-e-===Na+,0.9 g水的物质的量为0.05 mol,电解时转移电子0.1 mol,则消耗Na 0.1 mol,质量为2.3 g,故B正确;放电时,阳离子向正极移动,Na+由3A沸石分子筛膜的左侧向右侧迁移,故C错误。
方法点拨 根据能量的转化过程判断,二次电池放电时为原电池,充电时为电解池,电池的负极充电时为阴极,电池的正极充电时为阳极,因此充电时二次电池的正极接直流电源的正极,负极接直流电源的负极,即充电时“正接正,负接负”。
探究二 用惰性电极电解电解质水溶液的类型总结
方法突破
用惰性电极电解电解质溶液的基本类型
(1)电解H2O(或相当于电解水)型:含氧酸、强碱、活泼金属的含氧酸盐
电解质 H2SO4 NaOH Na2SO4
阳极电极反应 2H2O-4e-=== O2↑+4H+ 4OH--4e-=== O2↑+2H2O 2H2O-4e-=== O2↑+4H+
阴极电极反应 4H++4e-=== 2H2↑ 4H2O+4e-=== 2H2↑+4OH-
pH变化 减小 增大 不变
总反应 2H2O 2H2↑+O2↑
复原时加入的物质 加入H2O
(2)电解电解质型:无氧酸、不活泼金属的无氧酸盐
电解质 HCl CuCl2
阳极电极反应 2Cl--2e-=== Cl2↑
阴极电极反应 2H++2e-=== H2↑ Cu2++2e-=== Cu
pH变化 增大 —
总反应 2HCl H2↑+Cl2↑ CuCl2 Cu+Cl2↑
复原时加入的物质 加入HCl 加入CuCl2
(3)电解质和水都发生电解型:活泼金属的无氧酸盐、不活泼金属的含氧酸盐
电解质 NaCl CuSO4
阳极电极反应 2Cl--2e-=== Cl2↑ 2H2O-4e-=== O2↑+4H+
阴极电极反应 2H2O+2e-=== H2↑+2OH- 2Cu2++4e-=== 2Cu
pH变化 增大 减小
总反应 2NaCl+2H2O 2NaOH+ H2↑+Cl2↑ 2CuSO4+2H2O 2Cu+O2↑+2H2SO4
复原时加入的物质 加入HCl 加入CuO或CuCO3
名师点拨 溶液复原的分析方法
用惰性电极电解电解质溶液时,要使电解后溶液恢复原状态,加入的物质应由电解过程中从溶液中逸出或析出(以气体或固体形式脱离电解质溶液)的物质决定。应遵循“出来什么加什么,出来多少加多少”的原则,一般加入阴极产物和阳极产物化合得到的物质。
应用体验
视角1用惰性电极电解的分析方法
1.用惰性电极电解等物质的量硫酸铜和氯化钠的混合溶液,刚开始阴极和阳极上分别析出的物质是( )
A.H2和Cl2 B.H2和O2
C.Cu和O2 D.Cu和Cl2
D
解析 等物质的量硫酸铜和氯化钠的混合溶液,含有阳离子Cu2+、Na+、H+和阴离子Cl-、 、OH-,用惰性电极电解,在阴极上阳离子放电顺序为Cu2+>H+(水)>Na+,在阳极上阴离子放电顺序为Cl->OH-> ,所以刚开始阴极和阳极上分别析出的物质是Cu和Cl2,答案选D。
【变式设问】
(1)当溶液中的Cl-完全反应后,若继续电解,请写出阴、阳两极所有可能发生的电极反应。
(2)若原溶液中含有CuSO4和NaCl的物质的量均为1 mol,当Cu2+恰好完全放电时,计算阳极产生的气体在标准状况下的体积。
提示 Cl-完全反应时,阳离子还含有Cu2+,则阴极发生的反应为Cu2++2e-===Cu,2H++2e-===H2↑,阳极反应为2H2O-4e-===4H++O2↑。
提示 Cu2+恰好完全放电时,1 mol Cu2+完全反应转移2 mol电子,阳极上首先是Cl-放电生成Cl2,1 mol Cl-失去1 mol电子生成0.5 mol Cl2,还有1 mol电子来自H2O放电生成O2,则应生成0.25 mol O2,因此阳极气体的总的物质的量为0.75 mol,在标准状况下体积为16.8 L。
视角2用惰性电极电解的规律
2.以惰性电极电解下列溶液,有气体生成且溶液pH减小的是( )
A.NaCl B.CuSO4
C.Na2CO3 D.NaOH
B
解析 用惰性电极电解NaCl溶液,阳极Cl-放电生成氯气,阴极水放电生成氢气并产生OH-,溶液pH增大,故A不符合题意;用惰性电极电解CuSO4溶液,阴极Cu2+放电,阳极水放电产生氧气和H+,溶液pH减小,故B符合题意;用惰性电极电解Na2CO3溶液,阴极水放电产生H2,阳极水放电产生氧气,Na2CO3溶液浓度增大,溶液pH增大,故C不符合题意;用惰性电极电解NaOH溶液,阴极水放电产生H2,阳极OH-放电产生氧气,NaOH溶液浓度增大,溶液pH增大,故D不符合题意。
3.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2(CuSO4)
B.NaOH(NaOH)
C.NaCl(NaCl)
D.CuSO4(CuCO3)
D
解析 电解氯化铜时,阳极放出氯气,阴极生成金属铜,所以应加氯化铜让电解质溶液复原,A错误;电解氢氧化钠时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,B错误;电解氯化钠时,阳极产生氯气,阴极产生氢气,所以应加氯化氢让电解质溶液复原,C错误;电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加氧化铜或CuCO3让电解质溶液复原,D正确。
4.如图是一个用铂丝作电极,电解稀的MgSO4溶液(含有少量石蕊溶液)的装置,回答下列问题:
(1)开始U形管中溶液呈 色,原因为
(用离子
方程式表示)。
(2)写出A电极的电极反应:
,
写出B电极的电极反应: 。
红
Mg2++2H2O Mg(OH)2+2H+
2H2O+2e-===H2↑+2OH-,Mg2++2OH-===Mg(OH)2↓
2H2O-4e-===4H++O2↑
(3)当a管中收集满气体后,检验a管中气体的方法是___________________
___________________________________________________。
(4)通电一段时间后,a、b两试管中收集到的气体(均未收集满)体积之比约为 。
用拇指按住试管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有淡蓝色火焰
2∶1
本 课 结 束
第四章
第二节 第1课时 电解原理
素养 目标
1.理解电解池中电子的移动、阴离子和阳离子的移动、阴极和阳极上的反应及其变化、电流形成的过程和原理,培养宏观辨识与微观探析的化学核心素养。
2.建立电解过程的思维模型,理解电解的规律,判断电解的产物,书写电解的电极反应式和总反应式,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
电解原理
1.实验探究:电解CuCl2溶液
按如图所示装置完成实验,并填写下表。
实验现象 实验结论 原因分析
电流表指针发生偏转 说明电解质溶液导电,形成 自由移动离子发生定向移动
与负极相连的b极上逐渐覆盖了一层 ________________ 阴极:Cu2++2e-=== Cu
( 反应)
与正极相连的a极上有 气味的气体产生,能使湿润的碘化钾淀粉试纸 ________________ 阳极:2Cl--2e-=== Cl2↑
( 反应)
闭合回路
红色物质
析出金属铜
还原
刺激性
变蓝
产生了氯气
氧化
2.电解和电解池
(1)电解:使电流通过 而在阳极、阴极引起 反应的过程。
(2)电解池:将 转化为 的装置(也称 )。
(3)电解池的构成条件
①直流电源;②两个电极;③电解质溶液或熔融电解质;④形成闭合回路。
电解质溶液(或熔融电解质)
氧化还原
电能
化学能
电解槽
3.电解原理
电解原理示意图
正极
氧化
负极
还原
阴
阳
微思考
阅读教材电解CuCl2溶液的内容。思考:CuCl2溶液中含有哪些离子 分析开始在两电极上放电的离子分别是哪种离子
提示 CuCl2溶液中含有Cu2+、Cl-、H+和OH-;氧化性Cu2+>H+,还原性Cl->OH-,因此两电极上开始时放电的离子为Cu2+和Cl-。
深化理解
(1)原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置;原电池无外接电源,电解池有外接直流电源。
(2)电解时必须使用直流电源,不能使用交流电源。
(3)电解质水溶液或熔融电解质均可被电解,因为其中均含有可移动的阴、阳离子。
(4)电解是一种强氧化还原手段,可以实现非自发的氧化还原反应。
(5)金属导电为物理变化,电解质溶液导电为化学变化。
易错辨析
(1)电解池能将电能转化为化学能。( )
(2)电解质溶液导电属于化学变化。( )
(3)电解池的阳极与电源的负极相连。( )
√
√
×
提示 电解池的阳极与电源的正极相连。
重难探究·能力素养全提升
探究一 电极产物的判断 电极反应的书写
情境探究
1807年,英国化学家戴维将铂电极插入熔融的氢氧化钾中并接通直流电源时,奇迹发生了,在阴极附近产生一种银白色的金属,随即形成紫色火焰;在阳极产生一种无色气体和水蒸气。这就是发现钾元素的主要过程,在当时社会上引起轰动。
(1)通电过程中能量的转化形式是什么
提示 通电过程中电能转化为化学能。
(2)通电过程中阴极发生反应的类型是什么 阳极发生反应的类型是什么 试写出电解过程的电极反应。
(3)若将“熔融的氢氧化钾”换成KOH溶液,还能制得金属钾吗 试分析溶液中存在的离子并进行解释,写出两极的电极反应。
提示 阴极钾元素的化合价降低,发生还原反应,则阳极发生氧化反应。阴极反应:4K++4e-===4K,阳极反应:4OH--4e-===O2↑+2H2O。
提示 不能。溶液中含有KOH电离产生的K+和OH-,还有水电离产生的少量H+和OH-,故溶液中含有K+、H+和OH-,H+的放电顺序优先于K+,因此不能制得金属钾。阴极的电极反应为2H++2e-===H2↑,阳极的电极反应为4OH--4e-===O2↑+2H2O。
方法突破
电解池电极产物的判断
名师点拨 电解池中电极名称的判断
应用体验
视角1根据电源判断电解池的两极和反应
1.如图所示,下列有关实验现象的描述正确的是( )
选项 a电极 b电极 X溶液 实验现象
A 石墨 石墨 CuCl2 溶液 a极质量增加,b极放出无色气体
B Fe 石墨 KNO3 溶液 a极质量增加,b极放出无色气体
C Fe 石墨 CuSO4 溶液 a极质量增加,b极放出无色气体
D 石墨 石墨 HCl溶液 a极放出无色气体,b极放出无色气体
C
解析 a电极为阴极,得到电子,发生还原反应,b电极为阳极,失去电子,发生氧化反应。A项,a电极上有铜生成,质量增加,b电极上有黄绿色的氯气生成,错误;B项,a电极上有氢气生成,质量不变,b电极上有无色的氧气生成,错误;C项,a电极上有铜生成,质量增加,b电极上有无色的氧气生成,正确;D项,a电极上有无色的氢气生成,b电极上有黄绿色的氯气生成,错误。
归纳总结 根据化学电源确定电解池的两极,对于阳极首先观察是活性电极还是惰性电极,若为活性电极,电极本身反应;若为惰性电极,需分析溶液中存在的离子,确定在两极上发生反应的离子,正确书写电极反应。
视角2根据外电路电子移动方向或电流方向判断电解池的两极和反应
2.某同学将电解池工作时电子、离子移动方向及电极种类等信息表示在图中,下列有关分析完全正确的是( )
选项 A B C D
a电极 阳极 阴极 阳极 阴极
d电极 正极 正极 负极 负极
Q离子 阳离子 阳离子 阴离子 阴离子
B
解析 根据电子移动方向可知,c是电源负极,d是电源正极,a是阴极,b是阳极,电解时,电解质溶液中阳离子向阴极移动,阴离子向阳极移动,则Q离子是阳离子,P离子是阴离子,故B正确。
视角3根据离子移动方向判断电解池的两极和反应
3.有一款高压无阳极配置可充电钠电池,其充电过程的原理如图所示。下列说法正确的是( )
A.b为正极,电极c上发生氧化反应
B.用此电池做电解水实验,当消耗0.9 g水时,理论上c极消耗钠2.3 g
C.放电时,Na+由3A沸石分子筛膜的右侧向左侧迁移
D.充电时,d为阳极,发生还原反应
B
解析 充电时,钠电池相当于电解池,Na+从右往左移动,因此c为阴极,d为阳极,a为电源负极,b为电源正极,c为阴极发生还原反应,d为阳极发生氧化反应,A、D错误;用此电池做电解水实验时,则c为负极,电极反应为Na-e-===Na+,0.9 g水的物质的量为0.05 mol,电解时转移电子0.1 mol,则消耗Na 0.1 mol,质量为2.3 g,故B正确;放电时,阳离子向正极移动,Na+由3A沸石分子筛膜的左侧向右侧迁移,故C错误。
方法点拨 根据能量的转化过程判断,二次电池放电时为原电池,充电时为电解池,电池的负极充电时为阴极,电池的正极充电时为阳极,因此充电时二次电池的正极接直流电源的正极,负极接直流电源的负极,即充电时“正接正,负接负”。
探究二 用惰性电极电解电解质水溶液的类型总结
方法突破
用惰性电极电解电解质溶液的基本类型
(1)电解H2O(或相当于电解水)型:含氧酸、强碱、活泼金属的含氧酸盐
电解质 H2SO4 NaOH Na2SO4
阳极电极反应 2H2O-4e-=== O2↑+4H+ 4OH--4e-=== O2↑+2H2O 2H2O-4e-=== O2↑+4H+
阴极电极反应 4H++4e-=== 2H2↑ 4H2O+4e-=== 2H2↑+4OH-
pH变化 减小 增大 不变
总反应 2H2O 2H2↑+O2↑
复原时加入的物质 加入H2O
(2)电解电解质型:无氧酸、不活泼金属的无氧酸盐
电解质 HCl CuCl2
阳极电极反应 2Cl--2e-=== Cl2↑
阴极电极反应 2H++2e-=== H2↑ Cu2++2e-=== Cu
pH变化 增大 —
总反应 2HCl H2↑+Cl2↑ CuCl2 Cu+Cl2↑
复原时加入的物质 加入HCl 加入CuCl2
(3)电解质和水都发生电解型:活泼金属的无氧酸盐、不活泼金属的含氧酸盐
电解质 NaCl CuSO4
阳极电极反应 2Cl--2e-=== Cl2↑ 2H2O-4e-=== O2↑+4H+
阴极电极反应 2H2O+2e-=== H2↑+2OH- 2Cu2++4e-=== 2Cu
pH变化 增大 减小
总反应 2NaCl+2H2O 2NaOH+ H2↑+Cl2↑ 2CuSO4+2H2O 2Cu+O2↑+2H2SO4
复原时加入的物质 加入HCl 加入CuO或CuCO3
名师点拨 溶液复原的分析方法
用惰性电极电解电解质溶液时,要使电解后溶液恢复原状态,加入的物质应由电解过程中从溶液中逸出或析出(以气体或固体形式脱离电解质溶液)的物质决定。应遵循“出来什么加什么,出来多少加多少”的原则,一般加入阴极产物和阳极产物化合得到的物质。
应用体验
视角1用惰性电极电解的分析方法
1.用惰性电极电解等物质的量硫酸铜和氯化钠的混合溶液,刚开始阴极和阳极上分别析出的物质是( )
A.H2和Cl2 B.H2和O2
C.Cu和O2 D.Cu和Cl2
D
解析 等物质的量硫酸铜和氯化钠的混合溶液,含有阳离子Cu2+、Na+、H+和阴离子Cl-、 、OH-,用惰性电极电解,在阴极上阳离子放电顺序为Cu2+>H+(水)>Na+,在阳极上阴离子放电顺序为Cl->OH-> ,所以刚开始阴极和阳极上分别析出的物质是Cu和Cl2,答案选D。
【变式设问】
(1)当溶液中的Cl-完全反应后,若继续电解,请写出阴、阳两极所有可能发生的电极反应。
(2)若原溶液中含有CuSO4和NaCl的物质的量均为1 mol,当Cu2+恰好完全放电时,计算阳极产生的气体在标准状况下的体积。
提示 Cl-完全反应时,阳离子还含有Cu2+,则阴极发生的反应为Cu2++2e-===Cu,2H++2e-===H2↑,阳极反应为2H2O-4e-===4H++O2↑。
提示 Cu2+恰好完全放电时,1 mol Cu2+完全反应转移2 mol电子,阳极上首先是Cl-放电生成Cl2,1 mol Cl-失去1 mol电子生成0.5 mol Cl2,还有1 mol电子来自H2O放电生成O2,则应生成0.25 mol O2,因此阳极气体的总的物质的量为0.75 mol,在标准状况下体积为16.8 L。
视角2用惰性电极电解的规律
2.以惰性电极电解下列溶液,有气体生成且溶液pH减小的是( )
A.NaCl B.CuSO4
C.Na2CO3 D.NaOH
B
解析 用惰性电极电解NaCl溶液,阳极Cl-放电生成氯气,阴极水放电生成氢气并产生OH-,溶液pH增大,故A不符合题意;用惰性电极电解CuSO4溶液,阴极Cu2+放电,阳极水放电产生氧气和H+,溶液pH减小,故B符合题意;用惰性电极电解Na2CO3溶液,阴极水放电产生H2,阳极水放电产生氧气,Na2CO3溶液浓度增大,溶液pH增大,故C不符合题意;用惰性电极电解NaOH溶液,阴极水放电产生H2,阳极OH-放电产生氧气,NaOH溶液浓度增大,溶液pH增大,故D不符合题意。
3.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2(CuSO4)
B.NaOH(NaOH)
C.NaCl(NaCl)
D.CuSO4(CuCO3)
D
解析 电解氯化铜时,阳极放出氯气,阴极生成金属铜,所以应加氯化铜让电解质溶液复原,A错误;电解氢氧化钠时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,B错误;电解氯化钠时,阳极产生氯气,阴极产生氢气,所以应加氯化氢让电解质溶液复原,C错误;电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加氧化铜或CuCO3让电解质溶液复原,D正确。
4.如图是一个用铂丝作电极,电解稀的MgSO4溶液(含有少量石蕊溶液)的装置,回答下列问题:
(1)开始U形管中溶液呈 色,原因为
(用离子
方程式表示)。
(2)写出A电极的电极反应:
,
写出B电极的电极反应: 。
红
Mg2++2H2O Mg(OH)2+2H+
2H2O+2e-===H2↑+2OH-,Mg2++2OH-===Mg(OH)2↓
2H2O-4e-===4H++O2↑
(3)当a管中收集满气体后,检验a管中气体的方法是___________________
___________________________________________________。
(4)通电一段时间后,a、b两试管中收集到的气体(均未收集满)体积之比约为 。
用拇指按住试管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有淡蓝色火焰
2∶1
本 课 结 束
