1.3.电能转化为化学能-电解 (含解析)课后训练 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.3.电能转化为化学能-电解 (含解析)课后训练 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 12:41:05 | ||
图片预览

文档简介
1.3.电能转化为化学能-电解课后训练2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
一、单选题
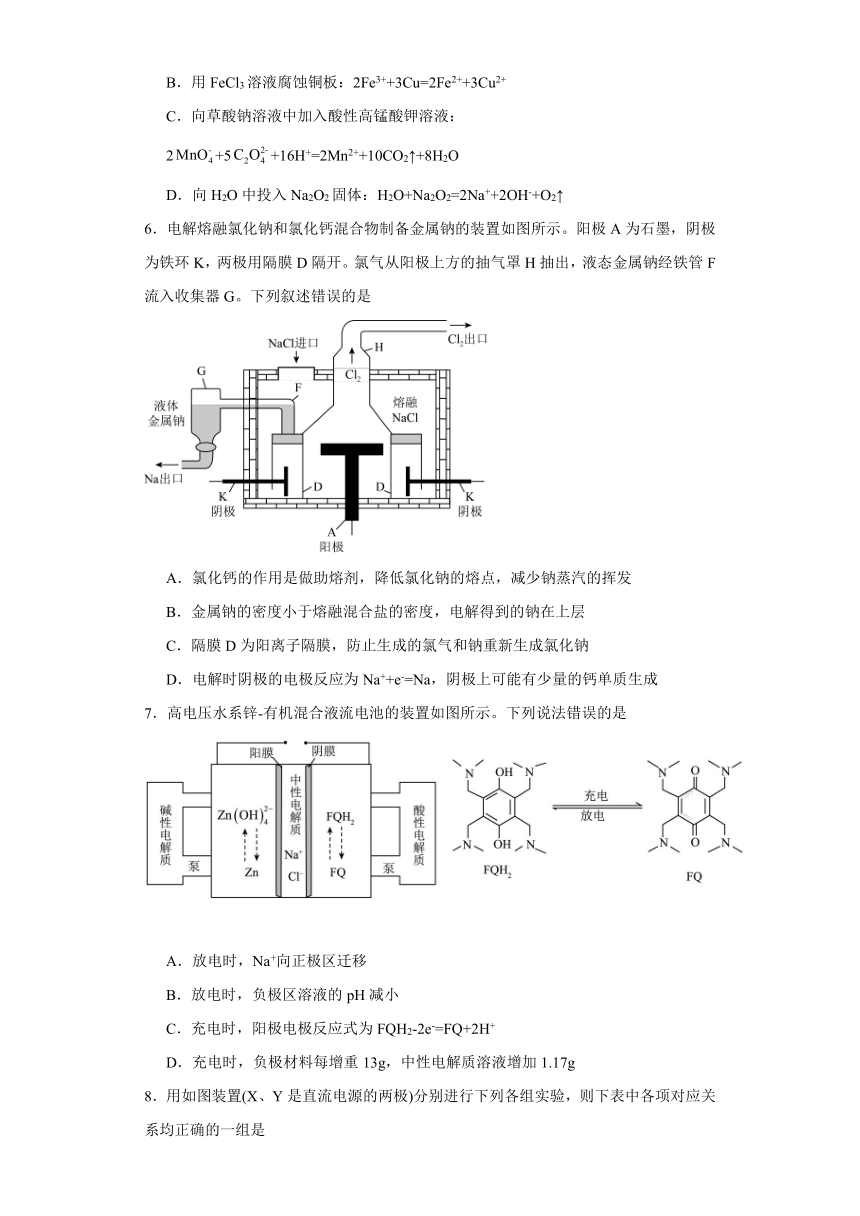
1.下列实验装置设计或操作正确的是
A.装置A滴定管的读数
B.操作B是酸式滴定管排气泡的方法
C.装置C组装铜银原电池
D.装置D用于制备少量含的消毒液
2.化学与生产、生活密切相关。下列装置工作时,将化学能转化为电能的是
A.锂离子电池 B.风力发电机
C.一次性保暖贴 D.工业电解食盐水
3.水溶液中电解催化还原制甲酸是实现“碳中和”的途径之一。下列说法正确的是
A.该过程将化学能转化为电能
B.生成甲酸的电极反应为:
C.阳离子由阴极移向阳极
D.电路中通过,阳极生成
4.铝是地壳中含量最多的金属元素。工业冶炼铝的正确方法是
A.热分解法 B.电解法 C.热还原法 D.物理方法
5.下列有关离子方程式的书写正确的是
A.用纯铜电板电解CuCl2溶液:Cu2++2Cl-Cu+Cl2↑
B.用FeCl3溶液腐蚀铜板:2Fe3++3Cu=2Fe2++3Cu2+
C.向草酸钠溶液中加入酸性高锰酸钾溶液:2+5+16H+=2Mn2++10CO2↑+8H2O
D.向H2O中投入Na2O2固体:H2O+Na2O2=2Na++2OH-+O2↑
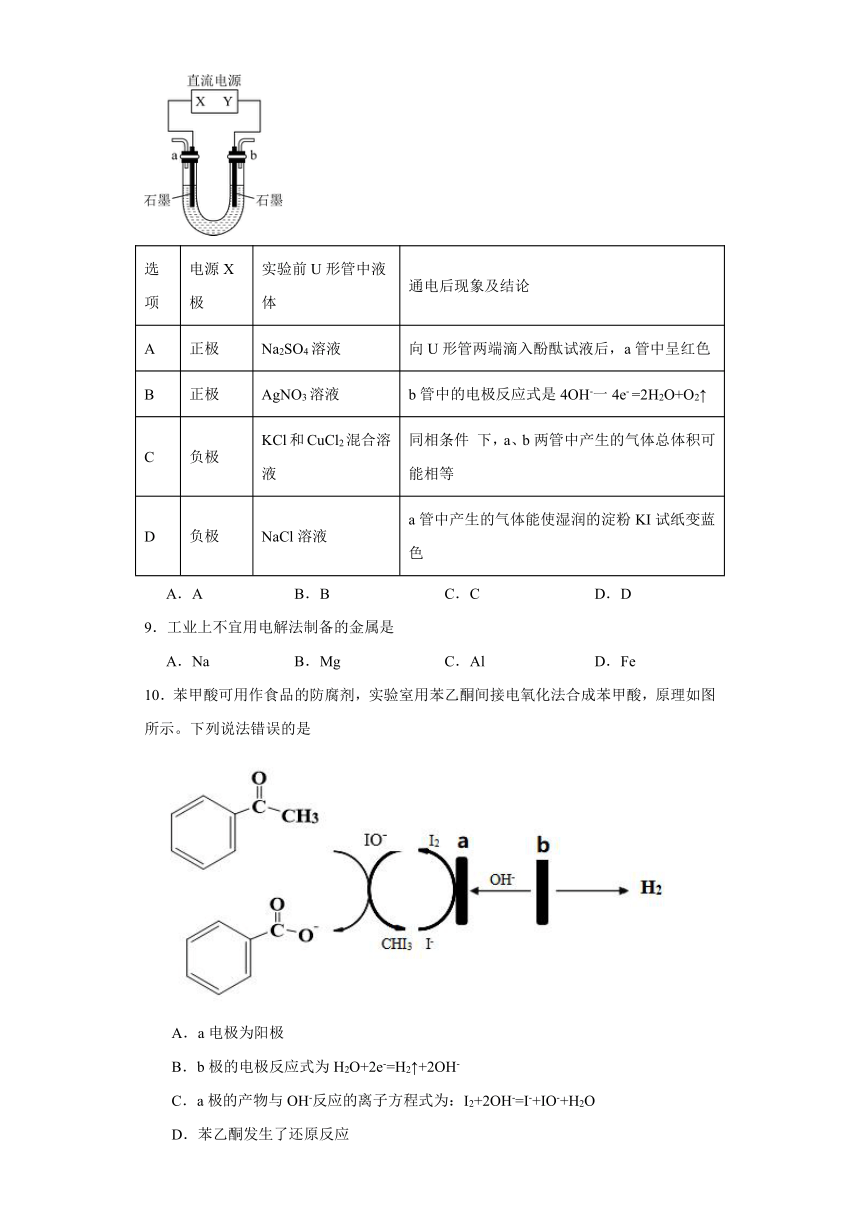
6.电解熔融氯化钠和氯化钙混合物制备金属钠的装置如图所示。阳极A为石墨,阴极为铁环K,两极用隔膜D隔开。氯气从阳极上方的抽气罩H抽出,液态金属钠经铁管F流入收集器G。下列叙述错误的是
A.氯化钙的作用是做助熔剂,降低氯化钠的熔点,减少钠蒸汽的挥发
B.金属钠的密度小于熔融混合盐的密度,电解得到的钠在上层
C.隔膜D为阳离子隔膜,防止生成的氯气和钠重新生成氯化钠
D.电解时阴极的电极反应为Na++e-=Na,阴极上可能有少量的钙单质生成
7.高电压水系锌-有机混合液流电池的装置如图所示。下列说法错误的是
A.放电时,Na+向正极区迁移
B.放电时,负极区溶液的pH减小
C.充电时,阳极电极反应式为FQH2-2e-=FQ+2H+
D.充电时,负极材料每增重13g,中性电解质溶液增加1.17g
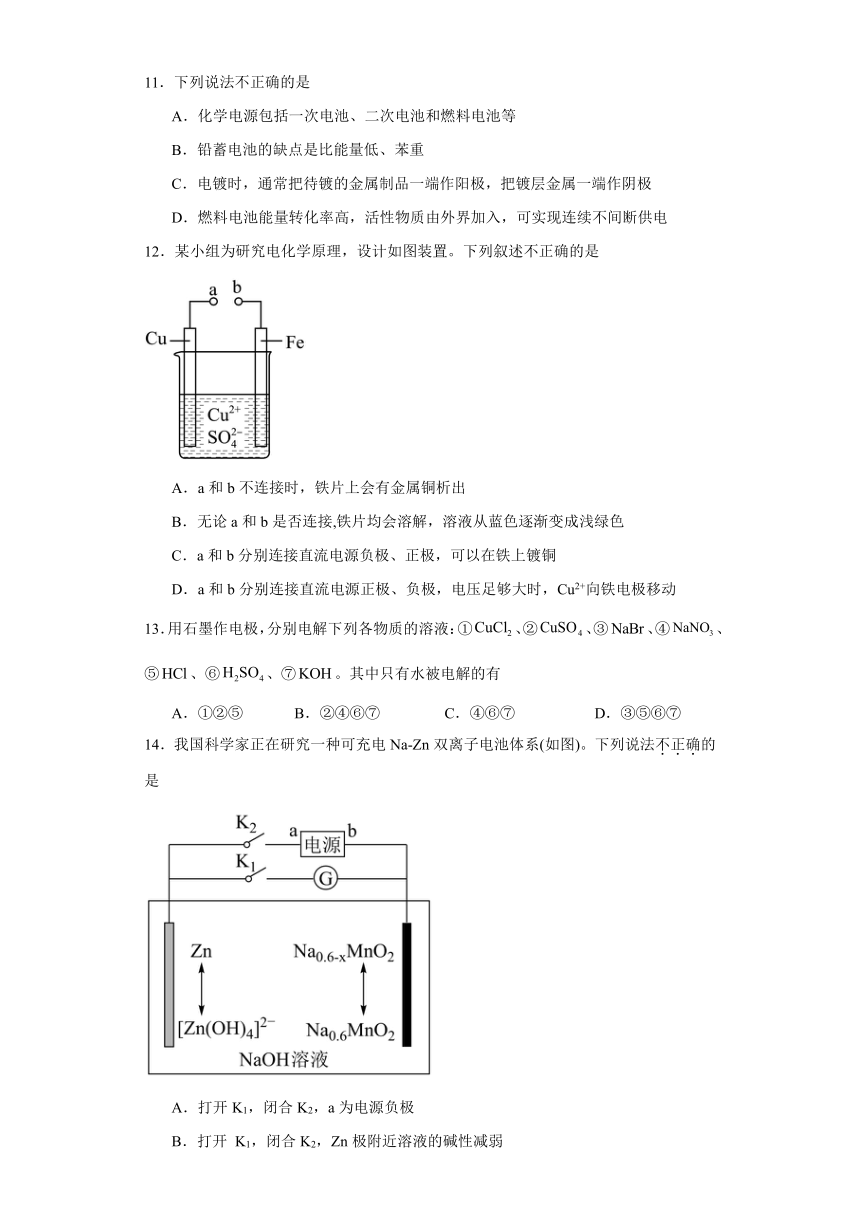
8.用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项对应关系均正确的一组是
选项 电源X极 实验前U形管中液体 通电后现象及结论
A 正极 Na2SO4溶液 向U形管两端滴入酚酞试液后,a管中呈红色
B 正极 AgNO3溶液 b管中的电极反应式是4OH-一4e- =2H2O+O2↑
C 负极 KCl和CuCl2混合溶液 同相条件 下,a、b两管中产生的气体总体积可能相等
D 负极 NaCl溶液 a管中产生的气体能使湿润的淀粉KI试纸变蓝色
A.A B.B C.C D.D
9.工业上不宜用电解法制备的金属是
A.Na B.Mg C.Al D.Fe
10.苯甲酸可用作食品的防腐剂,实验室用苯乙酮间接电氧化法合成苯甲酸,原理如图所示。下列说法错误的是
A.a电极为阳极
B.b极的电极反应式为H2O+2e-=H2↑+2OH-
C.a极的产物与OH-反应的离子方程式为:I2+2OH-=I-+IO-+H2O
D.苯乙酮发生了还原反应
11.下列说法不正确的是
A.化学电源包括一次电池、二次电池和燃料电池等
B.铅蓄电池的缺点是比能量低、苯重
C.电镀时,通常把待镀的金属制品一端作阳极,把镀层金属一端作阴极
D.燃料电池能量转化率高,活性物质由外界加入,可实现连续不间断供电
12.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
A.a和b不连接时,铁片上会有金属铜析出
B.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
C.a和b分别连接直流电源负极、正极,可以在铁上镀铜
D.a和b分别连接直流电源正极、负极,电压足够大时,Cu2+向铁电极移动
13.用石墨作电极,分别电解下列各物质的溶液:①、②、③、④、⑤、⑥、⑦。其中只有水被电解的有
A.①②⑤ B.②④⑥⑦ C.④⑥⑦ D.③⑤⑥⑦
14.我国科学家正在研究一种可充电Na-Zn双离子电池体系(如图)。下列说法不正确的是
A.打开K1,闭合K2,a为电源负极
B.打开 K1,闭合K2,Zn极附近溶液的碱性减弱
C.打开 K2,闭合K1,OH-向极移动
D.打开 K2,闭合K1,正极反应式为
15.“美丽中国·绿色冬奥”,千余辆氢能大巴穿梭于赛场。一种可实现氢气循环利用的新型电池的放电工作原理如图所示。下列说法正确的是
A.该装置化学能与电能之间的能量转化效率可达100%
B.放电时,N极电极反应式为
C.放电过程中由左池通过交换膜向右池移动
D.充电时,电极M接电源的负极
16.LiOH是制备锂离子电池的材料。电解LiCl溶液制备LiOH的装置如图所示。下列说法正确的是
A.电极A连接电源的负极
B.B极区电解液为LiCl溶液
C.电极每产生22.4L气体M,电路中转移2mole-
D.电池总反应为:2LiCl+2H2OH2↑+Cl2↑+2LiOH
17.通过亚硫酸盐电化学还原为连二亚硫酸钠,可消除烟气中的(、等)。电化学还原为的装置如图所示。下列有关说法不正确的是。
A.右室电极连接电源的正极
B.电解过程中,右室硫酸浓度增大
C.左室电极上发生的电极反应为:
D.当右室产生气体(标况下)时,理论上有由右室移向左室
18.近期,天津大学化学团队以CO2与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图。下列说法不正确的是
A.Ni2P电极与电源正极相连
B.在In/In2O3-x电极上发生的反应为:CO2+H2O+2e-=HCOO-+OH-
C.In/In2O3-x电极上可能有副产物H2生成
D.一段时间后,右侧电极室内溶液pH显著降低
19.新型可充电镁—溴电池能量密度高,循环性能优越,在未来能量存储领域潜力巨大。某镁—溴电池装置如下图(正负极区之间的离子选择性膜只允许Mg2+通过)。下列说法不正确的是
A.放电时,Mg电极发生还原反应
B.放电时,正极反应为:+2e = 3Br
C.充电时,Mg电极应连接电源负极
D.当0.1 mol Mg2+通过离子选择性膜时,导线中通过0.2 mol e
20.如图是我国科学家研发的某新型可充电电池的工作原理图,图中虚线转化表示充电状态,下列说法错误的是
A.放电时正极反应式为
B.放电时电极电势:多壁碳纳米管电极>钠箱
C.放电时总反应方程式为
D.充电时向多壁碳纳米管电极移动
21.下列化学用语表述不正确的是
A.HCl在水中电离:HCl = H+ + Cl-
B.NH4Cl晶体中,既有共价键,又有离子键
C.用电子式表示NaCl的形成过程:
D.惰性电极电解CuCl2溶液:Cu2++2Cl- Cu+Cl2↑
22.目前海水淡化可采用双极膜电渗析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N 为离子交换膜。下列说法正确的是
A.X 电极为电解池的阴极,该电极反应式为: 2H+-2e-=H2↑
B.电子流向: 电源负极→X电极→Y 电极→电源正极
C.电路中每转移1mol 电子,X、Y两极共得到标准状况下16.8L的气体
D.M为阳离子交换膜,A室获得副产品NaOH; 若去掉B室双极膜,B室产物不变
23.水系锌一碘二次电池是一种潜在的新型储能体系,其工作原理如图所示。下列说法正确的是
A.a为阳离子交换膜、b为阴离子交换膜
B.充电时,石墨 Zn复合电极接电源的正极
C.放电时,石墨电极的电极反应式为: 3I- 2e- =
D.放电时,电路中转移的电子数等于通过a膜的离子数
24.硫化氢有高毒性和强腐蚀性,用电化学处理的原理如图所示。下列说法错误的是
A.X电极连接电源的负极,发生还原反应
B.电解时,由X电极室移向Y电极室
C.Y电极反应式为
D.每转移理论上可处理
25.碱性锌铁液流电池采用资源丰富的铁和锌作为电池正、负极电解液活性物质,具有电压高、成本低的优点。该电池的总反应为Zn+2Fe(CN)+4OH-2Fe(CN)+ZN(OH).下列叙述正确的是
A.充电时,M极电极反应式为Fe(CN)+e-= Fe(CN)
B.放电时,N极电势高于M极
C.1mol Fe(CN)中含有σ键的数目为12 NA
D.放电时,电路中转移2 mol电子时,负极区电解质溶液增重65 g
二、填空题
26.电解精炼铜进行一段时间后,阳极减少的铜质量与阴极增加的铜的质量相等吗?为什么 ?
27.氯碱工业原理图
X为电源正极,A为 极,甲是 ,乙是 ,丙是 ,戊是 ,己是 ,庚是 。
28.如图1所示,其中甲池的总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O,回答下问题:
(1)甲池燃料电池的负极反应式为 。
(2)写出乙池中电解总反应的化学方程式: 。
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生 g沉淀,此时乙池中溶液的体积为400 mL,该溶液的pH= 。
(4)若乙池是铁片镀铜装置,则石墨电极和银电极应替换为 和 。
(5)若乙池是电解精炼铜装置,随着电解过程的进行,电解质溶液的浓度将 (填“变大”、“变小”或“不变”)。
(6)某同学利用甲醇燃料电池设计电解法制取漂白液的实验装置如图2,若用于制漂白液,则a为电池的 极,电解质溶液用 。随着电解过程的进行,溶液pH将 (填“变大”、“变小”或“不变”)。
试卷第1页,共3页
参考答案:
1.D
【详解】A.由图可知,装置A滴定管的读数,故A错误;
B.操作B是碱式滴定管排气泡的方法,故B错误;
C.装置C盐桥中的氯化钾饱和溶液会与硝酸银生成氯化银沉淀,C错误;
D.装置D电解池中底部为阳极,氯离子放电生成氯气;上部为阴极,水放电生成氢气和氢氧化钠,则上升的氯气和氢氧化钠反应生成,故D正确。
故选D。
2.A
【分析】原电池是将化学能转化为电能的装置,据此分析。
【详解】A.锂离子电池是利用原电池原理设计的电池,是将化学能转化为电能的装置,故A符合题意;
B.风力发电机是将风能转化为电能的装置,故B不符合题意;
C.一次性保暖贴是将化学能转化为热能的装置,故C不符合题意;
D.工业电解食盐水是利用电解池原理,是将电能转化为化学能的装置,故D不符合题意;
答案选A。
3.B
【详解】A.该过程的装置是电解池,是将电能转化为化学能的装置,选项A错误;
B.电解过程生成甲酸是利用二氧化碳得电子实现的,故电极反应为:,选项B正确;
C.电解池中阳离子由阳极移向阴极,选项C错误;
D.电路中通过,阳极生成1molO2,但没有说明标准状况,无法确定气体的体积,选项D错误;
答案选B。
4.B
【详解】铝属于活泼金属元素。工业上用电解熔融态三氧化二铝的方法进行冶炼,故B符合题意;
故答案:B。
5.C
【详解】A.用惰性电极电解溶液,阴极上放电,阳极上放电,离子方程式为:,用纯铜电板则阳极铜会失去电子生成铜离子,A错误;
B.溶液刻蚀电路铜板的离子方程式为:,B错误;
C.草酸根离子被酸性高锰酸钾氧化为二氧化碳气体,同时生成锰离子,离子方程式为:2+5+16H+=2Mn2++10CO2↑+8H2O,C正确;
D.过氧化钠和水生成氢氧化钠和氧气,反应为,D错误;
故选C。
6.C
【分析】该装置中为电解池,阳极A为石墨,电极反应为:2Cl--e-=Cl2↑;阴极为铁环K,电极反应为Na++e-=Na,氯化钙中的钙离子的氧化性强于Na+,故钙离子会在阴极上的电子生成少量钙,Cl-通过隔膜D移至阳极A放电产生Cl2,隔膜D应该为阴离子隔膜,由此分析。
【详解】A.本装置的目的是电解熔融氯化钠,氯化钠是离子化合物,熔点较高,加入氯化钙的目的为做助熔剂,降低氯化钠的熔点,减少钠蒸汽的挥发,故A不符合题意;
B.从图中知道,金属钠在上部收集,所以猜想到钠的密度小于混合盐的密度,故B不符合题意;
C.由图可知,Cl 通过隔膜D移至阳极A放电产生Cl2,所以,隔膜D应该为阴离子隔膜,故C符合题意;
D.根据分析,电解时阴极的电极反应为Na++e-=Na,氯化钙中的钙离子的氧化性强于Na+,故钙离子会在阴极上的电子生成少量钙,故阴极上可能有少量的钙单质生成,故D不符合题意;
答案选C。
7.D
【分析】高电压水系锌-有机混合液流电池工作原理为:放电时为原电池,金属Zn发生失电子的氧化反应生成Zn2+,为负极,则FQ所在电极为正极,正极反应式为2FQ+2e-+2H+═FQH2,负极反应式为;充电时电解池,原电池的正负极连接电源的正负极,阴阳极的电极反应与原电池的负正极的反应式相反,电解质中阳离子移向阴极、阴离子移向阳极,因此充电时,m接外接电源的负极,n接外接电源的正极,据此作答。
【详解】A.原电池中阳离子向正极移动,故放电时,Na+向正极区迁移,A正确;
B.放电时,负极区锌失去电子发生氧化反应,,溶液氢氧根离子浓度减小,pH减小,B正确;
C.充电时,阳极的FQH2失去电子反应氧化反应,电极反应式为FQH2-2e-=FQ+2H+,C正确;
D.充电时,负极材料作阴极,电极反应式为,负极材料每增重13g,即生成0.2mol Zn,转移电子0.4mol,中性溶液中和分别透过阳膜和阴膜进入阴极区和阳极区,物质的量为0.4mol NaCl,质量为23.4g,故D错误;
故选D。
8.C
【详解】A.a管中电极为阳极,a管中电极反应式是2H2O-4e-=O2↑+4H+,反应后溶液显酸性,不能使酚酞试液变红色,A错误;
B.b管中电极为阴极,发生反应:Ag++e-=Ag,B错误;
C.a管中电极是阴极,发生反应:Cu2++2e-=Cu,2H2O+2e-=H2↑+2OH-,b管中电极是阳极,发生反应:2Cl--2e-=Cl2↑,2H2O-4e-=O2↑+4H+,相同条件下,a、b两管中产生的气体总体积可能相等,C正确;
D.a管中电极是阴极,发生反应2H2O+2e-=H2↑+2OH-,生成气体不能使湿润的淀粉KI试纸变蓝色,D错误;
故选C。
9.D
【详解】A.工业上用电解熔融状态的NaCl制备金属Na,A不符题意;
B.工业上用电解熔融状态的MgCl2制备金属Mg,B不符题意;
C.工业上用电解熔融状态的Al2O3制备金属Al,C不符题意;
D.工业上用热还原法制备Fe,不用电解法制备Fe,D符合题意;
答案选D。
10.D
【详解】A.据图可知a电极上KI被氧化为I2,所以为阳极,A正确;
B.据图可知b电极上H2O得电子被还原生成H2,电极反应为H2O+2e-=H2↑+2OH-,B正确;
C.a极产物为I2,结合氯气和强碱溶液的反应可知I2与OH-反应的离子方程式为:I2+2OH-=I-+IO-+H2O,C正确;
D.苯乙酮生成苯甲酸根时加氧去氢,发生氧化反应,D错误;
综上所述答案为D。
11.C
【详解】A.化学电源是是一种能将化学能直接转变成电能的装置,主要包括一次电池、二次电池、燃料电池等,故A正确;
B.铅酸蓄电池的缺点是比能量(单位重量所蓄电能)低,十分苯重,对环境腐蚀性强,循环使用寿命短,故B正确;
C.电镀时,通常把待镀的金属制品一端作阴极,把镀层金属一端作阳极,故C错误;
D.燃料电池为一种把燃料所具有的化学能直接转换成电能的化学装置,能量转化率高,活性物质由外界加入,可实现连续不间断供电,故D正确;
故选C。
12.C
【详解】A.a和b不连接时,铁直接与硫酸铜溶液发生置换反应生成铜单质,故A正确;
B.无论a和b是否连接,铁都会与铜离子发生置换反应生成Fe2+和Cu,溶液从蓝色逐渐变成浅绿色,故B正确;
C.b连接电源的正极,则Fe为阳极,被氧化成亚铁离子,无法镀铜,故C错误;
D.电解池中阳离子流向阴极,b连接负极,则Fe为阴极,所以电压足够大时,Cu2+向铁电极移动,故D正确;
综上所述答案为C。
13.C
【详解】用石墨作电极,离子放电取决于离子的放电顺序,阳极: S2->I->Br->Cl->OH->含氧酸根离子,阴极: Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+,
①溶液中放电的是铜离子和氯离子,是CuCl2被电解;
②溶液中放电的是铜离子和氢氧根离子,硫酸铜和水都被电解;
③溶液中放电的是溴离子和氢氧根离子,溴化钠和水都电解;
④溶液中放电的是氢离子和氢氧根离子,也就是只有水被电解;
⑤溶液中放电的是氢离子和氯离子,氯化氢和水都被电解;
⑥液中放电的是氢离子和氢氧根离子,也就是只有水被电解;
⑦溶液中放电的是氢离子和氢氧根离子,也就是只有水被电解;
其中只有水被电解的有④⑥⑦,答案选C。
14.B
【详解】A.打开K1,闭合K2,装置为电解池,其中a为电源负极,左边Zn电极为阴极,发生还原反应,电极反应式为:[Zn(OH)4]2-+2e-=Zn+4OH-,A正确;
B.根据选项A分析可知:打开 K1,闭合K2时,Zn电极反应式为:[Zn(OH)4]2-+2e-=Zn+4OH-,反应产生OH-,使Zn极附近溶液的碱性增强,B错误;
C.打开 K2,闭合K1,Zn电极为负极,失去电子,发生氧化反应,电极反应式为:Zn-2e-+4OH-=[Zn(OH)4]2-,因此OH-向极移动,C正确;
D.打开 K2,闭合K1,右边电极为正极,得到电子,发生还原反应,则正极的电极反应式为,D正确;
故合理选项是B。
15.B
【分析】由图可知,放电时N极作负极,氢气失电子,碱性溶液中电极反应式为H2+2OH--2e-═2H2O,消耗氢氧根离子,钠离子剩余,电极M作正极,电极反应式为2H++2e-=H2↑,阳离子减少,故钠离子由右池透过交换膜进入左池,充电时,电池的负极连接电源的负极做阴极,电池的正极连接电源的正极作阳极,据此作答。
【详解】A.该装置工作时会产生热量,有能量损失,故化学能与电能之间的能量转化效率无法达到100%,故A错误;
B.放电时N极作负极,氢气失电子,碱性溶液中电极反应式为H2+2OH--2e-═2H2O,故B正确;
C.由分析可知,放电时由右池透过交换膜进入左池,故C错误;
D.由分析可知,充电时M极接电源的正极,故D错误;
故选:B。
16.D
【分析】电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B上氢离子放电,可知B为阴极,在B侧制备LiOH,Li+由A经过阳离子交换膜向 B移动,A中为LiCl溶液,氯离子放电生成氯气,据此分析解题。
【详解】A.由分析可知,A为阳极,与正极相连,故A错误;
B.通过以上分析知,B极区电解液为LiOH,否则无法得到纯净的LiOH,故B错误;
C.没有指明气体所处状态,无法计算其物质的量,所以无法计算转移电子物质的量,故C错误;
D.电解池的阳极上是氯离子失电子,阴极上是氢离子得电子,电解的总反应方程式为: 2LiCl+2H2OH2↑+Cl2↑+2LiOH,故D正确;
故选D。
17.D
【分析】由图可知,左室电极附近转化成,硫元素化合价从+4价降为+3价,被还原,则左室电极作电解池的阴极,右室电极作阳极。
【详解】A.根据分析可知,右室电极作阳极,连接电源的正极,A项正确;
B.电解过程中,右室(阳极)电极反应式为:,阳极消耗了水,使硫酸浓度增大,B项正确;
C.左室电极附近得电子生成,发生的电极反应为:,C项正确;
D.根据右室的电极反应式:可知,每生成1mol O2,转移4mol电子,同时有4molH+通过质子交换膜移向左室,所以当右室产生气体(标况下)即0.5mol时,理论上有由右室移向左室,D项错误;
答案选D。
18.D
【分析】装置为电解池,左侧二氧化碳得电子生成甲酸根,电极反应为CO2+H2O+2e-=HCOO-+OH-,左侧电极为阴极,右侧为阳极,接电源正极,电极反应为 。
【详解】A.右侧电极为阳极,Ni2P电极与电源正极相连,A正确;
B.根据分析,在左侧电极发生的反应正确,B正确;
C.左侧电极为阴极,发生还原反应,水可能得电子生成氢气,故可能有副产物H2生成,C正确;
D.右侧电极为阳极,从阳极电极方程式可以看出,当电路中有4mol电子转移时,氢氧根迁移过来的物质的量也是4mol,最终被消耗生成水,辛胺浓度降低,溶液的pH没有明显变化,D错误;
故选D。
19.A
【详解】A.放电时,镁是负极,Mg电极失电子发生氧化反应,故A错误;
B.由原电池原理可知,放电时,正极反应为:+2e = 3Br ,故B正确;
C.放电时,镁是负极,充电时,Mg电极应连接电源负极,故C正确;
D.根据电荷守恒,当0.1 mol Mg2+通过离子选择性膜时,导线中通过0.2 mol e ,故D正确;
选A。
20.D
【分析】由图知,放电时正极上转化为、C,负极上钠失电子产生,充电时钠离子转化为钠单质,向阴极钠箔电极移动;
【详解】A.由图中信息知,放电时正极上转化为、C,选项A正确;
B.放电时是原电池,正极电势高于负极的,选项B正确;
C.由图知,正极上转化为、C,负极上钠失电子产生,总反应方程式为,选项C正确;
D.充电时钠箔电极接电源负极作阴极,移向带负电的钠箔,选项D错误;
答案选D。
21.C
【详解】A.HCl为易溶于水的强电解质,在水中发生完全电离:HCl = H+ + Cl-,A正确;
B.NH4Cl晶体属于离子晶体,由和Cl-构成,二者间形成离子键,在中,N、H原子间形成共价键,B正确;
C.NaCl为离子化合物,由Na+和Cl-构成,电子式表示NaCl的形成过程: ,C不正确;
D.惰性电极电解CuCl2溶液,阳极Cl-失电子生成Cl2,阴极Cu2+得电子生成Cu:Cu2++2Cl- Cu+Cl2↑,D正确;
故选C。
22.C
【详解】A.电解池中阳离子向阴极移动,故X电极为阴极,电极反应式为:2H++2e-=H2↑,选项A错误;
B.电子不能通过电解质溶液,所以电子流向:电源负极→阴极X电极、阳极Y电极→电源正极,选项B错误;
C.阴极反应为2H++2e-=H2↑,阳极反应为:4OH--4e-=O2↑+2H2O,当电路中通过1mol电子时,阴极得到0.5molH2,阳极得到0.25molO2,两极一共得到气体为0.5mol+0.25mol=0.75mol,标准状况下16.8L的气体,选项C正确;
D.电解池中,电解时,溶液中的阳离子向阴极移动,阴离子向阳极移动,因此M为阳离子交换膜,A室获得副产品NaOH;若去掉双极膜(BP),则Cl-会在阳极失去电子,生成Cl2,在阳极室会有C12生成,,B室产物发生变化,选项D错误;
答案选C。
【点睛】本题考查电解原理,注意审题,不再是电解饱和食盐水的反应,由于双极膜(BP)是阴、阳复合膜的存在,使电解反应变成了电解水,是易错点。阴极是物质得到电子,发生还原反应;溶液中的阳离子向阴极移动,阴离子向阳极移动。
23.A
【分析】由图可知,Zn在石墨-Zn复合电极失去电子生成Zn2+,则石墨-Zn复合电极为负极,电极方程式为:Zn-2e-=Zn2+,在石墨电极处得到电子生成I-,石墨电极为正极,电极方程式为:+2e-=3I-。
【详解】A.由分析可知,石墨-Zn复合电极为负极,石墨电极为正极,负极生成的Zn2+通过a膜进去向正极移动,正极生成的I-通过b膜向负极移动,在中间区域生成ZnI2,a为阳离子交换膜、b为阴离子交换膜,故A正确;
B.由分析可知,石墨-Zn复合电极为负极,充电时,石墨 Zn复合电极接电源的负极,故B错误;
C.由分析可知,放电时,石墨电极的电极反应式为:+2e-=3I-,故C错误;
D.由A可知,Zn2+通过a膜进去向正极移动,放电时,电路中转移的电子数等于通过a膜的Zn2+数的一半,故D错误;
故选A。
24.B
【详解】A.X电极上氢离子得电子生成氢气,发生还原反应,X应作阴极,连接电源负极,故A正确;
B.电解时溶液中的阳离子移向阴极移动,氢离子由Y电极室移向X电极室,故B错误;
C.Y电极失电子生成,电极反应为:,故C正确;
D.由阳极反应可知转移2mol电子,生成2mol,与发生反应:,2mol可消耗1mol,标况下体积为22.4L,故D正确;
故选:B。
25.C
【分析】根据图示和总反应知,放电时,N为负极,Zn失去电子,发生氧化反应,M为正极,Fe(CN)得电子,发生还原反应;充电时,N为阴极,Zn(OH)得电子,发生还原反应,M为阳极,Fe(CN)失去电子,发生氧化反应。
【详解】A.根据分析,充电时,M为阳极,Fe(CN)失去电子,发生氧化反应,Fe(CN)- e-= Fe(CN),故A错误;
B.放电时,N为负极,M为正极,则N极电势低于M极,故B错误;
C.在配合物Fe(CN)中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12 NA,,故C正确;
D.放电时,Zn失电子后与氢氧根生成Zn(OH),溶液增加的质量为1molZn和2mol氢氧根之和,大于65g,故D错误。
故选:C。
26.不相等 ,根据电子守恒可知,阳极由于比铜活泼的金属失电子更容易,所以阴极质量的增加小于阳极质量的减小。
【解析】略
27. 阳极 精饱和食盐水 淡盐水 氯气 氢气 氢氧化钠溶液 稀氢氧化钠
【详解】氯碱工业利用电解饱和食盐水制备氢氧化钠和氯气,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,X为电源正极,和电源正极相连的A电极为阳极,和电源负极相连的B电极为阴极,阳极室中加入饱和食盐水,电极反应式2Cl--2e-=Cl2↑,Na+通过阳离子交换膜进入阴极室,乙是淡盐水,丙是Cl2,阴极室加入稀的氢氧化钠溶液,电极反应式2H2O+2e-=H2↑+2OH-,戊为H2, 己为氢氧化钠溶液,答案:阳极;精饱和食盐水;淡盐水;氯气;氢气;氢氧化钠溶液;稀氢氧化钠。
28.(1)CH3OH-6e-+8OH-= CO +6H2O
(2)2CuSO4+2H2O2Cu+2H2SO4+O2↑
(3) 1.16 1
(4) 铜 铁
(5)变小
(6) 负 饱和食盐水 变大
【分析】由图示可知甲为燃料电池,通甲醇的电极为负极,通氧气的电极为正极,乙池和丙池为电解池,乙池中石墨电极为阳极,银电极为阴极,丙池中左侧pt电极为阳极,右侧pt电极为阴极。
【详解】(1)甲池中通甲醇的电极为负极,电解质溶液为碱溶液,负极反应式CH3OH-6e-+8OH-= CO+6H2O,答案:CH3OH-6e-+8OH-= CO+6H2O;
(2)乙池中阳极水放电生成O2和H+,阴极Cu2+放电生成Cu,电解总反应的化学方程式2CuSO4+2H2O2Cu+2H2SO4+O2↑,答案:2CuSO4+2H2O2Cu+2H2SO4+O2↑;
(3)甲池中消耗O2为 ,转移电子0.01mol×4=0.04mol,丙池中MgCl2+2H2OMg(OH)2↓+H2↑+Cl2↑,根据得失电子守恒,理论上最多产生Mg(OH)20.02mol×58g/mol=1.16g沉淀,乙池中2CuSO4+2H2O2Cu+2H2SO4+O2↑得到硫酸0.02mol, ,该溶液的pH=1,答案:1.16;1;
(4)乙池中石墨电极为阳极,银电极为阴极,如果将乙池为铁片镀铜装置,则铁片做阴极,铜做阳极,所以需要石墨电极应替换为铜,银电极替换为铁,答案:铜;铁;
(5)乙池是电解精炼铜装置,随着电解过程的进行,电解质溶液的浓度将变小,答案:变小;
(6)用电解法制备漂白液,因为Cl2和NaOH反应能生成NaClO,用惰性电极电解饱和食盐水,阴极生成H2和OH-,阳极Cl-放电生成Cl2,和阴极生成的OH-反应生成ClO-,阴极产生的H2逸出,所以A端为电解池阴极,a为电池的负极,总方程式NaCl+H2ONaClO+H2↑,随着电解过程的进行,溶液pH变大。答案:负;饱和食盐水;变大
一、单选题
1.下列实验装置设计或操作正确的是
A.装置A滴定管的读数
B.操作B是酸式滴定管排气泡的方法
C.装置C组装铜银原电池
D.装置D用于制备少量含的消毒液
2.化学与生产、生活密切相关。下列装置工作时,将化学能转化为电能的是
A.锂离子电池 B.风力发电机
C.一次性保暖贴 D.工业电解食盐水
3.水溶液中电解催化还原制甲酸是实现“碳中和”的途径之一。下列说法正确的是
A.该过程将化学能转化为电能
B.生成甲酸的电极反应为:
C.阳离子由阴极移向阳极
D.电路中通过,阳极生成
4.铝是地壳中含量最多的金属元素。工业冶炼铝的正确方法是
A.热分解法 B.电解法 C.热还原法 D.物理方法
5.下列有关离子方程式的书写正确的是
A.用纯铜电板电解CuCl2溶液:Cu2++2Cl-Cu+Cl2↑
B.用FeCl3溶液腐蚀铜板:2Fe3++3Cu=2Fe2++3Cu2+
C.向草酸钠溶液中加入酸性高锰酸钾溶液:2+5+16H+=2Mn2++10CO2↑+8H2O
D.向H2O中投入Na2O2固体:H2O+Na2O2=2Na++2OH-+O2↑
6.电解熔融氯化钠和氯化钙混合物制备金属钠的装置如图所示。阳极A为石墨,阴极为铁环K,两极用隔膜D隔开。氯气从阳极上方的抽气罩H抽出,液态金属钠经铁管F流入收集器G。下列叙述错误的是
A.氯化钙的作用是做助熔剂,降低氯化钠的熔点,减少钠蒸汽的挥发
B.金属钠的密度小于熔融混合盐的密度,电解得到的钠在上层
C.隔膜D为阳离子隔膜,防止生成的氯气和钠重新生成氯化钠
D.电解时阴极的电极反应为Na++e-=Na,阴极上可能有少量的钙单质生成
7.高电压水系锌-有机混合液流电池的装置如图所示。下列说法错误的是
A.放电时,Na+向正极区迁移
B.放电时,负极区溶液的pH减小
C.充电时,阳极电极反应式为FQH2-2e-=FQ+2H+
D.充电时,负极材料每增重13g,中性电解质溶液增加1.17g
8.用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项对应关系均正确的一组是
选项 电源X极 实验前U形管中液体 通电后现象及结论
A 正极 Na2SO4溶液 向U形管两端滴入酚酞试液后,a管中呈红色
B 正极 AgNO3溶液 b管中的电极反应式是4OH-一4e- =2H2O+O2↑
C 负极 KCl和CuCl2混合溶液 同相条件 下,a、b两管中产生的气体总体积可能相等
D 负极 NaCl溶液 a管中产生的气体能使湿润的淀粉KI试纸变蓝色
A.A B.B C.C D.D
9.工业上不宜用电解法制备的金属是
A.Na B.Mg C.Al D.Fe
10.苯甲酸可用作食品的防腐剂,实验室用苯乙酮间接电氧化法合成苯甲酸,原理如图所示。下列说法错误的是
A.a电极为阳极
B.b极的电极反应式为H2O+2e-=H2↑+2OH-
C.a极的产物与OH-反应的离子方程式为:I2+2OH-=I-+IO-+H2O
D.苯乙酮发生了还原反应
11.下列说法不正确的是
A.化学电源包括一次电池、二次电池和燃料电池等
B.铅蓄电池的缺点是比能量低、苯重
C.电镀时,通常把待镀的金属制品一端作阳极,把镀层金属一端作阴极
D.燃料电池能量转化率高,活性物质由外界加入,可实现连续不间断供电
12.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
A.a和b不连接时,铁片上会有金属铜析出
B.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
C.a和b分别连接直流电源负极、正极,可以在铁上镀铜
D.a和b分别连接直流电源正极、负极,电压足够大时,Cu2+向铁电极移动
13.用石墨作电极,分别电解下列各物质的溶液:①、②、③、④、⑤、⑥、⑦。其中只有水被电解的有
A.①②⑤ B.②④⑥⑦ C.④⑥⑦ D.③⑤⑥⑦
14.我国科学家正在研究一种可充电Na-Zn双离子电池体系(如图)。下列说法不正确的是
A.打开K1,闭合K2,a为电源负极
B.打开 K1,闭合K2,Zn极附近溶液的碱性减弱
C.打开 K2,闭合K1,OH-向极移动
D.打开 K2,闭合K1,正极反应式为
15.“美丽中国·绿色冬奥”,千余辆氢能大巴穿梭于赛场。一种可实现氢气循环利用的新型电池的放电工作原理如图所示。下列说法正确的是
A.该装置化学能与电能之间的能量转化效率可达100%
B.放电时,N极电极反应式为
C.放电过程中由左池通过交换膜向右池移动
D.充电时,电极M接电源的负极
16.LiOH是制备锂离子电池的材料。电解LiCl溶液制备LiOH的装置如图所示。下列说法正确的是
A.电极A连接电源的负极
B.B极区电解液为LiCl溶液
C.电极每产生22.4L气体M,电路中转移2mole-
D.电池总反应为:2LiCl+2H2OH2↑+Cl2↑+2LiOH
17.通过亚硫酸盐电化学还原为连二亚硫酸钠,可消除烟气中的(、等)。电化学还原为的装置如图所示。下列有关说法不正确的是。
A.右室电极连接电源的正极
B.电解过程中,右室硫酸浓度增大
C.左室电极上发生的电极反应为:
D.当右室产生气体(标况下)时,理论上有由右室移向左室
18.近期,天津大学化学团队以CO2与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图。下列说法不正确的是
A.Ni2P电极与电源正极相连
B.在In/In2O3-x电极上发生的反应为:CO2+H2O+2e-=HCOO-+OH-
C.In/In2O3-x电极上可能有副产物H2生成
D.一段时间后,右侧电极室内溶液pH显著降低
19.新型可充电镁—溴电池能量密度高,循环性能优越,在未来能量存储领域潜力巨大。某镁—溴电池装置如下图(正负极区之间的离子选择性膜只允许Mg2+通过)。下列说法不正确的是
A.放电时,Mg电极发生还原反应
B.放电时,正极反应为:+2e = 3Br
C.充电时,Mg电极应连接电源负极
D.当0.1 mol Mg2+通过离子选择性膜时,导线中通过0.2 mol e
20.如图是我国科学家研发的某新型可充电电池的工作原理图,图中虚线转化表示充电状态,下列说法错误的是
A.放电时正极反应式为
B.放电时电极电势:多壁碳纳米管电极>钠箱
C.放电时总反应方程式为
D.充电时向多壁碳纳米管电极移动
21.下列化学用语表述不正确的是
A.HCl在水中电离:HCl = H+ + Cl-
B.NH4Cl晶体中,既有共价键,又有离子键
C.用电子式表示NaCl的形成过程:
D.惰性电极电解CuCl2溶液:Cu2++2Cl- Cu+Cl2↑
22.目前海水淡化可采用双极膜电渗析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N 为离子交换膜。下列说法正确的是
A.X 电极为电解池的阴极,该电极反应式为: 2H+-2e-=H2↑
B.电子流向: 电源负极→X电极→Y 电极→电源正极
C.电路中每转移1mol 电子,X、Y两极共得到标准状况下16.8L的气体
D.M为阳离子交换膜,A室获得副产品NaOH; 若去掉B室双极膜,B室产物不变
23.水系锌一碘二次电池是一种潜在的新型储能体系,其工作原理如图所示。下列说法正确的是
A.a为阳离子交换膜、b为阴离子交换膜
B.充电时,石墨 Zn复合电极接电源的正极
C.放电时,石墨电极的电极反应式为: 3I- 2e- =
D.放电时,电路中转移的电子数等于通过a膜的离子数
24.硫化氢有高毒性和强腐蚀性,用电化学处理的原理如图所示。下列说法错误的是
A.X电极连接电源的负极,发生还原反应
B.电解时,由X电极室移向Y电极室
C.Y电极反应式为
D.每转移理论上可处理
25.碱性锌铁液流电池采用资源丰富的铁和锌作为电池正、负极电解液活性物质,具有电压高、成本低的优点。该电池的总反应为Zn+2Fe(CN)+4OH-2Fe(CN)+ZN(OH).下列叙述正确的是
A.充电时,M极电极反应式为Fe(CN)+e-= Fe(CN)
B.放电时,N极电势高于M极
C.1mol Fe(CN)中含有σ键的数目为12 NA
D.放电时,电路中转移2 mol电子时,负极区电解质溶液增重65 g
二、填空题
26.电解精炼铜进行一段时间后,阳极减少的铜质量与阴极增加的铜的质量相等吗?为什么 ?
27.氯碱工业原理图
X为电源正极,A为 极,甲是 ,乙是 ,丙是 ,戊是 ,己是 ,庚是 。
28.如图1所示,其中甲池的总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O,回答下问题:
(1)甲池燃料电池的负极反应式为 。
(2)写出乙池中电解总反应的化学方程式: 。
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生 g沉淀,此时乙池中溶液的体积为400 mL,该溶液的pH= 。
(4)若乙池是铁片镀铜装置,则石墨电极和银电极应替换为 和 。
(5)若乙池是电解精炼铜装置,随着电解过程的进行,电解质溶液的浓度将 (填“变大”、“变小”或“不变”)。
(6)某同学利用甲醇燃料电池设计电解法制取漂白液的实验装置如图2,若用于制漂白液,则a为电池的 极,电解质溶液用 。随着电解过程的进行,溶液pH将 (填“变大”、“变小”或“不变”)。
试卷第1页,共3页
参考答案:
1.D
【详解】A.由图可知,装置A滴定管的读数,故A错误;
B.操作B是碱式滴定管排气泡的方法,故B错误;
C.装置C盐桥中的氯化钾饱和溶液会与硝酸银生成氯化银沉淀,C错误;
D.装置D电解池中底部为阳极,氯离子放电生成氯气;上部为阴极,水放电生成氢气和氢氧化钠,则上升的氯气和氢氧化钠反应生成,故D正确。
故选D。
2.A
【分析】原电池是将化学能转化为电能的装置,据此分析。
【详解】A.锂离子电池是利用原电池原理设计的电池,是将化学能转化为电能的装置,故A符合题意;
B.风力发电机是将风能转化为电能的装置,故B不符合题意;
C.一次性保暖贴是将化学能转化为热能的装置,故C不符合题意;
D.工业电解食盐水是利用电解池原理,是将电能转化为化学能的装置,故D不符合题意;
答案选A。
3.B
【详解】A.该过程的装置是电解池,是将电能转化为化学能的装置,选项A错误;
B.电解过程生成甲酸是利用二氧化碳得电子实现的,故电极反应为:,选项B正确;
C.电解池中阳离子由阳极移向阴极,选项C错误;
D.电路中通过,阳极生成1molO2,但没有说明标准状况,无法确定气体的体积,选项D错误;
答案选B。
4.B
【详解】铝属于活泼金属元素。工业上用电解熔融态三氧化二铝的方法进行冶炼,故B符合题意;
故答案:B。
5.C
【详解】A.用惰性电极电解溶液,阴极上放电,阳极上放电,离子方程式为:,用纯铜电板则阳极铜会失去电子生成铜离子,A错误;
B.溶液刻蚀电路铜板的离子方程式为:,B错误;
C.草酸根离子被酸性高锰酸钾氧化为二氧化碳气体,同时生成锰离子,离子方程式为:2+5+16H+=2Mn2++10CO2↑+8H2O,C正确;
D.过氧化钠和水生成氢氧化钠和氧气,反应为,D错误;
故选C。
6.C
【分析】该装置中为电解池,阳极A为石墨,电极反应为:2Cl--e-=Cl2↑;阴极为铁环K,电极反应为Na++e-=Na,氯化钙中的钙离子的氧化性强于Na+,故钙离子会在阴极上的电子生成少量钙,Cl-通过隔膜D移至阳极A放电产生Cl2,隔膜D应该为阴离子隔膜,由此分析。
【详解】A.本装置的目的是电解熔融氯化钠,氯化钠是离子化合物,熔点较高,加入氯化钙的目的为做助熔剂,降低氯化钠的熔点,减少钠蒸汽的挥发,故A不符合题意;
B.从图中知道,金属钠在上部收集,所以猜想到钠的密度小于混合盐的密度,故B不符合题意;
C.由图可知,Cl 通过隔膜D移至阳极A放电产生Cl2,所以,隔膜D应该为阴离子隔膜,故C符合题意;
D.根据分析,电解时阴极的电极反应为Na++e-=Na,氯化钙中的钙离子的氧化性强于Na+,故钙离子会在阴极上的电子生成少量钙,故阴极上可能有少量的钙单质生成,故D不符合题意;
答案选C。
7.D
【分析】高电压水系锌-有机混合液流电池工作原理为:放电时为原电池,金属Zn发生失电子的氧化反应生成Zn2+,为负极,则FQ所在电极为正极,正极反应式为2FQ+2e-+2H+═FQH2,负极反应式为;充电时电解池,原电池的正负极连接电源的正负极,阴阳极的电极反应与原电池的负正极的反应式相反,电解质中阳离子移向阴极、阴离子移向阳极,因此充电时,m接外接电源的负极,n接外接电源的正极,据此作答。
【详解】A.原电池中阳离子向正极移动,故放电时,Na+向正极区迁移,A正确;
B.放电时,负极区锌失去电子发生氧化反应,,溶液氢氧根离子浓度减小,pH减小,B正确;
C.充电时,阳极的FQH2失去电子反应氧化反应,电极反应式为FQH2-2e-=FQ+2H+,C正确;
D.充电时,负极材料作阴极,电极反应式为,负极材料每增重13g,即生成0.2mol Zn,转移电子0.4mol,中性溶液中和分别透过阳膜和阴膜进入阴极区和阳极区,物质的量为0.4mol NaCl,质量为23.4g,故D错误;
故选D。
8.C
【详解】A.a管中电极为阳极,a管中电极反应式是2H2O-4e-=O2↑+4H+,反应后溶液显酸性,不能使酚酞试液变红色,A错误;
B.b管中电极为阴极,发生反应:Ag++e-=Ag,B错误;
C.a管中电极是阴极,发生反应:Cu2++2e-=Cu,2H2O+2e-=H2↑+2OH-,b管中电极是阳极,发生反应:2Cl--2e-=Cl2↑,2H2O-4e-=O2↑+4H+,相同条件下,a、b两管中产生的气体总体积可能相等,C正确;
D.a管中电极是阴极,发生反应2H2O+2e-=H2↑+2OH-,生成气体不能使湿润的淀粉KI试纸变蓝色,D错误;
故选C。
9.D
【详解】A.工业上用电解熔融状态的NaCl制备金属Na,A不符题意;
B.工业上用电解熔融状态的MgCl2制备金属Mg,B不符题意;
C.工业上用电解熔融状态的Al2O3制备金属Al,C不符题意;
D.工业上用热还原法制备Fe,不用电解法制备Fe,D符合题意;
答案选D。
10.D
【详解】A.据图可知a电极上KI被氧化为I2,所以为阳极,A正确;
B.据图可知b电极上H2O得电子被还原生成H2,电极反应为H2O+2e-=H2↑+2OH-,B正确;
C.a极产物为I2,结合氯气和强碱溶液的反应可知I2与OH-反应的离子方程式为:I2+2OH-=I-+IO-+H2O,C正确;
D.苯乙酮生成苯甲酸根时加氧去氢,发生氧化反应,D错误;
综上所述答案为D。
11.C
【详解】A.化学电源是是一种能将化学能直接转变成电能的装置,主要包括一次电池、二次电池、燃料电池等,故A正确;
B.铅酸蓄电池的缺点是比能量(单位重量所蓄电能)低,十分苯重,对环境腐蚀性强,循环使用寿命短,故B正确;
C.电镀时,通常把待镀的金属制品一端作阴极,把镀层金属一端作阳极,故C错误;
D.燃料电池为一种把燃料所具有的化学能直接转换成电能的化学装置,能量转化率高,活性物质由外界加入,可实现连续不间断供电,故D正确;
故选C。
12.C
【详解】A.a和b不连接时,铁直接与硫酸铜溶液发生置换反应生成铜单质,故A正确;
B.无论a和b是否连接,铁都会与铜离子发生置换反应生成Fe2+和Cu,溶液从蓝色逐渐变成浅绿色,故B正确;
C.b连接电源的正极,则Fe为阳极,被氧化成亚铁离子,无法镀铜,故C错误;
D.电解池中阳离子流向阴极,b连接负极,则Fe为阴极,所以电压足够大时,Cu2+向铁电极移动,故D正确;
综上所述答案为C。
13.C
【详解】用石墨作电极,离子放电取决于离子的放电顺序,阳极: S2->I->Br->Cl->OH->含氧酸根离子,阴极: Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+,
①溶液中放电的是铜离子和氯离子,是CuCl2被电解;
②溶液中放电的是铜离子和氢氧根离子,硫酸铜和水都被电解;
③溶液中放电的是溴离子和氢氧根离子,溴化钠和水都电解;
④溶液中放电的是氢离子和氢氧根离子,也就是只有水被电解;
⑤溶液中放电的是氢离子和氯离子,氯化氢和水都被电解;
⑥液中放电的是氢离子和氢氧根离子,也就是只有水被电解;
⑦溶液中放电的是氢离子和氢氧根离子,也就是只有水被电解;
其中只有水被电解的有④⑥⑦,答案选C。
14.B
【详解】A.打开K1,闭合K2,装置为电解池,其中a为电源负极,左边Zn电极为阴极,发生还原反应,电极反应式为:[Zn(OH)4]2-+2e-=Zn+4OH-,A正确;
B.根据选项A分析可知:打开 K1,闭合K2时,Zn电极反应式为:[Zn(OH)4]2-+2e-=Zn+4OH-,反应产生OH-,使Zn极附近溶液的碱性增强,B错误;
C.打开 K2,闭合K1,Zn电极为负极,失去电子,发生氧化反应,电极反应式为:Zn-2e-+4OH-=[Zn(OH)4]2-,因此OH-向极移动,C正确;
D.打开 K2,闭合K1,右边电极为正极,得到电子,发生还原反应,则正极的电极反应式为,D正确;
故合理选项是B。
15.B
【分析】由图可知,放电时N极作负极,氢气失电子,碱性溶液中电极反应式为H2+2OH--2e-═2H2O,消耗氢氧根离子,钠离子剩余,电极M作正极,电极反应式为2H++2e-=H2↑,阳离子减少,故钠离子由右池透过交换膜进入左池,充电时,电池的负极连接电源的负极做阴极,电池的正极连接电源的正极作阳极,据此作答。
【详解】A.该装置工作时会产生热量,有能量损失,故化学能与电能之间的能量转化效率无法达到100%,故A错误;
B.放电时N极作负极,氢气失电子,碱性溶液中电极反应式为H2+2OH--2e-═2H2O,故B正确;
C.由分析可知,放电时由右池透过交换膜进入左池,故C错误;
D.由分析可知,充电时M极接电源的正极,故D错误;
故选:B。
16.D
【分析】电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B上氢离子放电,可知B为阴极,在B侧制备LiOH,Li+由A经过阳离子交换膜向 B移动,A中为LiCl溶液,氯离子放电生成氯气,据此分析解题。
【详解】A.由分析可知,A为阳极,与正极相连,故A错误;
B.通过以上分析知,B极区电解液为LiOH,否则无法得到纯净的LiOH,故B错误;
C.没有指明气体所处状态,无法计算其物质的量,所以无法计算转移电子物质的量,故C错误;
D.电解池的阳极上是氯离子失电子,阴极上是氢离子得电子,电解的总反应方程式为: 2LiCl+2H2OH2↑+Cl2↑+2LiOH,故D正确;
故选D。
17.D
【分析】由图可知,左室电极附近转化成,硫元素化合价从+4价降为+3价,被还原,则左室电极作电解池的阴极,右室电极作阳极。
【详解】A.根据分析可知,右室电极作阳极,连接电源的正极,A项正确;
B.电解过程中,右室(阳极)电极反应式为:,阳极消耗了水,使硫酸浓度增大,B项正确;
C.左室电极附近得电子生成,发生的电极反应为:,C项正确;
D.根据右室的电极反应式:可知,每生成1mol O2,转移4mol电子,同时有4molH+通过质子交换膜移向左室,所以当右室产生气体(标况下)即0.5mol时,理论上有由右室移向左室,D项错误;
答案选D。
18.D
【分析】装置为电解池,左侧二氧化碳得电子生成甲酸根,电极反应为CO2+H2O+2e-=HCOO-+OH-,左侧电极为阴极,右侧为阳极,接电源正极,电极反应为 。
【详解】A.右侧电极为阳极,Ni2P电极与电源正极相连,A正确;
B.根据分析,在左侧电极发生的反应正确,B正确;
C.左侧电极为阴极,发生还原反应,水可能得电子生成氢气,故可能有副产物H2生成,C正确;
D.右侧电极为阳极,从阳极电极方程式可以看出,当电路中有4mol电子转移时,氢氧根迁移过来的物质的量也是4mol,最终被消耗生成水,辛胺浓度降低,溶液的pH没有明显变化,D错误;
故选D。
19.A
【详解】A.放电时,镁是负极,Mg电极失电子发生氧化反应,故A错误;
B.由原电池原理可知,放电时,正极反应为:+2e = 3Br ,故B正确;
C.放电时,镁是负极,充电时,Mg电极应连接电源负极,故C正确;
D.根据电荷守恒,当0.1 mol Mg2+通过离子选择性膜时,导线中通过0.2 mol e ,故D正确;
选A。
20.D
【分析】由图知,放电时正极上转化为、C,负极上钠失电子产生,充电时钠离子转化为钠单质,向阴极钠箔电极移动;
【详解】A.由图中信息知,放电时正极上转化为、C,选项A正确;
B.放电时是原电池,正极电势高于负极的,选项B正确;
C.由图知,正极上转化为、C,负极上钠失电子产生,总反应方程式为,选项C正确;
D.充电时钠箔电极接电源负极作阴极,移向带负电的钠箔,选项D错误;
答案选D。
21.C
【详解】A.HCl为易溶于水的强电解质,在水中发生完全电离:HCl = H+ + Cl-,A正确;
B.NH4Cl晶体属于离子晶体,由和Cl-构成,二者间形成离子键,在中,N、H原子间形成共价键,B正确;
C.NaCl为离子化合物,由Na+和Cl-构成,电子式表示NaCl的形成过程: ,C不正确;
D.惰性电极电解CuCl2溶液,阳极Cl-失电子生成Cl2,阴极Cu2+得电子生成Cu:Cu2++2Cl- Cu+Cl2↑,D正确;
故选C。
22.C
【详解】A.电解池中阳离子向阴极移动,故X电极为阴极,电极反应式为:2H++2e-=H2↑,选项A错误;
B.电子不能通过电解质溶液,所以电子流向:电源负极→阴极X电极、阳极Y电极→电源正极,选项B错误;
C.阴极反应为2H++2e-=H2↑,阳极反应为:4OH--4e-=O2↑+2H2O,当电路中通过1mol电子时,阴极得到0.5molH2,阳极得到0.25molO2,两极一共得到气体为0.5mol+0.25mol=0.75mol,标准状况下16.8L的气体,选项C正确;
D.电解池中,电解时,溶液中的阳离子向阴极移动,阴离子向阳极移动,因此M为阳离子交换膜,A室获得副产品NaOH;若去掉双极膜(BP),则Cl-会在阳极失去电子,生成Cl2,在阳极室会有C12生成,,B室产物发生变化,选项D错误;
答案选C。
【点睛】本题考查电解原理,注意审题,不再是电解饱和食盐水的反应,由于双极膜(BP)是阴、阳复合膜的存在,使电解反应变成了电解水,是易错点。阴极是物质得到电子,发生还原反应;溶液中的阳离子向阴极移动,阴离子向阳极移动。
23.A
【分析】由图可知,Zn在石墨-Zn复合电极失去电子生成Zn2+,则石墨-Zn复合电极为负极,电极方程式为:Zn-2e-=Zn2+,在石墨电极处得到电子生成I-,石墨电极为正极,电极方程式为:+2e-=3I-。
【详解】A.由分析可知,石墨-Zn复合电极为负极,石墨电极为正极,负极生成的Zn2+通过a膜进去向正极移动,正极生成的I-通过b膜向负极移动,在中间区域生成ZnI2,a为阳离子交换膜、b为阴离子交换膜,故A正确;
B.由分析可知,石墨-Zn复合电极为负极,充电时,石墨 Zn复合电极接电源的负极,故B错误;
C.由分析可知,放电时,石墨电极的电极反应式为:+2e-=3I-,故C错误;
D.由A可知,Zn2+通过a膜进去向正极移动,放电时,电路中转移的电子数等于通过a膜的Zn2+数的一半,故D错误;
故选A。
24.B
【详解】A.X电极上氢离子得电子生成氢气,发生还原反应,X应作阴极,连接电源负极,故A正确;
B.电解时溶液中的阳离子移向阴极移动,氢离子由Y电极室移向X电极室,故B错误;
C.Y电极失电子生成,电极反应为:,故C正确;
D.由阳极反应可知转移2mol电子,生成2mol,与发生反应:,2mol可消耗1mol,标况下体积为22.4L,故D正确;
故选:B。
25.C
【分析】根据图示和总反应知,放电时,N为负极,Zn失去电子,发生氧化反应,M为正极,Fe(CN)得电子,发生还原反应;充电时,N为阴极,Zn(OH)得电子,发生还原反应,M为阳极,Fe(CN)失去电子,发生氧化反应。
【详解】A.根据分析,充电时,M为阳极,Fe(CN)失去电子,发生氧化反应,Fe(CN)- e-= Fe(CN),故A错误;
B.放电时,N为负极,M为正极,则N极电势低于M极,故B错误;
C.在配合物Fe(CN)中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12 NA,,故C正确;
D.放电时,Zn失电子后与氢氧根生成Zn(OH),溶液增加的质量为1molZn和2mol氢氧根之和,大于65g,故D错误。
故选:C。
26.不相等 ,根据电子守恒可知,阳极由于比铜活泼的金属失电子更容易,所以阴极质量的增加小于阳极质量的减小。
【解析】略
27. 阳极 精饱和食盐水 淡盐水 氯气 氢气 氢氧化钠溶液 稀氢氧化钠
【详解】氯碱工业利用电解饱和食盐水制备氢氧化钠和氯气,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,X为电源正极,和电源正极相连的A电极为阳极,和电源负极相连的B电极为阴极,阳极室中加入饱和食盐水,电极反应式2Cl--2e-=Cl2↑,Na+通过阳离子交换膜进入阴极室,乙是淡盐水,丙是Cl2,阴极室加入稀的氢氧化钠溶液,电极反应式2H2O+2e-=H2↑+2OH-,戊为H2, 己为氢氧化钠溶液,答案:阳极;精饱和食盐水;淡盐水;氯气;氢气;氢氧化钠溶液;稀氢氧化钠。
28.(1)CH3OH-6e-+8OH-= CO +6H2O
(2)2CuSO4+2H2O2Cu+2H2SO4+O2↑
(3) 1.16 1
(4) 铜 铁
(5)变小
(6) 负 饱和食盐水 变大
【分析】由图示可知甲为燃料电池,通甲醇的电极为负极,通氧气的电极为正极,乙池和丙池为电解池,乙池中石墨电极为阳极,银电极为阴极,丙池中左侧pt电极为阳极,右侧pt电极为阴极。
【详解】(1)甲池中通甲醇的电极为负极,电解质溶液为碱溶液,负极反应式CH3OH-6e-+8OH-= CO+6H2O,答案:CH3OH-6e-+8OH-= CO+6H2O;
(2)乙池中阳极水放电生成O2和H+,阴极Cu2+放电生成Cu,电解总反应的化学方程式2CuSO4+2H2O2Cu+2H2SO4+O2↑,答案:2CuSO4+2H2O2Cu+2H2SO4+O2↑;
(3)甲池中消耗O2为 ,转移电子0.01mol×4=0.04mol,丙池中MgCl2+2H2OMg(OH)2↓+H2↑+Cl2↑,根据得失电子守恒,理论上最多产生Mg(OH)20.02mol×58g/mol=1.16g沉淀,乙池中2CuSO4+2H2O2Cu+2H2SO4+O2↑得到硫酸0.02mol, ,该溶液的pH=1,答案:1.16;1;
(4)乙池中石墨电极为阳极,银电极为阴极,如果将乙池为铁片镀铜装置,则铁片做阴极,铜做阳极,所以需要石墨电极应替换为铜,银电极替换为铁,答案:铜;铁;
(5)乙池是电解精炼铜装置,随着电解过程的进行,电解质溶液的浓度将变小,答案:变小;
(6)用电解法制备漂白液,因为Cl2和NaOH反应能生成NaClO,用惰性电极电解饱和食盐水,阴极生成H2和OH-,阳极Cl-放电生成Cl2,和阴极生成的OH-反应生成ClO-,阴极产生的H2逸出,所以A端为电解池阴极,a为电池的负极,总方程式NaCl+H2ONaClO+H2↑,随着电解过程的进行,溶液pH变大。答案:负;饱和食盐水;变大
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
