2.3.1 共价键的极性课件(共36张PPT) 2023-2024学年高二化学人教版选择性必修2
文档属性
| 名称 | 2.3.1 共价键的极性课件(共36张PPT) 2023-2024学年高二化学人教版选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 14:45:03 | ||
图片预览









文档简介
(共36张PPT)
第二章
第三节 第一课时 共价键的极性
素 养 目 标
1.知道共价键可以分为极性键和非极性键,能利用电负性判断共价键的极性。
2.知道分子可以分为极性分子和非极性分子,了解分子极性与分子中键的极性、分子的空间结构密切相关,培养宏观辨识与微观探析的化学核心素养。
3.能根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释,形成“结构决定性质”的认知模型。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、键的极性和分子的极性
1.键的极性
分类 极性共价键 非极性共价键
成键 原子 一般为 元素的原子 一般为 元素的原子
共用 电子对 发生偏移,偏移程度越大,键的极性越强 偏移
成键原 子的电性 电负性较小的原子呈 , 电负性较大的原子呈 电中性
不同
同种
不发生
正电性(δ+)
负电性(δ-)
2.分子的极性
可理解为分子中有正电性和负电性这样的两性存在
不重合
重合
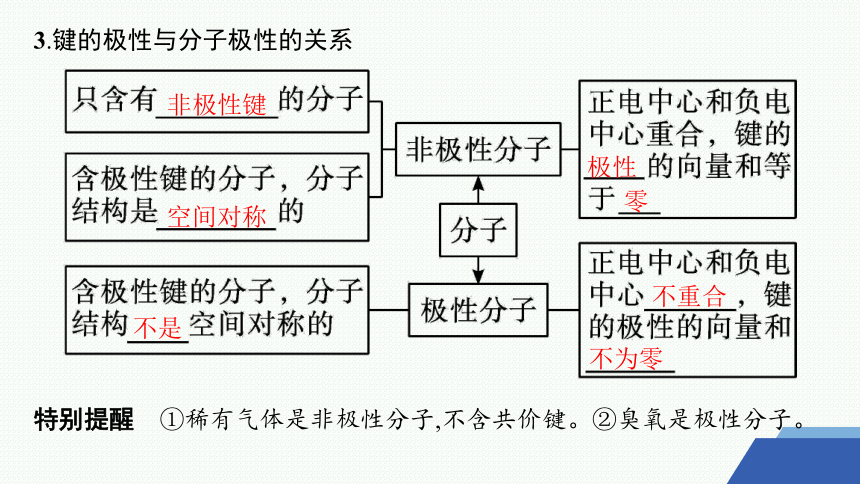
3.键的极性与分子极性的关系
特别提醒 ①稀有气体是非极性分子,不含共价键。②臭氧是极性分子。
非极性键
空间对称
极性
零
不为零
不重合
不是
二、键的极性对化学性质的影响
1.羧酸是一类含 的有机酸,羧基可电离出H+而呈 。
2.三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性 氯的电负性,C—F的极性大于C—Cl,导致三氟乙酸羧基中的O—H的极性 ,
电离出氢离子。
3.烷基(符号R—)是 基团,烷基越长 效应越大,使羧基中的羟基的极性 ,羧酸的酸性 。
羧基(—COOH)
酸性
大于
更大
更易
推电子
推电子
越小
越弱
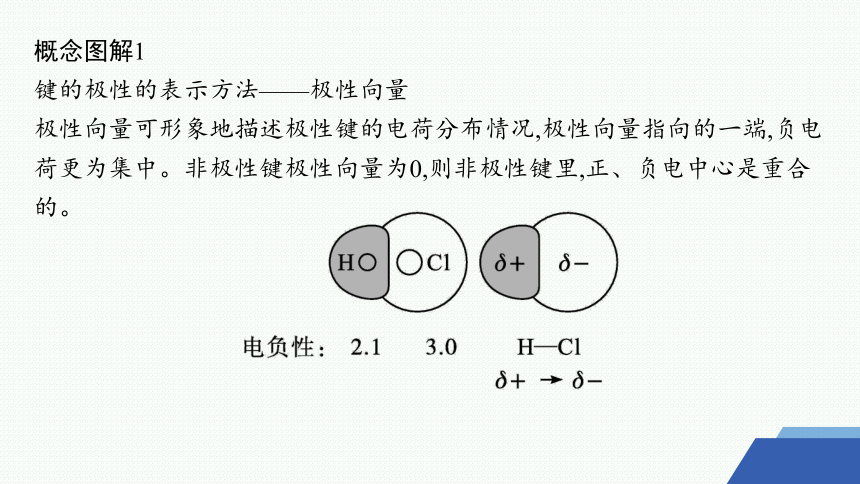
概念图解1
键的极性的表示方法——极性向量
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,负电荷更为集中。非极性键极性向量为0,则非极性键里,正、负电中心是重合的。
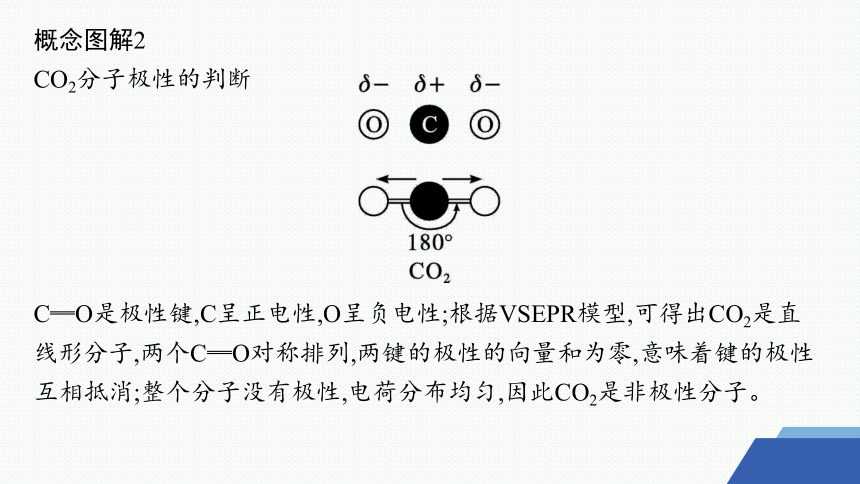
概念图解2
CO2分子极性的判断
C═O是极性键,C呈正电性,O呈负电性;根据VSEPR模型,可得出CO2是直线形分子,两个C═O对称排列,两键的极性的向量和为零,意味着键的极性互相抵消;整个分子没有极性,电荷分布均匀,因此CO2是非极性分子。
易错辨析
(1)同种非金属原子间形成的共价键一定是非极性键。( )
提示 例如臭氧分子中的共价键是极性键。
(2)非极性分子中不可能含有极性键。( )
提示 以极性键结合形成的分子,若分子空间结构对称,则为非极性分子,如CH4、CO2等。
(3)极性分子中一定含有极性键。( )
(4)H2O、CO2、CH4都是非极性分子。( )
提示 H2O是极性分子。
×
×
√
×
重难探究·能力素养全提升
探究一 极性分子和非极性分子的判断
情境探究
如图给出了一些常见物质的结构,试分析:
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)P4和C60是极性分子还是非极性分子
提示 HCl是极性分子,H2、O2、Cl2是非极性分子。
提示 P4和C60是非极性分子。
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
(4)分析H2O2分子中共价键的种类有哪些 H2O2属于极性分子还是非极性分子
提示 HCN、H2O、NH3、CH3Cl是极性分子,CO2、BF3、CH4是非极性分子。
提示 H2O2分子中H—O为极性共价键,O—O为非极性共价键。H2O2属于极性分子。
方法突破
1.共价键的极性与分子的极性的关系
分子 共价键 的极性 分子中正电中心和负电中心 结论 举例
同种元素的 双原子分子 非极性键 重合 非极性 分子 H2、N2、
O2
不同种元素的双原子分子 极性键 不重合 极性分子 CO、HF、HCl
多原子 分子 分子中键的极性的向量和为零 重合 非极性 分子 CO2、BF3、
CH4
分子中键的极性的向量和不为零 不重合 极性 分子 H2O、NH3、
CH3Cl
2.ABn型分子极性的判断
应用体验
视角1键的极性的判断
1.下列关于共价键的叙述不正确的是( )
A.由不同元素原子形成的共价键一般是极性键
B.由同种元素的两个原子形成的双原子分子中的共价键一定是非极性键
C.化合物中不可能含有非极性键
D.当O原子与F原子形成共价键时,共用电子对偏向F原子
C
解析 不同元素的原子吸引电子的能力不同,形成极性键;双原子分子中,同种元素的原子吸引电子的能力相同,形成非极性共价键,A、B项正确。某些化合物如Na2O2、H2O2中均含有非极性键,C项错误。F原子吸引电子的能力强于O原子,二者成键时共用电子对偏向F原子,D项正确。
2.下列共价键①H—H、②H—F、③H—O、④H—N中,键的极性由小到大的顺序排列正确的是( )
A.①②③④ B.④③②①
C.①④③② D.②③④①
C
解析 非金属元素的电负性越大,其原子与氢原子形成的共价键的极性越强。第二周期元素的电负性:N视角2分子极性的判断
3.下列对分子极性及分子的空间结构的判断错误的是( )
选项 A B C D
化学式 PCl3 CS2 SO2 CH4
分子极性 极性 非极性 极性 非极性
空间结构 平面三角形 直线形 V形 正四面体形
A
思维建模 解析有关ABn分子极性问题的经验规律如下:
①|中心原子化合价|=中心原子价电子数 非极性分子,
②|中心原子化合价|≠中心原子价电子数 极性分子。
4.某化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是( )
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O是非极性分子
B
解析 H2O2是极性分子,故A错误;反应Ⅰ是在催化剂作用下H2O生成H2和H2O2,涉及极性键H—O的断裂和非极性键H—H、O—O的形成,故B正确;分子的极性与分子内共价键的极性和分子的空间结构密切相关,分子中的正、负电中心是否重合是判断分子极性的依据,中心重合是非极性分子,不重合是极性分子,如甲烷是极性键形成的非极性分子,故C错误;H2O是极性分子,故D错误。
思维建模 分子的极性判断的方法
【变式设问】
(1)原理图中生成的最终产物分子的极性如何
(2)上述过程中元素形成的单质分子都是非极性分子吗
提示 都是非极性分子。最终产物为H2和O2,都属于非极性分子。
提示 不都是。O3分子的结构与水相似,属于极性分子。
易错警示 对键的极性和分子极性的认识误区
(1)一般情况下非金属单质分子是非极性分子,但O3例外。O3的空间结构呈V形,中心氧原子呈正电性,端位的两个氧原子呈负电性,正、负电中心不重合,属于极性分子,其中共价键也是极性键。
(2)极性分子中一定含有极性键,非极性分子中不一定含有非极性键。如CH4是非极性分子,分子中只含有极性键。
(3)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
探究二 键的极性对化学性质的影响
情境探究
羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。阅读教材表2-6不同羧酸的pKa,讨论交流:
(1)为什么甲酸、乙酸、丙酸的酸性逐渐减弱
提示 烃基是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。
(2)为什么三氯乙酸的酸性强于二氯乙酸的酸性
提示 由于Cl3C—比Cl2CH—多一个氯原子,使Cl3C—的极性大于Cl2CH—的极性,导致三氯乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
提示 非羟基氧原子的吸电子效应使O—H极性增强,更容易电离出H+,非羟基氧原子数越多,分子的酸性越强,故硫酸的酸性强于磷酸。
方法突破
从物质结构角度判断酸性强弱的方法
应用体验
视角1键的极性对物质酸性的影响
1.下列物质的酸性强弱比较正确的是( )
A.CH3CH2CH2COOH>HCOOH
B.CH3CH2COOH>CH3CH2CH2COOH
C.CCl3CH2COOHD.CH2FCOOHB
解析 CH3CH2CH2—的推电子效应使CH3CH2CH2COOH酸性弱于HCOOH,A项错误;含碳原子数越多的烃基推电子效应越强,导致相应羧酸的酸性减弱,所以B项正确;CCl3CH2COOH酸性强于CHCl2CH2COOH,C项错误;由于电负性F>Cl>H,故D项错误。
2.下列各组酸中,酸性依次增强的是( )
A.H2CO3、H2SiO3、H3PO4
B.HNO3、H3PO4、H2SO4
C.HI、HCl、H2S
D.HClO、HClO3、HClO4
D
解析 A项中由于非金属性:C>Si,故酸性:H2CO3>H2SiO3;B项中由于非金属性:N>P,故酸性:HNO3>H3PO4;C项中HCl是强酸,H2S是弱酸;D项可根据通式(HO)mClOn判断出非羟基氧原子数n值依次为0、2、3,从而得出酸性HClO视角2键的极性对物质碱性的影响
归纳总结 键的极性对化学性质的影响
(1)共价键的极性越强,键的活泼性也越强,容易发生断裂,易发生相关的化学反应。
(2)成键元素的原子吸引电子能力越强,电负性越大,共价键的极性就越强,在化学反应中该分子的反应活性越强,在化学反应中越容易断裂。
(3)烷基是推电子基团,即将电子推向羧基中的羟基,从而减小羧基中羟基的极性,导致羧酸的酸性减弱。一般地,烷基越长,推电子效应越大,羧酸的酸性越弱。随着烷基加长,酸性的差异越来越小。
本 课 结 束
第二章
第三节 第一课时 共价键的极性
素 养 目 标
1.知道共价键可以分为极性键和非极性键,能利用电负性判断共价键的极性。
2.知道分子可以分为极性分子和非极性分子,了解分子极性与分子中键的极性、分子的空间结构密切相关,培养宏观辨识与微观探析的化学核心素养。
3.能根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释,形成“结构决定性质”的认知模型。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、键的极性和分子的极性
1.键的极性
分类 极性共价键 非极性共价键
成键 原子 一般为 元素的原子 一般为 元素的原子
共用 电子对 发生偏移,偏移程度越大,键的极性越强 偏移
成键原 子的电性 电负性较小的原子呈 , 电负性较大的原子呈 电中性
不同
同种
不发生
正电性(δ+)
负电性(δ-)
2.分子的极性
可理解为分子中有正电性和负电性这样的两性存在
不重合
重合
3.键的极性与分子极性的关系
特别提醒 ①稀有气体是非极性分子,不含共价键。②臭氧是极性分子。
非极性键
空间对称
极性
零
不为零
不重合
不是
二、键的极性对化学性质的影响
1.羧酸是一类含 的有机酸,羧基可电离出H+而呈 。
2.三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性 氯的电负性,C—F的极性大于C—Cl,导致三氟乙酸羧基中的O—H的极性 ,
电离出氢离子。
3.烷基(符号R—)是 基团,烷基越长 效应越大,使羧基中的羟基的极性 ,羧酸的酸性 。
羧基(—COOH)
酸性
大于
更大
更易
推电子
推电子
越小
越弱
概念图解1
键的极性的表示方法——极性向量
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,负电荷更为集中。非极性键极性向量为0,则非极性键里,正、负电中心是重合的。
概念图解2
CO2分子极性的判断
C═O是极性键,C呈正电性,O呈负电性;根据VSEPR模型,可得出CO2是直线形分子,两个C═O对称排列,两键的极性的向量和为零,意味着键的极性互相抵消;整个分子没有极性,电荷分布均匀,因此CO2是非极性分子。
易错辨析
(1)同种非金属原子间形成的共价键一定是非极性键。( )
提示 例如臭氧分子中的共价键是极性键。
(2)非极性分子中不可能含有极性键。( )
提示 以极性键结合形成的分子,若分子空间结构对称,则为非极性分子,如CH4、CO2等。
(3)极性分子中一定含有极性键。( )
(4)H2O、CO2、CH4都是非极性分子。( )
提示 H2O是极性分子。
×
×
√
×
重难探究·能力素养全提升
探究一 极性分子和非极性分子的判断
情境探究
如图给出了一些常见物质的结构,试分析:
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)P4和C60是极性分子还是非极性分子
提示 HCl是极性分子,H2、O2、Cl2是非极性分子。
提示 P4和C60是非极性分子。
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
(4)分析H2O2分子中共价键的种类有哪些 H2O2属于极性分子还是非极性分子
提示 HCN、H2O、NH3、CH3Cl是极性分子,CO2、BF3、CH4是非极性分子。
提示 H2O2分子中H—O为极性共价键,O—O为非极性共价键。H2O2属于极性分子。
方法突破
1.共价键的极性与分子的极性的关系
分子 共价键 的极性 分子中正电中心和负电中心 结论 举例
同种元素的 双原子分子 非极性键 重合 非极性 分子 H2、N2、
O2
不同种元素的双原子分子 极性键 不重合 极性分子 CO、HF、HCl
多原子 分子 分子中键的极性的向量和为零 重合 非极性 分子 CO2、BF3、
CH4
分子中键的极性的向量和不为零 不重合 极性 分子 H2O、NH3、
CH3Cl
2.ABn型分子极性的判断
应用体验
视角1键的极性的判断
1.下列关于共价键的叙述不正确的是( )
A.由不同元素原子形成的共价键一般是极性键
B.由同种元素的两个原子形成的双原子分子中的共价键一定是非极性键
C.化合物中不可能含有非极性键
D.当O原子与F原子形成共价键时,共用电子对偏向F原子
C
解析 不同元素的原子吸引电子的能力不同,形成极性键;双原子分子中,同种元素的原子吸引电子的能力相同,形成非极性共价键,A、B项正确。某些化合物如Na2O2、H2O2中均含有非极性键,C项错误。F原子吸引电子的能力强于O原子,二者成键时共用电子对偏向F原子,D项正确。
2.下列共价键①H—H、②H—F、③H—O、④H—N中,键的极性由小到大的顺序排列正确的是( )
A.①②③④ B.④③②①
C.①④③② D.②③④①
C
解析 非金属元素的电负性越大,其原子与氢原子形成的共价键的极性越强。第二周期元素的电负性:N
3.下列对分子极性及分子的空间结构的判断错误的是( )
选项 A B C D
化学式 PCl3 CS2 SO2 CH4
分子极性 极性 非极性 极性 非极性
空间结构 平面三角形 直线形 V形 正四面体形
A
思维建模 解析有关ABn分子极性问题的经验规律如下:
①|中心原子化合价|=中心原子价电子数 非极性分子,
②|中心原子化合价|≠中心原子价电子数 极性分子。
4.某化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是( )
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O是非极性分子
B
解析 H2O2是极性分子,故A错误;反应Ⅰ是在催化剂作用下H2O生成H2和H2O2,涉及极性键H—O的断裂和非极性键H—H、O—O的形成,故B正确;分子的极性与分子内共价键的极性和分子的空间结构密切相关,分子中的正、负电中心是否重合是判断分子极性的依据,中心重合是非极性分子,不重合是极性分子,如甲烷是极性键形成的非极性分子,故C错误;H2O是极性分子,故D错误。
思维建模 分子的极性判断的方法
【变式设问】
(1)原理图中生成的最终产物分子的极性如何
(2)上述过程中元素形成的单质分子都是非极性分子吗
提示 都是非极性分子。最终产物为H2和O2,都属于非极性分子。
提示 不都是。O3分子的结构与水相似,属于极性分子。
易错警示 对键的极性和分子极性的认识误区
(1)一般情况下非金属单质分子是非极性分子,但O3例外。O3的空间结构呈V形,中心氧原子呈正电性,端位的两个氧原子呈负电性,正、负电中心不重合,属于极性分子,其中共价键也是极性键。
(2)极性分子中一定含有极性键,非极性分子中不一定含有非极性键。如CH4是非极性分子,分子中只含有极性键。
(3)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
探究二 键的极性对化学性质的影响
情境探究
羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。阅读教材表2-6不同羧酸的pKa,讨论交流:
(1)为什么甲酸、乙酸、丙酸的酸性逐渐减弱
提示 烃基是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。
(2)为什么三氯乙酸的酸性强于二氯乙酸的酸性
提示 由于Cl3C—比Cl2CH—多一个氯原子,使Cl3C—的极性大于Cl2CH—的极性,导致三氯乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
提示 非羟基氧原子的吸电子效应使O—H极性增强,更容易电离出H+,非羟基氧原子数越多,分子的酸性越强,故硫酸的酸性强于磷酸。
方法突破
从物质结构角度判断酸性强弱的方法
应用体验
视角1键的极性对物质酸性的影响
1.下列物质的酸性强弱比较正确的是( )
A.CH3CH2CH2COOH>HCOOH
B.CH3CH2COOH>CH3CH2CH2COOH
C.CCl3CH2COOH
解析 CH3CH2CH2—的推电子效应使CH3CH2CH2COOH酸性弱于HCOOH,A项错误;含碳原子数越多的烃基推电子效应越强,导致相应羧酸的酸性减弱,所以B项正确;CCl3CH2COOH酸性强于CHCl2CH2COOH,C项错误;由于电负性F>Cl>H,故D项错误。
2.下列各组酸中,酸性依次增强的是( )
A.H2CO3、H2SiO3、H3PO4
B.HNO3、H3PO4、H2SO4
C.HI、HCl、H2S
D.HClO、HClO3、HClO4
D
解析 A项中由于非金属性:C>Si,故酸性:H2CO3>H2SiO3;B项中由于非金属性:N>P,故酸性:HNO3>H3PO4;C项中HCl是强酸,H2S是弱酸;D项可根据通式(HO)mClOn判断出非羟基氧原子数n值依次为0、2、3,从而得出酸性HClO
归纳总结 键的极性对化学性质的影响
(1)共价键的极性越强,键的活泼性也越强,容易发生断裂,易发生相关的化学反应。
(2)成键元素的原子吸引电子能力越强,电负性越大,共价键的极性就越强,在化学反应中该分子的反应活性越强,在化学反应中越容易断裂。
(3)烷基是推电子基团,即将电子推向羧基中的羟基,从而减小羧基中羟基的极性,导致羧酸的酸性减弱。一般地,烷基越长,推电子效应越大,羧酸的酸性越弱。随着烷基加长,酸性的差异越来越小。
本 课 结 束
