3.1 物质的聚集状态与晶体的常识课件(共50张PPT) 2023-2024学年高二化学人教版选择性必修2
文档属性
| 名称 | 3.1 物质的聚集状态与晶体的常识课件(共50张PPT) 2023-2024学年高二化学人教版选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 14:45:43 | ||
图片预览







文档简介
(共50张PPT)
第三章
第一节 物质的聚集状态与晶体的常识
素 养 目 标
1.知道在一定条件下,物质的聚集状态随构成物质的微粒种类、微粒间相互作用、微粒聚集程度的不同而有所不同。认识物质的聚集状态会影响物质的性质,通过改变物质的聚集状态可能获得特殊的材料,培养变化观念与平衡思想的化学核心素养。
2.能说出晶体与非晶体的区别,了解晶体中微粒的空间排布存在周期性,认识简单的晶胞,培养证据推理与模型认知的化学核心素养。
3.知道晶体X射线衍射实验是测定物质结构的基本方法和实验手段,培养科学探究与创新意识的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
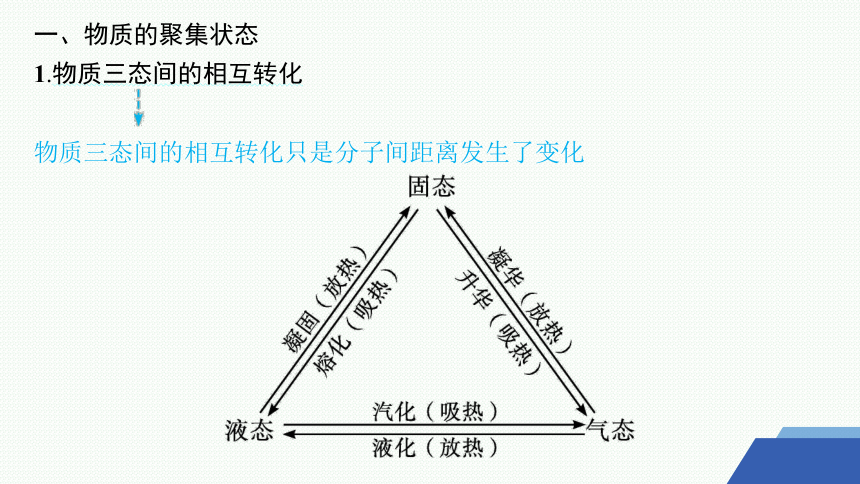
一、物质的聚集状态
1.物质三态间的相互转化
物质三态间的相互转化只是分子间距离发生了变化
2.不含分子的物质
(1)常见晶体:氯化钠、石墨、二氧化硅、金刚石以及各种金属等不含分子。
(2)等离子体是由 、 和 组成的整体上呈 性的气态物质。
(3)离子液体是熔点不高的仅由 组成的液体物质。
3.物质的聚集状态
物质的三态通常是指固态、液态和 ,还有 、非晶态,以及介乎晶态和非晶态之间的 、 等。
电子
阳离子
电中性粒子(分子或原子)
电中
离子
气态
晶态
塑晶态
液晶态
二、晶体与非晶体
1.晶体与非晶体的本质差异
固体 自范性 微观结构
晶体 (能自发呈现 外形) 原子在三维空间里呈
有序排列
非晶体 (不能自发呈现多面体外形) 原子排列相对
有
多面体
周期性
没有
无序
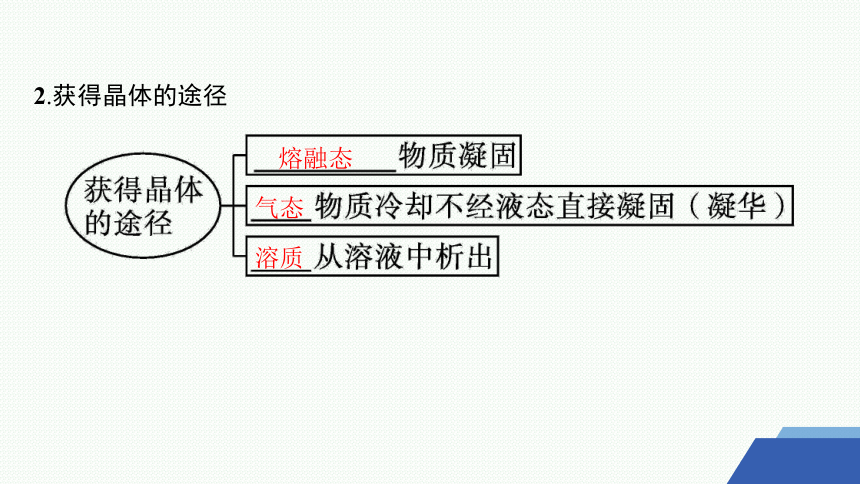
2.获得晶体的途径
熔融态
气态
溶质
3.晶体的特点
(1)自范性
(2)各向异性:晶体在不同方向上表现许多物理性质
(如 、 、光学性质等)的差异。
4.晶体和非晶体的区分
(1)测熔点:晶体 固定的熔点,非晶体 固定的熔点。
(2)最可靠的方法:对固体进行 实验。
自发地
周期性
速率
强度
导热性
有
没有
X射线衍射
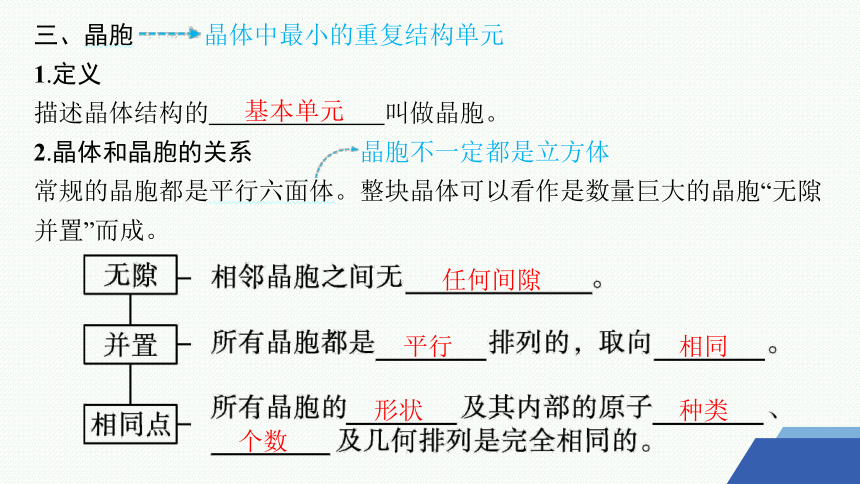
三、晶胞 晶体中最小的重复结构单元
1.定义
描述晶体结构的 叫做晶胞。
2.晶体和晶胞的关系 晶胞不一定都是立方体
常规的晶胞都是平行六面体。整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
基本单元
任何间隙
平行
相同
形状
种类
个数
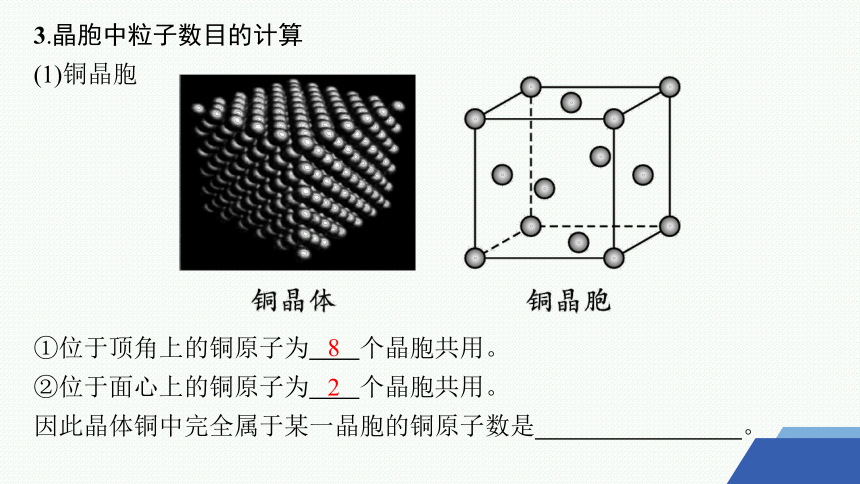
3.晶胞中粒子数目的计算
(1)铜晶胞
①位于顶角上的铜原子为 个晶胞共用。
②位于面心上的铜原子为 个晶胞共用。
因此晶体铜中完全属于某一晶胞的铜原子数是 。
8
2
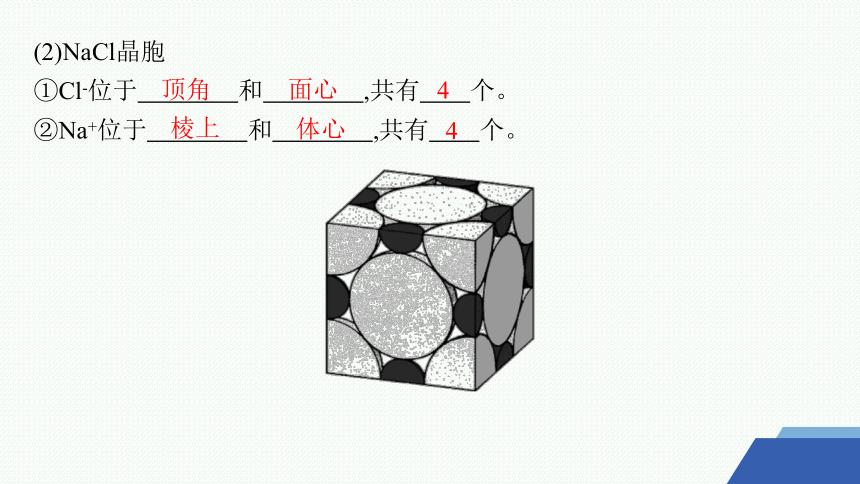
(2)NaCl晶胞
①Cl-位于 和 ,共有 个。
②Na+位于 和 ,共有 个。
顶角
面心
4
棱上
体心
4
四、晶体结构的测定
1.测量原理 区分晶体和非晶体的可靠方法,常用仪器为X射线衍射仪
单一波长的X射线通过晶体时,X射线和晶体中的 相互作用,会在记录仪上产生分立的 或明锐的衍射峰。
2.获得的晶胞信息
根据晶体的X射线衍射实验图,经过计算,可以获得包括晶胞 和大小、分子或原子在微观空间有序排列呈现的 、原子在晶胞里的 和 等,以及结合晶体化学组成的信息推出原子之间的相互关系。
电子
斑点
形状
对称类型
数目
位置
易错提醒
(1)固态、液态和气态物质不一定都由分子构成,也可能由原子或离子等微粒构成;由分子构成的物质,其聚集状态也不一定只有固态、液态和气态,也可能为晶态、非晶态等。
(2)同种物质在不同条件下可形成不同的聚集状态,物质的聚集状态会影响物质的性质,如硬度、熔点等。
易错辨析1
(1)气态物质一定由分子构成。( )
提示 如等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质。
(2)在物质的三态相互转化过程中只是分子间距离发生了变化。( )
提示 固态、液态和气态物质不一定都由分子构成。
(3)固态物质一定是晶体。( )
提示 固态物质分为晶体和非晶体。
(4)熔融的SiO2冷却一定得到水晶。( )
提示 熔融的SiO2快速冷却得到玛瑙。
×
×
×
×
概念辨析
微思考1
等离子体就是液态电解质吗 液晶属于晶体吗 液晶和液态是物质的同一种聚集状态吗
深化理解
是否具有规则的几何外形不能用作区分晶体和非晶体的依据,因为非晶体(如玻璃、塑料等)也能加工成规则几何外形;许多固体粉末用肉眼看不到晶体外形,但在光学显微镜或电子显微镜下可观察到规则的晶体外形,这些粉末仍是晶体,只是晶粒太小。
提示 不是。不属于。不是。等离子体由电子、阳离子和电中性粒子(分子或原子)组成,而液态电解质由阴离子和阳离子或分子组成;液晶不属于晶体;液晶是介于液态和晶态之间的一种特殊的聚集状态。
微思考2
把硫酸铜溶液蒸干,得不到硫酸铜晶体。获取硫酸铜晶体应怎样操作
提示 把硫酸铜溶液蒸发浓缩、冷却结晶,可得到硫酸铜晶体。
概念图解1
无隙并置的结构特点
概念图解2
晶胞“无隙并置”的理解
A中8个顶角相同,三组各4根平行棱分别相同,三组各两个平行面分别相同,满足“无隙并置”。B中8个顶角不同、C中4根平行棱不同、D中平行面不同,均不满足“无隙并置”。(可设想将完全相同的平行六面体B、C或D与原图并置,可知交界面上存在不为两个平行六面体所共有的原子)
易错辨析2
(1)相邻晶胞之间没有任何间隙。( )
(2)晶体是晶胞简单、随意堆积而成。( )
提示 晶体并不是晶胞简单、随意堆积而成,而是晶胞平行排列而成的,取向相同,且相邻晶胞之间没有任何间隙。
(3)粉末状的固体也有可能是晶体。( )
(4)晶胞排列时,取向相同。( )
(5)“并置”是指所有晶胞都是平行排列的。( )
√
×
√
√
√
重难探究·能力素养全提升
探究一 晶体与非晶体的区别
情境探究
材料1 如图Ⅰ、Ⅱ是两种固体的微观结构示意图。
材料2 食盐是日常生活中常用的食品添加剂。我们吃的食盐是粉末状的没有固定形状的颗粒。
问题思考:
(1)试根据示意图判断固体Ⅰ、Ⅱ的类型。
(2)将固体Ⅰ、Ⅱ分别加热至熔化,各有什么现象发生 该现象能说明晶体、非晶体的哪种性质
提示 根据题给结构图可知,Ⅰ中微粒呈周期性有序排列,为晶体;Ⅱ中微粒排列不规则,为非晶体。
提示 加热晶体Ⅰ,温度达到熔点时晶体Ⅰ开始熔化,在全部熔化以前,继续加热,温度基本保持不变,完全熔化后,温度才开始升高,即晶体有固定的熔点。加热非晶体Ⅱ时,温度升高到某一程度后非晶体Ⅱ开始软化,流动性增强,最后变为液体,从软化到完全熔化,中间经过较大的温度范围,即非晶体无固定的熔点。
(3)材料2中的食盐是不是晶体 能不能只通过外观就能区分晶体和非晶体
(4)如何鉴别宝石和用玻璃仿造的假宝石
(5)缺角的NaCl晶体在饱和NaCl溶液中能否慢慢变为完美的立方体块
提示 食盐是晶体。我们吃的食盐是经过粉碎的。不能仅仅通过外观判断晶体和非晶体,非晶体经过加工也能具有规则的几何外形。
提示 宝石是晶体,具有固定的熔点和各向异性,玻璃仿造的假宝石是非晶体,没有固定的熔点和各向异性,常用鉴别方法:①测试硬度,可在玻璃上刻划出痕迹;②利用宝石的折光率鉴别;③进行X射线衍射实验鉴别。
提示 能。
方法突破
晶体与非晶体的比较与鉴别
应用体验
视角1晶体的基本性质
1.下列关于晶体自范性说法错误的是( )
A.自范性是完全自发进行的
B.自范性是有条件自发进行的
C.自范性的结果表现为规则外形
D.自范性是微观有序排列的宏观表象
A
解析 晶体自范性是晶体自发地呈现多面体外形的性质,本质上自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象,当然这种自范性仍需要一定的条件。
2.晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300毫米,质量达81千克的大直径硅单晶,晶体硅大量用于电子产业。下列对晶体硅的叙述正确的是( )
A.晶体硅没有固定的熔点
B.形成晶体硅的速率越快越好
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性
C
解析 晶体有固定的熔点,非晶体没有固定的熔点,故A错误;晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,故B错误;晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否呈周期性有序排列,区别晶体与非晶体最可靠的科学方法是对固体进行X射线衍射实验,故C正确;晶体硅的形成与晶体的自范性有关,形成的晶体有各向异性,故D错误。
视角2晶体和非晶体的对比
3.晶体与非晶体的本质区别是( )
A.晶体具有各向异性,而非晶体具有各向同性
B.晶体具有自范性,而非晶体没有自范性
C.晶体具有固定的熔点,而非晶体没有固定的熔点
D.晶体能使X射线产生衍射,而非晶体则不能
B
解析 易将晶体与非晶体的本质区别及性质区别混为一谈。晶体与非晶体的性质差异是二者本质区别的外在表现。晶体的本质属性是具有自范性,晶体的性质是有固定的熔点,能使X射线产生衍射等。分析此类问题时,要分析晶体、非晶体的本质与性质,采用辩证的观点分析问题。同时也要注意不能用固体是否有规则的几何外形来判断其是否为晶体。
思维建模 解答有关晶体与非晶体的比较问题的思维流程如下:
4.关于晶体和非晶体的说法,正确的是( )
A.晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理性质
B.晶体在熔化过程中需要不断地吸热,温度不断地升高
C.普通玻璃在各个不同的方向上力学、热学、电学、光学性质相同
D.晶体和非晶体之间不可以相互转化
C
解析 晶体在三维空间里呈周期性有序排列,其许多物理性质常常会表现出各向异性,A项不正确;晶体的熔点是固定的,所以在熔化过程中温度几乎不会变化,B项不正确;玻璃不属于晶体,不具有物理性质各向异性的特点,C项正确;在一定条件下,晶体和非晶体是可以相互转化的,D项不正确。
特别警示 关于晶体与非晶体的认识误区
(1)同一物质可以是晶体,也可以是非晶体,如晶体SiO2和非晶体SiO2。
(2)有着规则几何外形或者美观、对称外形的固体,不一定是晶体。例如,玻璃制品可以塑造出规则的几何外形,也可以具有美观对称的外形。
(3)具有固定组成的物质也不一定是晶体,如某些无定形体也有固定的组成。
(4)晶体不一定都有规则的几何外形,如食盐。
探究二 晶胞结构及晶体化学式的确定
情境探究
材料1 超导体,又称为超导材料,指在某一温度下,电阻为零的导体。在实验中,若导体电阻的测量值低于10-25Ω,可以认为电阻为零。
研究发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。该新型超导晶体的一个晶胞如图所示。
材料2 团簇分子是由几个乃至上千个原子、分子或离子通过物理或化学结合力组成的相对稳定的分子,它是一个独立的分子。如由金属原子M和非金属原子N构成的气态团簇分子,如图所示,顶角和面心的原子是M原子,棱中心和体心的原子是N原子。
(1)材料1中晶胞有几组平行棱 有几组平行面
(2)材料1的晶体中镁原子主要位于什么位置
(3)材料1的晶体的化学式是什么
提示 晶胞有三组平行棱,三组平行面。
提示 该晶体中镁原子主要位于平行六面体的顶角上。
(4)材料2图示气态团簇分子的化学式能否利用“均摊法”求算
(5)试推算材料2中气态团簇分子的化学式。
提示 不能。对于独立原子构成的分子,与边界的原子并不存在共用关系,其分子式的确定不能用均摊法。
提示 由于M、N原子并不存在共用关系,所以由气态团簇分子结构图可知,其分子式可由示意图数原子个数来确定,M原子共14个,N原子共13个,即分子式为M14N13。
方法突破
“均摊法”计算晶胞中的粒子数
(1)长方体(含正方体)晶胞中不同位置的粒子数的计算(如下图)。
(2)六棱柱晶胞中不同位置的粒子数的计算:
(3)正三棱柱晶胞中不同位置的粒子数的计算
名师点拨 (1)晶胞中粒子个数的计算
关键是能够正确分析出晶胞中任意位置上的一个粒子被几个晶胞所共用。不同形状的晶胞情况不同。如六棱柱晶胞中,顶角、侧棱、底面、侧面的原子,依次被6、3、2、2个晶胞共用。
(2)确定晶体化学式的方法
观察微粒种类→确定微粒在晶体中的位置→用均摊法求各微粒的数目→求各微粒的最简个数比→确定化学式。
应用体验
视角1晶胞与晶体的关系
1.下列有关晶胞的叙述错误的是( )
A.晶胞是描述晶体结构的基本单元
B.整块晶体中,相邻晶胞之间没有间隙
C.晶胞一般都是平行六面体
D.晶胞都是正八面体
D
解析 晶胞是描述晶体结构的基本单元,A正确;整块晶体可以看作是数量巨大的晶胞“无隙并置”而成,“无隙”是指相邻晶胞之间没有任何间隙,B正确;常规的晶胞一般都是平行六面体,C正确、D错误。
2.[2023河北唐山开滦第一中学高二期末]对于某晶胞(如图所示)的描述错误的是( )
A.该晶胞是所在晶体内最小的平行六面体
B.该晶胞的每个顶角上和每个面的面心上都各有一个原子
C.平均每个晶胞中有14个原子
D.含该晶胞的整块晶体中,相邻晶胞之间没有任何间隙
C
解析 晶胞是最小的重复单元,为六方面心结构,A正确;该晶胞是六方面心结构,在晶胞的每个顶点上和每个面的面心上都各有一个原子,B正确;由于顶点为8个晶胞所共有,面上为2个晶胞所共有,所以平均每个晶胞中含有的原子个数为 ,即平均每个晶胞中有4个原子,C错误;整块晶体可以看作是数量巨大的晶胞“无隙并置”而成,整块晶体中,相邻晶胞之间无任何间隙,D正确。
视角2晶胞中粒子数目和化学式的确定
3.某晶体的晶胞如下图所示,这种晶体中A、B、C三种粒子数目之比是
( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
B
视角3晶体结构的测定
4.下列有关说法正确的是( )
A.测定晶体结构最常用的仪器是X射线衍射仪
B.石英玻璃和水晶的衍射图谱相同
C.通过乙酸晶体的X射线衍射实验,只能测定晶胞中含有的乙酸分子数,不能推出乙酸分子的空间结构
D.晶体的X射线衍射实验不能判断晶体中存在哪些化学键,也不能确定键长和键角
A
5.“嫦娥五号”带回的首批月球土壤主要用于科学研究,所得结论错误的是
( )
A.利用原子光谱可以确定月壤的元素组成
B.月壤所含的铁、金、银、铅、锌、铜、锑、铼等元素均属于过渡元素
C.月壤所含辉钼矿晶体具有对称性、各向异性等特征
D.构成月壤中玻璃颗粒的原子、离子、分子等呈无序排列
B
解析 每一种元素的原子光谱不相同,因此利用原子光谱可以确定月壤的元素组成,故A正确;铅、锑不属于过渡元素,故B错误;晶体都有对称性和各向异性,因此辉钼矿晶体具有对称性、各向异性等特征,故C正确;玻璃颗粒不是晶体,因此微粒是无序排列的,故D正确。
本 课 结 束
第三章
第一节 物质的聚集状态与晶体的常识
素 养 目 标
1.知道在一定条件下,物质的聚集状态随构成物质的微粒种类、微粒间相互作用、微粒聚集程度的不同而有所不同。认识物质的聚集状态会影响物质的性质,通过改变物质的聚集状态可能获得特殊的材料,培养变化观念与平衡思想的化学核心素养。
2.能说出晶体与非晶体的区别,了解晶体中微粒的空间排布存在周期性,认识简单的晶胞,培养证据推理与模型认知的化学核心素养。
3.知道晶体X射线衍射实验是测定物质结构的基本方法和实验手段,培养科学探究与创新意识的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、物质的聚集状态
1.物质三态间的相互转化
物质三态间的相互转化只是分子间距离发生了变化
2.不含分子的物质
(1)常见晶体:氯化钠、石墨、二氧化硅、金刚石以及各种金属等不含分子。
(2)等离子体是由 、 和 组成的整体上呈 性的气态物质。
(3)离子液体是熔点不高的仅由 组成的液体物质。
3.物质的聚集状态
物质的三态通常是指固态、液态和 ,还有 、非晶态,以及介乎晶态和非晶态之间的 、 等。
电子
阳离子
电中性粒子(分子或原子)
电中
离子
气态
晶态
塑晶态
液晶态
二、晶体与非晶体
1.晶体与非晶体的本质差异
固体 自范性 微观结构
晶体 (能自发呈现 外形) 原子在三维空间里呈
有序排列
非晶体 (不能自发呈现多面体外形) 原子排列相对
有
多面体
周期性
没有
无序
2.获得晶体的途径
熔融态
气态
溶质
3.晶体的特点
(1)自范性
(2)各向异性:晶体在不同方向上表现许多物理性质
(如 、 、光学性质等)的差异。
4.晶体和非晶体的区分
(1)测熔点:晶体 固定的熔点,非晶体 固定的熔点。
(2)最可靠的方法:对固体进行 实验。
自发地
周期性
速率
强度
导热性
有
没有
X射线衍射
三、晶胞 晶体中最小的重复结构单元
1.定义
描述晶体结构的 叫做晶胞。
2.晶体和晶胞的关系 晶胞不一定都是立方体
常规的晶胞都是平行六面体。整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
基本单元
任何间隙
平行
相同
形状
种类
个数
3.晶胞中粒子数目的计算
(1)铜晶胞
①位于顶角上的铜原子为 个晶胞共用。
②位于面心上的铜原子为 个晶胞共用。
因此晶体铜中完全属于某一晶胞的铜原子数是 。
8
2
(2)NaCl晶胞
①Cl-位于 和 ,共有 个。
②Na+位于 和 ,共有 个。
顶角
面心
4
棱上
体心
4
四、晶体结构的测定
1.测量原理 区分晶体和非晶体的可靠方法,常用仪器为X射线衍射仪
单一波长的X射线通过晶体时,X射线和晶体中的 相互作用,会在记录仪上产生分立的 或明锐的衍射峰。
2.获得的晶胞信息
根据晶体的X射线衍射实验图,经过计算,可以获得包括晶胞 和大小、分子或原子在微观空间有序排列呈现的 、原子在晶胞里的 和 等,以及结合晶体化学组成的信息推出原子之间的相互关系。
电子
斑点
形状
对称类型
数目
位置
易错提醒
(1)固态、液态和气态物质不一定都由分子构成,也可能由原子或离子等微粒构成;由分子构成的物质,其聚集状态也不一定只有固态、液态和气态,也可能为晶态、非晶态等。
(2)同种物质在不同条件下可形成不同的聚集状态,物质的聚集状态会影响物质的性质,如硬度、熔点等。
易错辨析1
(1)气态物质一定由分子构成。( )
提示 如等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质。
(2)在物质的三态相互转化过程中只是分子间距离发生了变化。( )
提示 固态、液态和气态物质不一定都由分子构成。
(3)固态物质一定是晶体。( )
提示 固态物质分为晶体和非晶体。
(4)熔融的SiO2冷却一定得到水晶。( )
提示 熔融的SiO2快速冷却得到玛瑙。
×
×
×
×
概念辨析
微思考1
等离子体就是液态电解质吗 液晶属于晶体吗 液晶和液态是物质的同一种聚集状态吗
深化理解
是否具有规则的几何外形不能用作区分晶体和非晶体的依据,因为非晶体(如玻璃、塑料等)也能加工成规则几何外形;许多固体粉末用肉眼看不到晶体外形,但在光学显微镜或电子显微镜下可观察到规则的晶体外形,这些粉末仍是晶体,只是晶粒太小。
提示 不是。不属于。不是。等离子体由电子、阳离子和电中性粒子(分子或原子)组成,而液态电解质由阴离子和阳离子或分子组成;液晶不属于晶体;液晶是介于液态和晶态之间的一种特殊的聚集状态。
微思考2
把硫酸铜溶液蒸干,得不到硫酸铜晶体。获取硫酸铜晶体应怎样操作
提示 把硫酸铜溶液蒸发浓缩、冷却结晶,可得到硫酸铜晶体。
概念图解1
无隙并置的结构特点
概念图解2
晶胞“无隙并置”的理解
A中8个顶角相同,三组各4根平行棱分别相同,三组各两个平行面分别相同,满足“无隙并置”。B中8个顶角不同、C中4根平行棱不同、D中平行面不同,均不满足“无隙并置”。(可设想将完全相同的平行六面体B、C或D与原图并置,可知交界面上存在不为两个平行六面体所共有的原子)
易错辨析2
(1)相邻晶胞之间没有任何间隙。( )
(2)晶体是晶胞简单、随意堆积而成。( )
提示 晶体并不是晶胞简单、随意堆积而成,而是晶胞平行排列而成的,取向相同,且相邻晶胞之间没有任何间隙。
(3)粉末状的固体也有可能是晶体。( )
(4)晶胞排列时,取向相同。( )
(5)“并置”是指所有晶胞都是平行排列的。( )
√
×
√
√
√
重难探究·能力素养全提升
探究一 晶体与非晶体的区别
情境探究
材料1 如图Ⅰ、Ⅱ是两种固体的微观结构示意图。
材料2 食盐是日常生活中常用的食品添加剂。我们吃的食盐是粉末状的没有固定形状的颗粒。
问题思考:
(1)试根据示意图判断固体Ⅰ、Ⅱ的类型。
(2)将固体Ⅰ、Ⅱ分别加热至熔化,各有什么现象发生 该现象能说明晶体、非晶体的哪种性质
提示 根据题给结构图可知,Ⅰ中微粒呈周期性有序排列,为晶体;Ⅱ中微粒排列不规则,为非晶体。
提示 加热晶体Ⅰ,温度达到熔点时晶体Ⅰ开始熔化,在全部熔化以前,继续加热,温度基本保持不变,完全熔化后,温度才开始升高,即晶体有固定的熔点。加热非晶体Ⅱ时,温度升高到某一程度后非晶体Ⅱ开始软化,流动性增强,最后变为液体,从软化到完全熔化,中间经过较大的温度范围,即非晶体无固定的熔点。
(3)材料2中的食盐是不是晶体 能不能只通过外观就能区分晶体和非晶体
(4)如何鉴别宝石和用玻璃仿造的假宝石
(5)缺角的NaCl晶体在饱和NaCl溶液中能否慢慢变为完美的立方体块
提示 食盐是晶体。我们吃的食盐是经过粉碎的。不能仅仅通过外观判断晶体和非晶体,非晶体经过加工也能具有规则的几何外形。
提示 宝石是晶体,具有固定的熔点和各向异性,玻璃仿造的假宝石是非晶体,没有固定的熔点和各向异性,常用鉴别方法:①测试硬度,可在玻璃上刻划出痕迹;②利用宝石的折光率鉴别;③进行X射线衍射实验鉴别。
提示 能。
方法突破
晶体与非晶体的比较与鉴别
应用体验
视角1晶体的基本性质
1.下列关于晶体自范性说法错误的是( )
A.自范性是完全自发进行的
B.自范性是有条件自发进行的
C.自范性的结果表现为规则外形
D.自范性是微观有序排列的宏观表象
A
解析 晶体自范性是晶体自发地呈现多面体外形的性质,本质上自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象,当然这种自范性仍需要一定的条件。
2.晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300毫米,质量达81千克的大直径硅单晶,晶体硅大量用于电子产业。下列对晶体硅的叙述正确的是( )
A.晶体硅没有固定的熔点
B.形成晶体硅的速率越快越好
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性
C
解析 晶体有固定的熔点,非晶体没有固定的熔点,故A错误;晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,故B错误;晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否呈周期性有序排列,区别晶体与非晶体最可靠的科学方法是对固体进行X射线衍射实验,故C正确;晶体硅的形成与晶体的自范性有关,形成的晶体有各向异性,故D错误。
视角2晶体和非晶体的对比
3.晶体与非晶体的本质区别是( )
A.晶体具有各向异性,而非晶体具有各向同性
B.晶体具有自范性,而非晶体没有自范性
C.晶体具有固定的熔点,而非晶体没有固定的熔点
D.晶体能使X射线产生衍射,而非晶体则不能
B
解析 易将晶体与非晶体的本质区别及性质区别混为一谈。晶体与非晶体的性质差异是二者本质区别的外在表现。晶体的本质属性是具有自范性,晶体的性质是有固定的熔点,能使X射线产生衍射等。分析此类问题时,要分析晶体、非晶体的本质与性质,采用辩证的观点分析问题。同时也要注意不能用固体是否有规则的几何外形来判断其是否为晶体。
思维建模 解答有关晶体与非晶体的比较问题的思维流程如下:
4.关于晶体和非晶体的说法,正确的是( )
A.晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理性质
B.晶体在熔化过程中需要不断地吸热,温度不断地升高
C.普通玻璃在各个不同的方向上力学、热学、电学、光学性质相同
D.晶体和非晶体之间不可以相互转化
C
解析 晶体在三维空间里呈周期性有序排列,其许多物理性质常常会表现出各向异性,A项不正确;晶体的熔点是固定的,所以在熔化过程中温度几乎不会变化,B项不正确;玻璃不属于晶体,不具有物理性质各向异性的特点,C项正确;在一定条件下,晶体和非晶体是可以相互转化的,D项不正确。
特别警示 关于晶体与非晶体的认识误区
(1)同一物质可以是晶体,也可以是非晶体,如晶体SiO2和非晶体SiO2。
(2)有着规则几何外形或者美观、对称外形的固体,不一定是晶体。例如,玻璃制品可以塑造出规则的几何外形,也可以具有美观对称的外形。
(3)具有固定组成的物质也不一定是晶体,如某些无定形体也有固定的组成。
(4)晶体不一定都有规则的几何外形,如食盐。
探究二 晶胞结构及晶体化学式的确定
情境探究
材料1 超导体,又称为超导材料,指在某一温度下,电阻为零的导体。在实验中,若导体电阻的测量值低于10-25Ω,可以认为电阻为零。
研究发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。该新型超导晶体的一个晶胞如图所示。
材料2 团簇分子是由几个乃至上千个原子、分子或离子通过物理或化学结合力组成的相对稳定的分子,它是一个独立的分子。如由金属原子M和非金属原子N构成的气态团簇分子,如图所示,顶角和面心的原子是M原子,棱中心和体心的原子是N原子。
(1)材料1中晶胞有几组平行棱 有几组平行面
(2)材料1的晶体中镁原子主要位于什么位置
(3)材料1的晶体的化学式是什么
提示 晶胞有三组平行棱,三组平行面。
提示 该晶体中镁原子主要位于平行六面体的顶角上。
(4)材料2图示气态团簇分子的化学式能否利用“均摊法”求算
(5)试推算材料2中气态团簇分子的化学式。
提示 不能。对于独立原子构成的分子,与边界的原子并不存在共用关系,其分子式的确定不能用均摊法。
提示 由于M、N原子并不存在共用关系,所以由气态团簇分子结构图可知,其分子式可由示意图数原子个数来确定,M原子共14个,N原子共13个,即分子式为M14N13。
方法突破
“均摊法”计算晶胞中的粒子数
(1)长方体(含正方体)晶胞中不同位置的粒子数的计算(如下图)。
(2)六棱柱晶胞中不同位置的粒子数的计算:
(3)正三棱柱晶胞中不同位置的粒子数的计算
名师点拨 (1)晶胞中粒子个数的计算
关键是能够正确分析出晶胞中任意位置上的一个粒子被几个晶胞所共用。不同形状的晶胞情况不同。如六棱柱晶胞中,顶角、侧棱、底面、侧面的原子,依次被6、3、2、2个晶胞共用。
(2)确定晶体化学式的方法
观察微粒种类→确定微粒在晶体中的位置→用均摊法求各微粒的数目→求各微粒的最简个数比→确定化学式。
应用体验
视角1晶胞与晶体的关系
1.下列有关晶胞的叙述错误的是( )
A.晶胞是描述晶体结构的基本单元
B.整块晶体中,相邻晶胞之间没有间隙
C.晶胞一般都是平行六面体
D.晶胞都是正八面体
D
解析 晶胞是描述晶体结构的基本单元,A正确;整块晶体可以看作是数量巨大的晶胞“无隙并置”而成,“无隙”是指相邻晶胞之间没有任何间隙,B正确;常规的晶胞一般都是平行六面体,C正确、D错误。
2.[2023河北唐山开滦第一中学高二期末]对于某晶胞(如图所示)的描述错误的是( )
A.该晶胞是所在晶体内最小的平行六面体
B.该晶胞的每个顶角上和每个面的面心上都各有一个原子
C.平均每个晶胞中有14个原子
D.含该晶胞的整块晶体中,相邻晶胞之间没有任何间隙
C
解析 晶胞是最小的重复单元,为六方面心结构,A正确;该晶胞是六方面心结构,在晶胞的每个顶点上和每个面的面心上都各有一个原子,B正确;由于顶点为8个晶胞所共有,面上为2个晶胞所共有,所以平均每个晶胞中含有的原子个数为 ,即平均每个晶胞中有4个原子,C错误;整块晶体可以看作是数量巨大的晶胞“无隙并置”而成,整块晶体中,相邻晶胞之间无任何间隙,D正确。
视角2晶胞中粒子数目和化学式的确定
3.某晶体的晶胞如下图所示,这种晶体中A、B、C三种粒子数目之比是
( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
B
视角3晶体结构的测定
4.下列有关说法正确的是( )
A.测定晶体结构最常用的仪器是X射线衍射仪
B.石英玻璃和水晶的衍射图谱相同
C.通过乙酸晶体的X射线衍射实验,只能测定晶胞中含有的乙酸分子数,不能推出乙酸分子的空间结构
D.晶体的X射线衍射实验不能判断晶体中存在哪些化学键,也不能确定键长和键角
A
5.“嫦娥五号”带回的首批月球土壤主要用于科学研究,所得结论错误的是
( )
A.利用原子光谱可以确定月壤的元素组成
B.月壤所含的铁、金、银、铅、锌、铜、锑、铼等元素均属于过渡元素
C.月壤所含辉钼矿晶体具有对称性、各向异性等特征
D.构成月壤中玻璃颗粒的原子、离子、分子等呈无序排列
B
解析 每一种元素的原子光谱不相同,因此利用原子光谱可以确定月壤的元素组成,故A正确;铅、锑不属于过渡元素,故B错误;晶体都有对称性和各向异性,因此辉钼矿晶体具有对称性、各向异性等特征,故C正确;玻璃颗粒不是晶体,因此微粒是无序排列的,故D正确。
本 课 结 束
