3.3.1 金属晶体与离子晶体课件(共41张PPT) 2023-2024学年高二化学人教版选择性必修2
文档属性
| 名称 | 3.3.1 金属晶体与离子晶体课件(共41张PPT) 2023-2024学年高二化学人教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 14:48:32 | ||
图片预览







文档简介
(共41张PPT)
第三章
第三节 第一课时 金属晶体与离子晶体
素 养 目 标
1.结合常见的离子化合物和金属单质的实例,认识这些物质的构成微粒、微粒间相互作用与物质性质的关系,培养宏观辨识与微观探析的化学核心素养。
2.借助离子晶体、金属晶体等模型认识晶体的结构特点,预测物质的性质,形成证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
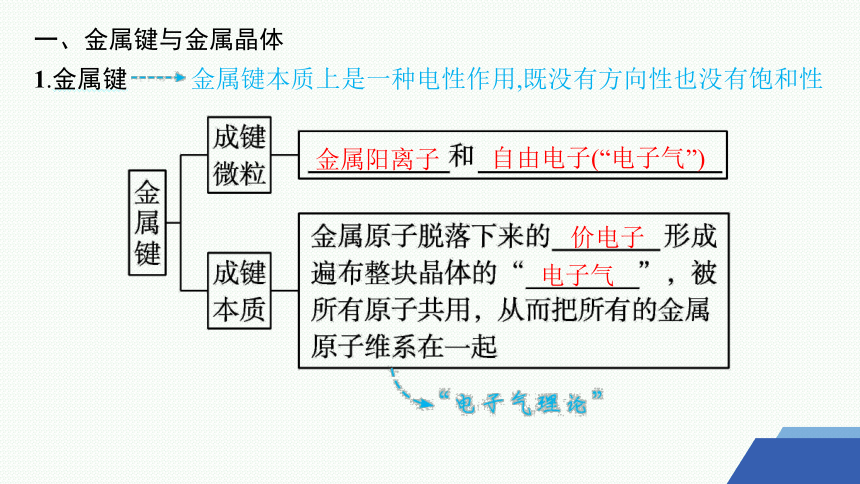
一、金属键与金属晶体
1.金属键 金属键本质上是一种电性作用,既没有方向性也没有饱和性
金属阳离子
自由电子(“电子气”)
价电子
电子气
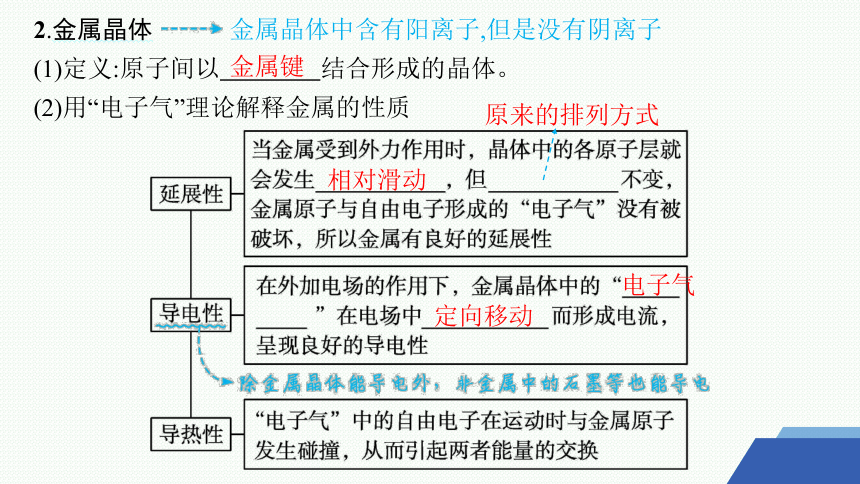
2.金属晶体 金属晶体中含有阳离子,但是没有阴离子
(1)定义:原子间以 结合形成的晶体。
(2)用“电子气”理论解释金属的性质
金属键
相对滑动
电子气
定向移动
原来的排列方式
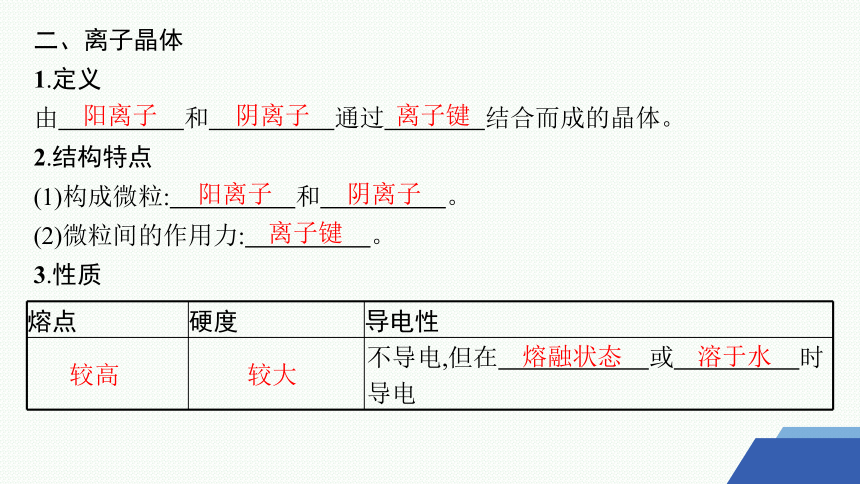
二、离子晶体
1.定义
由 和 通过 结合而成的晶体。
2.结构特点
(1)构成微粒: 和 。
(2)微粒间的作用力: 。
3.性质
熔点 硬度 导电性
不导电,但在 或 时导电
阳离子
阴离子
离子键
阳离子
阴离子
离子键
较高
较大
熔融状态
溶于水
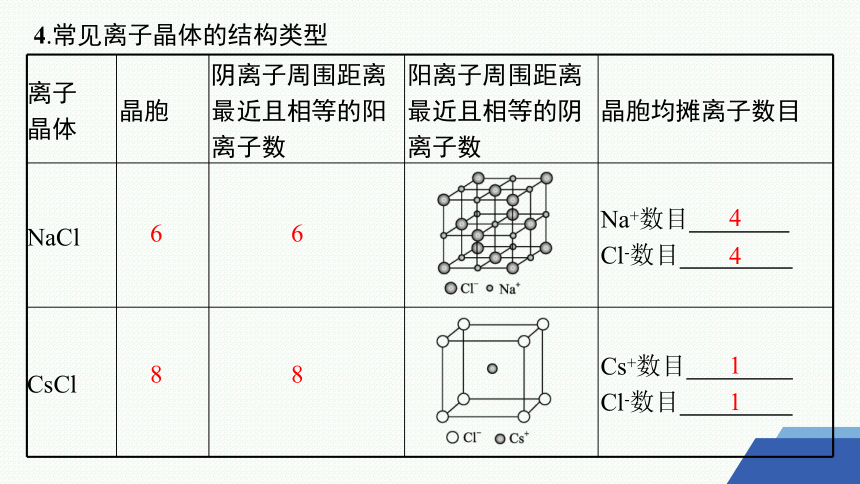
4.常见离子晶体的结构类型
离子 晶体 晶胞 阴离子周围距离最近且相等的阳离子数 阳离子周围距离最近且相等的阴离子数 晶胞均摊离子数目
NaCl Na+数目
Cl-数目
CsCl Cs+数目
Cl-数目
6
6
4
4
8
8
1
1
微思考1
金属原子的核外电子在金属晶体中都为自由电子吗 金属键有饱和性和方向性吗
提示 不都为。没有。因金属原子的最外层电子受原子核的吸引力小,易脱落而成为自由电子,内层电子受到核内质子的吸引力大。金属键是金属阳离子和自由电子之间的相互作用,自由电子为所有原子所共用,故金属键没有方向性和饱和性。
易错辨析1
(1)晶体中有阳离子时不一定有阴离子。( )
(2)金属晶体的熔点不一定比分子晶体的熔点高。( )
(3)金属受外力作用时常发生变形而不易折断,是由于金属原子间有较强的作用。( )
提示 金属受外力作用发生变形而不易折断,是因为金属晶体中各层发生相对滑动,但不会改变原来的排列方式。
(4)金属在拉成丝或者压成薄片的过程中,没有破坏金属键。( )
微思考2
含金属阳离子的晶体一定是离子晶体吗
√
√
×
√
提示 不一定,也可能是金属晶体。
教材拓展
NaCl晶体中阴、阳离子的配位数
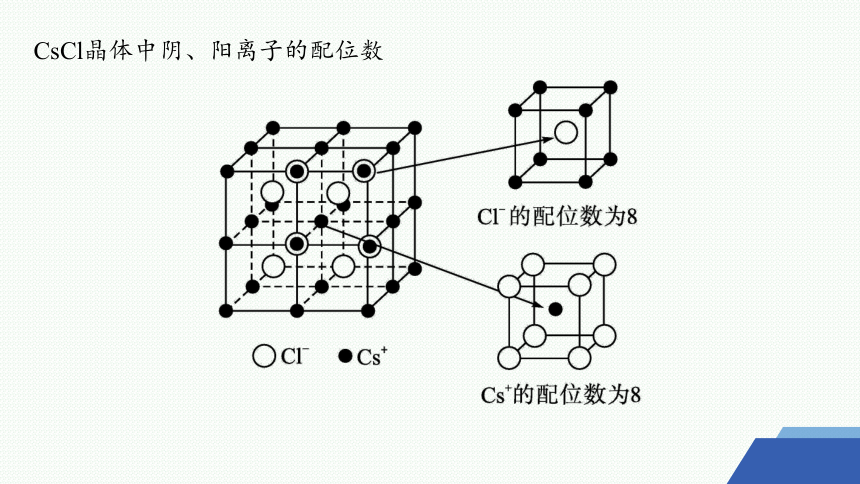
CsCl晶体中阴、阳离子的配位数
易错辨析2
(1)金属晶体可导电,离子晶体不导电。( )
(2)含有离子的晶体不一定是离子晶体。( )
(3)由金属元素和非金属元素组成的晶体不一定是离子晶体。( )
√
√
√
重难探究·能力素养全提升
探究一 金属键与金属晶体物理性质的关系
情境探究
材料 科学家利用增材制造(俗称3D打印),成功开发了一种超强、高延展性、超轻的钛基合金。通过在3D打印过程中控制激光功率和扫描速度等参数,成功地以可控的方式创造了新合金中元素的不均匀成分。
3D打印钛合金中的熔岩状微观结构
(1)合金属于什么晶体 构成粒子是什么
(2)合金的延展性比纯金属差,硬度比纯金属大,原因是什么
提示 金属晶体;构成粒子为金属阳离子和自由电子。
提示 合金与纯金属相比,增加了不同的金属或非金属,相当于填补了金属阳离子之间的空隙,所以一般情况下合金的延展性比纯金属差,硬度比纯金属大。
(3)试用“电子气理论”解释为什么金属具有良好的延展性、导电性和导热性
提示 ①当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但原来的排列方式不变,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,并且电子气没有被破坏,所以金属有良好的延展性;
②金属晶体中的自由电子在电场中定向移动而形成电流,呈现良好的导电性;
③电子气中的自由电子在热的作用下运动时频繁与金属原子碰撞,从而引起能量传递,呈现良好的导热性。
(5)根据规律判断下列金属的熔点高低
①Li、Na、K、Rb、Cs ②Na、Mg、Al
(4)合金的熔点与相应的成分金属的熔点有何关系
提示 合金的熔点一般低于任何一种成分金属的熔点。
提示 Li>Na>K>Rb>Cs,Na方法突破
1.金属晶体的结构
2.金属晶体的性质
(1)金属晶体具有良好的导电性、导热性和延展性。
(2)熔点:金属键越强,熔点越高。
①同周期金属单质,从左到右(如Na、Mg、Al)熔点升高。
②同主族金属单质,从上到下(如碱金属)熔点降低。
③合金的熔点一般比其各成分金属的熔点低。
④金属晶体熔点差别很大,如钠的熔点为97.8 ℃,而铁的熔点则高达1 535 ℃。
(3)硬度:金属键越强,晶体的硬度越大。
名师点拨 (1)有金属光泽的单质不一定是金属单质,如晶体硅、晶体碘也有金属光泽。
(2)金属晶体有导电性,但能导电的物质不一定是金属,如石墨、硅、能导电的有机高分子化合物等。
(3)温度升高,金属阳离子的振动频率和自由电子的无序运动增强,金属导电能力减弱;电解质溶液中,阴、阳离子随溶液温度升高,运动速率加快,导电能力增强。
应用体验
视角1金属键的理解
1.下列关于金属键的叙述不正确的是( )
A.金属键是金属阳离子和自由电子间的强烈相互作用,也是一种电性作用
B.金属键可以看作许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
C.金属键是金属阳离子和自由电子间的相互作用,故金属键无方向性和饱和性
D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动
B
解析 从构成基本粒子的性质来看,金属键也是一种电性作用,其特征是无方向性和饱和性。自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有原子所共用。
视角2金属晶体的结构
2.下列叙述正确的是( )
A.有阳离子的晶体一定有阴离子
B.有阳离子的晶体一定是化合物
C.金属晶体都具有较高的熔点和银白色金属光泽
D.由单质组成且在固态时能导电的晶体不一定是金属晶体
D
解析 金属晶体的构成微粒为金属阳离子和自由电子,故有阳离子的晶体中不一定有阴离子,也不一定是化合物(铁、铜等金属晶体是单质),A、B项错误;有的金属晶体的熔点很高,如钨是熔点最高的金属,有的很低,如汞在常温下是液体,绝大多数金属都具有银白色金属光泽,但少数金属有特殊颜色,如Au呈金黄色,Cu呈红色,Cs略带金色等,C项错误;金属晶体能导电,但能导电的晶体不一定是金属晶体,如晶体硅(属于共价晶体)能导电,D项正确。
视角3金属晶体的性质
3.下列关于金属晶体的叙述不正确的是( )
A.常温下,金属单质不都以金属晶体形式存在
B.金属键在一定外力作用下,会因形变而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越弱
B
解析 常温下,Hg为液态,故A正确;金属键无方向性,故金属键在一定范围内不会因形变而消失,故B错误;钙的金属键强于钾,故熔、沸点高于钾,故C正确;温度升高,自由电子的能量增大,无规则运动加剧,影响了自由电子的定向移动,金属的导电性减弱,故D正确。
4.金属的下列性质中,不能用金属键解释的是( )
A.易传热 B.加工易变形但不碎
C.易锈蚀 D.有特殊的金属光泽
C
解析 金属晶体易传热是由于晶体内部自由电子与金属原子的碰撞,即能用金属键解释,故A正确;金属有延展性,加工易变形,发生形变时,自由电子仍然可以在金属阳离子之间流动,使金属不会断裂破碎,即能用金属键解释,故B正确;金属易锈蚀与金属晶体结构无关,与化学性质有关,金属的化学性质比较活泼,容易被空气中的氧气氧化,故C错误;自由电子很容易被激发,在吸收可见光以后,发生跃迁,成为高能态,然后又回到低能态,把多余的能量以可见光的形式释放出来,能用金属键解释,故D正确。
易错提醒 金属晶体性质的认识误区
(1)金属晶体在受外力作用下,各层之间发生相对滑动,但金属键并没有被破坏。
(2)共价晶体的熔点不一定都比金属晶体的高,如金属钨的熔点就高于一般的共价晶体。
(3)分子晶体的熔点不一定都比金属晶体的低,如汞在常温下是液体,熔点很低。
探究二 离子晶体的结构与性质
情境探究
材料1 已知MgO、NaCl、CsCl、CaCO3、(NH4)2SO4、CuSO4·5H2O、[Cu(NH3)4]SO4·H2O等均为离子晶体。
材料2 以下是八种物质的熔点
序号 ① ② ③ ④
物质 NaF NaCl NaBr NaI
熔点/℃ 993 801 747 661
序号 ⑤ ⑥ ⑦ ⑧
物质 MgO CaO SrO BaO
熔点/℃ 2 852 2 614 2 430 1 918
根据材料回答下列问题:
(1)离子晶体中一定含有金属元素吗 由金属元素和非金属元素组成的晶体一定是离子晶体吗
提示 不一定。离子晶体中不一定含金属元素,如NH4Cl、NH4NO3等铵盐。由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是分子晶体。
(2)离子晶体中可以有分子存在吗 离子晶体中除含有离子键外,是否还可能含有共价键、氢键、分子间作用力
提示 可以。离子晶体是由阴、阳离子通过离子键按一定的方式排列组合而成,阴、阳离子是其构成基本微粒,但是对于一些带结晶水的离子晶体如CuSO4·5H2O、[Cu(NH3)4]SO4·H2O等同时还存在小分子。因此离子晶体中一定有离子键,还有可能含有共价键、氢键、分子间作用力等作用。
(3)材料2①~④、⑤~⑧中物质的熔点为什么会逐渐降低
(4)材料2⑤~⑧中物质的熔点远高于①~④中物质的原因是什么
提示 ①~④均为离子晶体且离子所带电荷数相同,从F-→I-随着离子半径的增大,离子键减弱,熔点逐渐降低。⑤~⑧均为离子晶体且离子所带电荷数相同,从Mg2+→Ba2+随着离子半径的增大,离子键减弱,熔点逐渐降低。
提示 ①~⑧中的物质均为离子晶体,但⑤~⑧中物质的离子所带电荷数多于①~④中的物质的离子所带的电荷数,离子所带电荷数越多,离子键越强,熔点越高。
方法突破
离子晶体的结构与性质特点
名师点拨 离子晶体认识中的常见易错点
(1)NaCl、CsCl只表示晶体中阴、阳离子个数比,为化学式,不是分子式。
(2)离子晶体中一定有离子键,可能有共价键和氢键等,如KNO3等晶体中既有离子键又有共价键;CuSO4·5H2O中除含有离子键外,还含有共价键和氢键。
(3)离子晶体中,每一个阴(阳)离子周围排列的带相反电荷离子的数目是固定的,不是任意的。
应用体验
视角1离子晶体的结构和特征
1.关于离子晶体的下列说法正确的是( )
①离子晶体中的组成微粒是阴、阳离子
②离子晶体中微粒间的作用是离子键
③离子晶体中微粒间只存在异性电荷的互相吸引
④离子晶体中只存在离子键
A.只有①② B.只有①③
C.只有②③ D.只有③④
A
解析 离子晶体中的组成微粒只有阴、阳离子,故①正确;离子晶体中阴、阳离子间的静电作用称为离子键,故②正确;离子晶体中微粒间的作用包括吸引力和排斥力,故③错误;离子晶体中一定含有离子键,可能含有共价键等,如NaOH中既有离子键,又有共价键,故④错误。
视角2离子晶体的性质
2.下列有关离子晶体的数据大小比较不正确的是( )
A.离子键:NaF>NaCl>NaBr
B.硬度:MgO>CaO>BaO
C.熔点:NaF>MgF2>AlF3
D.1个阴离子周围等距离且最近的阳离子数:CsCl>NaCl
C
解析 离子半径越小,所带电荷数越多,离子键越强,F-、Cl-、Br-所带电荷数相等,离子半径Br->Cl->F-,故A正确;离子半径越大,键能越小,硬度越小,离子半径Ba2+>Ca2+>Mg2+,故B正确;离子半径Na+>Mg2+>Al3+,离子半径越小,电荷数越多,则熔点越高,故C错误;CsCl晶胞中1个Cl-周围等距离且最近的Cs+有8个;NaCl晶胞中1个Cl-周围等距离且最近的Na+有6个,故D正确。
思维建模 解答有关离子晶体性质比较问题的思维流程如下:
3.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C
解析 离子晶体中含有离子键,离子键在熔融状态下被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的依据。
归纳总结 离子晶体的判断
(1)根据物质的分类
大多数盐(包括铵盐)、强碱、活泼金属的氧化物和过氧化物(如Na2O和Na2O2)、部分氢化物(如NaH)、部分硫化物等都是离子晶体。
(2)根据元素的性质和种类
①根据电负性:如成键元素的电负性差值大于1.7的物质;
②根据元素在元素周期表中的位置:金属元素(如第ⅠA、ⅡA族元素等)与非金属元素(如第ⅥA、ⅦA族元素等)组成的化合物。
(3)根据物质的性质
离子晶体一般具有较高的熔、沸点,难挥发,硬而脆;固体不导电,但熔融状态或溶于水时能导电,大多数离子晶体易溶于极性溶剂而难溶于非极性溶剂。
本 课 结 束
第三章
第三节 第一课时 金属晶体与离子晶体
素 养 目 标
1.结合常见的离子化合物和金属单质的实例,认识这些物质的构成微粒、微粒间相互作用与物质性质的关系,培养宏观辨识与微观探析的化学核心素养。
2.借助离子晶体、金属晶体等模型认识晶体的结构特点,预测物质的性质,形成证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、金属键与金属晶体
1.金属键 金属键本质上是一种电性作用,既没有方向性也没有饱和性
金属阳离子
自由电子(“电子气”)
价电子
电子气
2.金属晶体 金属晶体中含有阳离子,但是没有阴离子
(1)定义:原子间以 结合形成的晶体。
(2)用“电子气”理论解释金属的性质
金属键
相对滑动
电子气
定向移动
原来的排列方式
二、离子晶体
1.定义
由 和 通过 结合而成的晶体。
2.结构特点
(1)构成微粒: 和 。
(2)微粒间的作用力: 。
3.性质
熔点 硬度 导电性
不导电,但在 或 时导电
阳离子
阴离子
离子键
阳离子
阴离子
离子键
较高
较大
熔融状态
溶于水
4.常见离子晶体的结构类型
离子 晶体 晶胞 阴离子周围距离最近且相等的阳离子数 阳离子周围距离最近且相等的阴离子数 晶胞均摊离子数目
NaCl Na+数目
Cl-数目
CsCl Cs+数目
Cl-数目
6
6
4
4
8
8
1
1
微思考1
金属原子的核外电子在金属晶体中都为自由电子吗 金属键有饱和性和方向性吗
提示 不都为。没有。因金属原子的最外层电子受原子核的吸引力小,易脱落而成为自由电子,内层电子受到核内质子的吸引力大。金属键是金属阳离子和自由电子之间的相互作用,自由电子为所有原子所共用,故金属键没有方向性和饱和性。
易错辨析1
(1)晶体中有阳离子时不一定有阴离子。( )
(2)金属晶体的熔点不一定比分子晶体的熔点高。( )
(3)金属受外力作用时常发生变形而不易折断,是由于金属原子间有较强的作用。( )
提示 金属受外力作用发生变形而不易折断,是因为金属晶体中各层发生相对滑动,但不会改变原来的排列方式。
(4)金属在拉成丝或者压成薄片的过程中,没有破坏金属键。( )
微思考2
含金属阳离子的晶体一定是离子晶体吗
√
√
×
√
提示 不一定,也可能是金属晶体。
教材拓展
NaCl晶体中阴、阳离子的配位数
CsCl晶体中阴、阳离子的配位数
易错辨析2
(1)金属晶体可导电,离子晶体不导电。( )
(2)含有离子的晶体不一定是离子晶体。( )
(3)由金属元素和非金属元素组成的晶体不一定是离子晶体。( )
√
√
√
重难探究·能力素养全提升
探究一 金属键与金属晶体物理性质的关系
情境探究
材料 科学家利用增材制造(俗称3D打印),成功开发了一种超强、高延展性、超轻的钛基合金。通过在3D打印过程中控制激光功率和扫描速度等参数,成功地以可控的方式创造了新合金中元素的不均匀成分。
3D打印钛合金中的熔岩状微观结构
(1)合金属于什么晶体 构成粒子是什么
(2)合金的延展性比纯金属差,硬度比纯金属大,原因是什么
提示 金属晶体;构成粒子为金属阳离子和自由电子。
提示 合金与纯金属相比,增加了不同的金属或非金属,相当于填补了金属阳离子之间的空隙,所以一般情况下合金的延展性比纯金属差,硬度比纯金属大。
(3)试用“电子气理论”解释为什么金属具有良好的延展性、导电性和导热性
提示 ①当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但原来的排列方式不变,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,并且电子气没有被破坏,所以金属有良好的延展性;
②金属晶体中的自由电子在电场中定向移动而形成电流,呈现良好的导电性;
③电子气中的自由电子在热的作用下运动时频繁与金属原子碰撞,从而引起能量传递,呈现良好的导热性。
(5)根据规律判断下列金属的熔点高低
①Li、Na、K、Rb、Cs ②Na、Mg、Al
(4)合金的熔点与相应的成分金属的熔点有何关系
提示 合金的熔点一般低于任何一种成分金属的熔点。
提示 Li>Na>K>Rb>Cs,Na
1.金属晶体的结构
2.金属晶体的性质
(1)金属晶体具有良好的导电性、导热性和延展性。
(2)熔点:金属键越强,熔点越高。
①同周期金属单质,从左到右(如Na、Mg、Al)熔点升高。
②同主族金属单质,从上到下(如碱金属)熔点降低。
③合金的熔点一般比其各成分金属的熔点低。
④金属晶体熔点差别很大,如钠的熔点为97.8 ℃,而铁的熔点则高达1 535 ℃。
(3)硬度:金属键越强,晶体的硬度越大。
名师点拨 (1)有金属光泽的单质不一定是金属单质,如晶体硅、晶体碘也有金属光泽。
(2)金属晶体有导电性,但能导电的物质不一定是金属,如石墨、硅、能导电的有机高分子化合物等。
(3)温度升高,金属阳离子的振动频率和自由电子的无序运动增强,金属导电能力减弱;电解质溶液中,阴、阳离子随溶液温度升高,运动速率加快,导电能力增强。
应用体验
视角1金属键的理解
1.下列关于金属键的叙述不正确的是( )
A.金属键是金属阳离子和自由电子间的强烈相互作用,也是一种电性作用
B.金属键可以看作许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
C.金属键是金属阳离子和自由电子间的相互作用,故金属键无方向性和饱和性
D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动
B
解析 从构成基本粒子的性质来看,金属键也是一种电性作用,其特征是无方向性和饱和性。自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有原子所共用。
视角2金属晶体的结构
2.下列叙述正确的是( )
A.有阳离子的晶体一定有阴离子
B.有阳离子的晶体一定是化合物
C.金属晶体都具有较高的熔点和银白色金属光泽
D.由单质组成且在固态时能导电的晶体不一定是金属晶体
D
解析 金属晶体的构成微粒为金属阳离子和自由电子,故有阳离子的晶体中不一定有阴离子,也不一定是化合物(铁、铜等金属晶体是单质),A、B项错误;有的金属晶体的熔点很高,如钨是熔点最高的金属,有的很低,如汞在常温下是液体,绝大多数金属都具有银白色金属光泽,但少数金属有特殊颜色,如Au呈金黄色,Cu呈红色,Cs略带金色等,C项错误;金属晶体能导电,但能导电的晶体不一定是金属晶体,如晶体硅(属于共价晶体)能导电,D项正确。
视角3金属晶体的性质
3.下列关于金属晶体的叙述不正确的是( )
A.常温下,金属单质不都以金属晶体形式存在
B.金属键在一定外力作用下,会因形变而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越弱
B
解析 常温下,Hg为液态,故A正确;金属键无方向性,故金属键在一定范围内不会因形变而消失,故B错误;钙的金属键强于钾,故熔、沸点高于钾,故C正确;温度升高,自由电子的能量增大,无规则运动加剧,影响了自由电子的定向移动,金属的导电性减弱,故D正确。
4.金属的下列性质中,不能用金属键解释的是( )
A.易传热 B.加工易变形但不碎
C.易锈蚀 D.有特殊的金属光泽
C
解析 金属晶体易传热是由于晶体内部自由电子与金属原子的碰撞,即能用金属键解释,故A正确;金属有延展性,加工易变形,发生形变时,自由电子仍然可以在金属阳离子之间流动,使金属不会断裂破碎,即能用金属键解释,故B正确;金属易锈蚀与金属晶体结构无关,与化学性质有关,金属的化学性质比较活泼,容易被空气中的氧气氧化,故C错误;自由电子很容易被激发,在吸收可见光以后,发生跃迁,成为高能态,然后又回到低能态,把多余的能量以可见光的形式释放出来,能用金属键解释,故D正确。
易错提醒 金属晶体性质的认识误区
(1)金属晶体在受外力作用下,各层之间发生相对滑动,但金属键并没有被破坏。
(2)共价晶体的熔点不一定都比金属晶体的高,如金属钨的熔点就高于一般的共价晶体。
(3)分子晶体的熔点不一定都比金属晶体的低,如汞在常温下是液体,熔点很低。
探究二 离子晶体的结构与性质
情境探究
材料1 已知MgO、NaCl、CsCl、CaCO3、(NH4)2SO4、CuSO4·5H2O、[Cu(NH3)4]SO4·H2O等均为离子晶体。
材料2 以下是八种物质的熔点
序号 ① ② ③ ④
物质 NaF NaCl NaBr NaI
熔点/℃ 993 801 747 661
序号 ⑤ ⑥ ⑦ ⑧
物质 MgO CaO SrO BaO
熔点/℃ 2 852 2 614 2 430 1 918
根据材料回答下列问题:
(1)离子晶体中一定含有金属元素吗 由金属元素和非金属元素组成的晶体一定是离子晶体吗
提示 不一定。离子晶体中不一定含金属元素,如NH4Cl、NH4NO3等铵盐。由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是分子晶体。
(2)离子晶体中可以有分子存在吗 离子晶体中除含有离子键外,是否还可能含有共价键、氢键、分子间作用力
提示 可以。离子晶体是由阴、阳离子通过离子键按一定的方式排列组合而成,阴、阳离子是其构成基本微粒,但是对于一些带结晶水的离子晶体如CuSO4·5H2O、[Cu(NH3)4]SO4·H2O等同时还存在小分子。因此离子晶体中一定有离子键,还有可能含有共价键、氢键、分子间作用力等作用。
(3)材料2①~④、⑤~⑧中物质的熔点为什么会逐渐降低
(4)材料2⑤~⑧中物质的熔点远高于①~④中物质的原因是什么
提示 ①~④均为离子晶体且离子所带电荷数相同,从F-→I-随着离子半径的增大,离子键减弱,熔点逐渐降低。⑤~⑧均为离子晶体且离子所带电荷数相同,从Mg2+→Ba2+随着离子半径的增大,离子键减弱,熔点逐渐降低。
提示 ①~⑧中的物质均为离子晶体,但⑤~⑧中物质的离子所带电荷数多于①~④中的物质的离子所带的电荷数,离子所带电荷数越多,离子键越强,熔点越高。
方法突破
离子晶体的结构与性质特点
名师点拨 离子晶体认识中的常见易错点
(1)NaCl、CsCl只表示晶体中阴、阳离子个数比,为化学式,不是分子式。
(2)离子晶体中一定有离子键,可能有共价键和氢键等,如KNO3等晶体中既有离子键又有共价键;CuSO4·5H2O中除含有离子键外,还含有共价键和氢键。
(3)离子晶体中,每一个阴(阳)离子周围排列的带相反电荷离子的数目是固定的,不是任意的。
应用体验
视角1离子晶体的结构和特征
1.关于离子晶体的下列说法正确的是( )
①离子晶体中的组成微粒是阴、阳离子
②离子晶体中微粒间的作用是离子键
③离子晶体中微粒间只存在异性电荷的互相吸引
④离子晶体中只存在离子键
A.只有①② B.只有①③
C.只有②③ D.只有③④
A
解析 离子晶体中的组成微粒只有阴、阳离子,故①正确;离子晶体中阴、阳离子间的静电作用称为离子键,故②正确;离子晶体中微粒间的作用包括吸引力和排斥力,故③错误;离子晶体中一定含有离子键,可能含有共价键等,如NaOH中既有离子键,又有共价键,故④错误。
视角2离子晶体的性质
2.下列有关离子晶体的数据大小比较不正确的是( )
A.离子键:NaF>NaCl>NaBr
B.硬度:MgO>CaO>BaO
C.熔点:NaF>MgF2>AlF3
D.1个阴离子周围等距离且最近的阳离子数:CsCl>NaCl
C
解析 离子半径越小,所带电荷数越多,离子键越强,F-、Cl-、Br-所带电荷数相等,离子半径Br->Cl->F-,故A正确;离子半径越大,键能越小,硬度越小,离子半径Ba2+>Ca2+>Mg2+,故B正确;离子半径Na+>Mg2+>Al3+,离子半径越小,电荷数越多,则熔点越高,故C错误;CsCl晶胞中1个Cl-周围等距离且最近的Cs+有8个;NaCl晶胞中1个Cl-周围等距离且最近的Na+有6个,故D正确。
思维建模 解答有关离子晶体性质比较问题的思维流程如下:
3.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C
解析 离子晶体中含有离子键,离子键在熔融状态下被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的依据。
归纳总结 离子晶体的判断
(1)根据物质的分类
大多数盐(包括铵盐)、强碱、活泼金属的氧化物和过氧化物(如Na2O和Na2O2)、部分氢化物(如NaH)、部分硫化物等都是离子晶体。
(2)根据元素的性质和种类
①根据电负性:如成键元素的电负性差值大于1.7的物质;
②根据元素在元素周期表中的位置:金属元素(如第ⅠA、ⅡA族元素等)与非金属元素(如第ⅥA、ⅦA族元素等)组成的化合物。
(3)根据物质的性质
离子晶体一般具有较高的熔、沸点,难挥发,硬而脆;固体不导电,但熔融状态或溶于水时能导电,大多数离子晶体易溶于极性溶剂而难溶于非极性溶剂。
本 课 结 束
