3.4 配合物与超分子课件(共42张PPT) 2023-2024学年高二化学人教版选择性必修2
文档属性
| 名称 | 3.4 配合物与超分子课件(共42张PPT) 2023-2024学年高二化学人教版选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 14:52:08 | ||
图片预览










文档简介
(共42张PPT)
第三章
第四节 配合物与超分子
素 养 目 标
1.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的典型性质及存在与应用,培养证据推理与模型认知的化学核心素养。
2.了解从原子、分子、超分子等不同尺度认识物质结构的意义,了解超分子的特征,认识化学技术和社会之间的相互关系,培养科学态度与社会责任的化学核心素养。
3.能举例说明结构研究对于发现、制备新物质的作用。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、配合物
1.配位键 实质上是一种特殊的共价键
成键的一方提供 而另一方接受孤电子对形成的共价键,即“电子对给予—接受”键被称为 。[Cu(H2O)4]2+可表示为
。
2.配合物
金属离子或原子(称为中心离子或原子)与某些 (称为配体或配位体)以 结合形成的化合物称为配位化合物,简称
。
孤电子对
配位键
分子或离子
配位键
配合物
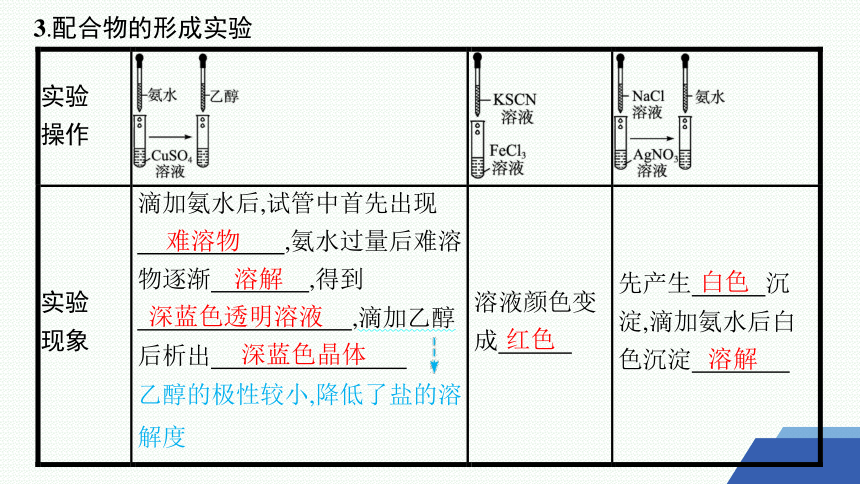
3.配合物的形成实验
难溶物
溶解
深蓝色透明溶液
深蓝色晶体
红色
白色
溶解
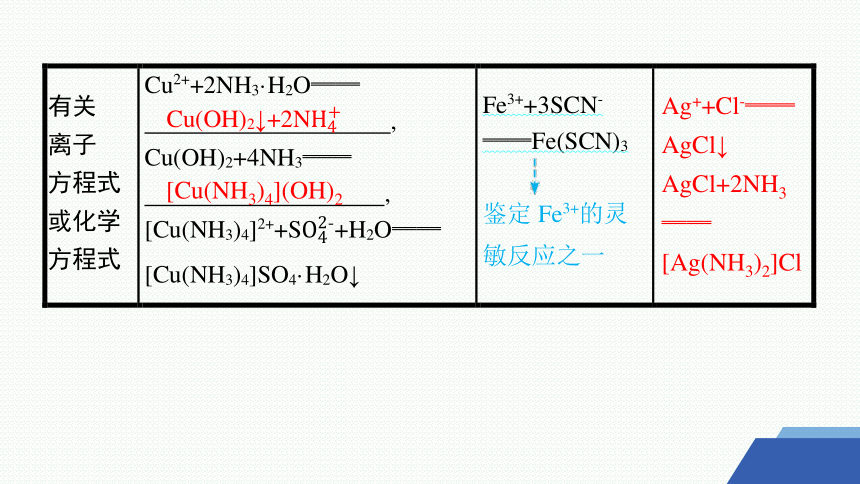
[Cu(NH3)4](OH)2
Ag++Cl-══
AgCl↓
AgCl+2NH3══
[Ag(NH3)2]Cl
4.配合物的用途
配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是 的配合物。配合物在生产和科学技术方面的应用也很广泛。
Fe2+
二、超分子 超分子是广义的,包括离子
1.定义
超分子是由 通过 形成的分子聚集体。
2.重要特征
和自组装。
两种或两种以上的分子
分子间相互作用
分子识别
3.超分子应用实例
(1)“杯酚” 。
将C60和C70的混合物加入一种空腔大小适配C60的“杯酚”中,得到超分子“杯酚”C60和C70;加入甲苯溶剂,甲苯将 溶解,经过滤后分离出 ;再向不溶物中加入氯仿,氯仿溶解“ ”而将不溶解的C60释放出来并沉淀,从而将C60和C70分离开来。
(2)冠醚 碱金属离子(如K+)。
冠醚分子中有不同大小的 适配不同大小的碱金属离子,而形成冠醚—碱金属离子超分子。
分离C60和C70
C70
C70
杯酚
识别
空穴
教材阅读
阅读本节教材的“资料卡片”,如图为卟啉配合物叶绿素的结构示意图:
思考:(1)叶绿素是配合物,中心离子是什么
(2)叶绿素的配体是N原子吗
(3)叶绿素是高分子化合物吗
提示 镁离子。
提示 不是。因氮原子还与碳原子成键,因此只能说氮原子是配位原子而不能说是配体。
提示 不是。该叶绿素是配合物,不是高分子化合物。
易错辨析1
(1)形成配位键的条件是一方有空轨道,另一方有孤电子对。( )
(2)配位化合物中的配体可以是分子也可以是阴离子。( )
(3)共价键的形成条件是成键原子必须有未成对电子。( )
(4)提供空轨道的只能是过渡元素的原子或离子。( )
提示 ×。H+也能提供空轨道。
易错辨析2
(1)分子形成超分子的作用力可能是分子间作用力。( )
(2)超分子具有分子识别的特性。( )
(3)超分子都是无限伸展的。( )
(4)冠醚是一种超分子,可以识别碱金属离子。( )
√
√
×
×
√
√
×
√
重难探究·能力素养全提升
探究一 配位键的特点及其对物质性质的影响
情境探究
观察下列固体和溶液的颜色,分析:
固体 固体颜色 溶液颜色
CuSO4 白色 蓝色
CuCl2·2H2O 绿色 蓝色
CuBr2 深褐色 蓝色
CuSO4·5H2O 蓝色 蓝色
NaCl 白色 无色
K2SO4 白色 无色
KBr 白色 无色
(1)分析为什么铜离子呈蓝色
提示 水溶液中Cu2+主要以水合离子[Cu(H2O)4]2+的形式存在,呈蓝色。
(2)依据电子式,讨论H2O与H+是如何形成H3O+的 类比H3O+,推测Cu2+与H2O是如何结合在一起形成[Cu(H2O)4]2+的
提示
(3)共价键有饱和性,NH3仍能与H+结合生成 ,分析其配位键的形成。
(4)NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子 你能写出NH3·BF3的结构式吗
提示 NH3有孤电子对,H+有空轨道,NH3中的孤电子对进入H+的空轨道,两者共用形成配位键。
提示 N原子提供孤电子对,B原子提供空轨道,NH3·BF3的结构式可表示为
。
方法突破
1.配位键及其形成条件
2.配位键的稳定性
(1)电子对给予体形成配位键的能力:NH3>H2O。
(2)电子对接受体形成配位键的能力:H+>过渡金属>主族金属。
(3)配位键越强,配合物越稳定。
如Cu2+—OH-应用体验
视角1配位键的形成
1.以下微粒含配位键的是( )
⑧[Ag(NH3)2]OH
A.①④⑤⑥⑦⑧ B.①②⑧
C.①③④⑤⑥⑦ D.全部
A
②CH4中4个H原子与C原子间形成共价单键,不存在配位键;
③OH-中O与H间形成共价键,不存在配位键;
⑤Fe(CO)5中配位体CO与中心原子Fe间形成配位键;⑥Fe(SCN)3中配位体SCN-与Fe3+间形成配位键;
⑦H3O+中有1个H+与O原子间形成配位键;
⑧[Ag(NH3)2]OH中配位体NH3与Ag+间形成配位键。
综合以上分析,①④⑤⑥⑦⑧中都存在配位键。
思维建模 解答有关配位键的理解和判断问题的思维流程如下:
【变式设问】
(1)写出 的结构式。
(2)[Ag(NH3)2]OH是强碱还是弱碱
提示 强碱。
2.下列不能形成配位键的组合是( )
A.Ag+ NH3 B.H2O H+
C.Co3+ CO D.Ag+ H+
D
解析 在A、B、C三项中,Ag+、H+、Co3+都能提供空轨道,而NH3、H2O、CO都能提供孤对电子,所以能形成配位键;D项中Ag+和H+都只能提供空轨道,无提供孤对电子的微粒,所以不能形成配位键。
视角2配位键和共价键的异同
3.如图为酞菁钴分子的结构简式。
下列说法不正确的是( )
A.电负性:N>C>H
B.4个N原子均与Co原子形成配位键
C.分子中C原子的杂化轨道类型为sp2
D.结构中存在σ键、π键
B
解析 同一周期元素从左往右电负性逐渐增强,碳元素的电负性大于氢元素的电负性,则电负性:N>C>H,故A正确;4个N原子中只有2个N原子形成3个σ键,可以提供孤电子对,与Co原子形成配位键,故B不正确;根据题给分子结构,碳氮键和苯环结构中,碳原子杂化轨道类型均为sp2,故C正确;酞菁钴分子结构中存在σ键、π键,故D正确。
易错提醒 配位键与共价键的区别与联系
①配位键一定是共价键,但共价键不一定是配位键。配位键与一般共价键只是在形成过程上有所不同:配位键的共用电子对是由某个原子单方面提供的,一般共价键的共用电子对是成键原子双方共同提供的。
②同共价键一样,配位键可以存在于分子中(如H2SO4),也可以存在于离子中(如 )。
探究二 配合物的组成与性质
情境探究
某兴趣小组在完成本节教材中【实验3-3】后,为研究反应后溶液中的微粒,设计并完成了下列实验:
试分析:
(1)已知CuSO4溶液中呈蓝色的物质是一种配离子,该配离子是什么 该配离子是怎样形成的 该配离子的中心离子、配体是什么 该配离子的配位数是多少
提示 蓝色的配离子是[Cu(H2O)4]2+。Cu2+提供空轨道,H2O中的O原子提供孤电子对,形成配位键:Cu2++4H2O→[ ]2+。中心离子是Cu2+,配体是H2O,配位数为4。
(2)已知CuSO4溶液中加入氨水后显示深蓝色是因为形成了一种配离子,该配离子是什么 该配离子是怎样形成的 该配离子的中心离子、配体是什么 该配离子的配位数是多少
提示 深蓝色的配离子是[Cu(NH3)4]2+。Cu2+提供空轨道,NH3中的N原子提
供孤电子对,形成配位键:Cu2++4NH3→[ ]2+。中心离子是
Cu2+,配体是NH3,配位数为4。
(3)向硫酸铜溶液中滴加氨水,为什么[Cu(H2O)4]2+转化为[Cu(NH3)4]2+呢
(4)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
提示 H2O、NH3同为中性分子,但电负性N提示 [Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。
方法突破
配合物的定义、组成和形成条件
应用体验
视角1配合物的组成
1.下列关于配位化合物的叙述不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的S原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
B
解析 配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
2.[2022吉林长春高二期末]某配合物的化学式为[TiCl(H2O)5]Cl2·H2O,下列说法中正确的是( )
A.配体是Cl-和H2O,配位数是8
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl-的数目比是1∶2
D.将1 mol该配合物加入足量AgNO3溶液中,可以得到3 mol AgCl沉淀
C
解析 对于配合物[TiCl(H2O)5]Cl2·H2O,中心离子是Ti3+,内界配体有1个Cl-和5个H2O分子,配位数是6,外界有2个Cl-,A、B错误,C正确;加入足量AgNO3溶液,只有外界的2个Cl-与Ag+反应生成AgCl沉淀,内界的1个Cl-不与Ag+反应,故1 mol该配合物只能生成2 mol AgCl沉淀,D错误。
思维建模 (1)解答有关配合物的组成和性质的思维流程:
(2)配合物中外界中的离子能电离出来,而内界中的离子不能电离出来。
【变式设问】
(1)[TiCl(H2O)5]Cl2·H2O在溶液中能电离出什么离子
(2)1 mol [TiCl(H2O)5]Cl2·H2O与足量AgNO3溶液反应,产生沉淀的物质的量是多少
提示 [TiCl(H2O)5]2+和Cl-。
提示 2 mol。
(3)1 mol [TiCl(H2O)5]2+含配位键和σ键的物质的量各是多少
提示 6 mol;16 mol。
视角2配合物的性质
3.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
B
解析 向CuSO4溶液中加入过量氨水发生的反应有CuSO4+2NH3·H2O══ Cu(OH)2↓+(NH4)2SO4,Cu(OH)2+4NH3══[Cu(NH3)4](OH)2,故A项不正确, B项正确;由于[Cu(NH3)4]2+在乙醇中的溶解度远小于在水中的溶解度,故加入乙醇会产生沉淀,C项不正确;在生成[Cu(NH3)4]2+过程中,Cu2+提供空轨道,NH3给出孤电子对,D项不正确。
4.已知NH3结合H+的能力比结合Ag+的能力更强,欲使银氨溶液{[Ag(NH3)2]OH}转化为Ag+,最合适的试剂是( )
A.稀盐酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液
C
解析 加酸中和OH-后,H+再与[Ag(NH3)2]+反应生成Ag+与 ,由于AgCl、Ag2SO4分别难溶和微溶于水,所以用稀硝酸最合适。
本 课 结 束
第三章
第四节 配合物与超分子
素 养 目 标
1.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的典型性质及存在与应用,培养证据推理与模型认知的化学核心素养。
2.了解从原子、分子、超分子等不同尺度认识物质结构的意义,了解超分子的特征,认识化学技术和社会之间的相互关系,培养科学态度与社会责任的化学核心素养。
3.能举例说明结构研究对于发现、制备新物质的作用。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、配合物
1.配位键 实质上是一种特殊的共价键
成键的一方提供 而另一方接受孤电子对形成的共价键,即“电子对给予—接受”键被称为 。[Cu(H2O)4]2+可表示为
。
2.配合物
金属离子或原子(称为中心离子或原子)与某些 (称为配体或配位体)以 结合形成的化合物称为配位化合物,简称
。
孤电子对
配位键
分子或离子
配位键
配合物
3.配合物的形成实验
难溶物
溶解
深蓝色透明溶液
深蓝色晶体
红色
白色
溶解
[Cu(NH3)4](OH)2
Ag++Cl-══
AgCl↓
AgCl+2NH3══
[Ag(NH3)2]Cl
4.配合物的用途
配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是 的配合物。配合物在生产和科学技术方面的应用也很广泛。
Fe2+
二、超分子 超分子是广义的,包括离子
1.定义
超分子是由 通过 形成的分子聚集体。
2.重要特征
和自组装。
两种或两种以上的分子
分子间相互作用
分子识别
3.超分子应用实例
(1)“杯酚” 。
将C60和C70的混合物加入一种空腔大小适配C60的“杯酚”中,得到超分子“杯酚”C60和C70;加入甲苯溶剂,甲苯将 溶解,经过滤后分离出 ;再向不溶物中加入氯仿,氯仿溶解“ ”而将不溶解的C60释放出来并沉淀,从而将C60和C70分离开来。
(2)冠醚 碱金属离子(如K+)。
冠醚分子中有不同大小的 适配不同大小的碱金属离子,而形成冠醚—碱金属离子超分子。
分离C60和C70
C70
C70
杯酚
识别
空穴
教材阅读
阅读本节教材的“资料卡片”,如图为卟啉配合物叶绿素的结构示意图:
思考:(1)叶绿素是配合物,中心离子是什么
(2)叶绿素的配体是N原子吗
(3)叶绿素是高分子化合物吗
提示 镁离子。
提示 不是。因氮原子还与碳原子成键,因此只能说氮原子是配位原子而不能说是配体。
提示 不是。该叶绿素是配合物,不是高分子化合物。
易错辨析1
(1)形成配位键的条件是一方有空轨道,另一方有孤电子对。( )
(2)配位化合物中的配体可以是分子也可以是阴离子。( )
(3)共价键的形成条件是成键原子必须有未成对电子。( )
(4)提供空轨道的只能是过渡元素的原子或离子。( )
提示 ×。H+也能提供空轨道。
易错辨析2
(1)分子形成超分子的作用力可能是分子间作用力。( )
(2)超分子具有分子识别的特性。( )
(3)超分子都是无限伸展的。( )
(4)冠醚是一种超分子,可以识别碱金属离子。( )
√
√
×
×
√
√
×
√
重难探究·能力素养全提升
探究一 配位键的特点及其对物质性质的影响
情境探究
观察下列固体和溶液的颜色,分析:
固体 固体颜色 溶液颜色
CuSO4 白色 蓝色
CuCl2·2H2O 绿色 蓝色
CuBr2 深褐色 蓝色
CuSO4·5H2O 蓝色 蓝色
NaCl 白色 无色
K2SO4 白色 无色
KBr 白色 无色
(1)分析为什么铜离子呈蓝色
提示 水溶液中Cu2+主要以水合离子[Cu(H2O)4]2+的形式存在,呈蓝色。
(2)依据电子式,讨论H2O与H+是如何形成H3O+的 类比H3O+,推测Cu2+与H2O是如何结合在一起形成[Cu(H2O)4]2+的
提示
(3)共价键有饱和性,NH3仍能与H+结合生成 ,分析其配位键的形成。
(4)NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子 你能写出NH3·BF3的结构式吗
提示 NH3有孤电子对,H+有空轨道,NH3中的孤电子对进入H+的空轨道,两者共用形成配位键。
提示 N原子提供孤电子对,B原子提供空轨道,NH3·BF3的结构式可表示为
。
方法突破
1.配位键及其形成条件
2.配位键的稳定性
(1)电子对给予体形成配位键的能力:NH3>H2O。
(2)电子对接受体形成配位键的能力:H+>过渡金属>主族金属。
(3)配位键越强,配合物越稳定。
如Cu2+—OH-
视角1配位键的形成
1.以下微粒含配位键的是( )
⑧[Ag(NH3)2]OH
A.①④⑤⑥⑦⑧ B.①②⑧
C.①③④⑤⑥⑦ D.全部
A
②CH4中4个H原子与C原子间形成共价单键,不存在配位键;
③OH-中O与H间形成共价键,不存在配位键;
⑤Fe(CO)5中配位体CO与中心原子Fe间形成配位键;⑥Fe(SCN)3中配位体SCN-与Fe3+间形成配位键;
⑦H3O+中有1个H+与O原子间形成配位键;
⑧[Ag(NH3)2]OH中配位体NH3与Ag+间形成配位键。
综合以上分析,①④⑤⑥⑦⑧中都存在配位键。
思维建模 解答有关配位键的理解和判断问题的思维流程如下:
【变式设问】
(1)写出 的结构式。
(2)[Ag(NH3)2]OH是强碱还是弱碱
提示 强碱。
2.下列不能形成配位键的组合是( )
A.Ag+ NH3 B.H2O H+
C.Co3+ CO D.Ag+ H+
D
解析 在A、B、C三项中,Ag+、H+、Co3+都能提供空轨道,而NH3、H2O、CO都能提供孤对电子,所以能形成配位键;D项中Ag+和H+都只能提供空轨道,无提供孤对电子的微粒,所以不能形成配位键。
视角2配位键和共价键的异同
3.如图为酞菁钴分子的结构简式。
下列说法不正确的是( )
A.电负性:N>C>H
B.4个N原子均与Co原子形成配位键
C.分子中C原子的杂化轨道类型为sp2
D.结构中存在σ键、π键
B
解析 同一周期元素从左往右电负性逐渐增强,碳元素的电负性大于氢元素的电负性,则电负性:N>C>H,故A正确;4个N原子中只有2个N原子形成3个σ键,可以提供孤电子对,与Co原子形成配位键,故B不正确;根据题给分子结构,碳氮键和苯环结构中,碳原子杂化轨道类型均为sp2,故C正确;酞菁钴分子结构中存在σ键、π键,故D正确。
易错提醒 配位键与共价键的区别与联系
①配位键一定是共价键,但共价键不一定是配位键。配位键与一般共价键只是在形成过程上有所不同:配位键的共用电子对是由某个原子单方面提供的,一般共价键的共用电子对是成键原子双方共同提供的。
②同共价键一样,配位键可以存在于分子中(如H2SO4),也可以存在于离子中(如 )。
探究二 配合物的组成与性质
情境探究
某兴趣小组在完成本节教材中【实验3-3】后,为研究反应后溶液中的微粒,设计并完成了下列实验:
试分析:
(1)已知CuSO4溶液中呈蓝色的物质是一种配离子,该配离子是什么 该配离子是怎样形成的 该配离子的中心离子、配体是什么 该配离子的配位数是多少
提示 蓝色的配离子是[Cu(H2O)4]2+。Cu2+提供空轨道,H2O中的O原子提供孤电子对,形成配位键:Cu2++4H2O→[ ]2+。中心离子是Cu2+,配体是H2O,配位数为4。
(2)已知CuSO4溶液中加入氨水后显示深蓝色是因为形成了一种配离子,该配离子是什么 该配离子是怎样形成的 该配离子的中心离子、配体是什么 该配离子的配位数是多少
提示 深蓝色的配离子是[Cu(NH3)4]2+。Cu2+提供空轨道,NH3中的N原子提
供孤电子对,形成配位键:Cu2++4NH3→[ ]2+。中心离子是
Cu2+,配体是NH3,配位数为4。
(3)向硫酸铜溶液中滴加氨水,为什么[Cu(H2O)4]2+转化为[Cu(NH3)4]2+呢
(4)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
提示 H2O、NH3同为中性分子,但电负性N
方法突破
配合物的定义、组成和形成条件
应用体验
视角1配合物的组成
1.下列关于配位化合物的叙述不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的S原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
B
解析 配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
2.[2022吉林长春高二期末]某配合物的化学式为[TiCl(H2O)5]Cl2·H2O,下列说法中正确的是( )
A.配体是Cl-和H2O,配位数是8
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl-的数目比是1∶2
D.将1 mol该配合物加入足量AgNO3溶液中,可以得到3 mol AgCl沉淀
C
解析 对于配合物[TiCl(H2O)5]Cl2·H2O,中心离子是Ti3+,内界配体有1个Cl-和5个H2O分子,配位数是6,外界有2个Cl-,A、B错误,C正确;加入足量AgNO3溶液,只有外界的2个Cl-与Ag+反应生成AgCl沉淀,内界的1个Cl-不与Ag+反应,故1 mol该配合物只能生成2 mol AgCl沉淀,D错误。
思维建模 (1)解答有关配合物的组成和性质的思维流程:
(2)配合物中外界中的离子能电离出来,而内界中的离子不能电离出来。
【变式设问】
(1)[TiCl(H2O)5]Cl2·H2O在溶液中能电离出什么离子
(2)1 mol [TiCl(H2O)5]Cl2·H2O与足量AgNO3溶液反应,产生沉淀的物质的量是多少
提示 [TiCl(H2O)5]2+和Cl-。
提示 2 mol。
(3)1 mol [TiCl(H2O)5]2+含配位键和σ键的物质的量各是多少
提示 6 mol;16 mol。
视角2配合物的性质
3.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
B
解析 向CuSO4溶液中加入过量氨水发生的反应有CuSO4+2NH3·H2O══ Cu(OH)2↓+(NH4)2SO4,Cu(OH)2+4NH3══[Cu(NH3)4](OH)2,故A项不正确, B项正确;由于[Cu(NH3)4]2+在乙醇中的溶解度远小于在水中的溶解度,故加入乙醇会产生沉淀,C项不正确;在生成[Cu(NH3)4]2+过程中,Cu2+提供空轨道,NH3给出孤电子对,D项不正确。
4.已知NH3结合H+的能力比结合Ag+的能力更强,欲使银氨溶液{[Ag(NH3)2]OH}转化为Ag+,最合适的试剂是( )
A.稀盐酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液
C
解析 加酸中和OH-后,H+再与[Ag(NH3)2]+反应生成Ag+与 ,由于AgCl、Ag2SO4分别难溶和微溶于水,所以用稀硝酸最合适。
本 课 结 束
