第3章 实验活动 简单配合物的形成课件(共10张PPT) 2023-2024学年高二化学人教版选择性必修2
文档属性
| 名称 | 第3章 实验活动 简单配合物的形成课件(共10张PPT) 2023-2024学年高二化学人教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 00:00:00 | ||
图片预览




文档简介
(共10张PPT)
第三章
实验活动 简单配合物的形成
【实验目的】
1.加深对配合物的认识。
2.了解配合物的形成。
【实验用品】
实验仪器:试管、胶头滴管;
实验试剂:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇、氯化钡溶液、氢氧化钠溶液、浓硝酸。
【实验过程和结论】
1.简单配合物的形成
序号 实验步骤 实验现象 解释
(1) 向盛有硫酸铜溶液的试管里加入氨水
继续加入氨水
再加入乙醇
形成难溶物
Cu2++2NH3·H2O══
难溶物溶解,得到深蓝色透明溶液
Cu(OH)2+4NH3══
[Cu(NH3)4]2++2OH-
析出深蓝色的晶体
乙醇的极性较小,降低了盐的溶解度
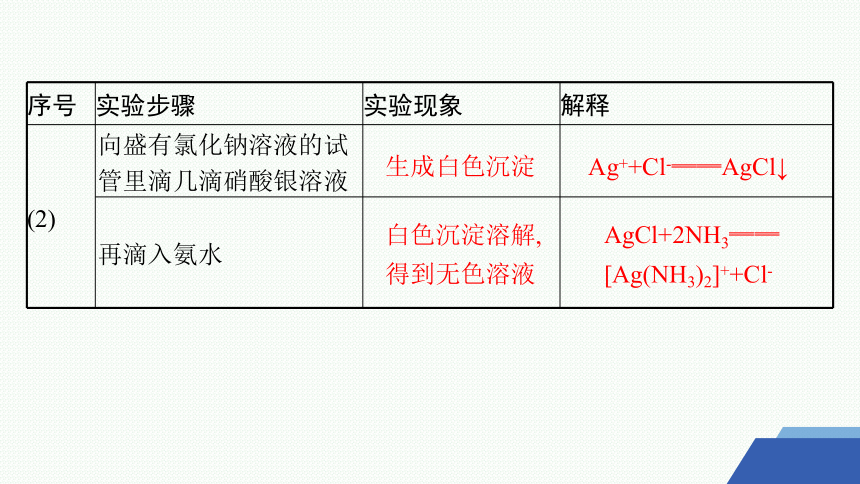
序号 实验步骤 实验现象 解释
(2) 向盛有氯化钠溶液的试管里滴几滴硝酸银溶液
再滴入氨水
生成白色沉淀
Ag++Cl-══AgCl↓
白色沉淀溶解,
得到无色溶液
AgCl+2NH3══
[Ag(NH3)2]++Cl-
2.简单离子与配离子的区别
实验步骤 实验现象 解释
(1)向盛有少量蒸馏水的试管里滴加2滴氯化铁溶液,然后再滴加2滴硫氰化钾溶液
(2)向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后再滴加2滴硫氰化钾溶液
溶液变红色
Fe3+可与SCN-形成
红色的配离子
无明显现象
K3[Fe(CN)6]与SCN-不能形成红色物质
【拓展实验】
配合物的性质
实验步骤 实验现象 解释
(1)将[Cu(NH3)4]SO4·H2O晶体溶于水中,均分为3份备用
(2)取一份加入BaCl2溶液
变成深蓝色溶液
深蓝色晶体溶解
瞬间生成白色沉淀
实验步骤 实验现象 解释
(3)取一份加入NaOH溶液
(4)取一份先加入浓硝酸, 然后加入NaOH溶液
无明显现象
溶液中无大量Cu2+
加入浓硝酸深蓝色变蓝色,加入NaOH溶液出现蓝色絮状沉淀
加入浓硝酸后,H+结合NH3生成 ,溶液中出现大量Cu2+,加入NaOH溶液生成Cu(OH)2
【问题讨论】
(1)写出[Cu(NH3)4]2+的结构式。
(2)K3[Fe(CN)6]在水中可电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体各是什么 配位数是多少 [Fe(CN)6]3-和Fe3+的性质一样吗
提示 [Fe(CN)6]3-的中心离子是Fe3+,配体是CN-;配位数是6;[Fe(CN)6]3-与Fe3+的性质不一样。
(3)写出[Cu(NH3)4]SO4在水中的电离方程式。
本 课 结 束
第三章
实验活动 简单配合物的形成
【实验目的】
1.加深对配合物的认识。
2.了解配合物的形成。
【实验用品】
实验仪器:试管、胶头滴管;
实验试剂:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇、氯化钡溶液、氢氧化钠溶液、浓硝酸。
【实验过程和结论】
1.简单配合物的形成
序号 实验步骤 实验现象 解释
(1) 向盛有硫酸铜溶液的试管里加入氨水
继续加入氨水
再加入乙醇
形成难溶物
Cu2++2NH3·H2O══
难溶物溶解,得到深蓝色透明溶液
Cu(OH)2+4NH3══
[Cu(NH3)4]2++2OH-
析出深蓝色的晶体
乙醇的极性较小,降低了盐的溶解度
序号 实验步骤 实验现象 解释
(2) 向盛有氯化钠溶液的试管里滴几滴硝酸银溶液
再滴入氨水
生成白色沉淀
Ag++Cl-══AgCl↓
白色沉淀溶解,
得到无色溶液
AgCl+2NH3══
[Ag(NH3)2]++Cl-
2.简单离子与配离子的区别
实验步骤 实验现象 解释
(1)向盛有少量蒸馏水的试管里滴加2滴氯化铁溶液,然后再滴加2滴硫氰化钾溶液
(2)向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后再滴加2滴硫氰化钾溶液
溶液变红色
Fe3+可与SCN-形成
红色的配离子
无明显现象
K3[Fe(CN)6]与SCN-不能形成红色物质
【拓展实验】
配合物的性质
实验步骤 实验现象 解释
(1)将[Cu(NH3)4]SO4·H2O晶体溶于水中,均分为3份备用
(2)取一份加入BaCl2溶液
变成深蓝色溶液
深蓝色晶体溶解
瞬间生成白色沉淀
实验步骤 实验现象 解释
(3)取一份加入NaOH溶液
(4)取一份先加入浓硝酸, 然后加入NaOH溶液
无明显现象
溶液中无大量Cu2+
加入浓硝酸深蓝色变蓝色,加入NaOH溶液出现蓝色絮状沉淀
加入浓硝酸后,H+结合NH3生成 ,溶液中出现大量Cu2+,加入NaOH溶液生成Cu(OH)2
【问题讨论】
(1)写出[Cu(NH3)4]2+的结构式。
(2)K3[Fe(CN)6]在水中可电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体各是什么 配位数是多少 [Fe(CN)6]3-和Fe3+的性质一样吗
提示 [Fe(CN)6]3-的中心离子是Fe3+,配体是CN-;配位数是6;[Fe(CN)6]3-与Fe3+的性质不一样。
(3)写出[Cu(NH3)4]SO4在水中的电离方程式。
本 课 结 束
