第一章 原子结构与性质 章末复习课课件(共21张PPT) 2023-2024学年高二化学人教版选择性必修2
文档属性
| 名称 | 第一章 原子结构与性质 章末复习课课件(共21张PPT) 2023-2024学年高二化学人教版选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 14:53:02 | ||
图片预览








文档简介
(共21张PPT)
章末复习课
考点一 原子(离子)核外电子排布式(图)的书写
例1 (1)[2022广东卷]硒(Se)是人体必需微量元素之一,Se与S同族,基态硒原子价层电子排布式为 。
(2)[2022湖南卷]铁和硒(Se)都是人体所必需的微量元素,基态Se原子的核外电子排布式为[Ar] 。
(3)[2022山东卷]研究笼形包合物结构和性质具有重要意义,某笼形包合物的化学式为Ni(CN)x·Zn(NH3)y·zC6H6,基态Ni原子的价层电子排布式为 ,在元素周期表中的位置为 。
答案 (1)4s24p4 (2)3d104s24p4 (3)3d84s2 第四周期第Ⅷ族
解析 (1)S属于第三周期第ⅥA族,价层电子排布式为3s23p4,硒位于第四周期第ⅥA族,则基态硒原子价层电子排布式为4s24p4。
(2)硒元素的原子序数为34,基态Se原子的核外电子排布式为[Ar]3d104s24p4。
(3)已知Ni是28号元素,故基态Ni原子的价层电子排布式为3d84s2,在元素周期表中位于第四周期第Ⅷ族。
归纳总结 核外电子排布的表示方法
原子(离 子)结构 示意图 含义 将每个能层上的电子总数表示在原子核外的图示
实例
电子排 布式 含义 用数字在能级符号右上角标明该能级上排布的电子数,并按照能层从左到右的顺序排列的式子
实例 K:1s22s22p63s23p64s1
简化电 子排 布式 含义 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体原子结构的部分以相应稀有气体元素符号外加方括号表示
实例 K:[Ar]4s1
价层电 子排 布式 含义 化学反应中可能发生电子变动的能级的电子排布式
注意区别价层电子排布式与最外层电子排布式,主族元素原子的价层电子排布式为最外层电子排布式,而副族元素原子的价层电子排布式与最外层电子排布式不同
实例 Al:3s23p1
轨道表示式(电子排布图) 含义 将每个原子轨道用一个方框(或圆圈)表示,在方框(或圆圈)内用箭头表示电子及其自旋状态,一个箭头代表一个电子
实例 Al:
电子式 含义 化学中常在元素符号周围用“·”或“×”来表示元素原子的最外层电子,相应的式子叫做电子式
实例
[针对训练1]
按要求回答下列各题。
(1)[2021湖南卷]基态硅原子最外层的电子排布图为 。
(2)[2021天津卷]基态Fe原子的价层电子排布式为 。
3d64s2
考点二 核外电子的运动状态的判断
例2 (1)[2022河北卷]基态S原子的价电子中,两种自旋状态的电子数之比为 。
(2)[2021全国乙卷]对于基态Cr原子,下列叙述正确的是 (填字母)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
(3)[2021山东卷]基态F原子核外电子的运动状态有 种。
答案 (1)2∶1(或1∶2) (2)A (3)9
解析 (1)基态S原子核外电子排布式为1s22s22p63s23p4,价层电子轨道表示式为 ,则两种自旋状态的电子数之比为2∶1(或1∶2)。(2)Cr是24号元素,基态Cr原子核外电子排布式为[Ar]3d54s1,3d和4s轨道均处于半充满状态,此时体系总能量低,A项正确;4s电子能量较高,但其并不总是在比3s电子离核更远的地方运动,B项错误。(3)基态F原子核外有9个电子,运动状态各不相同。
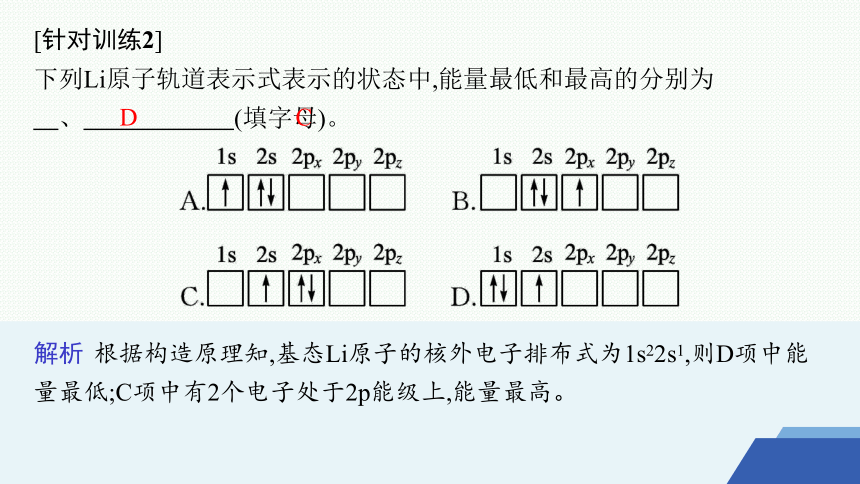
[针对训练2]
下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为 、 (填字母)。
解析 根据构造原理知,基态Li原子的核外电子排布式为1s22s1,则D项中能量最低;C项中有2个电子处于2p能级上,能量最高。
D
C
考点三 第一电离能的比较及其应用
例3 (1)[2022河北卷]Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(2)[2020全国甲卷]Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是 。
I1(Be)>I1(B)>I1(Li),原因是 。
I1/(kJ·mol-1)
Li 520 Be 900 B
801
Na 496 Mg 738 Al
578
答案 (1)Cu Cu的第一电离能比Zn的第一电离能小,但Cu失去1个电子后形成的Cu+的价层电子排布式为3d10,较难失去电子,Zn失去1个电子后形成的Zn+的价层电子排布式为3d104s1,较易失去1个电子达到稳定状态,Cu的第二电离能比Zn的第二电离能大
(2)Na与Li同主族,Na电子层数多,原子半径大,易失电子 Li、Be、B同周期,核电荷数依次增加。Be为1s22s2全充满稳定结构,第一电离能最大。与Li相比,B核电荷数大,原子半径小,较难失去电子,第一电离能较大
解析 (1)Cu的价层电子排布为3d104s1,易失去1个电子达到稳定状态,Zn的价层电子排布为3d104s2,4s轨道为全充满稳定状态,不易失去电子,故Cu的第一电离能比Zn的第一电离能小,Cu+的价层电子排布为3d10,Zn+的价层电子排布为3d104s1,Cu+的3d能级处于全充满状态,较稳定,Zn+失去4s能级上的1个电子可形成稳定结构,故Cu的第二电离能比Zn的第二电离能大,因此第二电离能与第一电离能差值更大的是Cu。
(2)同主族元素从上至下,原子核外的电子层数增多,原子半径增大,原子核对电子的吸引作用逐渐减小,元素第一电离能逐渐减小,所以I1(Li)>I1(Na);同周期元素从左至右,核电荷数依次增加,原子半径逐渐减小,越来越难失去电子,第一电离能呈现增大的趋势,但由于第ⅡA族元素基态原子ns轨道处于全充满的状态,能量更低,更稳定,所以其第一电离能大于同一周期的相邻元素,因此I1(Be)>I1(B)>I1(Li)。
归纳总结 解电离能及其应用类题的注意事项
1.同周期元素的第一电离能变化规律存在一些反常,这与它们的原子核外电子排布有关。当原子核外电子排布在能量相等的轨道(同一能级)上形成全空、半充满和全充满结构时,能量较低,原子较稳定,该元素具有较大的第一电离能。
2.应用逐级电离能数据解题时,要关注逐级电离能之间的差值,尤其是发生突变的电离能。同一元素的逐级电离能常用于判断元素(主要是主族元素)的化合价、所处的族序数及核外电子排布情况。
[针对训练3]
(高考组合)(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) (填“大于”或“小于”)I1(Cu)。原因是 。
(2)元素Mn与O中,第一电离能较大的是 。
(3)根据元素周期律,原子半径Ga (填“大于”或“小于”,下同)As,第一电离能Ga As。
(4)第一电离能介于B、N之间的第二周期元素有 种。
答案 (1)大于 Zn核外电子排布为全充满稳定结构,较难失去电子 (2)O (3)大于 小于 (4)3
解析 (1)基态Cu原子的价层电子排布式为3d104s1,4s轨道处于半充满状态,而Zn原子的4s轨道处于全充满状态,Zn原子更不易失去1个电子,所以Zn原子的第一电离能较大。(2)O是非金属元素,而Mn是金属元素,O易得电子而不易失电子,Mn则反之,所以O的第一电离能大于Mn的第一电离能。(3)同周期主族元素从左到右,原子半径逐渐减小,第一电离能总体呈增大趋势。Ga的原子半径大于As,Ga的第一电离能小于As。(4)同周期元素从左到右,第一电离能总体呈增大趋势,但由于氮原子的2p轨道处于半充满状态,较稳定,其第一电离能比氧的大,铍原子的2s轨道处于全充满状态,2p轨道处于全空状态,故铍的第一电离能比硼的大,所以第一电离能介于硼和氮之间的第二周期元素有铍、碳、氧3种。
考点四 电负性的比较及其应用
例4 (高考组合)(1)CaTiO3的组成元素的电负性大小顺序是 。
(2)NH4H2PO4中,电负性最高的元素是 。
(3)H、C、N的电负性由大到小的顺序为 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是 。
答案 (1)O>Ti>Ca (2)O (3)N>C>H (4)O>Ge>Zn
解析 (1)O为非金属元素,其电负性在三种元素中最大,Ca和Ti同为第四周期元素,金属性:Ca>Ti,故电负性:O>Ti>Ca。
(2)同周期主族元素从左到右,电负性逐渐增大,故O的电负性大于N;同主族元素从上到下,电负性逐渐减小,故N的电负性大于P,又H的电负性小于O,因此,NH4H2PO4中电负性最高的元素是O。
(3)H、C、N三种元素的电负性由大到小的顺序为N>C>H。
(4)Zn、Ge位于同一周期,同周期主族元素从左到右,电负性逐渐增大(稀有气体元素除外),而O是活泼非金属元素,电负性仅次于F,由此得出O、Ge、Zn的电负性依次减小。
误区警示 元素的电负性大小与元素原子得电子能力有关,与其最外层电子数多少无关;元素的电负性与元素的非金属性和金属性强弱相对应,一般来说,元素的电负性越大,非金属性越强,金属性越弱。
[针对训练4]
下列不能说明X的电负性比Y大的是( )
A.与氢化合时X单质比Y单质容易
B.X的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应的水化物的酸性强
C.X的单质可以把Y从其氢化物中置换出来
D.X原子的最外层电子数比Y原子最外层电子数多
D
解析 与氢化合时X单质比Y单质容易,则说明X的非金属性比Y的非金属性强,则X的电负性比Y的电负性大,故A不符合题意;X的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应的水化物的酸性强,则X的非金属性比Y的非金属性强,即X的电负性比Y的电负性大,故B不符合题意;X的单质可以把Y从其氢化物中置换出来说明X的非金属性比Y的非金属性强,即X的电负性比Y的电负性大,故C不符合题意;元素的电负性大小与元素原子最外层电子数多少无关,故D符合题意。
本 课 结 束
章末复习课
考点一 原子(离子)核外电子排布式(图)的书写
例1 (1)[2022广东卷]硒(Se)是人体必需微量元素之一,Se与S同族,基态硒原子价层电子排布式为 。
(2)[2022湖南卷]铁和硒(Se)都是人体所必需的微量元素,基态Se原子的核外电子排布式为[Ar] 。
(3)[2022山东卷]研究笼形包合物结构和性质具有重要意义,某笼形包合物的化学式为Ni(CN)x·Zn(NH3)y·zC6H6,基态Ni原子的价层电子排布式为 ,在元素周期表中的位置为 。
答案 (1)4s24p4 (2)3d104s24p4 (3)3d84s2 第四周期第Ⅷ族
解析 (1)S属于第三周期第ⅥA族,价层电子排布式为3s23p4,硒位于第四周期第ⅥA族,则基态硒原子价层电子排布式为4s24p4。
(2)硒元素的原子序数为34,基态Se原子的核外电子排布式为[Ar]3d104s24p4。
(3)已知Ni是28号元素,故基态Ni原子的价层电子排布式为3d84s2,在元素周期表中位于第四周期第Ⅷ族。
归纳总结 核外电子排布的表示方法
原子(离 子)结构 示意图 含义 将每个能层上的电子总数表示在原子核外的图示
实例
电子排 布式 含义 用数字在能级符号右上角标明该能级上排布的电子数,并按照能层从左到右的顺序排列的式子
实例 K:1s22s22p63s23p64s1
简化电 子排 布式 含义 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体原子结构的部分以相应稀有气体元素符号外加方括号表示
实例 K:[Ar]4s1
价层电 子排 布式 含义 化学反应中可能发生电子变动的能级的电子排布式
注意区别价层电子排布式与最外层电子排布式,主族元素原子的价层电子排布式为最外层电子排布式,而副族元素原子的价层电子排布式与最外层电子排布式不同
实例 Al:3s23p1
轨道表示式(电子排布图) 含义 将每个原子轨道用一个方框(或圆圈)表示,在方框(或圆圈)内用箭头表示电子及其自旋状态,一个箭头代表一个电子
实例 Al:
电子式 含义 化学中常在元素符号周围用“·”或“×”来表示元素原子的最外层电子,相应的式子叫做电子式
实例
[针对训练1]
按要求回答下列各题。
(1)[2021湖南卷]基态硅原子最外层的电子排布图为 。
(2)[2021天津卷]基态Fe原子的价层电子排布式为 。
3d64s2
考点二 核外电子的运动状态的判断
例2 (1)[2022河北卷]基态S原子的价电子中,两种自旋状态的电子数之比为 。
(2)[2021全国乙卷]对于基态Cr原子,下列叙述正确的是 (填字母)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
(3)[2021山东卷]基态F原子核外电子的运动状态有 种。
答案 (1)2∶1(或1∶2) (2)A (3)9
解析 (1)基态S原子核外电子排布式为1s22s22p63s23p4,价层电子轨道表示式为 ,则两种自旋状态的电子数之比为2∶1(或1∶2)。(2)Cr是24号元素,基态Cr原子核外电子排布式为[Ar]3d54s1,3d和4s轨道均处于半充满状态,此时体系总能量低,A项正确;4s电子能量较高,但其并不总是在比3s电子离核更远的地方运动,B项错误。(3)基态F原子核外有9个电子,运动状态各不相同。
[针对训练2]
下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为 、 (填字母)。
解析 根据构造原理知,基态Li原子的核外电子排布式为1s22s1,则D项中能量最低;C项中有2个电子处于2p能级上,能量最高。
D
C
考点三 第一电离能的比较及其应用
例3 (1)[2022河北卷]Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(2)[2020全国甲卷]Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是 。
I1(Be)>I1(B)>I1(Li),原因是 。
I1/(kJ·mol-1)
Li 520 Be 900 B
801
Na 496 Mg 738 Al
578
答案 (1)Cu Cu的第一电离能比Zn的第一电离能小,但Cu失去1个电子后形成的Cu+的价层电子排布式为3d10,较难失去电子,Zn失去1个电子后形成的Zn+的价层电子排布式为3d104s1,较易失去1个电子达到稳定状态,Cu的第二电离能比Zn的第二电离能大
(2)Na与Li同主族,Na电子层数多,原子半径大,易失电子 Li、Be、B同周期,核电荷数依次增加。Be为1s22s2全充满稳定结构,第一电离能最大。与Li相比,B核电荷数大,原子半径小,较难失去电子,第一电离能较大
解析 (1)Cu的价层电子排布为3d104s1,易失去1个电子达到稳定状态,Zn的价层电子排布为3d104s2,4s轨道为全充满稳定状态,不易失去电子,故Cu的第一电离能比Zn的第一电离能小,Cu+的价层电子排布为3d10,Zn+的价层电子排布为3d104s1,Cu+的3d能级处于全充满状态,较稳定,Zn+失去4s能级上的1个电子可形成稳定结构,故Cu的第二电离能比Zn的第二电离能大,因此第二电离能与第一电离能差值更大的是Cu。
(2)同主族元素从上至下,原子核外的电子层数增多,原子半径增大,原子核对电子的吸引作用逐渐减小,元素第一电离能逐渐减小,所以I1(Li)>I1(Na);同周期元素从左至右,核电荷数依次增加,原子半径逐渐减小,越来越难失去电子,第一电离能呈现增大的趋势,但由于第ⅡA族元素基态原子ns轨道处于全充满的状态,能量更低,更稳定,所以其第一电离能大于同一周期的相邻元素,因此I1(Be)>I1(B)>I1(Li)。
归纳总结 解电离能及其应用类题的注意事项
1.同周期元素的第一电离能变化规律存在一些反常,这与它们的原子核外电子排布有关。当原子核外电子排布在能量相等的轨道(同一能级)上形成全空、半充满和全充满结构时,能量较低,原子较稳定,该元素具有较大的第一电离能。
2.应用逐级电离能数据解题时,要关注逐级电离能之间的差值,尤其是发生突变的电离能。同一元素的逐级电离能常用于判断元素(主要是主族元素)的化合价、所处的族序数及核外电子排布情况。
[针对训练3]
(高考组合)(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) (填“大于”或“小于”)I1(Cu)。原因是 。
(2)元素Mn与O中,第一电离能较大的是 。
(3)根据元素周期律,原子半径Ga (填“大于”或“小于”,下同)As,第一电离能Ga As。
(4)第一电离能介于B、N之间的第二周期元素有 种。
答案 (1)大于 Zn核外电子排布为全充满稳定结构,较难失去电子 (2)O (3)大于 小于 (4)3
解析 (1)基态Cu原子的价层电子排布式为3d104s1,4s轨道处于半充满状态,而Zn原子的4s轨道处于全充满状态,Zn原子更不易失去1个电子,所以Zn原子的第一电离能较大。(2)O是非金属元素,而Mn是金属元素,O易得电子而不易失电子,Mn则反之,所以O的第一电离能大于Mn的第一电离能。(3)同周期主族元素从左到右,原子半径逐渐减小,第一电离能总体呈增大趋势。Ga的原子半径大于As,Ga的第一电离能小于As。(4)同周期元素从左到右,第一电离能总体呈增大趋势,但由于氮原子的2p轨道处于半充满状态,较稳定,其第一电离能比氧的大,铍原子的2s轨道处于全充满状态,2p轨道处于全空状态,故铍的第一电离能比硼的大,所以第一电离能介于硼和氮之间的第二周期元素有铍、碳、氧3种。
考点四 电负性的比较及其应用
例4 (高考组合)(1)CaTiO3的组成元素的电负性大小顺序是 。
(2)NH4H2PO4中,电负性最高的元素是 。
(3)H、C、N的电负性由大到小的顺序为 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是 。
答案 (1)O>Ti>Ca (2)O (3)N>C>H (4)O>Ge>Zn
解析 (1)O为非金属元素,其电负性在三种元素中最大,Ca和Ti同为第四周期元素,金属性:Ca>Ti,故电负性:O>Ti>Ca。
(2)同周期主族元素从左到右,电负性逐渐增大,故O的电负性大于N;同主族元素从上到下,电负性逐渐减小,故N的电负性大于P,又H的电负性小于O,因此,NH4H2PO4中电负性最高的元素是O。
(3)H、C、N三种元素的电负性由大到小的顺序为N>C>H。
(4)Zn、Ge位于同一周期,同周期主族元素从左到右,电负性逐渐增大(稀有气体元素除外),而O是活泼非金属元素,电负性仅次于F,由此得出O、Ge、Zn的电负性依次减小。
误区警示 元素的电负性大小与元素原子得电子能力有关,与其最外层电子数多少无关;元素的电负性与元素的非金属性和金属性强弱相对应,一般来说,元素的电负性越大,非金属性越强,金属性越弱。
[针对训练4]
下列不能说明X的电负性比Y大的是( )
A.与氢化合时X单质比Y单质容易
B.X的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应的水化物的酸性强
C.X的单质可以把Y从其氢化物中置换出来
D.X原子的最外层电子数比Y原子最外层电子数多
D
解析 与氢化合时X单质比Y单质容易,则说明X的非金属性比Y的非金属性强,则X的电负性比Y的电负性大,故A不符合题意;X的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应的水化物的酸性强,则X的非金属性比Y的非金属性强,即X的电负性比Y的电负性大,故B不符合题意;X的单质可以把Y从其氢化物中置换出来说明X的非金属性比Y的非金属性强,即X的电负性比Y的电负性大,故C不符合题意;元素的电负性大小与元素原子最外层电子数多少无关,故D符合题意。
本 课 结 束
