3.1.3铁盐和亚铁盐及其转化课件(共25张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.3铁盐和亚铁盐及其转化课件(共25张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 91.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-13 20:31:18 | ||
图片预览







文档简介
(共25张PPT)
3.1.3铁盐和亚铁盐及其转化
第三章 铁 金属材料
p70 资料卡片——人体中的铁元素
铁在成人体中的含量为4~5g,是人体必需微量元素中含量最多的一种。人体内的含铁化合物主要分为两类,即功能性铁和储存铁。功能性铁参与氧的运输,其余的铁与一些酶结合,分布于身体各器官。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。如果体内的铁不足以供给生命活动的需要,就会发生贫血。
为了满足生理需要,成人每天铁的适宜摄入量为15~20mg。动物内脏、肉类、鱼类、蛋类等动物性食物中的铁容易被吸收。一般蔬菜中铁的含量较少,吸收率也低,但我国膳食中一般食用蔬菜量很大,仍为铁的重要来源。我国已经实施在某些酱油中加入铁强化剂的措施,以减少缺铁性贫血问题的发生。
课堂导入
补铁是通过食物或专用营养剂为人体额外补充必须的、适量的无机铁或有机铁化合物,从而补充铁元素以达到强身健体、预防或辅助治疗疾病目的的过程。
补铁,铁元素的价态?
维C什么作用?
一.常见的铁盐和亚铁盐
FeSO4
Fe2(SO4)3
FeCl2
FeCl3
01
Fe2+:浅绿色 Fe3+:棕黄色
Fe2+ + 2OH-= Fe(OH)2↓
Fe3+ + 3OH- = Fe(OH)3↓
1.Fe3+、Fe2+的性质比较
【实验3-2】在两支试管中分别加入少量FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。
Fe3+ Fe2+
原溶液颜色 _____色 ___色
滴加KSCN溶液 溶液由黄色变______色 无明显现象
离子方程式 (反应原理) _________________________ 不反应
结论 利用含有Fe3+的盐溶液遇到KSCN溶液变成___色, 检验Fe3+的存在 2.Fe2+、Fe3+的检验
浅绿
黄
血红
Fe3++3SCN- = Fe(SCN)3
血红
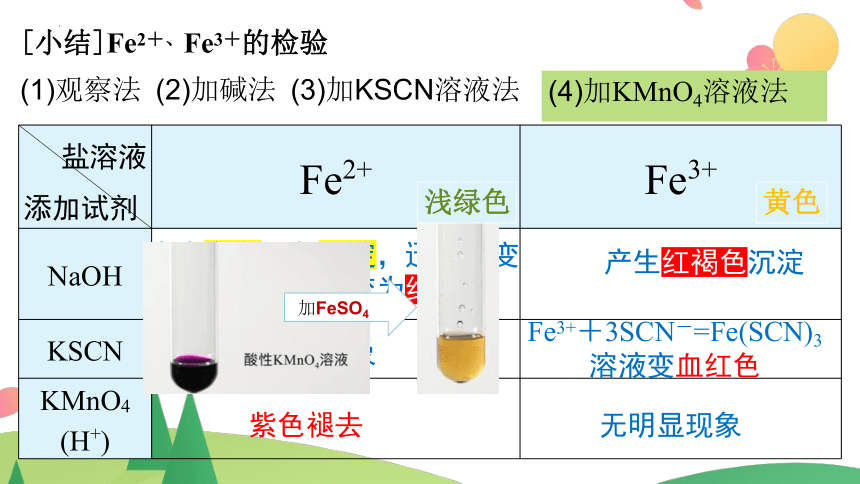
[小结]Fe2+、Fe3+的检验
(1)观察法 (2)加碱法 (3)加KSCN溶液法
盐溶液 添加试剂 Fe2+ Fe3+
NaOH
KSCN
KMnO4 (H+)
产生白色絮状沉淀,迅速转变为灰绿色,最终变为红褐色
产生红褐色沉淀
无明显现象
Fe3++3SCN-=Fe(SCN)3
溶液变血红色
紫色褪去
无明显现象
(4)加KMnO4溶液法
加FeSO4
黄色
浅绿色
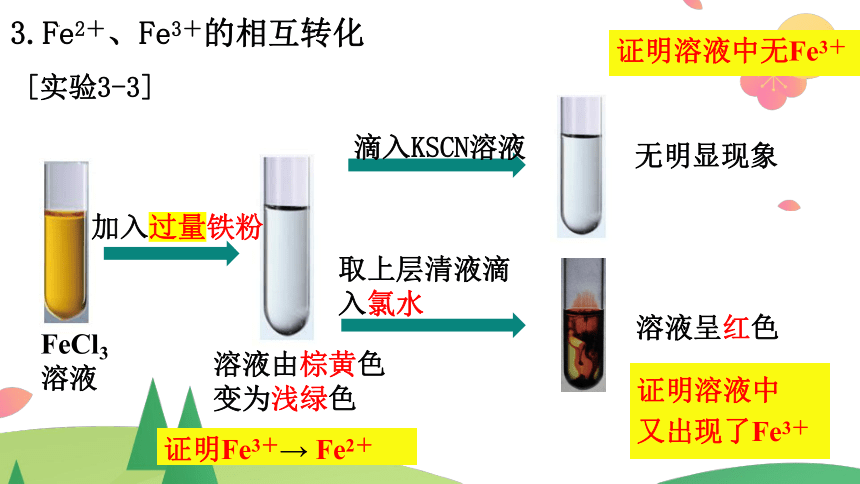
3.Fe2+、Fe3+的相互转化
[实验3-3]
3.Fe2+、Fe3+的相互转化
[实验3-3]
FeCl3溶液
加入过量铁粉
滴入KSCN溶液
取上层清液滴入氯水
溶液由棕黄色变为浅绿色
无明显现象
溶液呈红色
证明Fe3+→ Fe2+
证明溶液中无Fe3+
证明溶液中
又出现了Fe3+
3.Fe2+、Fe3+的相互转化
【实验3-3】
实验现象 溶液显_______,试管中有_________,再滴加KSCN溶液,溶液___________ 向上层溶液中滴加新制氯水,溶液变成_____
离子方程式 ___________________ ________________________
实验结论 Fe2+ Fe3+ 浅绿色
黑色固体
无明显变化
血红色
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
2Fe3++Fe=3Fe2+
Cl2
Fe粉
[对点训练]2.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是( )
A.先滴加氯水,再滴加硫氰化钾溶液后显红色
B.先滴加硫氰化钾溶液不显红色,再滴加氯水后显红色
C.先加入铁粉,再滴加硫氰化钾溶液不显红色
D.只需要滴加硫氰化钾溶液
B
溶液呈血红色
FeCl2溶液
加KSCN溶液
无明显现象
通Cl2或加氯水
可用来检验Fe2+
[迁移应用]
考点二. Fe2+与Fe3+的氧化性与还原性探究
[科学探究1]验证Fe3+的氧化性
[思考]可以选用什么试剂,实现Fe3+向Fe2+的转化?
[分析]请应用氧化还原反应的知识分析,Fe3+转化为Fe2+时,化合价_______,_____电子,Fe3+本身是_______(氧化剂或还原剂),需要加入_________(氧化剂或还原剂)。
常见的还原剂有:_________________________
FeCl3溶液
加入过量铁粉
滴入KSCN溶液
溶液由血红色变为浅绿色
溶液呈红色
铁粉
降低
得
氧化剂
还原剂
Fe、Cu、I-
[实验设计]
实验设计 需要的药品 实验现象及解释
取1毫升_________溶液于试管中,加入_____ 再加入________。 先观察到_______________,再观察到_________________________证明Fe3+已经__________成Fe2+(填被氧化或被还原)。
[科学探究1]验证Fe3+的氧化性
FeCl3
KSCN
Fe粉
FeCl3溶液、KSCN溶液、Fe粉
溶液变为血红色
溶液由血红色变为浅绿色
被还原
[结论]铁盐具有______________性。
氧化
考点二. Fe2+与Fe3+的氧化性与还原性探究
[科学探究2]验证Fe2+的还原性和氧化性
[思考1]可以选用什么试剂,实现Fe2+向Fe3+的转化?
[分析1]请应用氧化还原反应的知识分析,Fe2+转化为Fe3+时,化合价_____,___电子,Fe2+本身是 ______(氧化剂或还原剂),需要加入__________(氧化剂或还原剂)
常见的氧化剂有:_________________________
FeCl2溶液
滴入KSCN溶液
溶液呈红色
氯气
升高
失
还原剂
氧化剂
Cl2、HNO3、H2O2、KMnO4
[实验设计]
无明显现象
取上层清液滴入氯水
实验设计 需要的药品 实验现象及解释
取1毫升_________溶液于试管中,加入_____ 再加入________。 先观察到_______________,再观察到_________________________证明Fe2+已经__________成Fe3+(填被氧化或被还原)。
验证Fe2+的还原性
FeCl2
KSCN
氯水
FeCl2溶液、KSCN溶液、
氯水
溶液无明显现象
溶液由浅绿色变为血红色
被氧化
[思考2]可以选用什么试剂,实现Fe2+向Fe的转化?
[分析2]请应用氧化还原反应的知识分析,Fe2+转化为Fe时,化合价_______,_____电子,Fe2+本身是_______(氧化剂或还原剂),需要加入_________(氧化剂或还原剂)。
常见的还原剂有:_________________________
锌粉
降低
得
氧化剂
还原剂
Zn、CO、C、H2
[实验设计]
FeCl2溶液
Zn粉
溶液由浅绿色变为无色
实验设计 需要的药品 实验现象及解释
取1毫升_________溶液于试管中,加入_____ 观察到_____________________
证明Fe2+已经__________成Fe(填被氧化或被还原)。
验证Fe2+的氧化性
FeCl2
Zn粉
FeCl2溶液、Zn粉
溶液由浅绿色变为无色
被还原
[结论]亚铁盐(Fe2+)既有________性,又有________性
氧化
还原
[体系建模]铁三角
从化合价的角度——氧化性和还原性
Fe
Fe2+
Fe3+
还原剂 如Fe、 Cu、I- 、 S2-、H2S等
强氧化剂 如Cl2、H2O2、O2、HNO3、KMnO4等
弱氧化剂 如H+、Cu2+、Fe3+、S、I2 等
强还原剂 如Zn、Al、CO、H2等
强氧化剂 如Cl2、Br2、HNO3、浓硫酸等
强还原剂 如Al、CO、H2等
Fe、Fe3+与Fe2+的相互转化
[思考]3.实验室配制FeSO4溶液时加铁粉的作用是什么
防止亚铁离子被氧化,2Fe3+ + Fe = 3Fe2+
[对点训练]3.(2021山东济宁高一检测)下列溶液中,能使铁粉溶解,但不会产生沉淀和气体的是 ( )
A.稀H2SO4 B.CuSO4溶液
C.Fe2(SO4)3溶液 D.FeCl2溶液
C
4.部分含铁物质的分类与相应化合价的关系如图所示。下列说法错误的是( )
A.a可与e反应生成b
B.c在空气中可转化为d
C.可用KSCN溶液鉴别b、e
D.a在少量氯气中点燃可生成对应的盐b
D
5.下列试剂不能使Fe2+转化为Fe3+的是
①新制氯水 ②NaCl溶液
③酸性KMnO4溶液 ④H2O2溶液
⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④ C.②④⑤ D.②⑤⑥
D
①Fe2+与氧化性离子NO3-(H+)、ClO-、MnO4-;
②Fe3+与还原性离子S2-、I-、SO32-;
因发生氧化还原反应不能大量共存。
考点三 Fe3+、Fe2+离子共存问题
③Fe3+与SCN-发生络合反应不能大量共存
[思考]4.Fe2+与NO3-能否大量共存?若向其中再加入少量盐酸,情况又会如何?
[拓展]除杂
溶液 杂质 除杂方法 离子反应方程式
FeCl2 FeCl3
FeCl3 FeCl2
FeCl2 CuCl2
加足量氯水或H2O2溶液
加过量铁粉后过滤
加过量铁粉后过滤
2Fe3++Fe=3Fe2+
2Fe2++H2O2+2H+===2Fe3++2H2O
2Fe2++Cl2===2Fe3++2Cl-
Fe+Cu2+=Fe2++Cu
[课后达标]第7题
本课结束
3.1.3铁盐和亚铁盐及其转化
第三章 铁 金属材料
p70 资料卡片——人体中的铁元素
铁在成人体中的含量为4~5g,是人体必需微量元素中含量最多的一种。人体内的含铁化合物主要分为两类,即功能性铁和储存铁。功能性铁参与氧的运输,其余的铁与一些酶结合,分布于身体各器官。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。如果体内的铁不足以供给生命活动的需要,就会发生贫血。
为了满足生理需要,成人每天铁的适宜摄入量为15~20mg。动物内脏、肉类、鱼类、蛋类等动物性食物中的铁容易被吸收。一般蔬菜中铁的含量较少,吸收率也低,但我国膳食中一般食用蔬菜量很大,仍为铁的重要来源。我国已经实施在某些酱油中加入铁强化剂的措施,以减少缺铁性贫血问题的发生。
课堂导入
补铁是通过食物或专用营养剂为人体额外补充必须的、适量的无机铁或有机铁化合物,从而补充铁元素以达到强身健体、预防或辅助治疗疾病目的的过程。
补铁,铁元素的价态?
维C什么作用?
一.常见的铁盐和亚铁盐
FeSO4
Fe2(SO4)3
FeCl2
FeCl3
01
Fe2+:浅绿色 Fe3+:棕黄色
Fe2+ + 2OH-= Fe(OH)2↓
Fe3+ + 3OH- = Fe(OH)3↓
1.Fe3+、Fe2+的性质比较
【实验3-2】在两支试管中分别加入少量FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。
Fe3+ Fe2+
原溶液颜色 _____色 ___色
滴加KSCN溶液 溶液由黄色变______色 无明显现象
离子方程式 (反应原理) _________________________ 不反应
结论 利用含有Fe3+的盐溶液遇到KSCN溶液变成___色, 检验Fe3+的存在 2.Fe2+、Fe3+的检验
浅绿
黄
血红
Fe3++3SCN- = Fe(SCN)3
血红
[小结]Fe2+、Fe3+的检验
(1)观察法 (2)加碱法 (3)加KSCN溶液法
盐溶液 添加试剂 Fe2+ Fe3+
NaOH
KSCN
KMnO4 (H+)
产生白色絮状沉淀,迅速转变为灰绿色,最终变为红褐色
产生红褐色沉淀
无明显现象
Fe3++3SCN-=Fe(SCN)3
溶液变血红色
紫色褪去
无明显现象
(4)加KMnO4溶液法
加FeSO4
黄色
浅绿色
3.Fe2+、Fe3+的相互转化
[实验3-3]
3.Fe2+、Fe3+的相互转化
[实验3-3]
FeCl3溶液
加入过量铁粉
滴入KSCN溶液
取上层清液滴入氯水
溶液由棕黄色变为浅绿色
无明显现象
溶液呈红色
证明Fe3+→ Fe2+
证明溶液中无Fe3+
证明溶液中
又出现了Fe3+
3.Fe2+、Fe3+的相互转化
【实验3-3】
实验现象 溶液显_______,试管中有_________,再滴加KSCN溶液,溶液___________ 向上层溶液中滴加新制氯水,溶液变成_____
离子方程式 ___________________ ________________________
实验结论 Fe2+ Fe3+ 浅绿色
黑色固体
无明显变化
血红色
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
2Fe3++Fe=3Fe2+
Cl2
Fe粉
[对点训练]2.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是( )
A.先滴加氯水,再滴加硫氰化钾溶液后显红色
B.先滴加硫氰化钾溶液不显红色,再滴加氯水后显红色
C.先加入铁粉,再滴加硫氰化钾溶液不显红色
D.只需要滴加硫氰化钾溶液
B
溶液呈血红色
FeCl2溶液
加KSCN溶液
无明显现象
通Cl2或加氯水
可用来检验Fe2+
[迁移应用]
考点二. Fe2+与Fe3+的氧化性与还原性探究
[科学探究1]验证Fe3+的氧化性
[思考]可以选用什么试剂,实现Fe3+向Fe2+的转化?
[分析]请应用氧化还原反应的知识分析,Fe3+转化为Fe2+时,化合价_______,_____电子,Fe3+本身是_______(氧化剂或还原剂),需要加入_________(氧化剂或还原剂)。
常见的还原剂有:_________________________
FeCl3溶液
加入过量铁粉
滴入KSCN溶液
溶液由血红色变为浅绿色
溶液呈红色
铁粉
降低
得
氧化剂
还原剂
Fe、Cu、I-
[实验设计]
实验设计 需要的药品 实验现象及解释
取1毫升_________溶液于试管中,加入_____ 再加入________。 先观察到_______________,再观察到_________________________证明Fe3+已经__________成Fe2+(填被氧化或被还原)。
[科学探究1]验证Fe3+的氧化性
FeCl3
KSCN
Fe粉
FeCl3溶液、KSCN溶液、Fe粉
溶液变为血红色
溶液由血红色变为浅绿色
被还原
[结论]铁盐具有______________性。
氧化
考点二. Fe2+与Fe3+的氧化性与还原性探究
[科学探究2]验证Fe2+的还原性和氧化性
[思考1]可以选用什么试剂,实现Fe2+向Fe3+的转化?
[分析1]请应用氧化还原反应的知识分析,Fe2+转化为Fe3+时,化合价_____,___电子,Fe2+本身是 ______(氧化剂或还原剂),需要加入__________(氧化剂或还原剂)
常见的氧化剂有:_________________________
FeCl2溶液
滴入KSCN溶液
溶液呈红色
氯气
升高
失
还原剂
氧化剂
Cl2、HNO3、H2O2、KMnO4
[实验设计]
无明显现象
取上层清液滴入氯水
实验设计 需要的药品 实验现象及解释
取1毫升_________溶液于试管中,加入_____ 再加入________。 先观察到_______________,再观察到_________________________证明Fe2+已经__________成Fe3+(填被氧化或被还原)。
验证Fe2+的还原性
FeCl2
KSCN
氯水
FeCl2溶液、KSCN溶液、
氯水
溶液无明显现象
溶液由浅绿色变为血红色
被氧化
[思考2]可以选用什么试剂,实现Fe2+向Fe的转化?
[分析2]请应用氧化还原反应的知识分析,Fe2+转化为Fe时,化合价_______,_____电子,Fe2+本身是_______(氧化剂或还原剂),需要加入_________(氧化剂或还原剂)。
常见的还原剂有:_________________________
锌粉
降低
得
氧化剂
还原剂
Zn、CO、C、H2
[实验设计]
FeCl2溶液
Zn粉
溶液由浅绿色变为无色
实验设计 需要的药品 实验现象及解释
取1毫升_________溶液于试管中,加入_____ 观察到_____________________
证明Fe2+已经__________成Fe(填被氧化或被还原)。
验证Fe2+的氧化性
FeCl2
Zn粉
FeCl2溶液、Zn粉
溶液由浅绿色变为无色
被还原
[结论]亚铁盐(Fe2+)既有________性,又有________性
氧化
还原
[体系建模]铁三角
从化合价的角度——氧化性和还原性
Fe
Fe2+
Fe3+
还原剂 如Fe、 Cu、I- 、 S2-、H2S等
强氧化剂 如Cl2、H2O2、O2、HNO3、KMnO4等
弱氧化剂 如H+、Cu2+、Fe3+、S、I2 等
强还原剂 如Zn、Al、CO、H2等
强氧化剂 如Cl2、Br2、HNO3、浓硫酸等
强还原剂 如Al、CO、H2等
Fe、Fe3+与Fe2+的相互转化
[思考]3.实验室配制FeSO4溶液时加铁粉的作用是什么
防止亚铁离子被氧化,2Fe3+ + Fe = 3Fe2+
[对点训练]3.(2021山东济宁高一检测)下列溶液中,能使铁粉溶解,但不会产生沉淀和气体的是 ( )
A.稀H2SO4 B.CuSO4溶液
C.Fe2(SO4)3溶液 D.FeCl2溶液
C
4.部分含铁物质的分类与相应化合价的关系如图所示。下列说法错误的是( )
A.a可与e反应生成b
B.c在空气中可转化为d
C.可用KSCN溶液鉴别b、e
D.a在少量氯气中点燃可生成对应的盐b
D
5.下列试剂不能使Fe2+转化为Fe3+的是
①新制氯水 ②NaCl溶液
③酸性KMnO4溶液 ④H2O2溶液
⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④ C.②④⑤ D.②⑤⑥
D
①Fe2+与氧化性离子NO3-(H+)、ClO-、MnO4-;
②Fe3+与还原性离子S2-、I-、SO32-;
因发生氧化还原反应不能大量共存。
考点三 Fe3+、Fe2+离子共存问题
③Fe3+与SCN-发生络合反应不能大量共存
[思考]4.Fe2+与NO3-能否大量共存?若向其中再加入少量盐酸,情况又会如何?
[拓展]除杂
溶液 杂质 除杂方法 离子反应方程式
FeCl2 FeCl3
FeCl3 FeCl2
FeCl2 CuCl2
加足量氯水或H2O2溶液
加过量铁粉后过滤
加过量铁粉后过滤
2Fe3++Fe=3Fe2+
2Fe2++H2O2+2H+===2Fe3++2H2O
2Fe2++Cl2===2Fe3++2Cl-
Fe+Cu2+=Fe2++Cu
[课后达标]第7题
本课结束
