2023—2024学年鲁教版(五四学制)化学九年级全一册第四单元 金属 阶段性练习题(含答案)
文档属性
| 名称 | 2023—2024学年鲁教版(五四学制)化学九年级全一册第四单元 金属 阶段性练习题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 327.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-14 11:37:54 | ||
图片预览



文档简介
2023—2024学年鲁教版(五四学制)化学九年级全一册第4单元 金属 阶段性练习题有答案
第4单元 金属
一、选择题。
1、下列叙述错误的是( )
A.锰是非金属 B.锰具有导电性
C.锰钢是一种合金 D.锰钢属于金属材料
2、现有一包由2.4g镁、6.5g锌、1.6g碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是( )
A.10.5g B.35.6g C.44.8g D.45.8g
3、某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的( )
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
4、如图所示对应关系正确的是( )
A.
一定量的MgSO4溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液质量的关系
B.
相同质量的Mg、Fe分别与足量的同浓度稀硫酸反应,氢气的质量与反应时间的关系
C.
一定量的饱和石灰水中加入氧化钙,溶液中溶质质量与加入氧化钙质量的关系
D.
向氢氧化钠溶液中不断加水,溶液的pH与加入水的质量的关系
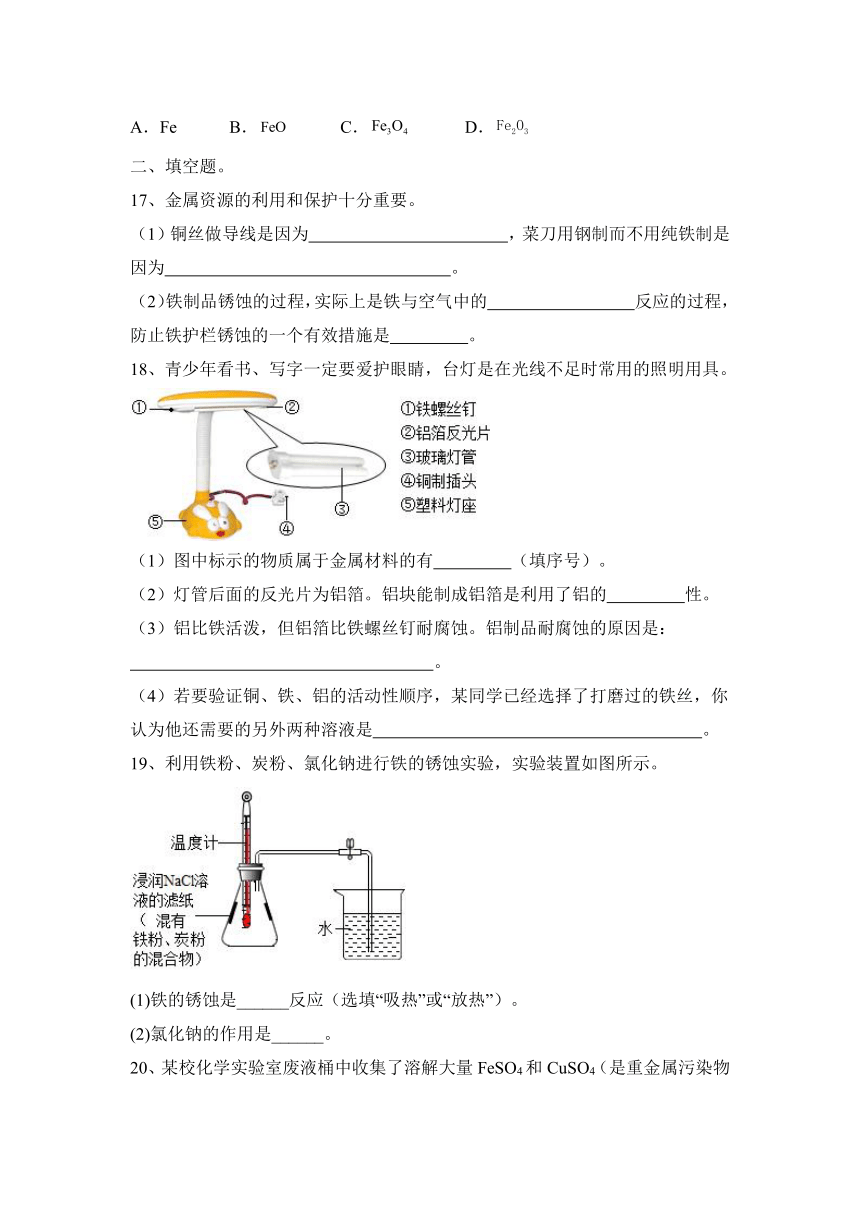
5、含杂质的Fe2O3固体样品20g,高温下用足量的CO完全还原(杂质不与CO反应),得剩余固体,并将生成的CO2气体用足量的澄清石灰水充分吸收后,产生30g白色沉淀。则下列说法不正确的是( )
A.通入CO质量大于8.4g B.反应后剩余固体质量为6.8g
C.样品中氧化铁的质量分数为80% D.上述反应过程中没有置换反应
6、某同学用如图装置进行CO与Fe2O3的反应,下列说法错误的是( )
A.反应后固体的颜色由红棕色变成了银白色
B.加热前应先通入一段时间的CO以排尽装置内的空气
C.NaOH溶液应改为Ca(OH)2溶液以检验产生的CO2气体
D.该实验装置应增加尾气处理装置
7、现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )
A.Cu>X>Y B.X>Cu>Y C.X>Y>Cu D.Y>X>Cu
8、下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
9、X、Y、Z是金属活动性顺序表里的三种金属,它们在溶液中能发生如下反应:
①X+YSO4==XSO4+Y ②Y+2ZNO3=Y(NO3)2+2Z
③X+H2SO4==XSO4+H2↑ ④Z与H2SO4不发生反应
则三种金属的活动性满足( )
A. X>Y>Z B. Z>Y>X C. Y>Z>X D. X>Z>Y
10、金属铜延展性好,导热性和导电性高,因此是电缆和电气、电子元件中最常见的材料,小雪同学将4.8g表面部分氧化为氧化铜的铜片,放入50g9.8%的稀硫酸中恰好完全反应,据此小雪推算该铜片氧化前的质量为( )
A.0.8g B.2.4g C.3.2g D.4.0g
11、我国第一个目标飞行器﹣﹣“天宫一号”与2011年11月3日凌晨顺利实现与神州八号飞船首次对接.“天宫一号”资源舱舱段使用了铝锂合金材料代替传统材料,从而为舱段减重10%.铝锂合金属于( )
A.天然材料 B.金属材料
C.有机合成材料 D.复合材料
12、某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
13、暖宝宝中的发热剂是铁粉、水和食盐等,用发热剂代替红磷测定空气中氧气含量,装置如图,以下对此改进实验的叙述错误的是( )
A.实验前要检查装置的气密性
B.此实验测出空气中氧气的质量分数约18%
C.此实验的原理是利用铁生锈消耗氧气
D.此实验必须到水不再流入左瓶才可获取进入广口瓶的水的体积
14、下面是某同学对课本中图表资料情况的叙述,其中不正确的是( )
A. 利用元素周期表,可直接查出元素的化合价
B. 根据溶解度曲线图,判断某物质在一定温度下的溶解度
C. 利用金属活动性顺序表,判断金属与盐酸是否发生置换反应
D. 根据酸、碱、盐的溶解性表,判断某些复分解反应能否发生
15、下列变化中,发生了化学变化的是( )
A.道路结冰 B.海水蒸发 C.钢铁生锈 D.工业制氧
*16、某只含铁、氧两种元素的样品X,高温下与足量的CO充分反应,生成的气体被足量氢氧化钙溶液吸收,测定沉淀的质量与原样品X质量相等。如果X中只含两种物质,则X中一定含有( )
A.Fe B. C. D.
二、填空题。
17、金属资源的利用和保护十分重要。
(1)铜丝做导线是因为 ,菜刀用钢制而不用纯铁制是因为 。
(2)铁制品锈蚀的过程,实际上是铁与空气中的 反应的过程,防止铁护栏锈蚀的一个有效措施是 。
18、青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。
(1)图中标示的物质属于金属材料的有 (填序号)。
(2)灯管后面的反光片为铝箔。铝块能制成铝箔是利用了铝的 性。
(3)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀。铝制品耐腐蚀的原因是:
。
(4)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是 。
19、利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如图所示。
(1)铁的锈蚀是______反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是______。
20、某校化学实验室废液桶中收集了溶解大量FeSO4和CuSO4(是重金属污染物之一)的废水,若直接排放到下水道既造成污染又造成浪费.某化学课外小组同学运用所学化学知识对废水进行处理,并回收硫酸亚铁晶体和铜,实验方案如下:
请回答:
①X是________ ,将其加入废水后发生反应的化学方程式为________ ;
②Y是________ ,利用其除去固体中的杂质。
21、某化学兴趣小组同学利用如图所给仪器和药品(金属片表面已经过打磨),验证 Al、Fe、Cu三种金属活动性的强弱顺序.
(1)金属片表面需经过打磨的原因是
(2)若他们仅通过改变依次插入这一支试管中三种金属片的顺序,设计了如下六种实验方案(假设每次反应中金属均过量,且反应充分进行)
①A1、Fe、Cu ②Al、Cu、Fe ③Fe、A1、Cu
④Fe、Cu、A1 ⑤Cu、Fe、A1 ⑥Cu、Al、Fe
其中能正确验证出三种金属活动性强弱顺序的实验方案有 (填序号)
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
四、实验题。
23、用如图所示装置(夹持装置已略去)分别进行实验。
(1)用装置A制备氧气.分液漏斗中盛放的药品是 ,反应的化学方程式是 。验证所得的气体是氧气的操作是 。
(2)用装置B进行性质实验。注入稀盐酸,试管内反应的化学方程式是:
。整个实验过程中,试管内产生大量气泡,固体减小,还能观察到的实验现象是 。
五、计算类综合题。
24、赤铁矿是炼铁的原料之一。
(1)赤铁矿外观为______色,其主要成分与铁锈相同,请列举一种防止铁生锈的措施_____ ,工业上用稀盐酸出去铁锈的方程式为____________________。
(2)工业上用含氧化铁800t的赤铁矿炼铁,理论上最终能得到多少纯铁?
( 方程式为:Fe2O3 + 3CO = 2Fe + 3CO2,条件略)
2023—2024学年鲁教版(五四学制)化学九年级全一册第4单元 金属 阶段性练习题有答案
第4单元 金属
一、选择题。
1、下列叙述错误的是( )
A.锰是非金属 B.锰具有导电性
C.锰钢是一种合金 D.锰钢属于金属材料
【答案】A
2、现有一包由2.4g镁、6.5g锌、1.6g碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是( )
A.10.5g B.35.6g C.44.8g D.45.8g
【答案】B
3、某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的( )
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
【答案】B
4、如图所示对应关系正确的是( )
A.
一定量的MgSO4溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液质量的关系
B.
相同质量的Mg、Fe分别与足量的同浓度稀硫酸反应,氢气的质量与反应时间的关系
C.
一定量的饱和石灰水中加入氧化钙,溶液中溶质质量与加入氧化钙质量的关系
D.
向氢氧化钠溶液中不断加水,溶液的pH与加入水的质量的关系
【答案】A
5、含杂质的Fe2O3固体样品20g,高温下用足量的CO完全还原(杂质不与CO反应),得剩余固体,并将生成的CO2气体用足量的澄清石灰水充分吸收后,产生30g白色沉淀。则下列说法不正确的是( )
A.通入CO质量大于8.4g B.反应后剩余固体质量为6.8g
C.样品中氧化铁的质量分数为80% D.上述反应过程中没有置换反应
【答案】B
6、某同学用如图装置进行CO与Fe2O3的反应,下列说法错误的是( )
A.反应后固体的颜色由红棕色变成了银白色
B.加热前应先通入一段时间的CO以排尽装置内的空气
C.NaOH溶液应改为Ca(OH)2溶液以检验产生的CO2气体
D.该实验装置应增加尾气处理装置
【答案】A
7、现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )
A.Cu>X>Y B.X>Cu>Y C.X>Y>Cu D.Y>X>Cu
【答案】B
8、下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
【答案】B
9、X、Y、Z是金属活动性顺序表里的三种金属,它们在溶液中能发生如下反应:
①X+YSO4==XSO4+Y ②Y+2ZNO3=Y(NO3)2+2Z
③X+H2SO4==XSO4+H2↑ ④Z与H2SO4不发生反应
则三种金属的活动性满足( )
A. X>Y>Z B. Z>Y>X C. Y>Z>X D. X>Z>Y
【答案】A
10、金属铜延展性好,导热性和导电性高,因此是电缆和电气、电子元件中最常见的材料,小雪同学将4.8g表面部分氧化为氧化铜的铜片,放入50g9.8%的稀硫酸中恰好完全反应,据此小雪推算该铜片氧化前的质量为( )
A.0.8g B.2.4g C.3.2g D.4.0g
【答案】D
11、我国第一个目标飞行器﹣﹣“天宫一号”与2011年11月3日凌晨顺利实现与神州八号飞船首次对接.“天宫一号”资源舱舱段使用了铝锂合金材料代替传统材料,从而为舱段减重10%.铝锂合金属于( )
A.天然材料 B.金属材料
C.有机合成材料 D.复合材料
【答案】B
12、某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
【答案】B
13、暖宝宝中的发热剂是铁粉、水和食盐等,用发热剂代替红磷测定空气中氧气含量,装置如图,以下对此改进实验的叙述错误的是( )
A.实验前要检查装置的气密性
B.此实验测出空气中氧气的质量分数约18%
C.此实验的原理是利用铁生锈消耗氧气
D.此实验必须到水不再流入左瓶才可获取进入广口瓶的水的体积
【答案】B
14、下面是某同学对课本中图表资料情况的叙述,其中不正确的是( )
A. 利用元素周期表,可直接查出元素的化合价
B. 根据溶解度曲线图,判断某物质在一定温度下的溶解度
C. 利用金属活动性顺序表,判断金属与盐酸是否发生置换反应
D. 根据酸、碱、盐的溶解性表,判断某些复分解反应能否发生
【答案】A
15、下列变化中,发生了化学变化的是( )
A.道路结冰 B.海水蒸发 C.钢铁生锈 D.工业制氧
【答案】C
*16、某只含铁、氧两种元素的样品X,高温下与足量的CO充分反应,生成的气体被足量氢氧化钙溶液吸收,测定沉淀的质量与原样品X质量相等。如果X中只含两种物质,则X中一定含有( )
A.Fe B. C. D.
【答案】A
二、填空题。
17、金属资源的利用和保护十分重要。
(1)铜丝做导线是因为 ,菜刀用钢制而不用纯铁制是因为 。
(2)铁制品锈蚀的过程,实际上是铁与空气中的 反应的过程,防止铁护栏锈蚀的一个有效措施是 。
【答案】(1)铜具有良好的导电性;钢的硬度和抗腐蚀性能都比铁强
(2)氧气和水蒸气;刷漆
18、青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。
(1)图中标示的物质属于金属材料的有 (填序号)。
(2)灯管后面的反光片为铝箔。铝块能制成铝箔是利用了铝的 性。
(3)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀。铝制品耐腐蚀的原因是:
。
(4)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是 。
【答案】(1)①②④ (2)延展
(3)铝与氧气反应表面形成致密氧化膜
(4)CuSO4和Al2(SO4)3或硫酸铜和硫酸铝(其他合理答案均可)
19、利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如图所示。
(1)铁的锈蚀是______反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是______。
【答案】(1)放热 (2)加快铁生锈
20、某校化学实验室废液桶中收集了溶解大量FeSO4和CuSO4(是重金属污染物之一)的废水,若直接排放到下水道既造成污染又造成浪费.某化学课外小组同学运用所学化学知识对废水进行处理,并回收硫酸亚铁晶体和铜,实验方案如下:
请回答:
①X是________ ,将其加入废水后发生反应的化学方程式为________ ;
②Y是________ ,利用其除去固体中的杂质。
【答案】Fe;Fe+CuSO4═Cu+FeSO4;H2SO4
21、某化学兴趣小组同学利用如图所给仪器和药品(金属片表面已经过打磨),验证 Al、Fe、Cu三种金属活动性的强弱顺序.
(1)金属片表面需经过打磨的原因是
(2)若他们仅通过改变依次插入这一支试管中三种金属片的顺序,设计了如下六种实验方案(假设每次反应中金属均过量,且反应充分进行)
①A1、Fe、Cu ②Al、Cu、Fe ③Fe、A1、Cu
④Fe、Cu、A1 ⑤Cu、Fe、A1 ⑥Cu、Al、Fe
其中能正确验证出三种金属活动性强弱顺序的实验方案有 (填序号)
【答案】除去表面的氧化物 ④⑤/⑤④
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
【答案】 (1) b (2)C
(3)锌比铁活泼,铁不能置换硫酸锌中的锌
稀盐酸 若产生气泡,则乙猜想正确,若不产生气泡,则甲猜想正确
Fe+2HCl===FeCl2+H2↑
(4)生成还原剂一氧化碳 反应Ⅰ和反应Ⅱ 400 t
四、实验题。
23、用如图所示装置(夹持装置已略去)分别进行实验。
(1)用装置A制备氧气.分液漏斗中盛放的药品是 ,反应的化学方程式是 。验证所得的气体是氧气的操作是 。
(2)用装置B进行性质实验。注入稀盐酸,试管内反应的化学方程式是:
。整个实验过程中,试管内产生大量气泡,固体减小,还能观察到的实验现象是 。
【答案】(1)过氧化氢溶液;2H2O22H2O+O2↑;
将带火星的木条放到K处
(2)Mg+2HCl═MgCl2+H2↑;烧杯中的导管口有气泡冒出,酚酞溶液变成红色,一段时间后烧杯中的液体倒吸
五、计算类综合题。
24、赤铁矿是炼铁的原料之一。
(1)赤铁矿外观为______色,其主要成分与铁锈相同,请列举一种防止铁生锈的措施_____ ,工业上用稀盐酸出去铁锈的方程式为____________________。
(2)工业上用含氧化铁800t的赤铁矿炼铁,理论上最终能得到多少纯铁?
( 方程式为:Fe2O3 + 3CO = 2Fe + 3CO2,条件略)
【答案】(1)红棕色;刷漆;Fe2O3 + 6HCl = 2FeCl3 + 3H2O (2)560t
第4单元 金属
一、选择题。
1、下列叙述错误的是( )
A.锰是非金属 B.锰具有导电性
C.锰钢是一种合金 D.锰钢属于金属材料
2、现有一包由2.4g镁、6.5g锌、1.6g碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是( )
A.10.5g B.35.6g C.44.8g D.45.8g
3、某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的( )
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
4、如图所示对应关系正确的是( )
A.
一定量的MgSO4溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液质量的关系
B.
相同质量的Mg、Fe分别与足量的同浓度稀硫酸反应,氢气的质量与反应时间的关系
C.
一定量的饱和石灰水中加入氧化钙,溶液中溶质质量与加入氧化钙质量的关系
D.
向氢氧化钠溶液中不断加水,溶液的pH与加入水的质量的关系
5、含杂质的Fe2O3固体样品20g,高温下用足量的CO完全还原(杂质不与CO反应),得剩余固体,并将生成的CO2气体用足量的澄清石灰水充分吸收后,产生30g白色沉淀。则下列说法不正确的是( )
A.通入CO质量大于8.4g B.反应后剩余固体质量为6.8g
C.样品中氧化铁的质量分数为80% D.上述反应过程中没有置换反应
6、某同学用如图装置进行CO与Fe2O3的反应,下列说法错误的是( )
A.反应后固体的颜色由红棕色变成了银白色
B.加热前应先通入一段时间的CO以排尽装置内的空气
C.NaOH溶液应改为Ca(OH)2溶液以检验产生的CO2气体
D.该实验装置应增加尾气处理装置
7、现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )
A.Cu>X>Y B.X>Cu>Y C.X>Y>Cu D.Y>X>Cu
8、下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
9、X、Y、Z是金属活动性顺序表里的三种金属,它们在溶液中能发生如下反应:
①X+YSO4==XSO4+Y ②Y+2ZNO3=Y(NO3)2+2Z
③X+H2SO4==XSO4+H2↑ ④Z与H2SO4不发生反应
则三种金属的活动性满足( )
A. X>Y>Z B. Z>Y>X C. Y>Z>X D. X>Z>Y
10、金属铜延展性好,导热性和导电性高,因此是电缆和电气、电子元件中最常见的材料,小雪同学将4.8g表面部分氧化为氧化铜的铜片,放入50g9.8%的稀硫酸中恰好完全反应,据此小雪推算该铜片氧化前的质量为( )
A.0.8g B.2.4g C.3.2g D.4.0g
11、我国第一个目标飞行器﹣﹣“天宫一号”与2011年11月3日凌晨顺利实现与神州八号飞船首次对接.“天宫一号”资源舱舱段使用了铝锂合金材料代替传统材料,从而为舱段减重10%.铝锂合金属于( )
A.天然材料 B.金属材料
C.有机合成材料 D.复合材料
12、某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
13、暖宝宝中的发热剂是铁粉、水和食盐等,用发热剂代替红磷测定空气中氧气含量,装置如图,以下对此改进实验的叙述错误的是( )
A.实验前要检查装置的气密性
B.此实验测出空气中氧气的质量分数约18%
C.此实验的原理是利用铁生锈消耗氧气
D.此实验必须到水不再流入左瓶才可获取进入广口瓶的水的体积
14、下面是某同学对课本中图表资料情况的叙述,其中不正确的是( )
A. 利用元素周期表,可直接查出元素的化合价
B. 根据溶解度曲线图,判断某物质在一定温度下的溶解度
C. 利用金属活动性顺序表,判断金属与盐酸是否发生置换反应
D. 根据酸、碱、盐的溶解性表,判断某些复分解反应能否发生
15、下列变化中,发生了化学变化的是( )
A.道路结冰 B.海水蒸发 C.钢铁生锈 D.工业制氧
*16、某只含铁、氧两种元素的样品X,高温下与足量的CO充分反应,生成的气体被足量氢氧化钙溶液吸收,测定沉淀的质量与原样品X质量相等。如果X中只含两种物质,则X中一定含有( )
A.Fe B. C. D.
二、填空题。
17、金属资源的利用和保护十分重要。
(1)铜丝做导线是因为 ,菜刀用钢制而不用纯铁制是因为 。
(2)铁制品锈蚀的过程,实际上是铁与空气中的 反应的过程,防止铁护栏锈蚀的一个有效措施是 。
18、青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。
(1)图中标示的物质属于金属材料的有 (填序号)。
(2)灯管后面的反光片为铝箔。铝块能制成铝箔是利用了铝的 性。
(3)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀。铝制品耐腐蚀的原因是:
。
(4)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是 。
19、利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如图所示。
(1)铁的锈蚀是______反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是______。
20、某校化学实验室废液桶中收集了溶解大量FeSO4和CuSO4(是重金属污染物之一)的废水,若直接排放到下水道既造成污染又造成浪费.某化学课外小组同学运用所学化学知识对废水进行处理,并回收硫酸亚铁晶体和铜,实验方案如下:
请回答:
①X是________ ,将其加入废水后发生反应的化学方程式为________ ;
②Y是________ ,利用其除去固体中的杂质。
21、某化学兴趣小组同学利用如图所给仪器和药品(金属片表面已经过打磨),验证 Al、Fe、Cu三种金属活动性的强弱顺序.
(1)金属片表面需经过打磨的原因是
(2)若他们仅通过改变依次插入这一支试管中三种金属片的顺序,设计了如下六种实验方案(假设每次反应中金属均过量,且反应充分进行)
①A1、Fe、Cu ②Al、Cu、Fe ③Fe、A1、Cu
④Fe、Cu、A1 ⑤Cu、Fe、A1 ⑥Cu、Al、Fe
其中能正确验证出三种金属活动性强弱顺序的实验方案有 (填序号)
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
四、实验题。
23、用如图所示装置(夹持装置已略去)分别进行实验。
(1)用装置A制备氧气.分液漏斗中盛放的药品是 ,反应的化学方程式是 。验证所得的气体是氧气的操作是 。
(2)用装置B进行性质实验。注入稀盐酸,试管内反应的化学方程式是:
。整个实验过程中,试管内产生大量气泡,固体减小,还能观察到的实验现象是 。
五、计算类综合题。
24、赤铁矿是炼铁的原料之一。
(1)赤铁矿外观为______色,其主要成分与铁锈相同,请列举一种防止铁生锈的措施_____ ,工业上用稀盐酸出去铁锈的方程式为____________________。
(2)工业上用含氧化铁800t的赤铁矿炼铁,理论上最终能得到多少纯铁?
( 方程式为:Fe2O3 + 3CO = 2Fe + 3CO2,条件略)
2023—2024学年鲁教版(五四学制)化学九年级全一册第4单元 金属 阶段性练习题有答案
第4单元 金属
一、选择题。
1、下列叙述错误的是( )
A.锰是非金属 B.锰具有导电性
C.锰钢是一种合金 D.锰钢属于金属材料
【答案】A
2、现有一包由2.4g镁、6.5g锌、1.6g碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是( )
A.10.5g B.35.6g C.44.8g D.45.8g
【答案】B
3、某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的( )
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
【答案】B
4、如图所示对应关系正确的是( )
A.
一定量的MgSO4溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液质量的关系
B.
相同质量的Mg、Fe分别与足量的同浓度稀硫酸反应,氢气的质量与反应时间的关系
C.
一定量的饱和石灰水中加入氧化钙,溶液中溶质质量与加入氧化钙质量的关系
D.
向氢氧化钠溶液中不断加水,溶液的pH与加入水的质量的关系
【答案】A
5、含杂质的Fe2O3固体样品20g,高温下用足量的CO完全还原(杂质不与CO反应),得剩余固体,并将生成的CO2气体用足量的澄清石灰水充分吸收后,产生30g白色沉淀。则下列说法不正确的是( )
A.通入CO质量大于8.4g B.反应后剩余固体质量为6.8g
C.样品中氧化铁的质量分数为80% D.上述反应过程中没有置换反应
【答案】B
6、某同学用如图装置进行CO与Fe2O3的反应,下列说法错误的是( )
A.反应后固体的颜色由红棕色变成了银白色
B.加热前应先通入一段时间的CO以排尽装置内的空气
C.NaOH溶液应改为Ca(OH)2溶液以检验产生的CO2气体
D.该实验装置应增加尾气处理装置
【答案】A
7、现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )
A.Cu>X>Y B.X>Cu>Y C.X>Y>Cu D.Y>X>Cu
【答案】B
8、下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
【答案】B
9、X、Y、Z是金属活动性顺序表里的三种金属,它们在溶液中能发生如下反应:
①X+YSO4==XSO4+Y ②Y+2ZNO3=Y(NO3)2+2Z
③X+H2SO4==XSO4+H2↑ ④Z与H2SO4不发生反应
则三种金属的活动性满足( )
A. X>Y>Z B. Z>Y>X C. Y>Z>X D. X>Z>Y
【答案】A
10、金属铜延展性好,导热性和导电性高,因此是电缆和电气、电子元件中最常见的材料,小雪同学将4.8g表面部分氧化为氧化铜的铜片,放入50g9.8%的稀硫酸中恰好完全反应,据此小雪推算该铜片氧化前的质量为( )
A.0.8g B.2.4g C.3.2g D.4.0g
【答案】D
11、我国第一个目标飞行器﹣﹣“天宫一号”与2011年11月3日凌晨顺利实现与神州八号飞船首次对接.“天宫一号”资源舱舱段使用了铝锂合金材料代替传统材料,从而为舱段减重10%.铝锂合金属于( )
A.天然材料 B.金属材料
C.有机合成材料 D.复合材料
【答案】B
12、某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
【答案】B
13、暖宝宝中的发热剂是铁粉、水和食盐等,用发热剂代替红磷测定空气中氧气含量,装置如图,以下对此改进实验的叙述错误的是( )
A.实验前要检查装置的气密性
B.此实验测出空气中氧气的质量分数约18%
C.此实验的原理是利用铁生锈消耗氧气
D.此实验必须到水不再流入左瓶才可获取进入广口瓶的水的体积
【答案】B
14、下面是某同学对课本中图表资料情况的叙述,其中不正确的是( )
A. 利用元素周期表,可直接查出元素的化合价
B. 根据溶解度曲线图,判断某物质在一定温度下的溶解度
C. 利用金属活动性顺序表,判断金属与盐酸是否发生置换反应
D. 根据酸、碱、盐的溶解性表,判断某些复分解反应能否发生
【答案】A
15、下列变化中,发生了化学变化的是( )
A.道路结冰 B.海水蒸发 C.钢铁生锈 D.工业制氧
【答案】C
*16、某只含铁、氧两种元素的样品X,高温下与足量的CO充分反应,生成的气体被足量氢氧化钙溶液吸收,测定沉淀的质量与原样品X质量相等。如果X中只含两种物质,则X中一定含有( )
A.Fe B. C. D.
【答案】A
二、填空题。
17、金属资源的利用和保护十分重要。
(1)铜丝做导线是因为 ,菜刀用钢制而不用纯铁制是因为 。
(2)铁制品锈蚀的过程,实际上是铁与空气中的 反应的过程,防止铁护栏锈蚀的一个有效措施是 。
【答案】(1)铜具有良好的导电性;钢的硬度和抗腐蚀性能都比铁强
(2)氧气和水蒸气;刷漆
18、青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。
(1)图中标示的物质属于金属材料的有 (填序号)。
(2)灯管后面的反光片为铝箔。铝块能制成铝箔是利用了铝的 性。
(3)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀。铝制品耐腐蚀的原因是:
。
(4)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是 。
【答案】(1)①②④ (2)延展
(3)铝与氧气反应表面形成致密氧化膜
(4)CuSO4和Al2(SO4)3或硫酸铜和硫酸铝(其他合理答案均可)
19、利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如图所示。
(1)铁的锈蚀是______反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是______。
【答案】(1)放热 (2)加快铁生锈
20、某校化学实验室废液桶中收集了溶解大量FeSO4和CuSO4(是重金属污染物之一)的废水,若直接排放到下水道既造成污染又造成浪费.某化学课外小组同学运用所学化学知识对废水进行处理,并回收硫酸亚铁晶体和铜,实验方案如下:
请回答:
①X是________ ,将其加入废水后发生反应的化学方程式为________ ;
②Y是________ ,利用其除去固体中的杂质。
【答案】Fe;Fe+CuSO4═Cu+FeSO4;H2SO4
21、某化学兴趣小组同学利用如图所给仪器和药品(金属片表面已经过打磨),验证 Al、Fe、Cu三种金属活动性的强弱顺序.
(1)金属片表面需经过打磨的原因是
(2)若他们仅通过改变依次插入这一支试管中三种金属片的顺序,设计了如下六种实验方案(假设每次反应中金属均过量,且反应充分进行)
①A1、Fe、Cu ②Al、Cu、Fe ③Fe、A1、Cu
④Fe、Cu、A1 ⑤Cu、Fe、A1 ⑥Cu、Al、Fe
其中能正确验证出三种金属活动性强弱顺序的实验方案有 (填序号)
【答案】除去表面的氧化物 ④⑤/⑤④
三、综合题。
22、金属与人类的生活和生产密切相关。
(1)图1为放置在空气中的铁锅,其中最容易生锈的部位是________(填字母代号)。
(2)图2为元素周期表中的一格,下列说法不正确的是________。
A.铝是地壳中含量最多的金属元素
B.铝原子的核外电子数为13
C.铝元素的原子结构示意图为
D.铝元素的相对原子质量为26.98
(3)在研究金属性质时,某小组同学进行了如下实验探究:将一定量铁粉加入到硫酸锌和硫酸铜的混合溶液中,充分反应后过滤,然后对滤纸上的物质进行分析和实验。
【提出问题】滤纸上的物质是什么?
【做出猜想】甲认为只有铜;乙认为是铜和铁的混合物;丙认为是铜、铁、锌的混合物。
【交流讨论】大家一致认为丙的猜想不合理,其理由是____________________。
【实验与结论】同学们通过实验确定了滤纸上物质的成分,请填写下表空白。
实验步骤 现象和结论 有关反应的化学方程式
取少量滤纸上剩余的物质于试管中,向其中滴加适量的________ ____________________ ___________________
(4)钢铁是人类生活和生产中非常重要的材料。
①工业炼铁的反应过程如图3所示。其中焦炭的作用是_____________________;属于化合反应的是________________。
②在工业冶炼中要得到224 t铁,理论上需要含Fe2O380%的赤铁矿石的质量是__________。
【答案】 (1) b (2)C
(3)锌比铁活泼,铁不能置换硫酸锌中的锌
稀盐酸 若产生气泡,则乙猜想正确,若不产生气泡,则甲猜想正确
Fe+2HCl===FeCl2+H2↑
(4)生成还原剂一氧化碳 反应Ⅰ和反应Ⅱ 400 t
四、实验题。
23、用如图所示装置(夹持装置已略去)分别进行实验。
(1)用装置A制备氧气.分液漏斗中盛放的药品是 ,反应的化学方程式是 。验证所得的气体是氧气的操作是 。
(2)用装置B进行性质实验。注入稀盐酸,试管内反应的化学方程式是:
。整个实验过程中,试管内产生大量气泡,固体减小,还能观察到的实验现象是 。
【答案】(1)过氧化氢溶液;2H2O22H2O+O2↑;
将带火星的木条放到K处
(2)Mg+2HCl═MgCl2+H2↑;烧杯中的导管口有气泡冒出,酚酞溶液变成红色,一段时间后烧杯中的液体倒吸
五、计算类综合题。
24、赤铁矿是炼铁的原料之一。
(1)赤铁矿外观为______色,其主要成分与铁锈相同,请列举一种防止铁生锈的措施_____ ,工业上用稀盐酸出去铁锈的方程式为____________________。
(2)工业上用含氧化铁800t的赤铁矿炼铁,理论上最终能得到多少纯铁?
( 方程式为:Fe2O3 + 3CO = 2Fe + 3CO2,条件略)
【答案】(1)红棕色;刷漆;Fe2O3 + 6HCl = 2FeCl3 + 3H2O (2)560t
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
