2023—2024学年人教版(五四学制)化学九年级全一册第3单元 酸和碱 期中复习评估(含答案)
文档属性
| 名称 | 2023—2024学年人教版(五四学制)化学九年级全一册第3单元 酸和碱 期中复习评估(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 761.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-14 16:04:43 | ||
图片预览



文档简介
2023—2024学年人教版(五四学制)化学九年级全一册第3单元 酸和碱 期中复习评估(含答案)
人教版(五四学制)第3单元 酸和碱
一、选择题。
1、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
2、硼酸常用于治疗小儿湿疹。如图是硼元素在元素周期表中的相关信息。下列关于硼元素的说法中正确的是( )
A.相对原子质量为10.81g B.属于金属元素
C.原子的核电荷数为5 D.原子核外有6个电子
3、下列物质必须密封保存的是( )
A. 木炭 B. 浓盐酸 C. 石灰石 D. 氯化钠
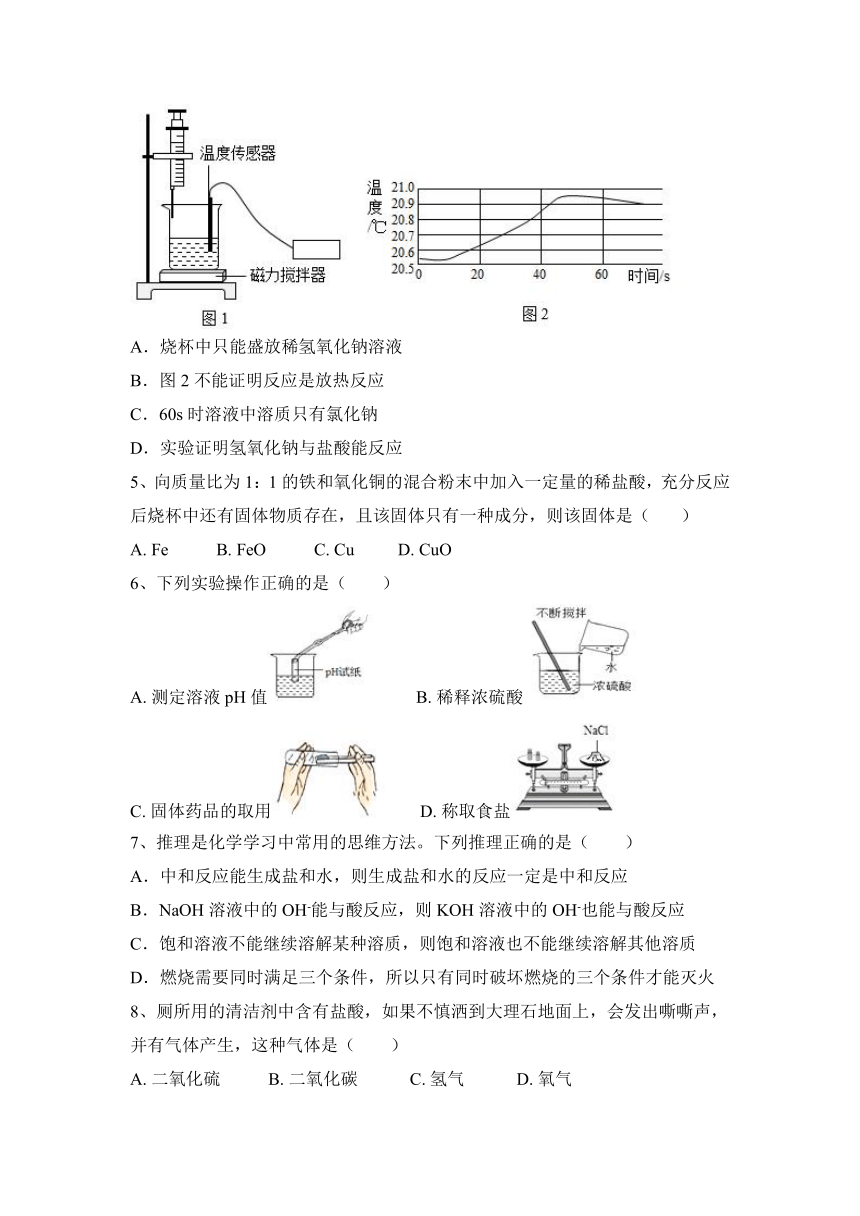
4、实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
5、向质量比为1:1的铁和氧化铜的混合粉末中加入一定量的稀盐酸,充分反应后烧杯中还有固体物质存在,且该固体只有一种成分,则该固体是( )
A. Fe B. FeO C. Cu D. CuO
6、下列实验操作正确的是( )
A. 测定溶液pH值 B. 稀释浓硫酸
C. 固体药品的取用 D. 称取食盐
7、推理是化学学习中常用的思维方法。下列推理正确的是( )
A.中和反应能生成盐和水,则生成盐和水的反应一定是中和反应
B.NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应
C.饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
D.燃烧需要同时满足三个条件,所以只有同时破坏燃烧的三个条件才能灭火
8、厕所用的清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生,这种气体是( )
A. 二氧化硫 B. 二氧化碳 C. 氢气 D. 氧气
9、下列关于氢氧化钠的描述中错误的是( )
A.易与空气中成分反应而变质
B.蚊虫叮咬后涂抹NaOH溶液减轻痛痒
C.能去除油污可作炉具清洁剂
D.NaOH水溶液能使紫色石蕊溶液变蓝
10、下列物质分别放入水里,滴加无色酚酞试液能变红的是( )
A. 生石灰 B. 食盐 C. 硫酸铜 D. 氢氧化铜
11、下列叙述中正确的是( )
A. 能使石蕊试液变蓝的溶液一定是碱溶液
B. 可用酚酞试液鉴别酸性溶液和中性溶液
C. pH小于7的溶液是酸的溶液
D. 碱溶液一定是碱性溶液
12、对下列事实的微观解释正确的是( )
选项 事实 解释
A 稀盐酸、稀硫酸均显酸性 溶液中都含有氢元素
B 氢氧化钠溶液能导电 溶液中存在自由移动的离子
C 金刚石和石墨的性质存在着明显差异 碳原子结构不同
D 压缩的乒乓球放入热水中重新鼓起 乒乓球内每个分子的体积都增大
A.A B.B C.C D.D
13、氢氧化钙的俗称是( )
A. 生石灰 B. 熟石灰 C. 食盐 D. 大理石
14、下列化学方程式书写完全正确的是( )
A.2S + 3O22SO3
B.HgOHg + O2↑
C.2NaOH + H2SO4=Na2SO4 + 2H2O
D.CuSO4 + 2NaOH=Na2SO4 + Cu(OH)2
15、某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
A. HCl和MgCl2一定存在
B. NaOH、H2SO4和MgCl2一定不存在
C. HCl和H2SO4一定存在
D. HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
16、人体不同器官的体液会保持相对稳定的酸碱度范围。由下表可知:以下叙述中正确的是( )
体液 血液 唾液 胃液
pH 7.35~7.45 6.6~7.2 0.9~1.5
A. 人的血液一定呈碱性 B. 人的胃液一定能使紫色石蕊试液变成蓝色
C. 人的唾液一定呈酸性 D. 用pH试纸能精确测定以上体液的pH
二、填空题。
17、生活中处处是化学,请回答问题:
①造成酸雨的主要气体是________;
②胃酸中的溶质是________;
近日一条微信在朋友圈中被疯狂转发:江西一名5岁男孩将海苔中的生石灰干燥剂倒进彩虹糖瓶子里兑水吹泡泡,摇晃瓶子后发生爆炸,喷出的液体灼伤男孩眼部,已致其失明.请你写出发生反应的化学方程式:________ 。
18、向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子.(填离子符号)
________; ________; ________
(3)氨水(NH3 N2O)也能使酚酞变色,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是________。(填离子符号)
19、下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)用60mL的浓盐酸可以配制溶质质量分数为10%的盐酸
(2)利用刚配好的盐酸测定某二价金属(R)的纯度:他取8克该不纯金属粉末(所含杂质不与酸反应,也不溶解于水)再取刚配好的盐酸溶液73克混合至恰好完全反应后过滤,将滤液蒸干,得到粉末状固体的质量为13.6克。
①金属R发生反应的化学方程式
②该金属的纯度 。
③若反应后的溶液只含有一种溶质,向反后的溶液中加入56.7克水,则此时溶液中溶质质量分数 。
20、实验室有A、B两种溶液,A能使紫色石蕊溶液变红色,B能使无色酚酞溶液变红色,则A、B两种溶液的pH大小关系是A________B(填“大于”或“小于”)。要测定A、B溶液的酸碱度,其做法是:________
________ 。
21、化学兴趣小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研细,加入酒精充分浸泡后过滤,得到三种溶液,将三种溶液分别加到下列液体中,得到以后信息:
花的种类 所制成溶液颜色 在有关试剂中呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
试回答:如果所制的溶液检验花盆中土壤的酸碱性,你会建议选择________花的酒精溶液来作酸碱指示剂:在以上三种酒精溶液中,酒精属于________,(“溶质”或“溶剂”)
三、简答题。
22、小明将氢氧化钠溶液与硝酸钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀。请解释可能的原因。
四、实验探究题。
23、以下是某同学进行的两个关于金属的探究实验.
【实验一】探究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化
(1)实验前需对镁条进行打磨,目的是________ 。
(2)检查图1 装置的气密性:
将镁条放入锥形瓶中,将注射器中的稀盐酸快速推入锥形瓶中.若稀盐酸是缓慢推入的,可能造成的后果是________ 。
(3)观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积与时间关系的图象如图2 所示。
则t1~t2时间内反应速率逐渐减慢的主要原因是________ ; t2~t3时间内注射器内气体体积逐渐减少的原因________ 。
(4)【实验二】探究实验一反应后所得溶液的酸碱性
甲同学用pH 试纸测定充分反应后锥形瓶中溶液的酸碱性,发现pH 小于7,说明甲同学所得溶液呈________ 性(选填“酸”、“碱”或“中”)。
甲同学:猜想Ⅰ:盐酸过量,使溶液pH 小于7;
猜想Ⅱ:溶液pH 小于7。
为验证猜想Ⅱ,甲同学测定了该溶液的酸碱性,显弱酸性。
(5)乙同学重复甲同学实验时,发现反应后所得溶液pH 大于7,发现实验与甲同学实验不同的是,反应后的锥形瓶中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁条与水反应的化学方程式________ 。
(6)【拓展延伸】中和反应也会放出热量.某化学小组初步探究“氢氧化钠溶液和稀盐酸发生中和反应时,溶液温度的变化情况”。
【实验用品】10%的氢氧化钠溶液、10%的稀盐酸、温度计…
【实验过程】在一定体积的10%的氢氧化钠溶液中滴加10%的稀盐酸(室温下),反应中溶液温度的变化如下:
加入稀盐酸的体积(V)/mL 0 2 4 6 8 10 12 14 16 18 20
溶液温度的变化(△t)/℃ 0 5.2 9.6 12.0 16.0 18.2 16.7 15.7 14.7 13.7 12.9
试在图3中绘出溶液温度变化与加入稀盐酸体积之间的关系图: 。
(7)写出该中和反应的化学方程式________ 。
(8)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线分析,大胆猜想新曲线最高点的位置(不考虑密度比热容及热量散失等影响因素)。
①横坐标及猜想理由:________ ;
②纵坐标及猜想理由:________ 。
五、计算题。
24、为了测定某赤铁矿石中氧化铁的质量分数,进行了如图10-1-13所示实验(矿石中的杂质既不溶于水也不与盐酸反应)。请根据实验过程和提供的数据计算:
(1)赤铁矿石中氧化铁的质量分数。
(2)盐酸中溶质的质量分数。
2023—2024学年人教版(五四学制)化学九年级全一册第3单元 酸和碱 期中复习评估(含答案)
人教版(五四学制)第3单元 酸和碱
一、选择题。
1、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
【答案】B
2、硼酸常用于治疗小儿湿疹。如图是硼元素在元素周期表中的相关信息。下列关于硼元素的说法中正确的是( )
A.相对原子质量为10.81g B.属于金属元素
C.原子的核电荷数为5 D.原子核外有6个电子
【答案】C
3、下列物质必须密封保存的是( )
A. 木炭 B. 浓盐酸 C. 石灰石 D. 氯化钠
【答案】B
4、实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
【答案】D
5、向质量比为1:1的铁和氧化铜的混合粉末中加入一定量的稀盐酸,充分反应后烧杯中还有固体物质存在,且该固体只有一种成分,则该固体是( )
A. Fe B. FeO C. Cu D. CuO
【答案】C
6、下列实验操作正确的是( )
A. 测定溶液pH值 B. 稀释浓硫酸
C. 固体药品的取用 D. 称取食盐
【答案】C
7、推理是化学学习中常用的思维方法。下列推理正确的是( )
A.中和反应能生成盐和水,则生成盐和水的反应一定是中和反应
B.NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应
C.饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
D.燃烧需要同时满足三个条件,所以只有同时破坏燃烧的三个条件才能灭火
【答案】B
8、厕所用的清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生,这种气体是( )
A. 二氧化硫 B. 二氧化碳 C. 氢气 D. 氧气
【答案】B
9、下列关于氢氧化钠的描述中错误的是( )
A.易与空气中成分反应而变质
B.蚊虫叮咬后涂抹NaOH溶液减轻痛痒
C.能去除油污可作炉具清洁剂
D.NaOH水溶液能使紫色石蕊溶液变蓝
【答案】B
10、下列物质分别放入水里,滴加无色酚酞试液能变红的是( )
A. 生石灰 B. 食盐 C. 硫酸铜 D. 氢氧化铜
【答案】A
11、下列叙述中正确的是( )
A. 能使石蕊试液变蓝的溶液一定是碱溶液
B. 可用酚酞试液鉴别酸性溶液和中性溶液
C. pH小于7的溶液是酸的溶液
D. 碱溶液一定是碱性溶液
【答案】 D
12、对下列事实的微观解释正确的是( )
选项 事实 解释
A 稀盐酸、稀硫酸均显酸性 溶液中都含有氢元素
B 氢氧化钠溶液能导电 溶液中存在自由移动的离子
C 金刚石和石墨的性质存在着明显差异 碳原子结构不同
D 压缩的乒乓球放入热水中重新鼓起 乒乓球内每个分子的体积都增大
A.A B.B C.C D.D
【答案】B
13、氢氧化钙的俗称是( )
A. 生石灰 B. 熟石灰 C. 食盐 D. 大理石
【答案】B
14、下列化学方程式书写完全正确的是( )
A.2S + 3O22SO3
B.HgOHg + O2↑
C.2NaOH + H2SO4=Na2SO4 + 2H2O
D.CuSO4 + 2NaOH=Na2SO4 + Cu(OH)2
【答案】C
15、某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
A. HCl和MgCl2一定存在
B. NaOH、H2SO4和MgCl2一定不存在
C. HCl和H2SO4一定存在
D. HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
【答案】A
16、人体不同器官的体液会保持相对稳定的酸碱度范围。由下表可知:以下叙述中正确的是( )
体液 血液 唾液 胃液
pH 7.35~7.45 6.6~7.2 0.9~1.5
A. 人的血液一定呈碱性 B. 人的胃液一定能使紫色石蕊试液变成蓝色
C. 人的唾液一定呈酸性 D. 用pH试纸能精确测定以上体液的pH
【答案】A
二、填空题。
17、生活中处处是化学,请回答问题:
①造成酸雨的主要气体是________;
②胃酸中的溶质是________;
近日一条微信在朋友圈中被疯狂转发:江西一名5岁男孩将海苔中的生石灰干燥剂倒进彩虹糖瓶子里兑水吹泡泡,摇晃瓶子后发生爆炸,喷出的液体灼伤男孩眼部,已致其失明.请你写出发生反应的化学方程式:________ 。
【答案】(1)SO2 (2)HCl (3)CaO+H2O=Ca(OH)2
18、向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子.(填离子符号)
________; ________; ________
(3)氨水(NH3 N2O)也能使酚酞变色,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是________。(填离子符号)
【答案】(1)溶液由红色变为无色
(2)Na+;OH﹣;Cl﹣ (3)OH﹣
19、下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)用60mL的浓盐酸可以配制溶质质量分数为10%的盐酸
(2)利用刚配好的盐酸测定某二价金属(R)的纯度:他取8克该不纯金属粉末(所含杂质不与酸反应,也不溶解于水)再取刚配好的盐酸溶液73克混合至恰好完全反应后过滤,将滤液蒸干,得到粉末状固体的质量为13.6克。
①金属R发生反应的化学方程式
②该金属的纯度 。
③若反应后的溶液只含有一种溶质,向反后的溶液中加入56.7克水,则此时溶液中溶质质量分数 。
【答案】288g;R + 2HCl = RCl2 + H2↑;81.25%;10%
20、实验室有A、B两种溶液,A能使紫色石蕊溶液变红色,B能使无色酚酞溶液变红色,则A、B两种溶液的pH大小关系是A________B(填“大于”或“小于”)。要测定A、B溶液的酸碱度,其做法是:________
________ 。
【答案】小于;用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值
21、化学兴趣小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研细,加入酒精充分浸泡后过滤,得到三种溶液,将三种溶液分别加到下列液体中,得到以后信息:
花的种类 所制成溶液颜色 在有关试剂中呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
试回答:如果所制的溶液检验花盆中土壤的酸碱性,你会建议选择________花的酒精溶液来作酸碱指示剂:在以上三种酒精溶液中,酒精属于________,(“溶质”或“溶剂”)
【答案】玫瑰;溶剂
三、简答题。
22、小明将氢氧化钠溶液与硝酸钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀。请解释可能的原因。
【答案】原因可能是NaOH溶液变质了,与空气中的CO2反应生成了Na2CO3,Na2CO3溶液与Ba(NO3)2溶液反应生成了BaCO3白色沉淀。
四、实验探究题。
23、以下是某同学进行的两个关于金属的探究实验.
【实验一】探究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化
(1)实验前需对镁条进行打磨,目的是________ 。
(2)检查图1 装置的气密性:
将镁条放入锥形瓶中,将注射器中的稀盐酸快速推入锥形瓶中.若稀盐酸是缓慢推入的,可能造成的后果是________ 。
(3)观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积与时间关系的图象如图2 所示。
则t1~t2时间内反应速率逐渐减慢的主要原因是________ ; t2~t3时间内注射器内气体体积逐渐减少的原因________ 。
(4)【实验二】探究实验一反应后所得溶液的酸碱性
甲同学用pH 试纸测定充分反应后锥形瓶中溶液的酸碱性,发现pH 小于7,说明甲同学所得溶液呈________ 性(选填“酸”、“碱”或“中”)。
甲同学:猜想Ⅰ:盐酸过量,使溶液pH 小于7;
猜想Ⅱ:溶液pH 小于7。
为验证猜想Ⅱ,甲同学测定了该溶液的酸碱性,显弱酸性。
(5)乙同学重复甲同学实验时,发现反应后所得溶液pH 大于7,发现实验与甲同学实验不同的是,反应后的锥形瓶中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁条与水反应的化学方程式________ 。
(6)【拓展延伸】中和反应也会放出热量.某化学小组初步探究“氢氧化钠溶液和稀盐酸发生中和反应时,溶液温度的变化情况”。
【实验用品】10%的氢氧化钠溶液、10%的稀盐酸、温度计…
【实验过程】在一定体积的10%的氢氧化钠溶液中滴加10%的稀盐酸(室温下),反应中溶液温度的变化如下:
加入稀盐酸的体积(V)/mL 0 2 4 6 8 10 12 14 16 18 20
溶液温度的变化(△t)/℃ 0 5.2 9.6 12.0 16.0 18.2 16.7 15.7 14.7 13.7 12.9
试在图3中绘出溶液温度变化与加入稀盐酸体积之间的关系图: 。
(7)写出该中和反应的化学方程式________ 。
(8)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线分析,大胆猜想新曲线最高点的位置(不考虑密度比热容及热量散失等影响因素)。
①横坐标及猜想理由:________ ;
②纵坐标及猜想理由:________ 。
【答案】(1)去除表面的氧化镁等杂质
(2)生成的热量会随之散失到周围的空气中,造成反应过程中温度几乎不变
(3)盐酸的浓度减小 ;温度降低,气体体积减小
(4)酸
(5)Mg+2H2O(热)═Mg(OH)2+H2↑
(6)如图所示:
(7)HCl+NaOH=NaCl+H2O
(8)5,当恰好完全反应时,放出热量的最大值与原实验相同,此时所需20%的盐酸的体积是原来的二分之一 ;
大于18.2的值,当恰好完全反应时,放出热量的最大值与原实验相同,此时实验总质量比原实验小,所以△t最大值大于18.2℃。
五、计算题。
24、为了测定某赤铁矿石中氧化铁的质量分数,进行了如图10-1-13所示实验(矿石中的杂质既不溶于水也不与盐酸反应)。请根据实验过程和提供的数据计算:
(1)赤铁矿石中氧化铁的质量分数。
(2)盐酸中溶质的质量分数。
【详解】(1)由图可知,赤铁矿石中氧化铁的质量为
20 g-4 g=16 g。
赤铁矿石中氧化铁的质量分数为
×100%=80%。
(2)设219 g盐酸中溶质的质量为x。
Fe2O3+6HCl===2FeCl3+3H2O
160 219
16 g x
= x=21.9 g
盐酸中溶质的质量分数为
×100%=10%。
答:(1)赤铁矿石中氧化铁的质量分数为80%;
(2)盐酸中溶质的质量分数为10%。
人教版(五四学制)第3单元 酸和碱
一、选择题。
1、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
2、硼酸常用于治疗小儿湿疹。如图是硼元素在元素周期表中的相关信息。下列关于硼元素的说法中正确的是( )
A.相对原子质量为10.81g B.属于金属元素
C.原子的核电荷数为5 D.原子核外有6个电子
3、下列物质必须密封保存的是( )
A. 木炭 B. 浓盐酸 C. 石灰石 D. 氯化钠
4、实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
5、向质量比为1:1的铁和氧化铜的混合粉末中加入一定量的稀盐酸,充分反应后烧杯中还有固体物质存在,且该固体只有一种成分,则该固体是( )
A. Fe B. FeO C. Cu D. CuO
6、下列实验操作正确的是( )
A. 测定溶液pH值 B. 稀释浓硫酸
C. 固体药品的取用 D. 称取食盐
7、推理是化学学习中常用的思维方法。下列推理正确的是( )
A.中和反应能生成盐和水,则生成盐和水的反应一定是中和反应
B.NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应
C.饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
D.燃烧需要同时满足三个条件,所以只有同时破坏燃烧的三个条件才能灭火
8、厕所用的清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生,这种气体是( )
A. 二氧化硫 B. 二氧化碳 C. 氢气 D. 氧气
9、下列关于氢氧化钠的描述中错误的是( )
A.易与空气中成分反应而变质
B.蚊虫叮咬后涂抹NaOH溶液减轻痛痒
C.能去除油污可作炉具清洁剂
D.NaOH水溶液能使紫色石蕊溶液变蓝
10、下列物质分别放入水里,滴加无色酚酞试液能变红的是( )
A. 生石灰 B. 食盐 C. 硫酸铜 D. 氢氧化铜
11、下列叙述中正确的是( )
A. 能使石蕊试液变蓝的溶液一定是碱溶液
B. 可用酚酞试液鉴别酸性溶液和中性溶液
C. pH小于7的溶液是酸的溶液
D. 碱溶液一定是碱性溶液
12、对下列事实的微观解释正确的是( )
选项 事实 解释
A 稀盐酸、稀硫酸均显酸性 溶液中都含有氢元素
B 氢氧化钠溶液能导电 溶液中存在自由移动的离子
C 金刚石和石墨的性质存在着明显差异 碳原子结构不同
D 压缩的乒乓球放入热水中重新鼓起 乒乓球内每个分子的体积都增大
A.A B.B C.C D.D
13、氢氧化钙的俗称是( )
A. 生石灰 B. 熟石灰 C. 食盐 D. 大理石
14、下列化学方程式书写完全正确的是( )
A.2S + 3O22SO3
B.HgOHg + O2↑
C.2NaOH + H2SO4=Na2SO4 + 2H2O
D.CuSO4 + 2NaOH=Na2SO4 + Cu(OH)2
15、某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
A. HCl和MgCl2一定存在
B. NaOH、H2SO4和MgCl2一定不存在
C. HCl和H2SO4一定存在
D. HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
16、人体不同器官的体液会保持相对稳定的酸碱度范围。由下表可知:以下叙述中正确的是( )
体液 血液 唾液 胃液
pH 7.35~7.45 6.6~7.2 0.9~1.5
A. 人的血液一定呈碱性 B. 人的胃液一定能使紫色石蕊试液变成蓝色
C. 人的唾液一定呈酸性 D. 用pH试纸能精确测定以上体液的pH
二、填空题。
17、生活中处处是化学,请回答问题:
①造成酸雨的主要气体是________;
②胃酸中的溶质是________;
近日一条微信在朋友圈中被疯狂转发:江西一名5岁男孩将海苔中的生石灰干燥剂倒进彩虹糖瓶子里兑水吹泡泡,摇晃瓶子后发生爆炸,喷出的液体灼伤男孩眼部,已致其失明.请你写出发生反应的化学方程式:________ 。
18、向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子.(填离子符号)
________; ________; ________
(3)氨水(NH3 N2O)也能使酚酞变色,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是________。(填离子符号)
19、下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)用60mL的浓盐酸可以配制溶质质量分数为10%的盐酸
(2)利用刚配好的盐酸测定某二价金属(R)的纯度:他取8克该不纯金属粉末(所含杂质不与酸反应,也不溶解于水)再取刚配好的盐酸溶液73克混合至恰好完全反应后过滤,将滤液蒸干,得到粉末状固体的质量为13.6克。
①金属R发生反应的化学方程式
②该金属的纯度 。
③若反应后的溶液只含有一种溶质,向反后的溶液中加入56.7克水,则此时溶液中溶质质量分数 。
20、实验室有A、B两种溶液,A能使紫色石蕊溶液变红色,B能使无色酚酞溶液变红色,则A、B两种溶液的pH大小关系是A________B(填“大于”或“小于”)。要测定A、B溶液的酸碱度,其做法是:________
________ 。
21、化学兴趣小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研细,加入酒精充分浸泡后过滤,得到三种溶液,将三种溶液分别加到下列液体中,得到以后信息:
花的种类 所制成溶液颜色 在有关试剂中呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
试回答:如果所制的溶液检验花盆中土壤的酸碱性,你会建议选择________花的酒精溶液来作酸碱指示剂:在以上三种酒精溶液中,酒精属于________,(“溶质”或“溶剂”)
三、简答题。
22、小明将氢氧化钠溶液与硝酸钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀。请解释可能的原因。
四、实验探究题。
23、以下是某同学进行的两个关于金属的探究实验.
【实验一】探究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化
(1)实验前需对镁条进行打磨,目的是________ 。
(2)检查图1 装置的气密性:
将镁条放入锥形瓶中,将注射器中的稀盐酸快速推入锥形瓶中.若稀盐酸是缓慢推入的,可能造成的后果是________ 。
(3)观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积与时间关系的图象如图2 所示。
则t1~t2时间内反应速率逐渐减慢的主要原因是________ ; t2~t3时间内注射器内气体体积逐渐减少的原因________ 。
(4)【实验二】探究实验一反应后所得溶液的酸碱性
甲同学用pH 试纸测定充分反应后锥形瓶中溶液的酸碱性,发现pH 小于7,说明甲同学所得溶液呈________ 性(选填“酸”、“碱”或“中”)。
甲同学:猜想Ⅰ:盐酸过量,使溶液pH 小于7;
猜想Ⅱ:溶液pH 小于7。
为验证猜想Ⅱ,甲同学测定了该溶液的酸碱性,显弱酸性。
(5)乙同学重复甲同学实验时,发现反应后所得溶液pH 大于7,发现实验与甲同学实验不同的是,反应后的锥形瓶中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁条与水反应的化学方程式________ 。
(6)【拓展延伸】中和反应也会放出热量.某化学小组初步探究“氢氧化钠溶液和稀盐酸发生中和反应时,溶液温度的变化情况”。
【实验用品】10%的氢氧化钠溶液、10%的稀盐酸、温度计…
【实验过程】在一定体积的10%的氢氧化钠溶液中滴加10%的稀盐酸(室温下),反应中溶液温度的变化如下:
加入稀盐酸的体积(V)/mL 0 2 4 6 8 10 12 14 16 18 20
溶液温度的变化(△t)/℃ 0 5.2 9.6 12.0 16.0 18.2 16.7 15.7 14.7 13.7 12.9
试在图3中绘出溶液温度变化与加入稀盐酸体积之间的关系图: 。
(7)写出该中和反应的化学方程式________ 。
(8)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线分析,大胆猜想新曲线最高点的位置(不考虑密度比热容及热量散失等影响因素)。
①横坐标及猜想理由:________ ;
②纵坐标及猜想理由:________ 。
五、计算题。
24、为了测定某赤铁矿石中氧化铁的质量分数,进行了如图10-1-13所示实验(矿石中的杂质既不溶于水也不与盐酸反应)。请根据实验过程和提供的数据计算:
(1)赤铁矿石中氧化铁的质量分数。
(2)盐酸中溶质的质量分数。
2023—2024学年人教版(五四学制)化学九年级全一册第3单元 酸和碱 期中复习评估(含答案)
人教版(五四学制)第3单元 酸和碱
一、选择题。
1、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
【答案】B
2、硼酸常用于治疗小儿湿疹。如图是硼元素在元素周期表中的相关信息。下列关于硼元素的说法中正确的是( )
A.相对原子质量为10.81g B.属于金属元素
C.原子的核电荷数为5 D.原子核外有6个电子
【答案】C
3、下列物质必须密封保存的是( )
A. 木炭 B. 浓盐酸 C. 石灰石 D. 氯化钠
【答案】B
4、实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
【答案】D
5、向质量比为1:1的铁和氧化铜的混合粉末中加入一定量的稀盐酸,充分反应后烧杯中还有固体物质存在,且该固体只有一种成分,则该固体是( )
A. Fe B. FeO C. Cu D. CuO
【答案】C
6、下列实验操作正确的是( )
A. 测定溶液pH值 B. 稀释浓硫酸
C. 固体药品的取用 D. 称取食盐
【答案】C
7、推理是化学学习中常用的思维方法。下列推理正确的是( )
A.中和反应能生成盐和水,则生成盐和水的反应一定是中和反应
B.NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应
C.饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
D.燃烧需要同时满足三个条件,所以只有同时破坏燃烧的三个条件才能灭火
【答案】B
8、厕所用的清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生,这种气体是( )
A. 二氧化硫 B. 二氧化碳 C. 氢气 D. 氧气
【答案】B
9、下列关于氢氧化钠的描述中错误的是( )
A.易与空气中成分反应而变质
B.蚊虫叮咬后涂抹NaOH溶液减轻痛痒
C.能去除油污可作炉具清洁剂
D.NaOH水溶液能使紫色石蕊溶液变蓝
【答案】B
10、下列物质分别放入水里,滴加无色酚酞试液能变红的是( )
A. 生石灰 B. 食盐 C. 硫酸铜 D. 氢氧化铜
【答案】A
11、下列叙述中正确的是( )
A. 能使石蕊试液变蓝的溶液一定是碱溶液
B. 可用酚酞试液鉴别酸性溶液和中性溶液
C. pH小于7的溶液是酸的溶液
D. 碱溶液一定是碱性溶液
【答案】 D
12、对下列事实的微观解释正确的是( )
选项 事实 解释
A 稀盐酸、稀硫酸均显酸性 溶液中都含有氢元素
B 氢氧化钠溶液能导电 溶液中存在自由移动的离子
C 金刚石和石墨的性质存在着明显差异 碳原子结构不同
D 压缩的乒乓球放入热水中重新鼓起 乒乓球内每个分子的体积都增大
A.A B.B C.C D.D
【答案】B
13、氢氧化钙的俗称是( )
A. 生石灰 B. 熟石灰 C. 食盐 D. 大理石
【答案】B
14、下列化学方程式书写完全正确的是( )
A.2S + 3O22SO3
B.HgOHg + O2↑
C.2NaOH + H2SO4=Na2SO4 + 2H2O
D.CuSO4 + 2NaOH=Na2SO4 + Cu(OH)2
【答案】C
15、某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
A. HCl和MgCl2一定存在
B. NaOH、H2SO4和MgCl2一定不存在
C. HCl和H2SO4一定存在
D. HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
【答案】A
16、人体不同器官的体液会保持相对稳定的酸碱度范围。由下表可知:以下叙述中正确的是( )
体液 血液 唾液 胃液
pH 7.35~7.45 6.6~7.2 0.9~1.5
A. 人的血液一定呈碱性 B. 人的胃液一定能使紫色石蕊试液变成蓝色
C. 人的唾液一定呈酸性 D. 用pH试纸能精确测定以上体液的pH
【答案】A
二、填空题。
17、生活中处处是化学,请回答问题:
①造成酸雨的主要气体是________;
②胃酸中的溶质是________;
近日一条微信在朋友圈中被疯狂转发:江西一名5岁男孩将海苔中的生石灰干燥剂倒进彩虹糖瓶子里兑水吹泡泡,摇晃瓶子后发生爆炸,喷出的液体灼伤男孩眼部,已致其失明.请你写出发生反应的化学方程式:________ 。
【答案】(1)SO2 (2)HCl (3)CaO+H2O=Ca(OH)2
18、向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为________ 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子.(填离子符号)
________; ________; ________
(3)氨水(NH3 N2O)也能使酚酞变色,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是________。(填离子符号)
【答案】(1)溶液由红色变为无色
(2)Na+;OH﹣;Cl﹣ (3)OH﹣
19、下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)用60mL的浓盐酸可以配制溶质质量分数为10%的盐酸
(2)利用刚配好的盐酸测定某二价金属(R)的纯度:他取8克该不纯金属粉末(所含杂质不与酸反应,也不溶解于水)再取刚配好的盐酸溶液73克混合至恰好完全反应后过滤,将滤液蒸干,得到粉末状固体的质量为13.6克。
①金属R发生反应的化学方程式
②该金属的纯度 。
③若反应后的溶液只含有一种溶质,向反后的溶液中加入56.7克水,则此时溶液中溶质质量分数 。
【答案】288g;R + 2HCl = RCl2 + H2↑;81.25%;10%
20、实验室有A、B两种溶液,A能使紫色石蕊溶液变红色,B能使无色酚酞溶液变红色,则A、B两种溶液的pH大小关系是A________B(填“大于”或“小于”)。要测定A、B溶液的酸碱度,其做法是:________
________ 。
【答案】小于;用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值
21、化学兴趣小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研细,加入酒精充分浸泡后过滤,得到三种溶液,将三种溶液分别加到下列液体中,得到以后信息:
花的种类 所制成溶液颜色 在有关试剂中呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
试回答:如果所制的溶液检验花盆中土壤的酸碱性,你会建议选择________花的酒精溶液来作酸碱指示剂:在以上三种酒精溶液中,酒精属于________,(“溶质”或“溶剂”)
【答案】玫瑰;溶剂
三、简答题。
22、小明将氢氧化钠溶液与硝酸钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀。请解释可能的原因。
【答案】原因可能是NaOH溶液变质了,与空气中的CO2反应生成了Na2CO3,Na2CO3溶液与Ba(NO3)2溶液反应生成了BaCO3白色沉淀。
四、实验探究题。
23、以下是某同学进行的两个关于金属的探究实验.
【实验一】探究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化
(1)实验前需对镁条进行打磨,目的是________ 。
(2)检查图1 装置的气密性:
将镁条放入锥形瓶中,将注射器中的稀盐酸快速推入锥形瓶中.若稀盐酸是缓慢推入的,可能造成的后果是________ 。
(3)观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积与时间关系的图象如图2 所示。
则t1~t2时间内反应速率逐渐减慢的主要原因是________ ; t2~t3时间内注射器内气体体积逐渐减少的原因________ 。
(4)【实验二】探究实验一反应后所得溶液的酸碱性
甲同学用pH 试纸测定充分反应后锥形瓶中溶液的酸碱性,发现pH 小于7,说明甲同学所得溶液呈________ 性(选填“酸”、“碱”或“中”)。
甲同学:猜想Ⅰ:盐酸过量,使溶液pH 小于7;
猜想Ⅱ:溶液pH 小于7。
为验证猜想Ⅱ,甲同学测定了该溶液的酸碱性,显弱酸性。
(5)乙同学重复甲同学实验时,发现反应后所得溶液pH 大于7,发现实验与甲同学实验不同的是,反应后的锥形瓶中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁条与水反应的化学方程式________ 。
(6)【拓展延伸】中和反应也会放出热量.某化学小组初步探究“氢氧化钠溶液和稀盐酸发生中和反应时,溶液温度的变化情况”。
【实验用品】10%的氢氧化钠溶液、10%的稀盐酸、温度计…
【实验过程】在一定体积的10%的氢氧化钠溶液中滴加10%的稀盐酸(室温下),反应中溶液温度的变化如下:
加入稀盐酸的体积(V)/mL 0 2 4 6 8 10 12 14 16 18 20
溶液温度的变化(△t)/℃ 0 5.2 9.6 12.0 16.0 18.2 16.7 15.7 14.7 13.7 12.9
试在图3中绘出溶液温度变化与加入稀盐酸体积之间的关系图: 。
(7)写出该中和反应的化学方程式________ 。
(8)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线分析,大胆猜想新曲线最高点的位置(不考虑密度比热容及热量散失等影响因素)。
①横坐标及猜想理由:________ ;
②纵坐标及猜想理由:________ 。
【答案】(1)去除表面的氧化镁等杂质
(2)生成的热量会随之散失到周围的空气中,造成反应过程中温度几乎不变
(3)盐酸的浓度减小 ;温度降低,气体体积减小
(4)酸
(5)Mg+2H2O(热)═Mg(OH)2+H2↑
(6)如图所示:
(7)HCl+NaOH=NaCl+H2O
(8)5,当恰好完全反应时,放出热量的最大值与原实验相同,此时所需20%的盐酸的体积是原来的二分之一 ;
大于18.2的值,当恰好完全反应时,放出热量的最大值与原实验相同,此时实验总质量比原实验小,所以△t最大值大于18.2℃。
五、计算题。
24、为了测定某赤铁矿石中氧化铁的质量分数,进行了如图10-1-13所示实验(矿石中的杂质既不溶于水也不与盐酸反应)。请根据实验过程和提供的数据计算:
(1)赤铁矿石中氧化铁的质量分数。
(2)盐酸中溶质的质量分数。
【详解】(1)由图可知,赤铁矿石中氧化铁的质量为
20 g-4 g=16 g。
赤铁矿石中氧化铁的质量分数为
×100%=80%。
(2)设219 g盐酸中溶质的质量为x。
Fe2O3+6HCl===2FeCl3+3H2O
160 219
16 g x
= x=21.9 g
盐酸中溶质的质量分数为
×100%=10%。
答:(1)赤铁矿石中氧化铁的质量分数为80%;
(2)盐酸中溶质的质量分数为10%。
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
