人教版 高中化学 必修二 5.1硫及其化合物(共35张ppt)
文档属性
| 名称 | 人教版 高中化学 必修二 5.1硫及其化合物(共35张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 12:37:58 | ||
图片预览










文档简介
(共35张PPT)
硫及其化合物
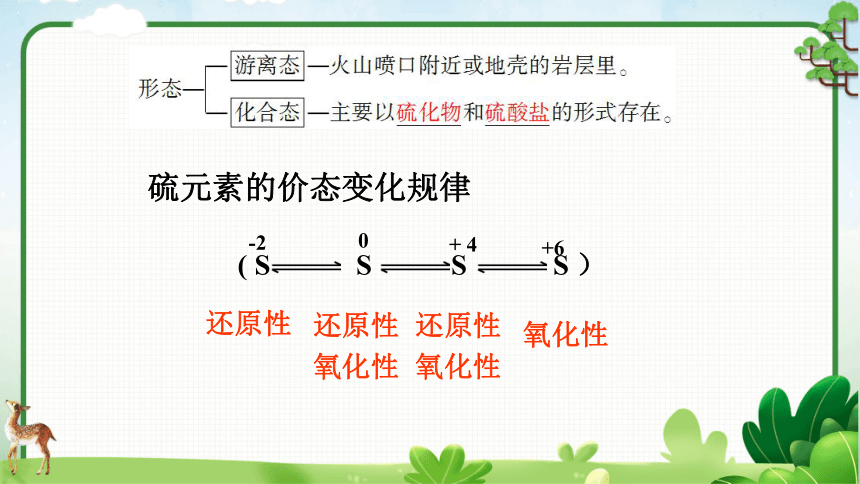
硫元素的价态变化规律
( S S S S )
-2
0
+ 4
+6
还原性
还原性
氧化性
还原性
氧化性
氧化性
硫化氢(H2S)
1、物理性质
无色有臭鸡蛋气味的气体,溶于水(1:2.6).
有剧毒。其水溶液叫氢硫酸 (二元弱酸,不稳定)
2、H2S的化学性质
氧气不足
2H2S + O2 === 2S + 2H2O
点燃
2)还原性
能与一些氧化剂如:
SO2、氯气、浓硫酸、 硝酸、高锰酸钾溶液等反应
3)热分解
H2S == H2 + S
1)可燃性
氧气充足
2H2S + 3O2 === 2SO2 + 2H2O
点燃
(与O2反应)
H2S + Cl2 = 2HCl+ S↓
H2S + H2SO4(浓) = S↓+SO2↑+2H2O
4)弱酸性:二元弱酸
H2S+NaOH(少量)=NaHS+H2O
H2S+2NaOH(足量)=Na2S+2H2O
S2-+2H+=H2S↑
S2-+H+ =HS-
①与酸反应
②与盐反应
S2-+Cu2+=CuS↓
S2-+Pb2+=PbS↓
检验
S2-、H2S
不溶于水和酸
FeS不溶于水,但溶于酸
制H2S
硫化物
FeS+2HCl=FeCl2+H2S ↑
方程式:
S2-水解 还原性
硫黄
黄色晶体
不溶
易溶
(1)与金属反应:与变价金属反应生成低价态硫化物
①硫与铁反应: 。
②硫与铜反应:
③硫与汞反应:
3.硫单质的化学性质
S + Hg =HgS
(常温下反应,除汞的方法)
②硫与O2反应: 。
硫在空气中燃烧火焰颜色为 ,在氧气中燃烧火焰颜色为 。
淡蓝色
蓝紫色
硫与过量氧气反应能否生成SO3?
(3)与化合物反应
3S+6NaOH===2Na2S+Na2SO3+3H2O 可用于清除硫
△
燃烧火焰呈淡蓝色:
H2、H2S、CH4、C2H5OH
CO燃烧火焰呈蓝色
S+6HNO3===H2SO4+6NO2↑+2H2O
△
△
S+H2 ===H2S。
(2)与非金属反应
①硫与H2反应:
S+2H2SO4===3SO2↑+2H2O
△
提示:硫易溶于CS2而难溶于水,故可用CS2或热的NaOH溶液洗涤。
无色,有刺激性气味的气体,有毒,密度比空气的大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40)。
二、硫的氧化物的性质及其应用
1.二氧化硫
(1)SO2的物理性质
(2)SO2的化学性质
先生成白色沉淀,后沉淀溶解
*亚硫酸是一种弱酸,不稳定
(酸性:亚硫酸>醋酸>碳酸)
实验室制取SO2,可选择用碱液(NaOH溶液)吸收尾气,防止空气污染。
c.与碱性氧化物反应:
SO2+Na2O=Na2SO3
a.与O2反应:
b.通入氯水中离子方程式:
现象: 。
c.能使酸性KMnO4溶液褪色。
溶液颜色褪去
2SO2 + O2 2SO3
催化剂
△
③氧化性
(Ⅰ)与硫化氢的反应为:
SO2+2H2S=3S↓+2H2O。
(Ⅱ)镁能在SO2气体中燃烧,其方程式为:
②还原性
2KMnO4+5SO2+2H2O = 2MnSO4+ K2SO4+2H2SO4
SO2+2Mg===2MgO+S
点燃
S+ Mg=== MgS
点燃
d.与某些盐反应
SO2+2NaHCO3=Na2SO3+CO2 ↑ +H2O
(除CO2中含的SO2杂质)
通入品红溶液,一段时间后再加热。
现象为:
原理:
品红溶液先褪色,加热后又恢复原色
④漂白性
与有色物质结合生成不稳定的无色物质。
---暂时性.
使品红溶液的红色褪去;加热后,溶液又恢复红色
这是检验SO2的方法之一.
不能使紫色石蕊试液褪色(石蕊变红)
选择性:
氯水、H2O2、Na2O2、O3 二氧化硫 活性炭
原 理
实 质
效 果
范 围
几种物质漂白原理的比较
氯水中HClO将有色物质氧化成无色物质
氧化还原反应
永久性
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
SO2溶于水与有色物质直接化合生成不稳定的无色物质
非氧化还原反应
暂时性
漂白某些有色物质,不能使紫色石蕊试液褪色(石蕊变红)
吸附有色物质
物理变化
易错点1 混淆二氧化硫的漂白性与还原性而出错
例:下列叙述正确的是 ( )
A.将SO2通入紫色石蕊试液中溶液褪色
B.SO2能使品红溶液、溴水、酸性高锰酸钾溶液褪色,是因为SO2具有漂白性
C.将SO2通入品红溶液,溶液褪色后加热恢复原色
D.将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2
C
练习:能证明SO2有漂白性的是 ( )
A.酸性KMnO4溶液中能入SO2气体后紫色消失
B.显红色的酚酞溶液中通入SO2气体后红色消失
C.品红溶液中通入SO2气体后红色消失
D.溴水中通入SO2气体后红色消失
C
(1)②中的实验现象是 此实验证实了SO2水溶液显
(2)⑤中的品红溶液 ,证明SO2 有 性。
(3)④中的实验现象是 ,证明SO2 有 性。
(4)①中的实验现象是 ,证明SO2 有 性。
(5)③的作用是
反应方程式是
变红
酸性
褪色
漂白
有淡黄色沉淀
氧化
溶液褪色
还原
吸收二氧化硫,防止其污染环境
SO2+2NaOH=Na2SO3+H2O
5.
H2SO4
Na2SO3
(4)SO2对大气的污染与防治
①来源:
②危害:
化石燃料的燃烧及含硫矿石的冶炼生产;硫酸 磷肥等产生的废气
污染大气,危害人体健康,形成酸雨。
形成酸雨的反应过程
③防治:开发新能源、燃煤除硫、处理工业废气。
处理方法通常用碱液吸收(NaOH或氨水)
(5)SO2的用途
A.制硫酸:SO2—SO3—H2SO4
B.漂白纸浆、毛、丝、草帽。
C.杀菌消毒
SO2 CO2
颜色
气味 无色、刺激性气味 无色无味
溶解性 易溶,常温常压1∶40 微溶,常温常压下1∶1
与碱
反应 通入澄清石灰水中,先生成沉淀,当气体过量时沉淀又溶解
Ca(OH)2+SO2
==CaSO3↓+H2O
CaSO3+SO2+H2O
==Ca(HSO3)2 通入澄清石灰水中,先生成沉淀,当气体过量时沉淀又溶解
Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O==Ca(HCO3)2
1.SO2与CO2性质的比较
2.SO2与CO2的常用鉴别法
(1)闻气味法
CO2无刺激性气味,而SO2有刺激性气味。但是由于SO2有毒,此法一般不用。
(2)品红溶液法
(3)高锰酸钾(或溴水)法
A
2、下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红
SO2有刺激性气味,而CO2没有
都可以使澄清石灰水变浑浊
SO2可使品红褪色,而CO2不能
BD
(1)物理性质
熔点16.8℃,沸点44.8℃,常温下为 ,标准状况下为 。
液态
固态
CaO+SO3===CaSO4
SO3+Ca(OH)2===CaSO4+H2O
(2)化学性质
2.三氧化硫
与CaO、Ca(OH)2反应的方程式为:
酸性氧化物(硫酐)的通性
SO3与水反应的方程式: ,该反应剧烈,同时释放大量的热,产生酸雾, SO3易溶于浓H2SO4,得到发烟硫酸
SO3+H2O==H2SO4
用饱和NaHSO3溶液除去SO2中的SO3,其反应方程式:
2NaHSO3+SO 3==Na2SO4+2SO2↑+H2O
含硫化石燃料
金属矿物
酸雨
5.6
脱硫
纯硫酸是一种无色黏稠油状液体,沸点高,难挥发 98%的硫酸称为浓硫酸,其密度为1.84 g/mL,物质的量浓度为18.4 mol/L,浓H2SO4与水以任意比互溶,浓硫酸溶于水时放出大量的热 浓H2SO4稀释的方法是:
2.稀H2SO4具有酸的通性
硫酸是强电解质,在水溶液中发生电离的方程式为
,能与指示剂、金属、碱性氧化物、碱、盐等物质发生反应。
将H2SO4沿器壁慢慢注入水中并不断搅拌
1.物理性质
四、硫酸
(1)强氧化性:
3、浓硫酸的特性:
Cu+2H2SO4(浓) = CuSO4 + SO2 ↑+ 2H2O
2Fe(少) +6H2SO4(浓) = Fe2 (SO4)3+ 3SO2↑+ 6H2O
在上述反应中,硫酸表现出了________和_____。
强氧化性
酸性
①浓硫酸与金属的反应
类型
(1)钝化:
常温下浓H2SO4使铁、铝钝化
(2)活泼金属(如Zn)
①开始如产生SO2
②浓度变小后,产生H2
(3)不活泼金属(如Cu)
①开始如产生SO2(加热)
②浓度变小,稀硫酸不再与Cu不反应
问题探究4:将64 g铜箔加入到盛有含2 mol H2SO4的浓H2SO4试管中加热。
(1)铜箔能否完全溶解?请解释原因。
H+与NO3-又能氧化铜片,发生反应3Cu+2NO3- +8H+===3Cu2++2NO↑+4H2O
不能,因为随着反应的进行,浓H2SO4变为稀H2SO4,反应停止。
(2)在反应后的溶液中再加入少量硝酸钠晶体,铜箔表面又有气泡冒出,其原因为_____________________________。
2HI+H2SO4(浓)==I2+SO2↑+2H2O
C+2H2SO4(浓)=== CO2↑+2SO2↑+2H2O
△
2P + 5H2SO4(浓) = 2H3PO4 + 5SO2↑ + 2H2O
②与非金属单质C、S、P反应
S+2H2SO4(浓)=== 3SO2↑+2H2O
△
③与还原性HI、HBr、H2S等物质反应
(2)吸水性:
是指浓硫酸所具有的吸收 的性质。
应用:常用作干燥剂
游离水
H2SO4+nH2O=H2SO4·nH2O
常用浓硫酸干燥的气体有:
不能用浓硫酸干燥的气体有:
a.碱性气体: NH3
b.还原性气体: H2S HBr HI
O2 H2 CO2 Cl2 HCl SO2 CO CH4 C2H2等气体
(3)脱水性:
是指浓硫酸将许多 化合物中的 按照按2∶1的个数比例脱去,生成水的性质
有机
H、O
(4)难挥发性
H2SO4(浓)+2NaCl Na2SO4+2HCl↑ H2SO4(浓)+NaNO3 NaHSO4+HNO3↑ 根据此性质可制挥发性酸
实验 实验现象 硫酸的特性
少量胆矾加入浓硫酸中
用玻璃棒蘸取浓硫酸滴在滤纸上
将铜片加入盛有浓硫酸的试管中加热
蓝色固体变白
沾有浓H2SO4的滤纸变黑
吸水性
脱水性
铜片逐渐溶解,产生无色刺激性气味的气体
强氧化性
(2)分别写出浓硫酸与Cu、C反应的化学方程式:
3.浓H2SO4的特性
(1)填写下表
问题探究5:硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
(1)锌和稀H2SO4制H2 ________;
(2)浓硫酸作干燥剂________;
(3)浓硫酸与蔗糖的炭化实验(黑面包实验)________;
(4)实验室用乙醇和冰醋酸制取乙酸乙酯________;
(5)乙酸乙酯的水解________;
(6)纤维素的水解________;
(7)浓硫酸与铜的反应________;
(8)浓硫酸使湿润蓝色石蕊试纸变红,后来又变黑________。
①
②
③④
②⑤
⑤
⑤
①④
①③
常见的硫酸盐晶体有石膏(CaSO4·2H2O) 熟石膏(2CaSO4·H2O) 胆矾(CuSO4·5H2O) 明矾(KAl(SO4)2·12H2O) 重晶石(BaSO4) 皓矾(ZnSO4·7H2O) 芒硝(Na2SO4·10H2O) 绿矾(FeSO4·7H2O)(可与氯水同时使 用作净水剂、杀菌消毒剂。)等, 其中熟石膏可用于制造模型及绷带,调节水泥凝结时间;胆矾可用于制波尔多液;明矾可做净水剂;重晶石在医疗上可用做“钡餐”,原因是不溶于水,不溶于酸,不易被X射线透过;绿矾制农药,在医疗上可用于治疗贫血
[说明]①带有结晶水的硫酸盐常称作矾。
②硫酸盐的溶解性 难溶:BaSO4、PbSO4 微溶:CaSO4、Ag2SO4
硫酸盐
工业上生产胆矾时,一般不用铜和浓硫酸反应,而是先把铜在空气中灼烧后,再与稀硫酸反应,目的是节约原料和防止污染。
B
硫及其化合物
硫元素的价态变化规律
( S S S S )
-2
0
+ 4
+6
还原性
还原性
氧化性
还原性
氧化性
氧化性
硫化氢(H2S)
1、物理性质
无色有臭鸡蛋气味的气体,溶于水(1:2.6).
有剧毒。其水溶液叫氢硫酸 (二元弱酸,不稳定)
2、H2S的化学性质
氧气不足
2H2S + O2 === 2S + 2H2O
点燃
2)还原性
能与一些氧化剂如:
SO2、氯气、浓硫酸、 硝酸、高锰酸钾溶液等反应
3)热分解
H2S == H2 + S
1)可燃性
氧气充足
2H2S + 3O2 === 2SO2 + 2H2O
点燃
(与O2反应)
H2S + Cl2 = 2HCl+ S↓
H2S + H2SO4(浓) = S↓+SO2↑+2H2O
4)弱酸性:二元弱酸
H2S+NaOH(少量)=NaHS+H2O
H2S+2NaOH(足量)=Na2S+2H2O
S2-+2H+=H2S↑
S2-+H+ =HS-
①与酸反应
②与盐反应
S2-+Cu2+=CuS↓
S2-+Pb2+=PbS↓
检验
S2-、H2S
不溶于水和酸
FeS不溶于水,但溶于酸
制H2S
硫化物
FeS+2HCl=FeCl2+H2S ↑
方程式:
S2-水解 还原性
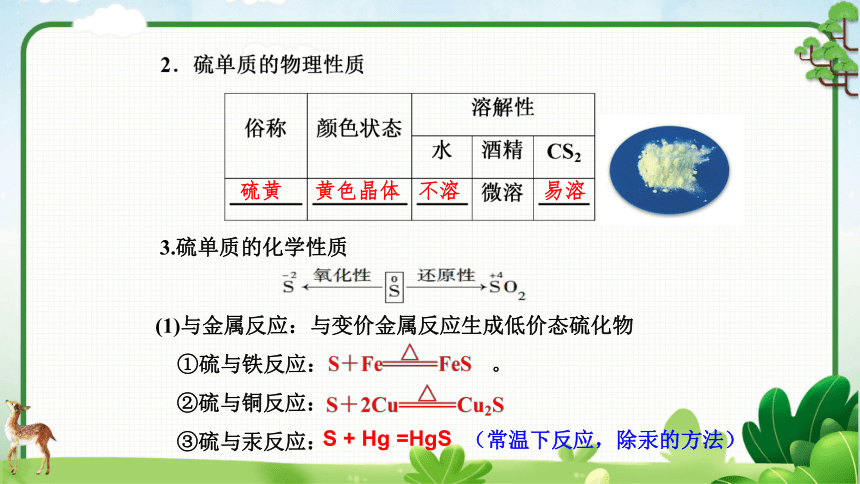
硫黄
黄色晶体
不溶
易溶
(1)与金属反应:与变价金属反应生成低价态硫化物
①硫与铁反应: 。
②硫与铜反应:
③硫与汞反应:
3.硫单质的化学性质
S + Hg =HgS
(常温下反应,除汞的方法)
②硫与O2反应: 。
硫在空气中燃烧火焰颜色为 ,在氧气中燃烧火焰颜色为 。
淡蓝色
蓝紫色
硫与过量氧气反应能否生成SO3?
(3)与化合物反应
3S+6NaOH===2Na2S+Na2SO3+3H2O 可用于清除硫
△
燃烧火焰呈淡蓝色:
H2、H2S、CH4、C2H5OH
CO燃烧火焰呈蓝色
S+6HNO3===H2SO4+6NO2↑+2H2O
△
△
S+H2 ===H2S。
(2)与非金属反应
①硫与H2反应:
S+2H2SO4===3SO2↑+2H2O
△
提示:硫易溶于CS2而难溶于水,故可用CS2或热的NaOH溶液洗涤。
无色,有刺激性气味的气体,有毒,密度比空气的大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40)。
二、硫的氧化物的性质及其应用
1.二氧化硫
(1)SO2的物理性质
(2)SO2的化学性质
先生成白色沉淀,后沉淀溶解
*亚硫酸是一种弱酸,不稳定
(酸性:亚硫酸>醋酸>碳酸)
实验室制取SO2,可选择用碱液(NaOH溶液)吸收尾气,防止空气污染。
c.与碱性氧化物反应:
SO2+Na2O=Na2SO3
a.与O2反应:
b.通入氯水中离子方程式:
现象: 。
c.能使酸性KMnO4溶液褪色。
溶液颜色褪去
2SO2 + O2 2SO3
催化剂
△
③氧化性
(Ⅰ)与硫化氢的反应为:
SO2+2H2S=3S↓+2H2O。
(Ⅱ)镁能在SO2气体中燃烧,其方程式为:
②还原性
2KMnO4+5SO2+2H2O = 2MnSO4+ K2SO4+2H2SO4
SO2+2Mg===2MgO+S
点燃
S+ Mg=== MgS
点燃
d.与某些盐反应
SO2+2NaHCO3=Na2SO3+CO2 ↑ +H2O
(除CO2中含的SO2杂质)
通入品红溶液,一段时间后再加热。
现象为:
原理:
品红溶液先褪色,加热后又恢复原色
④漂白性
与有色物质结合生成不稳定的无色物质。
---暂时性.
使品红溶液的红色褪去;加热后,溶液又恢复红色
这是检验SO2的方法之一.
不能使紫色石蕊试液褪色(石蕊变红)
选择性:
氯水、H2O2、Na2O2、O3 二氧化硫 活性炭
原 理
实 质
效 果
范 围
几种物质漂白原理的比较
氯水中HClO将有色物质氧化成无色物质
氧化还原反应
永久性
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
SO2溶于水与有色物质直接化合生成不稳定的无色物质
非氧化还原反应
暂时性
漂白某些有色物质,不能使紫色石蕊试液褪色(石蕊变红)
吸附有色物质
物理变化
易错点1 混淆二氧化硫的漂白性与还原性而出错
例:下列叙述正确的是 ( )
A.将SO2通入紫色石蕊试液中溶液褪色
B.SO2能使品红溶液、溴水、酸性高锰酸钾溶液褪色,是因为SO2具有漂白性
C.将SO2通入品红溶液,溶液褪色后加热恢复原色
D.将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2
C
练习:能证明SO2有漂白性的是 ( )
A.酸性KMnO4溶液中能入SO2气体后紫色消失
B.显红色的酚酞溶液中通入SO2气体后红色消失
C.品红溶液中通入SO2气体后红色消失
D.溴水中通入SO2气体后红色消失
C
(1)②中的实验现象是 此实验证实了SO2水溶液显
(2)⑤中的品红溶液 ,证明SO2 有 性。
(3)④中的实验现象是 ,证明SO2 有 性。
(4)①中的实验现象是 ,证明SO2 有 性。
(5)③的作用是
反应方程式是
变红
酸性
褪色
漂白
有淡黄色沉淀
氧化
溶液褪色
还原
吸收二氧化硫,防止其污染环境
SO2+2NaOH=Na2SO3+H2O
5.
H2SO4
Na2SO3
(4)SO2对大气的污染与防治
①来源:
②危害:
化石燃料的燃烧及含硫矿石的冶炼生产;硫酸 磷肥等产生的废气
污染大气,危害人体健康,形成酸雨。
形成酸雨的反应过程
③防治:开发新能源、燃煤除硫、处理工业废气。
处理方法通常用碱液吸收(NaOH或氨水)
(5)SO2的用途
A.制硫酸:SO2—SO3—H2SO4
B.漂白纸浆、毛、丝、草帽。
C.杀菌消毒
SO2 CO2
颜色
气味 无色、刺激性气味 无色无味
溶解性 易溶,常温常压1∶40 微溶,常温常压下1∶1
与碱
反应 通入澄清石灰水中,先生成沉淀,当气体过量时沉淀又溶解
Ca(OH)2+SO2
==CaSO3↓+H2O
CaSO3+SO2+H2O
==Ca(HSO3)2 通入澄清石灰水中,先生成沉淀,当气体过量时沉淀又溶解
Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O==Ca(HCO3)2
1.SO2与CO2性质的比较
2.SO2与CO2的常用鉴别法
(1)闻气味法
CO2无刺激性气味,而SO2有刺激性气味。但是由于SO2有毒,此法一般不用。
(2)品红溶液法
(3)高锰酸钾(或溴水)法
A
2、下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红
SO2有刺激性气味,而CO2没有
都可以使澄清石灰水变浑浊
SO2可使品红褪色,而CO2不能
BD
(1)物理性质
熔点16.8℃,沸点44.8℃,常温下为 ,标准状况下为 。
液态
固态
CaO+SO3===CaSO4
SO3+Ca(OH)2===CaSO4+H2O
(2)化学性质
2.三氧化硫
与CaO、Ca(OH)2反应的方程式为:
酸性氧化物(硫酐)的通性
SO3与水反应的方程式: ,该反应剧烈,同时释放大量的热,产生酸雾, SO3易溶于浓H2SO4,得到发烟硫酸
SO3+H2O==H2SO4
用饱和NaHSO3溶液除去SO2中的SO3,其反应方程式:
2NaHSO3+SO 3==Na2SO4+2SO2↑+H2O
含硫化石燃料
金属矿物
酸雨
5.6
脱硫
纯硫酸是一种无色黏稠油状液体,沸点高,难挥发 98%的硫酸称为浓硫酸,其密度为1.84 g/mL,物质的量浓度为18.4 mol/L,浓H2SO4与水以任意比互溶,浓硫酸溶于水时放出大量的热 浓H2SO4稀释的方法是:
2.稀H2SO4具有酸的通性
硫酸是强电解质,在水溶液中发生电离的方程式为
,能与指示剂、金属、碱性氧化物、碱、盐等物质发生反应。
将H2SO4沿器壁慢慢注入水中并不断搅拌
1.物理性质
四、硫酸
(1)强氧化性:
3、浓硫酸的特性:
Cu+2H2SO4(浓) = CuSO4 + SO2 ↑+ 2H2O
2Fe(少) +6H2SO4(浓) = Fe2 (SO4)3+ 3SO2↑+ 6H2O
在上述反应中,硫酸表现出了________和_____。
强氧化性
酸性
①浓硫酸与金属的反应
类型
(1)钝化:
常温下浓H2SO4使铁、铝钝化
(2)活泼金属(如Zn)
①开始如产生SO2
②浓度变小后,产生H2
(3)不活泼金属(如Cu)
①开始如产生SO2(加热)
②浓度变小,稀硫酸不再与Cu不反应
问题探究4:将64 g铜箔加入到盛有含2 mol H2SO4的浓H2SO4试管中加热。
(1)铜箔能否完全溶解?请解释原因。
H+与NO3-又能氧化铜片,发生反应3Cu+2NO3- +8H+===3Cu2++2NO↑+4H2O
不能,因为随着反应的进行,浓H2SO4变为稀H2SO4,反应停止。
(2)在反应后的溶液中再加入少量硝酸钠晶体,铜箔表面又有气泡冒出,其原因为_____________________________。
2HI+H2SO4(浓)==I2+SO2↑+2H2O
C+2H2SO4(浓)=== CO2↑+2SO2↑+2H2O
△
2P + 5H2SO4(浓) = 2H3PO4 + 5SO2↑ + 2H2O
②与非金属单质C、S、P反应
S+2H2SO4(浓)=== 3SO2↑+2H2O
△
③与还原性HI、HBr、H2S等物质反应
(2)吸水性:
是指浓硫酸所具有的吸收 的性质。
应用:常用作干燥剂
游离水
H2SO4+nH2O=H2SO4·nH2O
常用浓硫酸干燥的气体有:
不能用浓硫酸干燥的气体有:
a.碱性气体: NH3
b.还原性气体: H2S HBr HI
O2 H2 CO2 Cl2 HCl SO2 CO CH4 C2H2等气体
(3)脱水性:
是指浓硫酸将许多 化合物中的 按照按2∶1的个数比例脱去,生成水的性质
有机
H、O
(4)难挥发性
H2SO4(浓)+2NaCl Na2SO4+2HCl↑ H2SO4(浓)+NaNO3 NaHSO4+HNO3↑ 根据此性质可制挥发性酸
实验 实验现象 硫酸的特性
少量胆矾加入浓硫酸中
用玻璃棒蘸取浓硫酸滴在滤纸上
将铜片加入盛有浓硫酸的试管中加热
蓝色固体变白
沾有浓H2SO4的滤纸变黑
吸水性
脱水性
铜片逐渐溶解,产生无色刺激性气味的气体
强氧化性
(2)分别写出浓硫酸与Cu、C反应的化学方程式:
3.浓H2SO4的特性
(1)填写下表
问题探究5:硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
(1)锌和稀H2SO4制H2 ________;
(2)浓硫酸作干燥剂________;
(3)浓硫酸与蔗糖的炭化实验(黑面包实验)________;
(4)实验室用乙醇和冰醋酸制取乙酸乙酯________;
(5)乙酸乙酯的水解________;
(6)纤维素的水解________;
(7)浓硫酸与铜的反应________;
(8)浓硫酸使湿润蓝色石蕊试纸变红,后来又变黑________。
①
②
③④
②⑤
⑤
⑤
①④
①③
常见的硫酸盐晶体有石膏(CaSO4·2H2O) 熟石膏(2CaSO4·H2O) 胆矾(CuSO4·5H2O) 明矾(KAl(SO4)2·12H2O) 重晶石(BaSO4) 皓矾(ZnSO4·7H2O) 芒硝(Na2SO4·10H2O) 绿矾(FeSO4·7H2O)(可与氯水同时使 用作净水剂、杀菌消毒剂。)等, 其中熟石膏可用于制造模型及绷带,调节水泥凝结时间;胆矾可用于制波尔多液;明矾可做净水剂;重晶石在医疗上可用做“钡餐”,原因是不溶于水,不溶于酸,不易被X射线透过;绿矾制农药,在医疗上可用于治疗贫血
[说明]①带有结晶水的硫酸盐常称作矾。
②硫酸盐的溶解性 难溶:BaSO4、PbSO4 微溶:CaSO4、Ag2SO4
硫酸盐
工业上生产胆矾时,一般不用铜和浓硫酸反应,而是先把铜在空气中灼烧后,再与稀硫酸反应,目的是节约原料和防止污染。
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
