苏教版(2019)高中化学 必修二 化学键(共42张PPT)
文档属性
| 名称 | 苏教版(2019)高中化学 必修二 化学键(共42张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 12:39:35 | ||
图片预览








文档简介
(共42张PPT)
汇报人:XXX
XX月XX日
化学键
苏教版高中化学必修二课件
构成物质的微粒有 、 、 等
金刚石由 构成
食盐由 和 构成
氯气由 构成
分子
原子
离子
碳原子
钠离子
氯离子
氯气分子
你知道吗?
不同的物质含有不同的微粒,这些微粒是如何彼此结合而构成物质的?
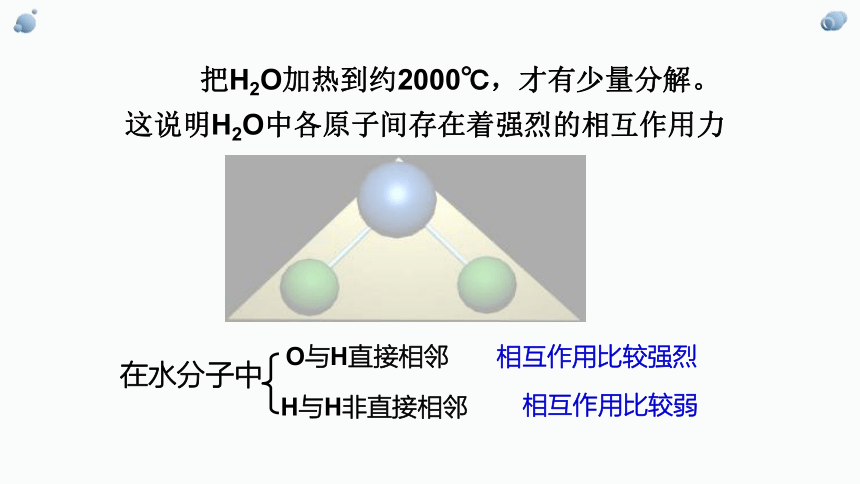
把H2O加热到约2000℃,才有少量分解。
这说明H2O中各原子间存在着强烈的相互作用力
在水分子中
O与H直接相邻
H与H非直接相邻
相互作用比较强烈
相互作用比较弱
氯化钠和氯化镁是由阴、阳离子构成的,离子间存在强烈的相互作用;
氯气是由许多氯气分子构成的,分子中氯原子与氯原子间存在着强烈的相互作用;
金刚石是由许多碳原子彼此结合形成的空间网状晶体,在晶体中,直接相邻的碳原子间存在强烈的相互作用。
我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
一、化学键
物质中直接相邻的原子或离子之间存在 的强烈的相互作用
注:1、直接相邻
2、强烈的相互作用包括吸引和排斥
3、化学键的分类:
A、离子键 B、共价键
二、离子键
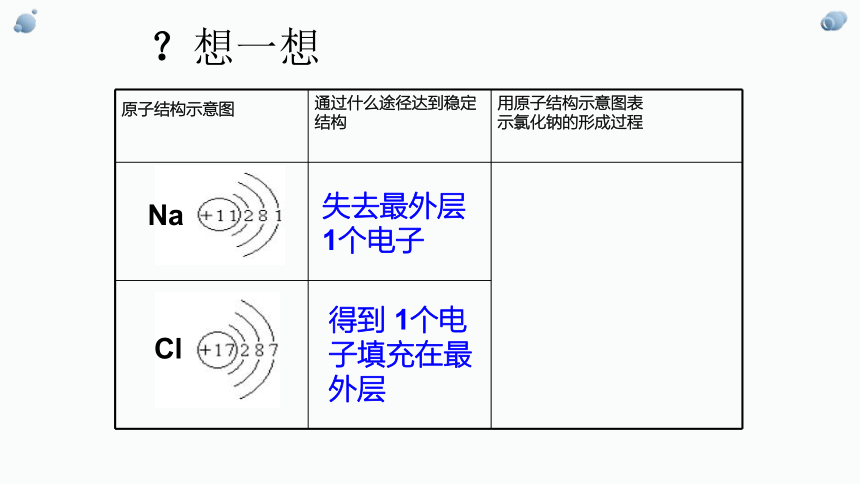
以氯化钠的形成过程为例分析离子键的成因
?想一想
原子结构示意图 通过什么途径达到稳定结构 用原子结构示意图表
示氯化钠的形成过程
失去最外层1个电子
得到 1个电子填充在最外层
Na
Cl
Na+
Cl-
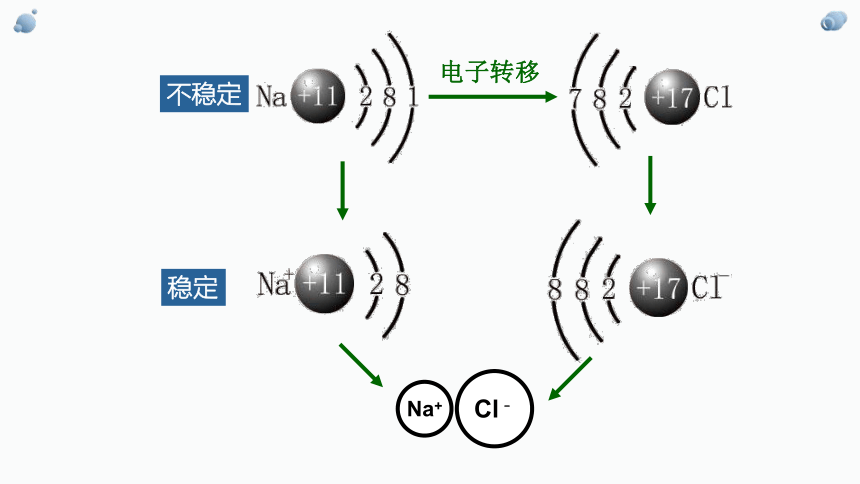
电子转移
不稳定
稳定
+11
8
1
2
+17
8
7
2
+11
8
1
2
Na
Na+
+11
8
2
+17
8
7
2
Cl
+17
8
8
2
Cl-
Na+
Cl-
原子结构示意图
通过什么途径
达到稳定结构
用原子结构示意图表示
氯化钠的形成过程
Na
Cl
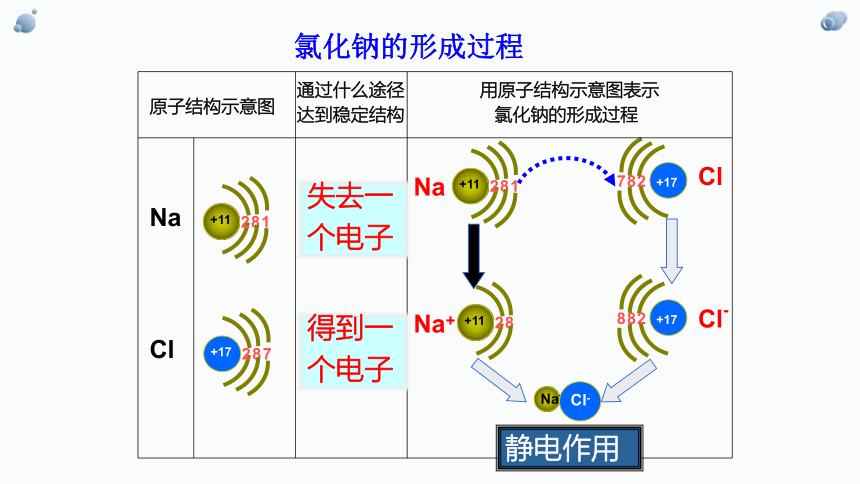
氯化钠的形成过程
失去一
个电子
得到一
个电子
静电作用
三
氯化钠的形成过程
思考
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。
阴阳离子结合在一起,彼此电荷是否会抵消呢?
阴阳离子间、电子与电子、原子核与原子核间
的相互排斥作用
请分析在氯化钠晶体中Na+和Cl-间存在哪些作用?
1、 Na+和Cl-间的相互吸引作用。
当阴、阳离子接近到一定距离时,吸引和
排斥作用达到平衡,阴阳离子间形成稳定的化
学键
————离子键
2、阴、阳离子的电子与电子、原子核与原子核
间的相互排斥作用。
1.离子键:
(1)定义:使阴阳离子结合成化合物的静电作用,叫做离子键。
(3)相互作用:静电作用(静电吸引和排斥)
二、离子键
(2)成键微粒:阴、阳离子
(4)成键元素:活泼金属与活泼非金属之间。
(5)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
含有离子键的化合物就是离子化合物。
2.离子化合物:
阴、阳离子通过静电作用而形成的化合物.
二、离子键
思考
哪些物质中含有离子键?
判断离子化合物的方法:
a.活泼金属(IA、IIA族)元素和活泼的非 金属元素(VIA、VIIA族)形成的化合物。
b.活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物 (如NaCl、 BaCO3、 NaOH ) C.铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。
d.活泼金属氧化物、活泼金属过氧化物(如Na2O、Na2O2)等属于离子化合物。
大部分的盐、碱、金属氧化物
3、形成离子键的条件(成键条件)
VIA,VIIA
酸根离子、OH-
阳离子
阴离子
活泼的金属
活泼的非金属
IA,IIA
铵根离子
常见离子化合物:金属氧化物、盐、强碱
H 元素周期表
Li Be …… N O F
Na Mg P S Cl
K Ca As Se Br
Rb Sr Sb Te I
Cs Ba Bi Po At
Fr Rb
下列哪些物质中存在离子键?
Na2O MgCl2 SO2 HCl
Na2O2 NaOH KNO3 NH4Cl
现学现用
练习
1.下列离子化合物中阳离子与阴离子半径之比最小的是( )
A.NaCl B.NaBr C.NaI D.LiI
D
3.哪些元素的原子之间可能形成离子键?
2.在离子化合物中,离子间有哪些作用
1.形成离子键的微粒是什么?
阴、阳离子
静电引力和静电斥力(统称静电作用)
a.活泼金属(ⅠA族、ⅡA族)与活泼
非金属(ⅥA族、Ⅶ A族)之间
b.活泼的金属元素和酸根离子之间
c.铵根离子和酸根离子之间
小结
1、化学键
2、离子键
3、电子式的书写(包括原子、离子、离子化合物的电子式)
练习:下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
2.证明下列化合物是离子化合物的依据是( )
A.可以溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态下能导电
D
判断离子化合物的方法?
a.活泼金属(IA、IIA族)元素和活泼的非 金属元素(VIA、VIIA族)形成的化合物。
b.活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物 (如NaCl、 BaCO3、 NaOH ) C.铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。
d.活泼金属氧化物、活泼金属过氧化物(如Na2O、Na2O2)等属于离子化合物。
大部分的盐、碱、金属氧化物
三、用电子式表示微粒以及离子化合物
电子式:
在元素符号周围用 “ · ” (或×)来表示该微粒最外层电子的式子。
例如:
C
H
O
×
三、用电子式表示微粒以及离子化合物
(1)原子的电子式:
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
常把其最外层电子数用小黑点“.”或小叉“×”来表示。
写出Na、Mg、Al、Si、P、S、Cl、Ar的电子式。
Cl
S
Ar
P
Na
Mg
Al
Si
练习
+12
8
2
2
Mg
原子结构示意图
+12
8
2
Mg 2+
离子结构示意图
Mg 2+
Mg
原子的电子式
阳离子的电子式
(2)常见离子的电子式
a.常见阳离子的电子式:
只要写出其离子符号即可
+17
8
7
2
Cl
原子结构示意图
+17
8
8
2
Cl-
离子结构示意图
b.常见阴离子的电子式
Cl
原子的电子式
阴离子的电子式
[ ]-
Cl
b.常见阴离子的电子式
不但要画出最外层电子数,而且还应用中括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
练习
写出H+、Na+、Al 3+、Br-、S 2-的电子式。
H+、 Na+、 Al 3+
[ ]-
Br
[ ]2-
S
写出下列微粒的电子式:
氟原子,氟离子,
钙原子, 钙离子
练习
(3)常见离子化合物的电子式
NaCl
MgCl2
Na2S
注:离子化合物的电子式由阴阳离子的电子式组成,阴、阳离子的电子式相间写,但对于相同的离子不得合并,每个离子都要单独写。
S
[ ]
2
Na+
Na+
Cl
[ ]-
Na+
2+
Mg
Cl
[ ]-
Cl
[ ]-
AB型
AB2型
A2B型
(1)原子的电子式:常把其最外层电子数用小黑点“ · ”或小叉“ × ” 来表示。
(2)简单阳离子的电子式:只要写出其离子符号即可。
(3)阴离子的电子式:不但要画出最外层电子数,而且还应用中括号“ [ ]” 括起来,并在右上角标出“n- ” 电荷字样。
“电子式” 书写小结
(4)离子化合物的电子式:写出阴、阳离子的电子式,注意相同离子不能合并。
(带正电荷原子团阳离子电子式书写方法随后学)
+11
8
1
2
Na
Na+
+11
8
2
+17
8
7
2
Cl
+17
8
8
2
Cl-
Na+
Cl-
原子结构示意图表示氯化钠的形成过程
用电子式表示NaCl的形成过程
·Cl
··
··
··
Na ×
+
→
Na+
··
··
:
[ × Cl ]-
·
用 电子式 表示 离子化合物 的 形成过程
用电子式表示CaBr2的形成过程
Br :
··
··
Br·
··
··
:
×Ca×
Ca2+
+
+·
→
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
格式:
原子电子式 → 离子化合物的电子式
⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
注:在箭头左面是原子的电子式,右面是离子化合物的电子式,相同原子的电子式可合并,但不建议,但离子化合物中相同离子不能合并。
练习
练习
使阴阳离子结合成化合物的静电作用,叫做离子键。
含有离子键的化合物一定是离子化合物
区分: 用电子式表示物质
用电子式表示物质形成过程
1.下列不是离子化合物的是( )
A. H2O B.CaBr2
C. KOH D.NaNO3
2.下列各数值表示有关元素的原子序数,其所表示的各原子间能以离子键形成稳定化合物的是( )
A.10与19 B.6与16
C.14与8 D.11与17
A
D
Cl
2
S
Br
[ ]-
2+
Ca
2+
Ca
Cl
[ ]-
2
F
[ ]-
K+
2+
Mg
[ ]
O
[ ]
2
S
[ ]
2
Na+
Na+
1.下列微粒电子式错误的是( )
2.下列化合物电子式书写正确的是( )
A.氯原子
B.硫离子
C.溴离子
D.钙离子
A.
B.
C.
D.
随堂练习
B
D
3.下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与活泼非金属化合时,能形成离子键
D
AlCl3, BeCl2
HCl
NH4Cl
4.下列说法中正确的是 ( )
(A)两个原子或多个原子之间的相互作用叫做化学键
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键
(C)只有金属元素和非金属元素化合时才能形成离子键
(D)大多数的盐、碱和低价金属氧化物中含有离子键
应指相邻的两个或多个原子,强烈的相互作用
静电引力应改为静电作用,它包括引力和斥力。
铵根离子和和酸根离子(或活泼非金属元素离子)也可形成离子键。
正确
D
作业
1.写出下列微粒或化合物的电子式
镁原子,镁离子,氧原子,氧离子
氧化钠,氯化钙
2.用电子式表示以下化合物的形成过程
硫化钠
氯化钙
3.某ⅡA族元素 X 和ⅦA族元素 Y 可形成离子化合物,请用电子式表示该离子化合物。
汇报人:XXX
XX月XX日
化学键
苏教版高中化学必修二课件
构成物质的微粒有 、 、 等
金刚石由 构成
食盐由 和 构成
氯气由 构成
分子
原子
离子
碳原子
钠离子
氯离子
氯气分子
你知道吗?
不同的物质含有不同的微粒,这些微粒是如何彼此结合而构成物质的?
把H2O加热到约2000℃,才有少量分解。
这说明H2O中各原子间存在着强烈的相互作用力
在水分子中
O与H直接相邻
H与H非直接相邻
相互作用比较强烈
相互作用比较弱
氯化钠和氯化镁是由阴、阳离子构成的,离子间存在强烈的相互作用;
氯气是由许多氯气分子构成的,分子中氯原子与氯原子间存在着强烈的相互作用;
金刚石是由许多碳原子彼此结合形成的空间网状晶体,在晶体中,直接相邻的碳原子间存在强烈的相互作用。
我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
一、化学键
物质中直接相邻的原子或离子之间存在 的强烈的相互作用
注:1、直接相邻
2、强烈的相互作用包括吸引和排斥
3、化学键的分类:
A、离子键 B、共价键
二、离子键
以氯化钠的形成过程为例分析离子键的成因
?想一想
原子结构示意图 通过什么途径达到稳定结构 用原子结构示意图表
示氯化钠的形成过程
失去最外层1个电子
得到 1个电子填充在最外层
Na
Cl
Na+
Cl-
电子转移
不稳定
稳定
+11
8
1
2
+17
8
7
2
+11
8
1
2
Na
Na+
+11
8
2
+17
8
7
2
Cl
+17
8
8
2
Cl-
Na+
Cl-
原子结构示意图
通过什么途径
达到稳定结构
用原子结构示意图表示
氯化钠的形成过程
Na
Cl
氯化钠的形成过程
失去一
个电子
得到一
个电子
静电作用
三
氯化钠的形成过程
思考
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。
阴阳离子结合在一起,彼此电荷是否会抵消呢?
阴阳离子间、电子与电子、原子核与原子核间
的相互排斥作用
请分析在氯化钠晶体中Na+和Cl-间存在哪些作用?
1、 Na+和Cl-间的相互吸引作用。
当阴、阳离子接近到一定距离时,吸引和
排斥作用达到平衡,阴阳离子间形成稳定的化
学键
————离子键
2、阴、阳离子的电子与电子、原子核与原子核
间的相互排斥作用。
1.离子键:
(1)定义:使阴阳离子结合成化合物的静电作用,叫做离子键。
(3)相互作用:静电作用(静电吸引和排斥)
二、离子键
(2)成键微粒:阴、阳离子
(4)成键元素:活泼金属与活泼非金属之间。
(5)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
含有离子键的化合物就是离子化合物。
2.离子化合物:
阴、阳离子通过静电作用而形成的化合物.
二、离子键
思考
哪些物质中含有离子键?
判断离子化合物的方法:
a.活泼金属(IA、IIA族)元素和活泼的非 金属元素(VIA、VIIA族)形成的化合物。
b.活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物 (如NaCl、 BaCO3、 NaOH ) C.铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。
d.活泼金属氧化物、活泼金属过氧化物(如Na2O、Na2O2)等属于离子化合物。
大部分的盐、碱、金属氧化物
3、形成离子键的条件(成键条件)
VIA,VIIA
酸根离子、OH-
阳离子
阴离子
活泼的金属
活泼的非金属
IA,IIA
铵根离子
常见离子化合物:金属氧化物、盐、强碱
H 元素周期表
Li Be …… N O F
Na Mg P S Cl
K Ca As Se Br
Rb Sr Sb Te I
Cs Ba Bi Po At
Fr Rb
下列哪些物质中存在离子键?
Na2O MgCl2 SO2 HCl
Na2O2 NaOH KNO3 NH4Cl
现学现用
练习
1.下列离子化合物中阳离子与阴离子半径之比最小的是( )
A.NaCl B.NaBr C.NaI D.LiI
D
3.哪些元素的原子之间可能形成离子键?
2.在离子化合物中,离子间有哪些作用
1.形成离子键的微粒是什么?
阴、阳离子
静电引力和静电斥力(统称静电作用)
a.活泼金属(ⅠA族、ⅡA族)与活泼
非金属(ⅥA族、Ⅶ A族)之间
b.活泼的金属元素和酸根离子之间
c.铵根离子和酸根离子之间
小结
1、化学键
2、离子键
3、电子式的书写(包括原子、离子、离子化合物的电子式)
练习:下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
2.证明下列化合物是离子化合物的依据是( )
A.可以溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态下能导电
D
判断离子化合物的方法?
a.活泼金属(IA、IIA族)元素和活泼的非 金属元素(VIA、VIIA族)形成的化合物。
b.活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物 (如NaCl、 BaCO3、 NaOH ) C.铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。
d.活泼金属氧化物、活泼金属过氧化物(如Na2O、Na2O2)等属于离子化合物。
大部分的盐、碱、金属氧化物
三、用电子式表示微粒以及离子化合物
电子式:
在元素符号周围用 “ · ” (或×)来表示该微粒最外层电子的式子。
例如:
C
H
O
×
三、用电子式表示微粒以及离子化合物
(1)原子的电子式:
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
常把其最外层电子数用小黑点“.”或小叉“×”来表示。
写出Na、Mg、Al、Si、P、S、Cl、Ar的电子式。
Cl
S
Ar
P
Na
Mg
Al
Si
练习
+12
8
2
2
Mg
原子结构示意图
+12
8
2
Mg 2+
离子结构示意图
Mg 2+
Mg
原子的电子式
阳离子的电子式
(2)常见离子的电子式
a.常见阳离子的电子式:
只要写出其离子符号即可
+17
8
7
2
Cl
原子结构示意图
+17
8
8
2
Cl-
离子结构示意图
b.常见阴离子的电子式
Cl
原子的电子式
阴离子的电子式
[ ]-
Cl
b.常见阴离子的电子式
不但要画出最外层电子数,而且还应用中括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
练习
写出H+、Na+、Al 3+、Br-、S 2-的电子式。
H+、 Na+、 Al 3+
[ ]-
Br
[ ]2-
S
写出下列微粒的电子式:
氟原子,氟离子,
钙原子, 钙离子
练习
(3)常见离子化合物的电子式
NaCl
MgCl2
Na2S
注:离子化合物的电子式由阴阳离子的电子式组成,阴、阳离子的电子式相间写,但对于相同的离子不得合并,每个离子都要单独写。
S
[ ]
2
Na+
Na+
Cl
[ ]-
Na+
2+
Mg
Cl
[ ]-
Cl
[ ]-
AB型
AB2型
A2B型
(1)原子的电子式:常把其最外层电子数用小黑点“ · ”或小叉“ × ” 来表示。
(2)简单阳离子的电子式:只要写出其离子符号即可。
(3)阴离子的电子式:不但要画出最外层电子数,而且还应用中括号“ [ ]” 括起来,并在右上角标出“n- ” 电荷字样。
“电子式” 书写小结
(4)离子化合物的电子式:写出阴、阳离子的电子式,注意相同离子不能合并。
(带正电荷原子团阳离子电子式书写方法随后学)
+11
8
1
2
Na
Na+
+11
8
2
+17
8
7
2
Cl
+17
8
8
2
Cl-
Na+
Cl-
原子结构示意图表示氯化钠的形成过程
用电子式表示NaCl的形成过程
·Cl
··
··
··
Na ×
+
→
Na+
··
··
:
[ × Cl ]-
·
用 电子式 表示 离子化合物 的 形成过程
用电子式表示CaBr2的形成过程
Br :
··
··
Br·
··
··
:
×Ca×
Ca2+
+
+·
→
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
格式:
原子电子式 → 离子化合物的电子式
⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
注:在箭头左面是原子的电子式,右面是离子化合物的电子式,相同原子的电子式可合并,但不建议,但离子化合物中相同离子不能合并。
练习
练习
使阴阳离子结合成化合物的静电作用,叫做离子键。
含有离子键的化合物一定是离子化合物
区分: 用电子式表示物质
用电子式表示物质形成过程
1.下列不是离子化合物的是( )
A. H2O B.CaBr2
C. KOH D.NaNO3
2.下列各数值表示有关元素的原子序数,其所表示的各原子间能以离子键形成稳定化合物的是( )
A.10与19 B.6与16
C.14与8 D.11与17
A
D
Cl
2
S
Br
[ ]-
2+
Ca
2+
Ca
Cl
[ ]-
2
F
[ ]-
K+
2+
Mg
[ ]
O
[ ]
2
S
[ ]
2
Na+
Na+
1.下列微粒电子式错误的是( )
2.下列化合物电子式书写正确的是( )
A.氯原子
B.硫离子
C.溴离子
D.钙离子
A.
B.
C.
D.
随堂练习
B
D
3.下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与活泼非金属化合时,能形成离子键
D
AlCl3, BeCl2
HCl
NH4Cl
4.下列说法中正确的是 ( )
(A)两个原子或多个原子之间的相互作用叫做化学键
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键
(C)只有金属元素和非金属元素化合时才能形成离子键
(D)大多数的盐、碱和低价金属氧化物中含有离子键
应指相邻的两个或多个原子,强烈的相互作用
静电引力应改为静电作用,它包括引力和斥力。
铵根离子和和酸根离子(或活泼非金属元素离子)也可形成离子键。
正确
D
作业
1.写出下列微粒或化合物的电子式
镁原子,镁离子,氧原子,氧离子
氧化钠,氯化钙
2.用电子式表示以下化合物的形成过程
硫化钠
氯化钙
3.某ⅡA族元素 X 和ⅦA族元素 Y 可形成离子化合物,请用电子式表示该离子化合物。
