苏教版(2019)高中化学 必修二 化学反应中的热量(共22张PPT)
文档属性
| 名称 | 苏教版(2019)高中化学 必修二 化学反应中的热量(共22张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 12:40:29 | ||
图片预览








文档简介
(共22张PPT)
汇报人:XXX
XX月XX日
化学反应中的热量
苏教版高中化学必修二课件
镁条的燃烧
化学反应中的能量变化,通常表现为热量的变化
高温冶炼铁
电池放电
闪电时产生氮氧化物
【活动与探究】
实验操作 实验现象 实验结论
【实验1】向试管中放入用砂纸打磨光亮的镁条,加入5mL 2mol/L 盐酸,用手触摸试管外壁,有什么感觉?
【实验2】向小烧杯加入约20g 氢氧化钡晶体,再加入约10g NH4Cl晶体,用玻璃棒搅拌,使充分混合,用手触摸烧杯外壁。
冰凉
试管外壁发热
镁与盐酸反应有热量放出
氢氧化钡与氯化铵反应需要吸收热量
1、放热反应:
一、放热化学 吸热反应
请结合所学的知识,请举出一些放热反应和吸热反应的例子?
吸收热量的化学反应。
有热量放出的化学反应。
吸热反应:
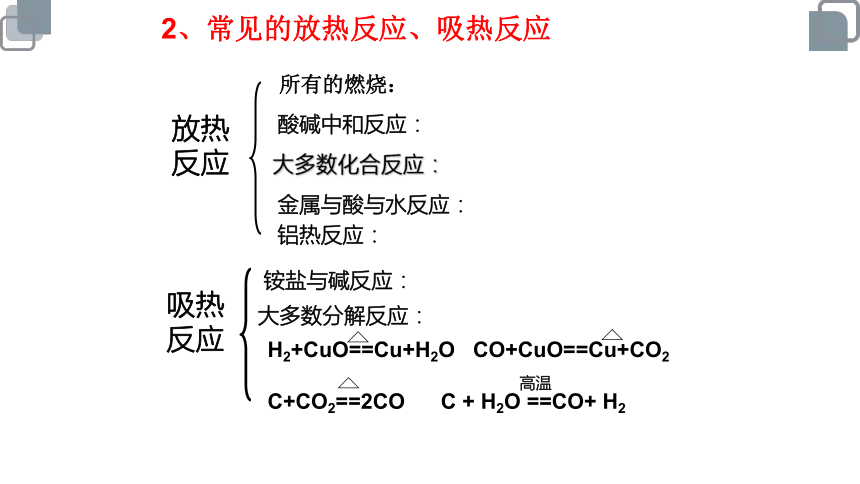
2、常见的放热反应、吸热反应
放热
反应
吸热
反应
酸碱中和反应:
所有的燃烧:
金属与酸与水反应:
大多数化合反应:
铵盐与碱反应:
大多数分解反应:
H2+CuO==Cu+H2O CO+CuO==Cu+CO2
C+CO2==2CO C + H2O ==CO+ H2
铝热反应:
高温
判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.高温煅烧石灰石
3.氧化钙与水的反应。
4.盐酸与氢氧化钠溶液反应
抢答
5.高温下木炭与二氧化碳反应生成一氧化碳。
6.炸药爆炸
7.Ca(OH)2和NH4Cl的反应
8.炽热的碳与H2O的反应
9.甲烷在氧气中的燃烧
生活应用
暧宝宝
暖贴的主要成分有木炭、铁粉、食盐。
请解释发热原理。
使用前黑色 使用后红棕色
为什么撕开包装后暖宝宝能发热呢?
猜想暖宝宝发热原因:
暖宝宝成份由铁、活性炭、无机盐、水等组成,可在空气中氧气的作用下发生放热反应。这种反应过程是从一打开真空包装的时候就开始的。是一个缓慢氧化的过程。
化学反应中为什么会伴随着能量转化?
一、从宏观角度分析(总能量)
二、从微观角度分析
(吸收能量)
旧化学键
破坏
原子
(放出能量)
新化学键
形成
吸收能量<放出能量
吸收能量>放出能量
放热反应
吸热反应
决定
请你试试:
已知拆开1 mol H2化学键需要消耗436.4 kJ能量,拆开1 mol Cl2中化学键需要消耗242.7 kJ能量,形成氯化氢分子中的1 mol
H-Cl能够释放431.8 kJ能量。
你能根据以上所给的数据判断反应:
H2+Cl2=2HCl
是放热反应还是吸热反应?
化学反应中的热量变化该如何表示呢
1、定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式
不仅表明了化学反应中的物质变化,也表明了化学反应中的热量变化。
C(s)+ O2(g)==CO2(g) △H= - 393.6kJ/mol
【观察与思考1】化学方程式与热化学方程式有什么不同
C + O2===CO2
CaCO3(s)==CaO(s) + CO2(g) △H= + 178.5kJ/mol
化学方程式
C(s)+ O2(g)==CO2(g) △H= - 393.6kJ/mol
CaCO3===CaO + CO2
热化学方程式
标明物质的聚集状态,用g、l、s分别代表气态(gas)、
液态 (liquid)、固态(solid),不用写反应条件和沉淀、气体符号。
用△H 标明反应放出或吸收的热量,放热△H为“-”, 吸热△H为“+” ,单位为kJ/mol
高温
点燃
C(s)+ O2(g)==CO2(g) △H= - 393.6kJ/mol
2、热化学方程式表示的意义
1mol 固体碳与1mol 氧气完全反应生成1mol二氧化碳气体,放出393.6kJ的热量
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
【说一说】下列热化学方程式的意义
【观察与思考2】
下列热化学方程式有什么不同与联系
H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
热化学方程式中各物质前的化学计量数不表示分子个数,只表示物 质的量,因此可以是整数或简单分数。
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与化学计量数成正比 。
【观察与思考3】
下列热化学方程式有什么不同与联系
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
2H2O(l) =2H2(g) + O2(g) △H = + 571.6 kJ /mol
正逆反应的△H数值的绝对值相等,符号相反。
【例】 250C ,1.01×105Pa下,1g 硫粉在氧气中充分
燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
9.36 ×32=299.52 kJ
计算热量:1 mol 硫粉在氧气中充分燃烧放出热量
S (s) + O2 (g) = SO2 ( g ) △H = - 299.52 kJ /mol
写化学方程式:S + O2 = SO2
标聚集状态:S (s) + O2 (g) = SO2 ( g )
注明 △H:△H>0表示吸热, △H<0表示放 单位:kJ/mol
3g红热的碳和水蒸气完全反应,生成CO和H2,吸收32.8kJ热量,写出该反应的热化学方程式。
C(s)+H2O(g)==CO(g)+H2(g) △H= +131.2kJ/mol
汇报人:XXX
XX月XX日
化学反应中的热量
苏教版高中化学必修二课件
镁条的燃烧
化学反应中的能量变化,通常表现为热量的变化
高温冶炼铁
电池放电
闪电时产生氮氧化物
【活动与探究】
实验操作 实验现象 实验结论
【实验1】向试管中放入用砂纸打磨光亮的镁条,加入5mL 2mol/L 盐酸,用手触摸试管外壁,有什么感觉?
【实验2】向小烧杯加入约20g 氢氧化钡晶体,再加入约10g NH4Cl晶体,用玻璃棒搅拌,使充分混合,用手触摸烧杯外壁。
冰凉
试管外壁发热
镁与盐酸反应有热量放出
氢氧化钡与氯化铵反应需要吸收热量
1、放热反应:
一、放热化学 吸热反应
请结合所学的知识,请举出一些放热反应和吸热反应的例子?
吸收热量的化学反应。
有热量放出的化学反应。
吸热反应:
2、常见的放热反应、吸热反应
放热
反应
吸热
反应
酸碱中和反应:
所有的燃烧:
金属与酸与水反应:
大多数化合反应:
铵盐与碱反应:
大多数分解反应:
H2+CuO==Cu+H2O CO+CuO==Cu+CO2
C+CO2==2CO C + H2O ==CO+ H2
铝热反应:
高温
判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.高温煅烧石灰石
3.氧化钙与水的反应。
4.盐酸与氢氧化钠溶液反应
抢答
5.高温下木炭与二氧化碳反应生成一氧化碳。
6.炸药爆炸
7.Ca(OH)2和NH4Cl的反应
8.炽热的碳与H2O的反应
9.甲烷在氧气中的燃烧
生活应用
暧宝宝
暖贴的主要成分有木炭、铁粉、食盐。
请解释发热原理。
使用前黑色 使用后红棕色
为什么撕开包装后暖宝宝能发热呢?
猜想暖宝宝发热原因:
暖宝宝成份由铁、活性炭、无机盐、水等组成,可在空气中氧气的作用下发生放热反应。这种反应过程是从一打开真空包装的时候就开始的。是一个缓慢氧化的过程。
化学反应中为什么会伴随着能量转化?
一、从宏观角度分析(总能量)
二、从微观角度分析
(吸收能量)
旧化学键
破坏
原子
(放出能量)
新化学键
形成
吸收能量<放出能量
吸收能量>放出能量
放热反应
吸热反应
决定
请你试试:
已知拆开1 mol H2化学键需要消耗436.4 kJ能量,拆开1 mol Cl2中化学键需要消耗242.7 kJ能量,形成氯化氢分子中的1 mol
H-Cl能够释放431.8 kJ能量。
你能根据以上所给的数据判断反应:
H2+Cl2=2HCl
是放热反应还是吸热反应?
化学反应中的热量变化该如何表示呢
1、定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式
不仅表明了化学反应中的物质变化,也表明了化学反应中的热量变化。
C(s)+ O2(g)==CO2(g) △H= - 393.6kJ/mol
【观察与思考1】化学方程式与热化学方程式有什么不同
C + O2===CO2
CaCO3(s)==CaO(s) + CO2(g) △H= + 178.5kJ/mol
化学方程式
C(s)+ O2(g)==CO2(g) △H= - 393.6kJ/mol
CaCO3===CaO + CO2
热化学方程式
标明物质的聚集状态,用g、l、s分别代表气态(gas)、
液态 (liquid)、固态(solid),不用写反应条件和沉淀、气体符号。
用△H 标明反应放出或吸收的热量,放热△H为“-”, 吸热△H为“+” ,单位为kJ/mol
高温
点燃
C(s)+ O2(g)==CO2(g) △H= - 393.6kJ/mol
2、热化学方程式表示的意义
1mol 固体碳与1mol 氧气完全反应生成1mol二氧化碳气体,放出393.6kJ的热量
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
【说一说】下列热化学方程式的意义
【观察与思考2】
下列热化学方程式有什么不同与联系
H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
热化学方程式中各物质前的化学计量数不表示分子个数,只表示物 质的量,因此可以是整数或简单分数。
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与化学计量数成正比 。
【观察与思考3】
下列热化学方程式有什么不同与联系
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
2H2O(l) =2H2(g) + O2(g) △H = + 571.6 kJ /mol
正逆反应的△H数值的绝对值相等,符号相反。
【例】 250C ,1.01×105Pa下,1g 硫粉在氧气中充分
燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
9.36 ×32=299.52 kJ
计算热量:1 mol 硫粉在氧气中充分燃烧放出热量
S (s) + O2 (g) = SO2 ( g ) △H = - 299.52 kJ /mol
写化学方程式:S + O2 = SO2
标聚集状态:S (s) + O2 (g) = SO2 ( g )
注明 △H:△H>0表示吸热, △H<0表示放 单位:kJ/mol
3g红热的碳和水蒸气完全反应,生成CO和H2,吸收32.8kJ热量,写出该反应的热化学方程式。
C(s)+H2O(g)==CO(g)+H2(g) △H= +131.2kJ/mol
