苏教版(2019)高中化学 必修二 从海水中获得的化学物质(共34张ppt)
文档属性
| 名称 | 苏教版(2019)高中化学 必修二 从海水中获得的化学物质(共34张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 12:41:22 | ||
图片预览








文档简介
(共34张PPT)
汇报人:XXX
XX月XX日
苏教版高中化学必修二课件
从海水中获得的化学物质
个人自主学习,阅读课本P53-55,独立思考以下问题:
(1)回顾已学过的电解质和非电解质的概念,思考:常见的电解质有哪几类物质?
(2)阅读课本,对比强、弱电解质的定义,思考:强弱电解质的本质区别是什么?强电解质有哪些?弱电解质又有哪些?书写电离方程式时要注意哪些问题?
(3)什么是离子反应?怎样书写离子方程式?离子反应发生的条件是什么?
【先学指导】
在前面的内容中,我们一起探究过电解质和非电解质的性质,你还记得它们的涵义吗?
电解质:
非电解质:
常见的酸、碱、盐大多是电解质!
【先学检查】
在水溶液或熔融状态能够导电的化合物
在水溶液和熔融状态均不导电的化合物
电解质溶液具有导电性,物质的量浓度相等的不同电解质溶液,其导电能力是否相同?
【自主思考】
在4只相同的小烧杯中分别加入100 mL的物质的量浓度均为0.1 mol/L的盐酸溶液、氢氧化钠溶液、醋酸溶液、氨水,进行导电性实验。
【演示实验】
溶液 盐酸 氢氧化钠 醋酸 氨水
现象
亮
亮
暗
暗
在4只相同的小烧杯中分别加入100 mL的物质的量浓度均为0.1 mol/L的盐酸溶液、氢氧化钠溶液、醋酸溶液、氨水,进行导电性实验。
【演示实验】
相同的条件下,溶液自由移动离子的浓度越大,自由移动离子所带的电荷数越多,溶液的导电能力越好。
为什么物质的量浓度相同的醋酸溶液、氨水的导电能力明显弱于盐酸溶液、氢氧化钠溶液?
【释疑解惑】
对于以上四种溶液而言,物质的量浓度相同、所带的电荷数相同时,一定是其在水溶液中的电离程度不同。
强电解质 弱电解质
定 义
本质区别
电离方程式中的连接符号
电解质在溶液中的存在形式
举 例
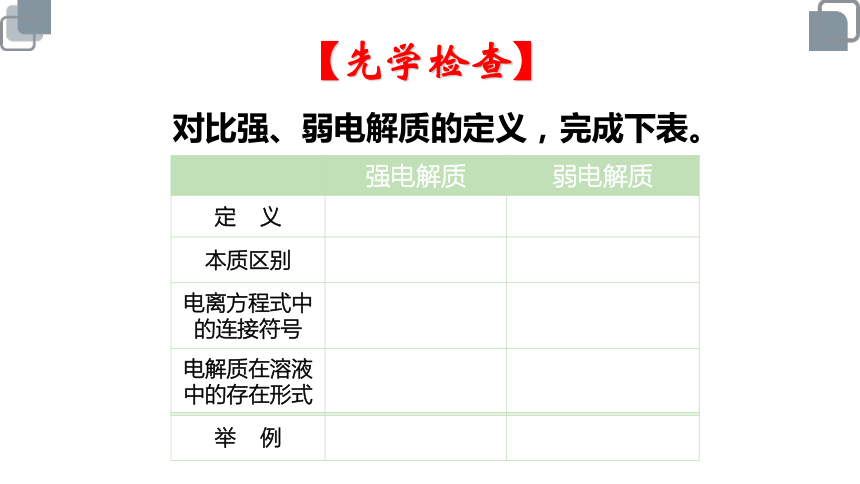
对比强、弱电解质的定义,完成下表。
【先学检查】
强电解质 弱电解质
定 义
本质区别
电离方程式中的连接符号
电解质在溶液中的存在形式
举 例
一、强弱电解质
是否完全电离
在水溶液中能完全电离
离子
离子和分子共存
强酸、强碱
绝大多数盐
弱酸、弱碱
水
【交流展示】
在水溶液中不完全电离
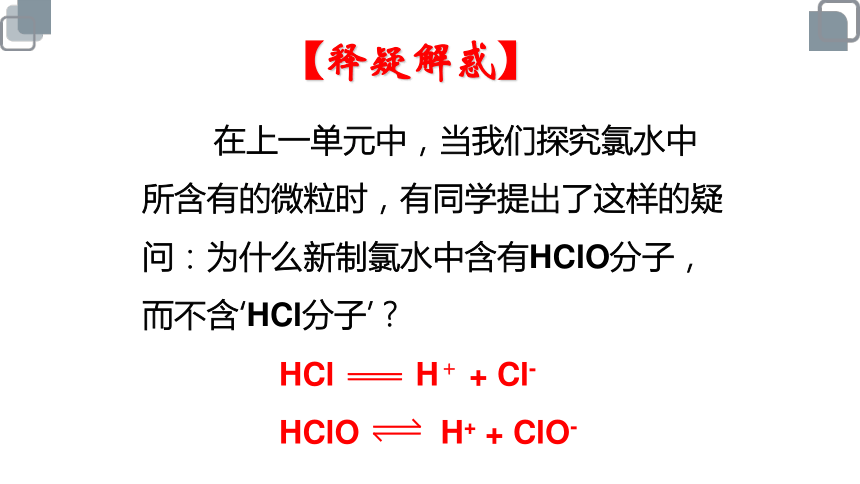
在上一单元中,当我们探究氯水中所含有的微粒时,有同学提出了这样的疑问:为什么新制氯水中含有HClO分子,而不含‘HCl分子’?
【释疑解惑】
HCl H+ + Cl-
HClO H+ + ClO-
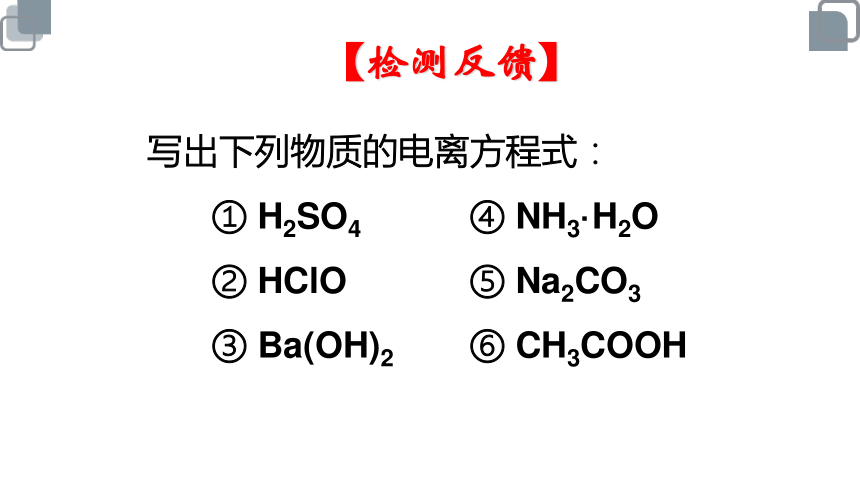
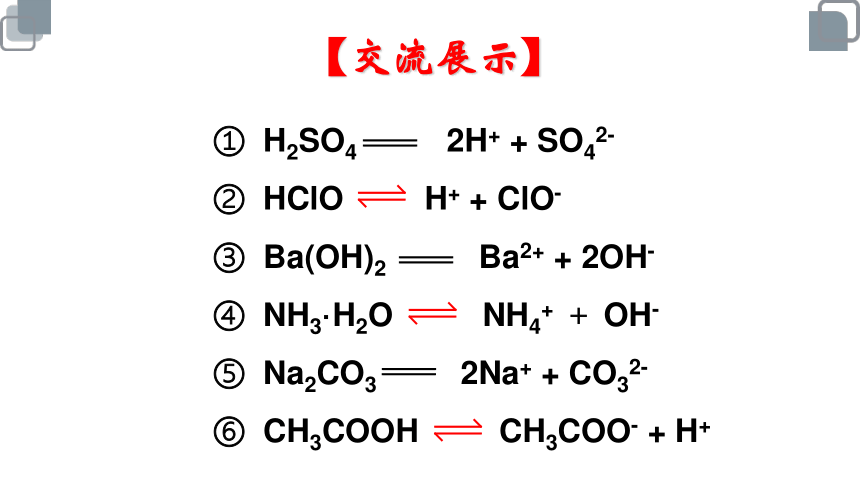
写出下列物质的电离方程式:
① H2SO4 ④ NH3·H2O
② HClO ⑤ Na2CO3
③ Ba(OH)2 ⑥ CH3COOH
【检测反馈】
① H2SO4 2H+ + SO42-
② HClO H+ + ClO-
③ Ba(OH)2 Ba2+ + 2OH-
④ NH3·H2O NH4+ + OH-
⑤ Na2CO3 2Na+ + CO32-
⑥ CH3COOH CH3COO- + H+
【交流展示】
我们在书写电离方程式时,要注意哪些问题?
判断强、弱电解质
离子的解离形式
质量守恒和电荷守恒
【小结反思】
实验一:在洁净的试管中加入1 mL CaCl2溶液,再向其中滴加1 mL Na2CO3溶液,振荡后,观察实验现象。
实验二:在洁净的试管中加入1 mL澄清石灰水,再向其中滴加1 mL Na2CO3溶液,振荡后,观察实验现象。
【分组实验】
自主思考:描述实验现象,书写上述反应的化学方程式。
小组讨论:参加反应的各物质在水溶液中主要以什么形式存在?哪些离子真正参加反应?哪些离子没有参加反应?这两种反应的实质是否相同?
【小组合作】
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
实验现象:产生白色沉淀
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
实验现象:产生白色沉淀
CaCO3↓+ 2NaCl
CaCO3↓+ 2NaOH
【小组展示】
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
【小组展示】
+
+
=
CO32- + Ca2+ = CaCO3↓
+
+
=
CO32- + Ca2+ = CaCO3↓
2Na+ + CO32-
2Na+ + 2Cl-
CaCO3↓
Ca2+ + 2Cl-
2Na+ + CO32-
Ca2+ + 2OH-
CaCO3↓
2Na+ + 2OH-
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
CO32- + Ca2+ = CaCO3↓
【小组展示】
二、离子反应
1、离子反应:
有离子参加的化学反应
2、离子方程式:
用实际参加反应的离子符号表示离子反应的式子
【自主学习】
阅读课本P54-55,“信息提示”!以碳酸钠溶液与盐酸反应为例,整理书写离子方程式的步骤,并思考:书写离子方程式时,要注意哪些问题?
二、离子反应
3、离子方程式的书写规则:
“写、拆、删、查”
①写:写出反应的化学方程式
②拆:把溶于水且完全电离的物质(易溶、强电解质)
拆成离子形式,难溶于水或溶于水难电离的物
质仍用化学式表示
③删:删去化学方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子数目(质量
守恒)和离子所带电荷总数(电荷守恒)是否
相同
【成果报告】
【检测反馈】
按照书写步骤,写出下列反应的离子方程式
①盐酸与氢氧化钠溶液反应:
H+ + OH- = H2O
②稀硫酸与氢氧化钾溶液反应:
H+ + OH- = H2O
③大理石与盐酸反应:
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
④碳酸钠溶液与过量的醋酸溶液反应:
CO32- + 2CH3COOH = 2CH3COO- + CO2↑ + H2O
在书写离子方程式时,究竟什么物质可以拆成离子形式,什么物质不可拆成离子形式?
【质疑拓展】
【检测反馈】
①盐酸与氢氧化钠溶液反应:
H+ + OH- = H2O
②稀硫酸与氢氧化钾溶液反应:
H+ + OH- = H2O
③大理石与盐酸反应:
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
④碳酸钠溶液与过量的醋酸溶液反应:
CO32- + 2CH3COOH = 2CH3COO- + CO2↑ + H2O
CaCO3
CO2
CH3COOH
H2O
CO2
H2O
【教师点拨】
可拆成离子形式的物质:
易溶的强电解质(强酸、强碱、盐)
不可拆成离子形式的物质:
难溶物
弱电解质
气体
单质
氧化物
与化学方程式相比,离子方程式有哪些特点?
【总结提升】
【检测反馈】
①盐酸与氢氧化钠溶液反应:
H+ + OH- = H2O
②稀硫酸与氢氧化钾溶液反应:
H+ + OH- = H2O
③大理石与盐酸反应:
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
④碳酸钠溶液与过量的醋酸溶液反应:
CO32- + 2CH3COOH = 2CH3COO- + CO2↑ + H2O
二、离子反应
4、离子方程式的意义:
①表示电解质之间发生反应的实质
实际参加反应的离子来表示
②表示所有同一类型的离子反应
【检测反馈】
离子方程式可以表示所有同一类型的离子反应。如:H+ + OH- = H2O可以表示 ( )
A、酸与碱生成盐和水的反应
B、酸与碱生成可溶性盐盐和水的反应
C、强酸与强碱生成盐和水的反应
D、强酸与强碱生成可溶性盐和水的反应
D
二、离子反应
回顾这堂课的学习,你是否了解强、弱电解质的本质区别与判断?是否对水溶液中发生的离子反应有了深入的认识?是否学会了用离子方程式表示真正发生的离子反应?是否体会到离子反应发生的条件?
【小结反思】
【小结反思】
完成学案P74-76
【课后作业】
写出下列反应的离子方程式
①锌与硫酸铜溶液反应
②氯化钠溶液与硝酸银溶液反应
③硫酸铜溶液与氢氧化钠溶液反应
④用醋酸溶液除水垢(CaCO3)反应
个人自主学习,阅读课本P55-56,独立思考以下问题:
(1)自然界中的镁主要以什么形式存在?镁制品在工业生产、日常生活中有哪些用途?
(2)小组讨论:如何从海水中提取金属镁?整个过程涉及到哪些化学反应?
(3)画出镁原子结构示意图,自主思考:镁在化学反应中易得电子还是易失电子?
(4)阅读课本,整理金属镁可以与哪些物质发生化学反应?
【先学指导】—镁的提取及应用
汇报人:XXX
XX月XX日
苏教版高中化学必修二课件
从海水中获得的化学物质
个人自主学习,阅读课本P53-55,独立思考以下问题:
(1)回顾已学过的电解质和非电解质的概念,思考:常见的电解质有哪几类物质?
(2)阅读课本,对比强、弱电解质的定义,思考:强弱电解质的本质区别是什么?强电解质有哪些?弱电解质又有哪些?书写电离方程式时要注意哪些问题?
(3)什么是离子反应?怎样书写离子方程式?离子反应发生的条件是什么?
【先学指导】
在前面的内容中,我们一起探究过电解质和非电解质的性质,你还记得它们的涵义吗?
电解质:
非电解质:
常见的酸、碱、盐大多是电解质!
【先学检查】
在水溶液或熔融状态能够导电的化合物
在水溶液和熔融状态均不导电的化合物
电解质溶液具有导电性,物质的量浓度相等的不同电解质溶液,其导电能力是否相同?
【自主思考】
在4只相同的小烧杯中分别加入100 mL的物质的量浓度均为0.1 mol/L的盐酸溶液、氢氧化钠溶液、醋酸溶液、氨水,进行导电性实验。
【演示实验】
溶液 盐酸 氢氧化钠 醋酸 氨水
现象
亮
亮
暗
暗
在4只相同的小烧杯中分别加入100 mL的物质的量浓度均为0.1 mol/L的盐酸溶液、氢氧化钠溶液、醋酸溶液、氨水,进行导电性实验。
【演示实验】
相同的条件下,溶液自由移动离子的浓度越大,自由移动离子所带的电荷数越多,溶液的导电能力越好。
为什么物质的量浓度相同的醋酸溶液、氨水的导电能力明显弱于盐酸溶液、氢氧化钠溶液?
【释疑解惑】
对于以上四种溶液而言,物质的量浓度相同、所带的电荷数相同时,一定是其在水溶液中的电离程度不同。
强电解质 弱电解质
定 义
本质区别
电离方程式中的连接符号
电解质在溶液中的存在形式
举 例
对比强、弱电解质的定义,完成下表。
【先学检查】
强电解质 弱电解质
定 义
本质区别
电离方程式中的连接符号
电解质在溶液中的存在形式
举 例
一、强弱电解质
是否完全电离
在水溶液中能完全电离
离子
离子和分子共存
强酸、强碱
绝大多数盐
弱酸、弱碱
水
【交流展示】
在水溶液中不完全电离
在上一单元中,当我们探究氯水中所含有的微粒时,有同学提出了这样的疑问:为什么新制氯水中含有HClO分子,而不含‘HCl分子’?
【释疑解惑】
HCl H+ + Cl-
HClO H+ + ClO-
写出下列物质的电离方程式:
① H2SO4 ④ NH3·H2O
② HClO ⑤ Na2CO3
③ Ba(OH)2 ⑥ CH3COOH
【检测反馈】
① H2SO4 2H+ + SO42-
② HClO H+ + ClO-
③ Ba(OH)2 Ba2+ + 2OH-
④ NH3·H2O NH4+ + OH-
⑤ Na2CO3 2Na+ + CO32-
⑥ CH3COOH CH3COO- + H+
【交流展示】
我们在书写电离方程式时,要注意哪些问题?
判断强、弱电解质
离子的解离形式
质量守恒和电荷守恒
【小结反思】
实验一:在洁净的试管中加入1 mL CaCl2溶液,再向其中滴加1 mL Na2CO3溶液,振荡后,观察实验现象。
实验二:在洁净的试管中加入1 mL澄清石灰水,再向其中滴加1 mL Na2CO3溶液,振荡后,观察实验现象。
【分组实验】
自主思考:描述实验现象,书写上述反应的化学方程式。
小组讨论:参加反应的各物质在水溶液中主要以什么形式存在?哪些离子真正参加反应?哪些离子没有参加反应?这两种反应的实质是否相同?
【小组合作】
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
实验现象:产生白色沉淀
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
实验现象:产生白色沉淀
CaCO3↓+ 2NaCl
CaCO3↓+ 2NaOH
【小组展示】
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
【小组展示】
+
+
=
CO32- + Ca2+ = CaCO3↓
+
+
=
CO32- + Ca2+ = CaCO3↓
2Na+ + CO32-
2Na+ + 2Cl-
CaCO3↓
Ca2+ + 2Cl-
2Na+ + CO32-
Ca2+ + 2OH-
CaCO3↓
2Na+ + 2OH-
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
CO32- + Ca2+ = CaCO3↓
【小组展示】
二、离子反应
1、离子反应:
有离子参加的化学反应
2、离子方程式:
用实际参加反应的离子符号表示离子反应的式子
【自主学习】
阅读课本P54-55,“信息提示”!以碳酸钠溶液与盐酸反应为例,整理书写离子方程式的步骤,并思考:书写离子方程式时,要注意哪些问题?
二、离子反应
3、离子方程式的书写规则:
“写、拆、删、查”
①写:写出反应的化学方程式
②拆:把溶于水且完全电离的物质(易溶、强电解质)
拆成离子形式,难溶于水或溶于水难电离的物
质仍用化学式表示
③删:删去化学方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子数目(质量
守恒)和离子所带电荷总数(电荷守恒)是否
相同
【成果报告】
【检测反馈】
按照书写步骤,写出下列反应的离子方程式
①盐酸与氢氧化钠溶液反应:
H+ + OH- = H2O
②稀硫酸与氢氧化钾溶液反应:
H+ + OH- = H2O
③大理石与盐酸反应:
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
④碳酸钠溶液与过量的醋酸溶液反应:
CO32- + 2CH3COOH = 2CH3COO- + CO2↑ + H2O
在书写离子方程式时,究竟什么物质可以拆成离子形式,什么物质不可拆成离子形式?
【质疑拓展】
【检测反馈】
①盐酸与氢氧化钠溶液反应:
H+ + OH- = H2O
②稀硫酸与氢氧化钾溶液反应:
H+ + OH- = H2O
③大理石与盐酸反应:
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
④碳酸钠溶液与过量的醋酸溶液反应:
CO32- + 2CH3COOH = 2CH3COO- + CO2↑ + H2O
CaCO3
CO2
CH3COOH
H2O
CO2
H2O
【教师点拨】
可拆成离子形式的物质:
易溶的强电解质(强酸、强碱、盐)
不可拆成离子形式的物质:
难溶物
弱电解质
气体
单质
氧化物
与化学方程式相比,离子方程式有哪些特点?
【总结提升】
【检测反馈】
①盐酸与氢氧化钠溶液反应:
H+ + OH- = H2O
②稀硫酸与氢氧化钾溶液反应:
H+ + OH- = H2O
③大理石与盐酸反应:
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
④碳酸钠溶液与过量的醋酸溶液反应:
CO32- + 2CH3COOH = 2CH3COO- + CO2↑ + H2O
二、离子反应
4、离子方程式的意义:
①表示电解质之间发生反应的实质
实际参加反应的离子来表示
②表示所有同一类型的离子反应
【检测反馈】
离子方程式可以表示所有同一类型的离子反应。如:H+ + OH- = H2O可以表示 ( )
A、酸与碱生成盐和水的反应
B、酸与碱生成可溶性盐盐和水的反应
C、强酸与强碱生成盐和水的反应
D、强酸与强碱生成可溶性盐和水的反应
D
二、离子反应
回顾这堂课的学习,你是否了解强、弱电解质的本质区别与判断?是否对水溶液中发生的离子反应有了深入的认识?是否学会了用离子方程式表示真正发生的离子反应?是否体会到离子反应发生的条件?
【小结反思】
【小结反思】
完成学案P74-76
【课后作业】
写出下列反应的离子方程式
①锌与硫酸铜溶液反应
②氯化钠溶液与硝酸银溶液反应
③硫酸铜溶液与氢氧化钠溶液反应
④用醋酸溶液除水垢(CaCO3)反应
个人自主学习,阅读课本P55-56,独立思考以下问题:
(1)自然界中的镁主要以什么形式存在?镁制品在工业生产、日常生活中有哪些用途?
(2)小组讨论:如何从海水中提取金属镁?整个过程涉及到哪些化学反应?
(3)画出镁原子结构示意图,自主思考:镁在化学反应中易得电子还是易失电子?
(4)阅读课本,整理金属镁可以与哪些物质发生化学反应?
【先学指导】—镁的提取及应用
