2.4化学反应的调控 (含解析)同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 (含解析)同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 134.4KB | ||
| 资源类型 | 教案 | ||
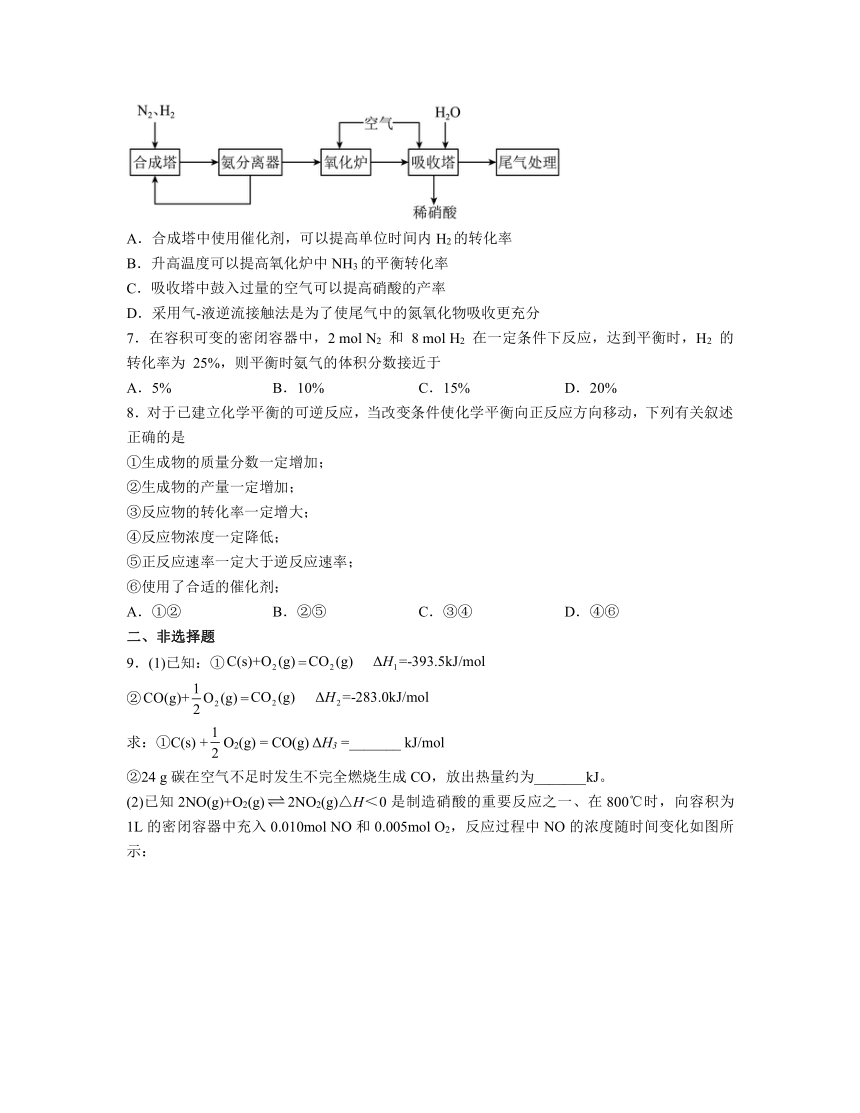
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-14 22:16:00 | ||
图片预览


文档简介
2.4化学反应的调控同步练习题
一、选择题
1.下列科学家或研究团队与其研究贡献匹配错误的是
A.侯德榜——联合制碱
B.盖斯——平衡移动原理
C.中科院大连化学物理研究所——合成氨的催化剂
D.徐光宪——稀土元素分离及应用
2.下列关于化工生产的说法错误的是
A.生产条件的选择只考虑转化率 B.生产过程中要考虑“废热”利用
C.厂址的选择要考虑环境保护 D.原料的选择要考虑成本
3.对可逆反应2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向逆反应方向移动 ②升高温度,平衡向逆反应方向移动,v正减小 ③缩小体积使压强增大一倍,平衡不移动,v正、v逆不变 ④增大B的浓度,v正>v逆 ⑤加入催化剂,B的转化率提高
A.①② B.④⑤ C.③ D.④
4.在体积可变的密闭容器中,甲醇在浓硫酸的作用下发生如下反应: 。下列说法正确的是
A.向密闭容器中通入,反应放出的热量为
B.浓硫酸在该反应中只作催化剂
C.
D.升高温度或压缩体积均可加快该反应的反应速率
5.下列措施或事实不能用化学平衡移动原理解释的是
A.将NO2平衡球浸泡在冰水中颜色变浅
B.工业合成氨气时使用过量的氮气
C.打开可乐盖后看到大量的气泡逸出
D.使用催化剂,使二氧化硫和氧气在一定条件下转化为三氧化硫
6.工业常采用氨氧化法制硝酸,主要工艺流程如图所示;将氨和空气(氧∶氮≈2∶1)混合通入灼热的铂铑合金网,发生反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H <0, 生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,2NO(g)+O2(g)=2NO2(g) H =-116.4 kJ·mol-1随后将二氧化氮通入水中制取硝酸;吸收塔排放的尾气中含有少量的NO、NO2等氮氧化物。工业以石灰乳为试剂,采用气-液逆流接触法(尾气从处理设备的底部进入,石灰乳从设备顶部喷淋)处理尾气;下列有关硝酸工业制备说法不正确的是
A.合成塔中使用催化剂,可以提高单位时间内H2的转化率
B.升高温度可以提高氧化炉中NH3的平衡转化率
C.吸收塔中鼓入过量的空气可以提高硝酸的产率
D.采用气-液逆流接触法是为了使尾气中的氮氧化物吸收更充分
7.在容积可变的密闭容器中,2 mol N2 和 8 mol H2 在一定条件下反应,达到平衡时,H2 的转化率为 25%,则平衡时氨气的体积分数接近于
A.5% B.10% C.15% D.20%
8.对于已建立化学平衡的可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是
①生成物的质量分数一定增加;
②生成物的产量一定增加;
③反应物的转化率一定增大;
④反应物浓度一定降低;
⑤正反应速率一定大于逆反应速率;
⑥使用了合适的催化剂;
A.①② B.②⑤ C.③④ D.④⑥
二、非选择题
9.(1)已知:①=
②=
求:①C(s) +O2(g) = CO(g) ΔH3 =_______ kJ/mol
②24 g碳在空气不足时发生不完全燃烧生成CO,放出热量约为_______kJ。
(2)已知2NO(g)+O2(g)2NO2(g)△H<0是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005mol O2,反应过程中NO的浓度随时间变化如图所示:
请回答:
①2min内,v(O2)=_______mol/(L min)。
②升高温度,平衡向_______(填“正”或“逆”)反应方向移动。
③平衡时,NO的转化率是_______。
④2min后化学反应达到平衡状态以下判断正确的是_______。
A、ν正(NO2)= ν逆(O2) B、ν正(NO) = ν逆(NO2) C、ν正(NO)= ν逆(O2)
10.CH3OH(g)+H2O(g)CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率______(填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率__________。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为__________。
(3)判断该可逆反应达到平衡状态的依据是(填序号)_____。
A. v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D .CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方 向移动的是_______________(填序号)。
A.升高温度 B.降低温度 C.增大压强
【参考答案】
一、选择题
1.B
解析:A.侯德榜先生的贡献是联合制碱法制纯碱,故A正确;
B.盖斯先生的贡献是提出了盖斯定律用于计算反应热,故B错误;
C.中科院大连化学物理研究所合成氨的催化剂,故C正确;
D.徐光宪先生的贡献是提出了稀土元素分离及应用的方法,故D正确;
故选B。
2.A
解析:在化工生产中,原料的选择要考虑成本,厂址的选择要考虑环境保护,生产过程中要考虑“废热”利用,生产条件的选择不但要考虑转化率,还要考虑反应速率,A错误,故选A。
3.D
解析:①A是固体,增加A的量,平衡不移动,故①错误;
②2A(s)+3B(g)C(g)+2D(g),ΔH<0,正反应放热,升高温度,平衡向逆反应方向移动,但v(正)、v(逆)均增大,故②错误;
③2A(s)+3B(g)C(g)+2D(g),反应前后气体系数和不变,压强增大一倍,平衡不移动,v正、v逆均增大,故③错误;
④增大B的浓度,反应物浓度增大,平衡正向移动,所以v正>v逆,故④正确;
⑤加入催化剂,平衡不移动,B的转化率不变,故⑤错误;
故答案选D。
4.D
解析:A.可逆反应达到平衡,反应物不可能完全转化,所以放热量不可能达到热化学方程式表达的放热量,描述错误,不符题意;
B.浓硫酸同时做吸水剂,吸收生成的水,促进反应物更多转化,描述错误,不符题意;
C.速率值未标正逆,故无法确定速率比例关系,描述错误,不符题意;
D.升温,物质能量升高,更多分子达到活化状态,增大有效碰撞概率;压缩体积,单位体积内活化分子数量上升,增大有效碰撞概率;所以升温或压缩体积均可加快反应速率,描述正确,符合题意;
综上,本题应选D。
5.D
解析:A.存在平衡2NO2(g)N2O4(g),该反应为放热反应,浸泡在冰水中,温度降低平衡正向移动,NO2浓度变小,颜色变浅,可以用化学平衡移动原理解释,A不符合题意;
B.氢气的成本高于氮气,过量的氮气可以使平衡正向移动,增大氢气的转化率,可以化学平衡移动原理解释,B不符合题意;
C.可乐中存在平衡CO2(g)+H2O(l)H2CO3(g),打开瓶盖后压强减小,平衡向生成气体的方向移动,二氧化碳逸出,能用平衡移动原理解释,C不符合题意;
D.催化剂可以提高反应速率,但不改变平衡,不能用平衡移动原理解释,D符合题意;
综上所述答案为D。
6.B
解析:A.催化剂可以加快反应速率,提高提高单位时间内H2的转化率,A正确;
B.合成氨的反应为放热反应,升高温度会降低氨气的平衡转化率,B错误;
C.鼓入过量空气可以增大NO的转化率,提高NO2的产率,同时也可以增大压强,提高NO2的溶解度,提高硝酸的产率,C正确;
D.采用气-液逆流接触法可以增大氮氧化物与石灰乳的接触的面积,充分吸收,D正确;
综上所述答案为B。
7.C
解析:在容积可变的密闭容器中,2molN2和8molH2在一定条件下反应,达到平衡时,H2的转化率为25%,消耗的氢气为2mol,则:
平衡时氨气的体积分数= ,故选:C。
8.B
解析:①总质量不变,向正反应移动,生成物的质量分数一定增大,若生成物质量增大小于混合物总质量增大,生成物的质量分数可能降低,故①错误;
②平衡向正反应移动,生成物会增加,即生成物的产量一定增加,故②正确;
③降低生成物的浓度,平衡向正反应方向移动,反应物的转化率一定增大,但增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故③错误;
④如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大,故④错误;
⑤平衡向正反应移动,正反应速率一定大于逆反应速率,故⑤正确;
⑥加入催化剂,正逆反应速率同等程度增大,平衡不移动,故⑥错误;
综上所述②⑤正确,
故选:B。
二、非选择题
9. -110.5 221 1.25×10-3 逆 50% B
解析:(1)①根据盖斯定律可知,将①-②可得C(s) +O2(g) = CO(g) ΔH3=(-393.5kJ/mol)-(-283.0 kJ/mol)=-110.5kJ/mol;
②24 g碳的物质的量为=2mol,1mol C不完全燃烧放出110.5kJ能量,所以2mol C在空气不足时发生不完全燃烧生成CO,放出热量约为110.5kJ×2=221kJ;
(2)①2min内Δc(NO)=0.005mol/L,则Δc(O2)=Δc(NO)=0.0025mol/L,v(O2)===1.25×10-3 mol/(L min);
②该反应正向为放热反应,因此升高温度平衡逆向移动;
③由图可知,反应自2min后达到平衡,反应开始至平衡时,Δc(NO)=0.005mol/L,则平衡时,NO的转化率是×100%=50%;
④反应达到平衡时,同一物质正逆反应速率相等,不同物质之间的正逆速率之比等于其计量数之比,2NO(g)+O2(g)2NO2(g)中NO与NO2的系数相同,故A、C错误,B项正确,故答案为B。
10. 减小 增大 0.01mol/(L·s) CD BC
【分析】(1)在其它条件不变的情况下,针对可逆反应,降低温度,正逆反应速率均减小;加压,体积缩小,浓度增大,正逆反应速率均增大;
(2)根据气体的压强之比和气体的总量成正比规律,结合三段式列方程进行计算求出甲醇的变化量,最后根据v= c/ t计算。
(3)根据平衡状态的判断的标准进行分析:v正=v逆,各组分浓度保持不变及由此衍生出的物理量进行分析判断;
(4)根据平衡移动规律进行分析。
解析:(1)在其它条件不变的情况下降低温度,正逆反应速率均减小;在其它条件不变的情况下加压,体积缩小,浓度增大,正逆反应速率均增大;
故答案为减小;增大 ;
(2)密闭容器(体积为2L)中发生可逆反应,设甲醇的变化量为xmol,
CH3OH(g)+H2O(g)CO2(g)+3H2(g);
起始量 1mol 3mol 0 0
变化量 x x x 3x
20s后量 1-x 3-x x 3x
根据气体的压强之比和气体的总量成正比可知,(1-x+3-x+x+3x):(1+3)=1.2:1,计算出x=0.4mol;甲醇表示该反应的速率为(0.4/2)/20=0.01mol/(L·s);
故答案为0.01mol/(L·s);
(3)A. v正(CH3OH)=v正(CO2)都表示正反应速率,自始至终都按1:1进行,不能说明到达平衡,故A错误;
B.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故B错误;
C.混合气体的质量不变,混合气体的物质的量增大,随反应进行平均相对分子质量减小,混合气体的平均相对分子质量不变,说明到达平衡,故C正确;
D.平衡时各物质的浓度保持不变, CH3OH、H2O、CO2、H2的浓度都不再发生变化,说明到达平衡,故D正确;
故答案选CD。
(4)A.该反应正反应是吸热反应,升高温度,平衡正反应移动,故A错误;
B.该反应正反应是吸热反应,降低温度,平衡向逆反应移动,故B正确;
C.该反应正反应是体积增大的反应,增大压强,平衡逆反应移动,故C正确;
故答案选BC
一、选择题
1.下列科学家或研究团队与其研究贡献匹配错误的是
A.侯德榜——联合制碱
B.盖斯——平衡移动原理
C.中科院大连化学物理研究所——合成氨的催化剂
D.徐光宪——稀土元素分离及应用
2.下列关于化工生产的说法错误的是
A.生产条件的选择只考虑转化率 B.生产过程中要考虑“废热”利用
C.厂址的选择要考虑环境保护 D.原料的选择要考虑成本
3.对可逆反应2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向逆反应方向移动 ②升高温度,平衡向逆反应方向移动,v正减小 ③缩小体积使压强增大一倍,平衡不移动,v正、v逆不变 ④增大B的浓度,v正>v逆 ⑤加入催化剂,B的转化率提高
A.①② B.④⑤ C.③ D.④
4.在体积可变的密闭容器中,甲醇在浓硫酸的作用下发生如下反应: 。下列说法正确的是
A.向密闭容器中通入,反应放出的热量为
B.浓硫酸在该反应中只作催化剂
C.
D.升高温度或压缩体积均可加快该反应的反应速率
5.下列措施或事实不能用化学平衡移动原理解释的是
A.将NO2平衡球浸泡在冰水中颜色变浅
B.工业合成氨气时使用过量的氮气
C.打开可乐盖后看到大量的气泡逸出
D.使用催化剂,使二氧化硫和氧气在一定条件下转化为三氧化硫
6.工业常采用氨氧化法制硝酸,主要工艺流程如图所示;将氨和空气(氧∶氮≈2∶1)混合通入灼热的铂铑合金网,发生反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H <0, 生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,2NO(g)+O2(g)=2NO2(g) H =-116.4 kJ·mol-1随后将二氧化氮通入水中制取硝酸;吸收塔排放的尾气中含有少量的NO、NO2等氮氧化物。工业以石灰乳为试剂,采用气-液逆流接触法(尾气从处理设备的底部进入,石灰乳从设备顶部喷淋)处理尾气;下列有关硝酸工业制备说法不正确的是
A.合成塔中使用催化剂,可以提高单位时间内H2的转化率
B.升高温度可以提高氧化炉中NH3的平衡转化率
C.吸收塔中鼓入过量的空气可以提高硝酸的产率
D.采用气-液逆流接触法是为了使尾气中的氮氧化物吸收更充分
7.在容积可变的密闭容器中,2 mol N2 和 8 mol H2 在一定条件下反应,达到平衡时,H2 的转化率为 25%,则平衡时氨气的体积分数接近于
A.5% B.10% C.15% D.20%
8.对于已建立化学平衡的可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是
①生成物的质量分数一定增加;
②生成物的产量一定增加;
③反应物的转化率一定增大;
④反应物浓度一定降低;
⑤正反应速率一定大于逆反应速率;
⑥使用了合适的催化剂;
A.①② B.②⑤ C.③④ D.④⑥
二、非选择题
9.(1)已知:①=
②=
求:①C(s) +O2(g) = CO(g) ΔH3 =_______ kJ/mol
②24 g碳在空气不足时发生不完全燃烧生成CO,放出热量约为_______kJ。
(2)已知2NO(g)+O2(g)2NO2(g)△H<0是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005mol O2,反应过程中NO的浓度随时间变化如图所示:
请回答:
①2min内,v(O2)=_______mol/(L min)。
②升高温度,平衡向_______(填“正”或“逆”)反应方向移动。
③平衡时,NO的转化率是_______。
④2min后化学反应达到平衡状态以下判断正确的是_______。
A、ν正(NO2)= ν逆(O2) B、ν正(NO) = ν逆(NO2) C、ν正(NO)= ν逆(O2)
10.CH3OH(g)+H2O(g)CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率______(填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率__________。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为__________。
(3)判断该可逆反应达到平衡状态的依据是(填序号)_____。
A. v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D .CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方 向移动的是_______________(填序号)。
A.升高温度 B.降低温度 C.增大压强
【参考答案】
一、选择题
1.B
解析:A.侯德榜先生的贡献是联合制碱法制纯碱,故A正确;
B.盖斯先生的贡献是提出了盖斯定律用于计算反应热,故B错误;
C.中科院大连化学物理研究所合成氨的催化剂,故C正确;
D.徐光宪先生的贡献是提出了稀土元素分离及应用的方法,故D正确;
故选B。
2.A
解析:在化工生产中,原料的选择要考虑成本,厂址的选择要考虑环境保护,生产过程中要考虑“废热”利用,生产条件的选择不但要考虑转化率,还要考虑反应速率,A错误,故选A。
3.D
解析:①A是固体,增加A的量,平衡不移动,故①错误;
②2A(s)+3B(g)C(g)+2D(g),ΔH<0,正反应放热,升高温度,平衡向逆反应方向移动,但v(正)、v(逆)均增大,故②错误;
③2A(s)+3B(g)C(g)+2D(g),反应前后气体系数和不变,压强增大一倍,平衡不移动,v正、v逆均增大,故③错误;
④增大B的浓度,反应物浓度增大,平衡正向移动,所以v正>v逆,故④正确;
⑤加入催化剂,平衡不移动,B的转化率不变,故⑤错误;
故答案选D。
4.D
解析:A.可逆反应达到平衡,反应物不可能完全转化,所以放热量不可能达到热化学方程式表达的放热量,描述错误,不符题意;
B.浓硫酸同时做吸水剂,吸收生成的水,促进反应物更多转化,描述错误,不符题意;
C.速率值未标正逆,故无法确定速率比例关系,描述错误,不符题意;
D.升温,物质能量升高,更多分子达到活化状态,增大有效碰撞概率;压缩体积,单位体积内活化分子数量上升,增大有效碰撞概率;所以升温或压缩体积均可加快反应速率,描述正确,符合题意;
综上,本题应选D。
5.D
解析:A.存在平衡2NO2(g)N2O4(g),该反应为放热反应,浸泡在冰水中,温度降低平衡正向移动,NO2浓度变小,颜色变浅,可以用化学平衡移动原理解释,A不符合题意;
B.氢气的成本高于氮气,过量的氮气可以使平衡正向移动,增大氢气的转化率,可以化学平衡移动原理解释,B不符合题意;
C.可乐中存在平衡CO2(g)+H2O(l)H2CO3(g),打开瓶盖后压强减小,平衡向生成气体的方向移动,二氧化碳逸出,能用平衡移动原理解释,C不符合题意;
D.催化剂可以提高反应速率,但不改变平衡,不能用平衡移动原理解释,D符合题意;
综上所述答案为D。
6.B
解析:A.催化剂可以加快反应速率,提高提高单位时间内H2的转化率,A正确;
B.合成氨的反应为放热反应,升高温度会降低氨气的平衡转化率,B错误;
C.鼓入过量空气可以增大NO的转化率,提高NO2的产率,同时也可以增大压强,提高NO2的溶解度,提高硝酸的产率,C正确;
D.采用气-液逆流接触法可以增大氮氧化物与石灰乳的接触的面积,充分吸收,D正确;
综上所述答案为B。
7.C
解析:在容积可变的密闭容器中,2molN2和8molH2在一定条件下反应,达到平衡时,H2的转化率为25%,消耗的氢气为2mol,则:
平衡时氨气的体积分数= ,故选:C。
8.B
解析:①总质量不变,向正反应移动,生成物的质量分数一定增大,若生成物质量增大小于混合物总质量增大,生成物的质量分数可能降低,故①错误;
②平衡向正反应移动,生成物会增加,即生成物的产量一定增加,故②正确;
③降低生成物的浓度,平衡向正反应方向移动,反应物的转化率一定增大,但增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故③错误;
④如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大,故④错误;
⑤平衡向正反应移动,正反应速率一定大于逆反应速率,故⑤正确;
⑥加入催化剂,正逆反应速率同等程度增大,平衡不移动,故⑥错误;
综上所述②⑤正确,
故选:B。
二、非选择题
9. -110.5 221 1.25×10-3 逆 50% B
解析:(1)①根据盖斯定律可知,将①-②可得C(s) +O2(g) = CO(g) ΔH3=(-393.5kJ/mol)-(-283.0 kJ/mol)=-110.5kJ/mol;
②24 g碳的物质的量为=2mol,1mol C不完全燃烧放出110.5kJ能量,所以2mol C在空气不足时发生不完全燃烧生成CO,放出热量约为110.5kJ×2=221kJ;
(2)①2min内Δc(NO)=0.005mol/L,则Δc(O2)=Δc(NO)=0.0025mol/L,v(O2)===1.25×10-3 mol/(L min);
②该反应正向为放热反应,因此升高温度平衡逆向移动;
③由图可知,反应自2min后达到平衡,反应开始至平衡时,Δc(NO)=0.005mol/L,则平衡时,NO的转化率是×100%=50%;
④反应达到平衡时,同一物质正逆反应速率相等,不同物质之间的正逆速率之比等于其计量数之比,2NO(g)+O2(g)2NO2(g)中NO与NO2的系数相同,故A、C错误,B项正确,故答案为B。
10. 减小 增大 0.01mol/(L·s) CD BC
【分析】(1)在其它条件不变的情况下,针对可逆反应,降低温度,正逆反应速率均减小;加压,体积缩小,浓度增大,正逆反应速率均增大;
(2)根据气体的压强之比和气体的总量成正比规律,结合三段式列方程进行计算求出甲醇的变化量,最后根据v= c/ t计算。
(3)根据平衡状态的判断的标准进行分析:v正=v逆,各组分浓度保持不变及由此衍生出的物理量进行分析判断;
(4)根据平衡移动规律进行分析。
解析:(1)在其它条件不变的情况下降低温度,正逆反应速率均减小;在其它条件不变的情况下加压,体积缩小,浓度增大,正逆反应速率均增大;
故答案为减小;增大 ;
(2)密闭容器(体积为2L)中发生可逆反应,设甲醇的变化量为xmol,
CH3OH(g)+H2O(g)CO2(g)+3H2(g);
起始量 1mol 3mol 0 0
变化量 x x x 3x
20s后量 1-x 3-x x 3x
根据气体的压强之比和气体的总量成正比可知,(1-x+3-x+x+3x):(1+3)=1.2:1,计算出x=0.4mol;甲醇表示该反应的速率为(0.4/2)/20=0.01mol/(L·s);
故答案为0.01mol/(L·s);
(3)A. v正(CH3OH)=v正(CO2)都表示正反应速率,自始至终都按1:1进行,不能说明到达平衡,故A错误;
B.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故B错误;
C.混合气体的质量不变,混合气体的物质的量增大,随反应进行平均相对分子质量减小,混合气体的平均相对分子质量不变,说明到达平衡,故C正确;
D.平衡时各物质的浓度保持不变, CH3OH、H2O、CO2、H2的浓度都不再发生变化,说明到达平衡,故D正确;
故答案选CD。
(4)A.该反应正反应是吸热反应,升高温度,平衡正反应移动,故A错误;
B.该反应正反应是吸热反应,降低温度,平衡向逆反应移动,故B正确;
C.该反应正反应是体积增大的反应,增大压强,平衡逆反应移动,故C正确;
故答案选BC
