2.4化学反应的调控 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 368.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-15 09:27:58 | ||
图片预览


文档简介
2.4化学反应的调控同步练习题
一、选择题
1.对可逆反应2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向逆反应方向移动 ②升高温度,平衡向逆反应方向移动,v正减小 ③缩小体积使压强增大一倍,平衡不移动,v正、v逆不变 ④增大B的浓度,v正>v逆 ⑤加入催化剂,B的转化率提高
A.①② B.④⑤ C.③ D.④
2.下列措施与化学反应速率无关的是
A.炉膛内用煤粉代替煤块 B.食物冷藏在冰箱
C.工业合成氨时,及时将氨气液化分离 D.在铁制品表面喷涂油漆
3.氨基甲酸铵发生分解的化学方程式为。在一定温度下,向恒容密闭容器中投入一定量氨基甲酸铵,下列叙述中不能说明该反应达到平衡状态的是
A.
B.混合气体的平均相对分子质量不再发生变化
C.混合气体的密度不再发生变化
D.混合气体的总物质的量不再发生变化
4.合成氨反应为N2(g)+3H2(g)2NH3(g)。图1表示在一定温度下此反应过程中的能量变化。图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量,平衡时NH3的质量分数w(NH3)的变化曲线。下列说法正确的是
A.该反应为自发反应,由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其他条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为b
C.图3中,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
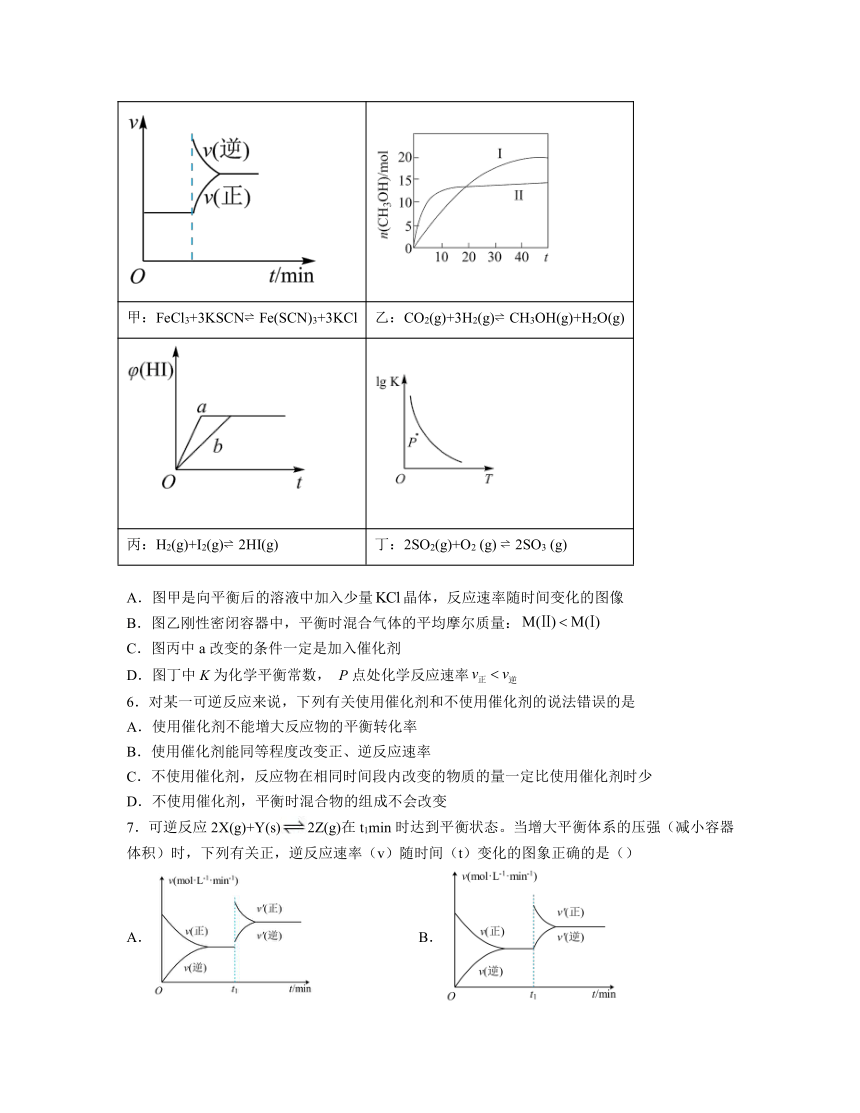
5.下列叙述与图中甲、乙、丙、丁相符合的是
甲:FeCl3+3KSCN Fe(SCN)3+3KCl 乙:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
丙:H2(g)+I2(g) 2HI(g) 丁:2SO2(g)+O2 (g) 2SO3 (g)
A.图甲是向平衡后的溶液中加入少量晶体,反应速率随时间变化的图像
B.图乙刚性密闭容器中,平衡时混合气体的平均摩尔质量:
C.图丙中a改变的条件一定是加入催化剂
D.图丁中K为化学平衡常数, P点处化学反应速率
6.对某一可逆反应来说,下列有关使用催化剂和不使用催化剂的说法错误的是
A.使用催化剂不能增大反应物的平衡转化率
B.使用催化剂能同等程度改变正、逆反应速率
C.不使用催化剂,反应物在相同时间段内改变的物质的量一定比使用催化剂时少
D.不使用催化剂,平衡时混合物的组成不会改变
7.可逆反应2X(g)+Y(s)2Z(g)在t1min时达到平衡状态。当增大平衡体系的压强(减小容器体积)时,下列有关正,逆反应速率(v)随时间(t)变化的图象正确的是()
A. B.
C. D.
8.压强变化不会使下列化学反应的平衡发生移动的是( )
A. B.
C. D.
二、非选择题
9.CH4—CO2催化重整是减少温室气体排放的重要途径。回答下列问题:
(1)已知:
C(s)+2H2(g) = CH4(g) ΔH= —75kJ·mol—1
C(s)+O2(g)= CO2(g) ΔH = —394kJ·mol—1
C(s)+O2(g)= CO(g) ΔH= —111 kJ·mol—1
则催化重整反应CH4(g)+CO2(g) = 2CO(g)+2H2(g)的ΔH =___kJ·mol—1;从温度和压强的角度考虑,有利于提高CH4平衡转化率的条件是_____。
(2)催化重整时催化剂的活性随积碳的增多而减弱,有关积碳反应和消碳反应的数据如表:
积碳反应/消碳反应 催化剂 活化能/kJ·mol—1
CH4(g)= C(s)+2H2(g) ΔH =+75 kJ·mol—1 X 33
Y 43
CO2(g)+C(s) = 2CO(g) ΔH =+172 kJ·mol—1 X 91
Y 72
①由表中数据分析:从有利于催化重整的角度考虑,应选用的催化剂为______(填“X”或“Y”);催化剂可以改变同一化学反应的________(填“活化能”或“反应热”,下同),但不能改变其_____
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则p(CO2)数值最大的是______(填“a”“b”或“c”)。
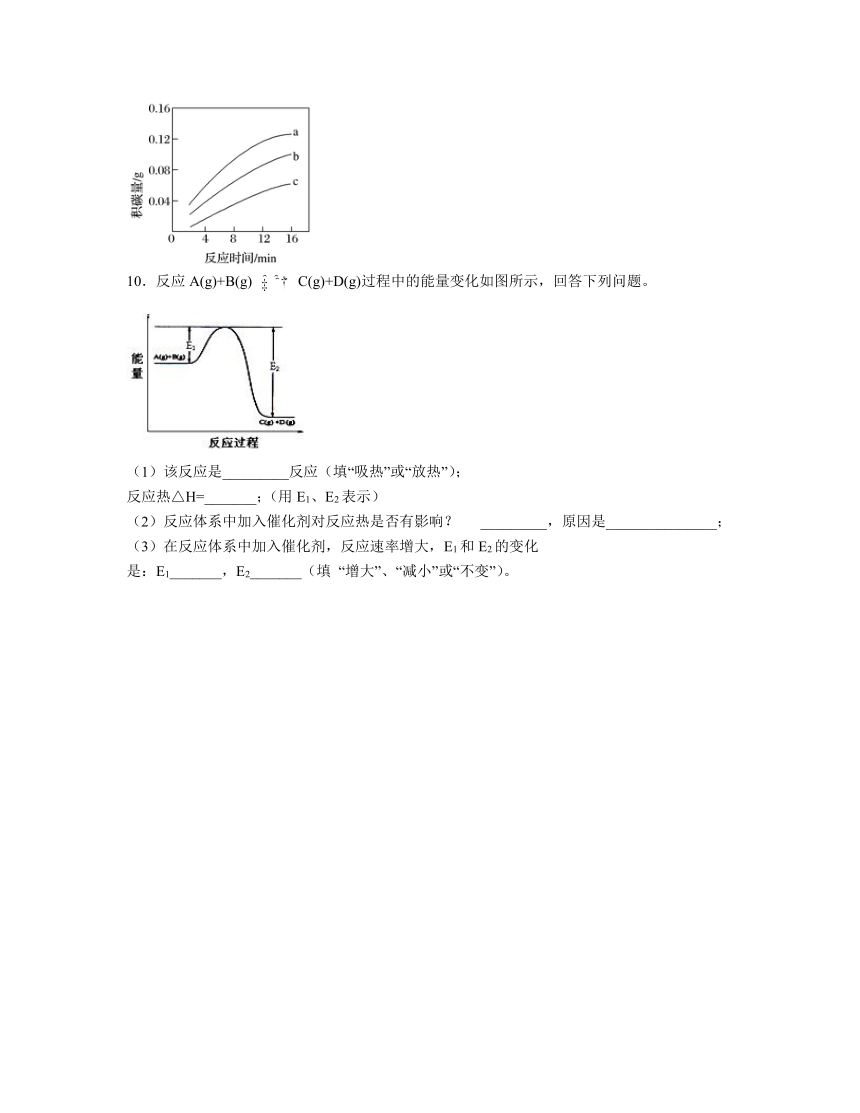
10.反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是_________反应(填“吸热”或“放热”);
反应热△H=_______;(用E1、E2表示)
(2)反应体系中加入催化剂对反应热是否有影响? _________,原因是_______________;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______,E2_______(填 “增大”、“减小”或“不变”)。
【参考答案】
一、选择题
1.D
解析:①A是固体,增加A的量,平衡不移动,故①错误;
②2A(s)+3B(g)C(g)+2D(g),ΔH<0,正反应放热,升高温度,平衡向逆反应方向移动,但v(正)、v(逆)均增大,故②错误;
③2A(s)+3B(g)C(g)+2D(g),反应前后气体系数和不变,压强增大一倍,平衡不移动,v正、v逆均增大,故③错误;
④增大B的浓度,反应物浓度增大,平衡正向移动,所以v正>v逆,故④正确;
⑤加入催化剂,平衡不移动,B的转化率不变,故⑤错误;
故答案选D。
2.C
解析:A.用煤粉代替煤块,反应物表面积增大,反应速率增大,A与反应速率有关;
B.冰箱中温度较低,食物放在冰箱中,可减小食物腐败的速率,B与反应速率有关;
C.工业合成氨时,及时将氨气液化分离,是降低生成物浓度,使平衡正向进行,提高氨产率,与速率无关,C符合题意;
D.在钢铁表面喷涂油漆可减小钢铁的腐蚀速率,有利于金属制品使用寿命的延长,D与反应速率有关;
故答案选C。
3.B
解析:A.化学反应平衡时对于同一物质,其正、逆反应速率相等,而对于同一反应得不同物质,其反应速率之比等于其化学计量系数之比,由题可知,若,可知二氧化碳正、逆反应速率相等,则反应到达平衡状态,A正确;
B.因为反应是由固体生成气体的反应,在题目条件下生成的两种气体的比例始终不变,则混合气体的相对分子质量也始终不变,不能作为判断平衡的依据,B错误;
C.混合气体的平均密度,其中m总为混合气体的质量,在恒容密闭的条件下,若反应未到达平衡,则m总大小会不断变化,可推得若混合气体密度不变,则反应到达平衡状态,C正确;
D.反应未到达平衡,气体的总物质的量的大小会不断变化,可以作为判断平衡的依据,D正确;
故选B。
4.C
【分析】A.催化剂可以降低活化能,不影响焓变,由图1可知,合成氨是焓减熵减过程,根据△G=△H T△S可知,该反应在低温下自发进行;
B.由图2可知,0~10min内氮气的物质的量变化量为0.6mol 0.3mol=0.3mol,根据 计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);11min压缩体积,压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡;
C.图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大;
D.由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,据此解答。
解析:A.加入催化剂活化能E降低,但不影响焓变,△H不变,由图1可知,合成氨是焓减熵减过程,△G<0反应自发进行,根据△G=△H T△S可知,该反应在低温下自发进行,故A错误;
B.由图2可知,0~10min内氮气的物质的量变化量为0.6mol 0.3mol=0.3mol,,速率之比等于化学计量数之比,故v(H2)=3v(N2)=3×0.015mol/(L min)=0.045mol/(L min),11min压缩体积,压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡,故n(N2)的变化曲线为d,故B错误;
C.图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高,故C正确;
D.由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,温度越高化学平衡越低,故K1>K2,故D错误;
故答案选C。
【点睛】本题考查反应进程与反应热关系图象、化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,理解外界条件对平衡的影响是解题关键。
5.B
解析:A.图甲是向平衡后的溶液中加入少量晶体,对反应速率没有影响,A错误;
B.Ⅰ的平衡状态中甲醇的含量高于Ⅱ平衡状态中甲醇,即Ⅰ的平衡状态中气体的总物质的量小于Ⅱ平衡状态中气体的总物质的量,根据 知M(Ⅱ)C.图丙中a改变的条件可能是加入催化剂也可能是改变压强,C错误;
D.点的 〈 ,平衡向正反应移动〉,D错误;
故选B。
6.C
解析:A.使用催化剂不影响平衡,不能改变转化率,A正确;
B.使用催化剂能同等程度的改变反应速率,B正确;
C.反应达到平衡后,相同时间段内物质的改变量均为零,C错误;
D.平衡时混合物的组成不会改变,催化剂对平衡不影响,D正确;
故选C。
7.C
解析:对于反应前后气体分子数不变的可逆反应,达到平衡状态后,增大平衡体系的压强(减小容器体积),平衡不移动,正、逆反应速率仍相等,但由于压强增大,所以正、逆反应速率同等程度地增大,故选C。
8.A
解析:压强变化时,平衡不发生移动,主要考虑两种情况:一是没有气体参加的反应,二是反应前后气体体积不发生改变的反应,B、C、D选项所给方程式反应前后气体的体积发生改变,压强的改变会使平衡发生移动,A项中反应前后气体体积没有改变,所以压强变化时平衡不发生移动,故答案为A。
二、非选择题
9. +247 升高温度和降低压强 Y 活化能 反应热 c
【分析】催化剂可以改变同一化学反应的活化能,但不能改变其反应热。
解析:(1)已知:
①C(s)+2H2(g) = CH4(g) ΔH= -75kJ·mol-1
②C(s)+O2(g)= CO2(g) ΔH =-394kJ·mol-1
③C(s)+O2(g)= CO(g) ΔH=-111 kJ·mol-1
利用盖斯定律可知,2×③-①-②可得CH4(g)+CO2(g) = 2CO(g)+2H2(g),其ΔH =+247kJ·mol-1;该反应是熵增的反应,而且是吸热反应,所以从温度和压强的角度考虑,有利于提高CH4平衡转化率的条件是升高温度和降低压强;
(2)①由表中数据分析:从有利于催化重整的角度考虑,积碳反应中X和Y的活化能相差不大,消碳反应中Y的活化能比X的低得多,所以应选用的催化剂为Y;催化剂可以改变同一化学反应的活化能,但不能改变其反应热;
②根据某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)可知,沉积碳的生成速率v与p(CO2)成反比。根据在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势图,可判断同一条件下c的速率最小,所以c的p(CO2)数值最大。
10. 放热 E1-E2 无影响 催化剂不改变反应物总能量与生成物总能量之差即反应热不变 减小 减小
解析:(1)反应物的能量和大于生成物,该反应是放热反应;反应热△H= E1-E2;
(2)催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以E的大小对该反应的反应热无影响;
(3)在反应体系中加入催化剂,反应速率增大,说明降低反应物和生成物的活化能,即E1和E2均减小
一、选择题
1.对可逆反应2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向逆反应方向移动 ②升高温度,平衡向逆反应方向移动,v正减小 ③缩小体积使压强增大一倍,平衡不移动,v正、v逆不变 ④增大B的浓度,v正>v逆 ⑤加入催化剂,B的转化率提高
A.①② B.④⑤ C.③ D.④
2.下列措施与化学反应速率无关的是
A.炉膛内用煤粉代替煤块 B.食物冷藏在冰箱
C.工业合成氨时,及时将氨气液化分离 D.在铁制品表面喷涂油漆
3.氨基甲酸铵发生分解的化学方程式为。在一定温度下,向恒容密闭容器中投入一定量氨基甲酸铵,下列叙述中不能说明该反应达到平衡状态的是
A.
B.混合气体的平均相对分子质量不再发生变化
C.混合气体的密度不再发生变化
D.混合气体的总物质的量不再发生变化
4.合成氨反应为N2(g)+3H2(g)2NH3(g)。图1表示在一定温度下此反应过程中的能量变化。图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量,平衡时NH3的质量分数w(NH3)的变化曲线。下列说法正确的是
A.该反应为自发反应,由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其他条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为b
C.图3中,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
5.下列叙述与图中甲、乙、丙、丁相符合的是
甲:FeCl3+3KSCN Fe(SCN)3+3KCl 乙:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
丙:H2(g)+I2(g) 2HI(g) 丁:2SO2(g)+O2 (g) 2SO3 (g)
A.图甲是向平衡后的溶液中加入少量晶体,反应速率随时间变化的图像
B.图乙刚性密闭容器中,平衡时混合气体的平均摩尔质量:
C.图丙中a改变的条件一定是加入催化剂
D.图丁中K为化学平衡常数, P点处化学反应速率
6.对某一可逆反应来说,下列有关使用催化剂和不使用催化剂的说法错误的是
A.使用催化剂不能增大反应物的平衡转化率
B.使用催化剂能同等程度改变正、逆反应速率
C.不使用催化剂,反应物在相同时间段内改变的物质的量一定比使用催化剂时少
D.不使用催化剂,平衡时混合物的组成不会改变
7.可逆反应2X(g)+Y(s)2Z(g)在t1min时达到平衡状态。当增大平衡体系的压强(减小容器体积)时,下列有关正,逆反应速率(v)随时间(t)变化的图象正确的是()
A. B.
C. D.
8.压强变化不会使下列化学反应的平衡发生移动的是( )
A. B.
C. D.
二、非选择题
9.CH4—CO2催化重整是减少温室气体排放的重要途径。回答下列问题:
(1)已知:
C(s)+2H2(g) = CH4(g) ΔH= —75kJ·mol—1
C(s)+O2(g)= CO2(g) ΔH = —394kJ·mol—1
C(s)+O2(g)= CO(g) ΔH= —111 kJ·mol—1
则催化重整反应CH4(g)+CO2(g) = 2CO(g)+2H2(g)的ΔH =___kJ·mol—1;从温度和压强的角度考虑,有利于提高CH4平衡转化率的条件是_____。
(2)催化重整时催化剂的活性随积碳的增多而减弱,有关积碳反应和消碳反应的数据如表:
积碳反应/消碳反应 催化剂 活化能/kJ·mol—1
CH4(g)= C(s)+2H2(g) ΔH =+75 kJ·mol—1 X 33
Y 43
CO2(g)+C(s) = 2CO(g) ΔH =+172 kJ·mol—1 X 91
Y 72
①由表中数据分析:从有利于催化重整的角度考虑,应选用的催化剂为______(填“X”或“Y”);催化剂可以改变同一化学反应的________(填“活化能”或“反应热”,下同),但不能改变其_____
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则p(CO2)数值最大的是______(填“a”“b”或“c”)。
10.反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是_________反应(填“吸热”或“放热”);
反应热△H=_______;(用E1、E2表示)
(2)反应体系中加入催化剂对反应热是否有影响? _________,原因是_______________;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______,E2_______(填 “增大”、“减小”或“不变”)。
【参考答案】
一、选择题
1.D
解析:①A是固体,增加A的量,平衡不移动,故①错误;
②2A(s)+3B(g)C(g)+2D(g),ΔH<0,正反应放热,升高温度,平衡向逆反应方向移动,但v(正)、v(逆)均增大,故②错误;
③2A(s)+3B(g)C(g)+2D(g),反应前后气体系数和不变,压强增大一倍,平衡不移动,v正、v逆均增大,故③错误;
④增大B的浓度,反应物浓度增大,平衡正向移动,所以v正>v逆,故④正确;
⑤加入催化剂,平衡不移动,B的转化率不变,故⑤错误;
故答案选D。
2.C
解析:A.用煤粉代替煤块,反应物表面积增大,反应速率增大,A与反应速率有关;
B.冰箱中温度较低,食物放在冰箱中,可减小食物腐败的速率,B与反应速率有关;
C.工业合成氨时,及时将氨气液化分离,是降低生成物浓度,使平衡正向进行,提高氨产率,与速率无关,C符合题意;
D.在钢铁表面喷涂油漆可减小钢铁的腐蚀速率,有利于金属制品使用寿命的延长,D与反应速率有关;
故答案选C。
3.B
解析:A.化学反应平衡时对于同一物质,其正、逆反应速率相等,而对于同一反应得不同物质,其反应速率之比等于其化学计量系数之比,由题可知,若,可知二氧化碳正、逆反应速率相等,则反应到达平衡状态,A正确;
B.因为反应是由固体生成气体的反应,在题目条件下生成的两种气体的比例始终不变,则混合气体的相对分子质量也始终不变,不能作为判断平衡的依据,B错误;
C.混合气体的平均密度,其中m总为混合气体的质量,在恒容密闭的条件下,若反应未到达平衡,则m总大小会不断变化,可推得若混合气体密度不变,则反应到达平衡状态,C正确;
D.反应未到达平衡,气体的总物质的量的大小会不断变化,可以作为判断平衡的依据,D正确;
故选B。
4.C
【分析】A.催化剂可以降低活化能,不影响焓变,由图1可知,合成氨是焓减熵减过程,根据△G=△H T△S可知,该反应在低温下自发进行;
B.由图2可知,0~10min内氮气的物质的量变化量为0.6mol 0.3mol=0.3mol,根据 计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);11min压缩体积,压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡;
C.图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大;
D.由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,据此解答。
解析:A.加入催化剂活化能E降低,但不影响焓变,△H不变,由图1可知,合成氨是焓减熵减过程,△G<0反应自发进行,根据△G=△H T△S可知,该反应在低温下自发进行,故A错误;
B.由图2可知,0~10min内氮气的物质的量变化量为0.6mol 0.3mol=0.3mol,,速率之比等于化学计量数之比,故v(H2)=3v(N2)=3×0.015mol/(L min)=0.045mol/(L min),11min压缩体积,压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡,故n(N2)的变化曲线为d,故B错误;
C.图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高,故C正确;
D.由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,温度越高化学平衡越低,故K1>K2,故D错误;
故答案选C。
【点睛】本题考查反应进程与反应热关系图象、化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,理解外界条件对平衡的影响是解题关键。
5.B
解析:A.图甲是向平衡后的溶液中加入少量晶体,对反应速率没有影响,A错误;
B.Ⅰ的平衡状态中甲醇的含量高于Ⅱ平衡状态中甲醇,即Ⅰ的平衡状态中气体的总物质的量小于Ⅱ平衡状态中气体的总物质的量,根据 知M(Ⅱ)
D.点的 〈 ,平衡向正反应移动〉,D错误;
故选B。
6.C
解析:A.使用催化剂不影响平衡,不能改变转化率,A正确;
B.使用催化剂能同等程度的改变反应速率,B正确;
C.反应达到平衡后,相同时间段内物质的改变量均为零,C错误;
D.平衡时混合物的组成不会改变,催化剂对平衡不影响,D正确;
故选C。
7.C
解析:对于反应前后气体分子数不变的可逆反应,达到平衡状态后,增大平衡体系的压强(减小容器体积),平衡不移动,正、逆反应速率仍相等,但由于压强增大,所以正、逆反应速率同等程度地增大,故选C。
8.A
解析:压强变化时,平衡不发生移动,主要考虑两种情况:一是没有气体参加的反应,二是反应前后气体体积不发生改变的反应,B、C、D选项所给方程式反应前后气体的体积发生改变,压强的改变会使平衡发生移动,A项中反应前后气体体积没有改变,所以压强变化时平衡不发生移动,故答案为A。
二、非选择题
9. +247 升高温度和降低压强 Y 活化能 反应热 c
【分析】催化剂可以改变同一化学反应的活化能,但不能改变其反应热。
解析:(1)已知:
①C(s)+2H2(g) = CH4(g) ΔH= -75kJ·mol-1
②C(s)+O2(g)= CO2(g) ΔH =-394kJ·mol-1
③C(s)+O2(g)= CO(g) ΔH=-111 kJ·mol-1
利用盖斯定律可知,2×③-①-②可得CH4(g)+CO2(g) = 2CO(g)+2H2(g),其ΔH =+247kJ·mol-1;该反应是熵增的反应,而且是吸热反应,所以从温度和压强的角度考虑,有利于提高CH4平衡转化率的条件是升高温度和降低压强;
(2)①由表中数据分析:从有利于催化重整的角度考虑,积碳反应中X和Y的活化能相差不大,消碳反应中Y的活化能比X的低得多,所以应选用的催化剂为Y;催化剂可以改变同一化学反应的活化能,但不能改变其反应热;
②根据某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)可知,沉积碳的生成速率v与p(CO2)成反比。根据在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势图,可判断同一条件下c的速率最小,所以c的p(CO2)数值最大。
10. 放热 E1-E2 无影响 催化剂不改变反应物总能量与生成物总能量之差即反应热不变 减小 减小
解析:(1)反应物的能量和大于生成物,该反应是放热反应;反应热△H= E1-E2;
(2)催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以E的大小对该反应的反应热无影响;
(3)在反应体系中加入催化剂,反应速率增大,说明降低反应物和生成物的活化能,即E1和E2均减小
