2.2 氯及其化合物 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2 氯及其化合物 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 270.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-15 09:28:17 | ||
图片预览


文档简介
2.2 氯及其化合物 同步练习题
一、选择题
1.下列制取 Cl2并用其氧化含I-废液,回收提纯I2,相应的装置和操作正确的是
A.制取氯气 B.氧化碘离子 C. 萃取碘并分离 D.升华提纯碘
A.A B.B C.C D.D
2.在给定条件下,下列选项所示的物质间转化均能实现的是
A.MgCl2(熔融) Cl2FeCl2
B.SSO3H2SO4
C.CuO CuSO4溶液Cu
D.NaNa2O2NaOH
3.下列实验结论与实验操作及现象相符的一组是
选项 实验操作及现象 实验结论
A 向FeBr2溶液中滴加氯水,溶液颜色变为黄色 非金属性Cl>Br
B 向某溶液中加入盐酸有气体生成,将气体通入澄清石灰水,石灰水浑浊 该溶液中一定含有CO
C 向紫色石蕊溶液中加入新制氯水,溶液先变红后褪色 褪色是因为氯水中含有HClO
D 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变红色 原溶液中一定有Fe2+
A.A B.B C.C D.D
4.下列解释事实的方程式不正确的是
A.用食醋清洗水垢:CO+2CH3COOH=2CH3COO-+H2O+CO2↑
B.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+H2O
C.用小苏打治疗胃酸过多:HCO+H+=CO2↑+H2O
D.用硫化钠除去废水中的汞离子:Hg2++S2-=HgS↓
5.下列关于和的说法中正确的是
A.都有毒 B.都属于同一元素 C.都呈黄绿色 D.化学性质相似
6.下列属于纯净物的是
A.盐酸 B.陈醋 C.氯水 D.小苏打
7.下列物质不能使湿润的有色布条褪色的是
A.氯水 B.氯化钙 C.次氯酸钙 D.次氯酸钠
8.化学与生活密切相关,下列物质与其用途不符合的是
A B C D
物质
用途 做调味品 做膨松剂 做供氧剂 做消毒剂
A.A B.B C.C D.D
二、非选择题
9.氯的原子结构和存在
(1)原子结构:Cl原子结构示意图为_______,容易_______1个电子而形成_______,表现出较强的_______。
(2)存在:氯在自然界中均以化合态存在,主要以氯盐形式存在于海水以及陆地盐湖和盐矿中。
10.为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是_______;
(2)盛有氯水的试管中的有色布条褪色,说明氯水中含有的粒子是_______;
11.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色 沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D的分子式分别为:A_______、B_______、C_______、D_______。
(2)写出下列各反应的化学方程式:A与B____;B与水____;B与NaOH溶液____
12.化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)实验室制Cl2的反应中,浓盐酸所起的作用有_______(填序号)。
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为_______(用离子方程式表示,)。
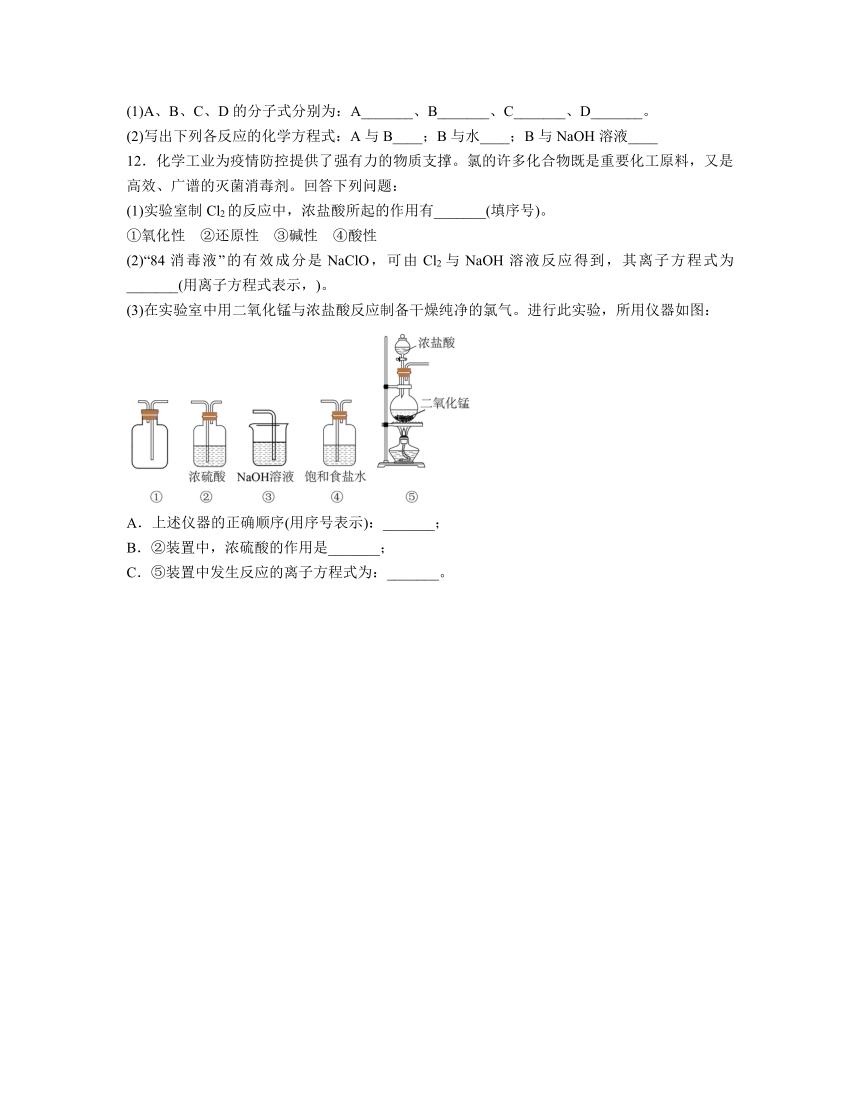
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
A.上述仪器的正确顺序(用序号表示):_______;
B.②装置中,浓硫酸的作用是_______;
C.⑤装置中发生反应的离子方程式为:_______。
【参考答案】
一、选择题
1.D
解析:A.稀盐酸与二氧化锰不反应,应选用浓盐酸、二氧化锰加热制备氯气,A错误;
B.导管应长进短出,B错误;
C.四氯化碳密度大于水,水在上层,应从上口倒出,C错误;
D.加热碘易升华,冷却变为固体碘,则图中装置可分离碘,D正确。
答案选D。
2.D
解析:A.MgCl2(熔融)电解得到镁单质和Cl2,Cl2和Fe反应生成FeCl3,故A错误;
B.S和O2反应生成SO2,故B错误;
C.CuSO4溶液和Na反应时,Na先和水反应,最终得到Cu(OH)2沉淀,不能得到单质Cu,故C错误;
D.Na和O2在加热的条件下反应生成Na2O2,Na2O2和H2O反应生成NaOH,故D正确;
故选D。
3.C
解析:A.亚铁离子还原性大于溴离子,故会先被氧化成黄色的铁离子,不能证明非金属性Cl>Br,A错误;
B.某溶液能与盐酸反应生成使石灰水变浑浊的气体,该溶液中可能含有碳酸根离子也可能含有碳酸氢根离子,B错误;
C.氯气通入水中生成盐酸和次氯酸,变红是因为盐酸电离出氢离子,褪色是因为次氯酸的漂白性,C正确;
D. 如果原溶液中本来就有铁离子,则遇到硫氰化钾溶液也会变红,故不能证明一定有亚铁离子,D错误;
故选C。
4.A
解析:A.碳酸钙为沉淀,不能拆成离子,正确离子方程式为CaCO3+2CH3COOH=2CH3COO-+H2O+CO2↑+Ca2+,A错误;
B.84消毒液主要成分为NaClO,洁厕灵主要成分为盐酸,二者混合后发生归中反应生成氯气,离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,B正确;
C.小苏打为NaHCO3,可以和胃酸即HCl反应生成二氧化碳和水,离子方程式为HCO+H+=CO2↑+H2O,C正确;
D.硫化钠可以和汞离子生成硫化汞沉淀,离子方程式为Hg2++S2-=HgS↓,D正确;
综上所述答案为A。
5.B
解析:A.因Cl-无毒,而Cl2有毒,故A错误;
B.氯气是由氯元素组成的单质,Cl-是氯原子得到一个电子形成的离子,都属于同一元素氯元素,故B正确;
C.Cl-为无色,而Cl2为黄绿色,故C错误;
D.Cl-不能与金属单质反应,而Cl2能与金属单质反应,化学性质不同,故D错误;
故选B。
6.D
解析:A.盐酸是HCl的水溶液,是混合物,A不选;
B.陈醋含醋酸的水溶液,是混合物,B不选;
C.氯水是氯气溶液水中得到的溶液,是混合物,C不选;
D.小苏打是NaHCO3,是纯净物,D选;
故选D。
7.B
解析:A. 氯水中的HClO具有强氧化性,能将有色物质氧化为无色物质而具有漂白性,故能使湿润的有色布条褪色,故A不符合题意;
B. 氯化钙无漂白作用,不能使湿润的有色布条褪色,故B符合题意;
C. 次氯酸钙溶于水与空气中的二氧化碳和水反应生成HClO,HClO具有强氧化性,能漂白有色物质,因此能使湿润的有色布条褪色,故C不符合题意;
D. 次氯酸钠溶于水与空气中的二氧化碳和水反应生成HClO,HClO具有强氧化性,能漂白有色物质,因此能使湿润的有色布条褪色,故D不符合题意;
故选B。
8.B
解析:A.氯化钠具有咸味,做调味品,A正确;
B.碳酸钠受热稳定,碳酸氢钠受热生成二氧化碳使糕点疏松,做膨松剂,B错误;
C.过氧化钠和二氧化碳生成氧气,做供氧剂,C正确;
D.次氯酸钠具有氧化性,能杀菌消毒,做消毒剂,D正确;
故选B。
二、非选择题
9. 得到 Cl- 氧化性
解析:氯为17号元素,核外电子数为17,原子结构示意图为: ,最外层7个电子,非常容易得到1个电子达稳定结构,而形成阴离子,Cl得电子能力强,表现很强的氧化性。
10. Cl2 HClO
解析:(1)氯水中含有氯气分子,所以氯水呈浅黄绿色;
(2)次氯酸具有漂白性,能盛有色布条褪色。
11. H2 Cl2 CO2 HCl H2+ Cl22HCl Cl2+ H2O = HCl + HClO Cl2+ 2NaOH =NaCl + NaClO+ H2O
【分析】A是密度最小的气体,应为H2,B在通常情况下呈黄绿色,应为Cl2,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D,生成HCl,则D为HCl,把无色无刺激气味气体C通入澄清石灰水时变浑浊,应为CO2,结合对应物质的性质解答该题。
解析:(1)由以上分析可以知道A为H2,B为Cl2,C为CO2,D为HCl,因此,本题正确答案是:H2;Cl2;CO2;HCl;
(2)H2在点燃条件下与氯气反应生成氯化氢,化学方程式为:H2+ Cl22HCl,
Cl2与水反应生成盐酸和次氯酸,反应方程式为:Cl2+ H2O = HCl + HClO,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的方程式为:Cl2+ 2NaOH =NaCl + NaClO+ H2O,因此,本题正确答案是:H2+ Cl22HCl;Cl2+ H2O = HCl + HClO;Cl2+ 2NaOH =NaCl + NaClO+ H2O。
12.(1)②④
(2)2OH-+Cl2=Cl-+ClO-+H2O
(3) ⑤④②①③ 吸收混在Cl2中的H2O 或 干燥氯气 MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
【分析】二氧化锰和浓盐酸在加热条件下生成氯气,通过饱和食盐水除去挥发的氯化氢气体,通过浓硫酸干燥后,使用向上排空气发生收集,尾气使用碱液吸收处理;
解析:(1)实验室制Cl2的反应中,浓盐酸和金属氧化物反应体现酸性,HCl中部分氯元素化合价升高,体现还原性;故选②④;
(2)Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,2OH-+Cl2=Cl-+ClO-+H2O;
(3)A.由分析可知,上述仪器的正确顺序(用序号表示):⑤④②①③;
B.浓硫酸具有吸水性,②装置中,浓硫酸的作用是吸收混在Cl2中的H2O 或 干燥氯气;
C.⑤装置中二氧化锰和浓盐酸在加热条件下生成氯气、氯化锰、水:
一、选择题
1.下列制取 Cl2并用其氧化含I-废液,回收提纯I2,相应的装置和操作正确的是
A.制取氯气 B.氧化碘离子 C. 萃取碘并分离 D.升华提纯碘
A.A B.B C.C D.D
2.在给定条件下,下列选项所示的物质间转化均能实现的是
A.MgCl2(熔融) Cl2FeCl2
B.SSO3H2SO4
C.CuO CuSO4溶液Cu
D.NaNa2O2NaOH
3.下列实验结论与实验操作及现象相符的一组是
选项 实验操作及现象 实验结论
A 向FeBr2溶液中滴加氯水,溶液颜色变为黄色 非金属性Cl>Br
B 向某溶液中加入盐酸有气体生成,将气体通入澄清石灰水,石灰水浑浊 该溶液中一定含有CO
C 向紫色石蕊溶液中加入新制氯水,溶液先变红后褪色 褪色是因为氯水中含有HClO
D 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变红色 原溶液中一定有Fe2+
A.A B.B C.C D.D
4.下列解释事实的方程式不正确的是
A.用食醋清洗水垢:CO+2CH3COOH=2CH3COO-+H2O+CO2↑
B.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+H2O
C.用小苏打治疗胃酸过多:HCO+H+=CO2↑+H2O
D.用硫化钠除去废水中的汞离子:Hg2++S2-=HgS↓
5.下列关于和的说法中正确的是
A.都有毒 B.都属于同一元素 C.都呈黄绿色 D.化学性质相似
6.下列属于纯净物的是
A.盐酸 B.陈醋 C.氯水 D.小苏打
7.下列物质不能使湿润的有色布条褪色的是
A.氯水 B.氯化钙 C.次氯酸钙 D.次氯酸钠
8.化学与生活密切相关,下列物质与其用途不符合的是
A B C D
物质
用途 做调味品 做膨松剂 做供氧剂 做消毒剂
A.A B.B C.C D.D
二、非选择题
9.氯的原子结构和存在
(1)原子结构:Cl原子结构示意图为_______,容易_______1个电子而形成_______,表现出较强的_______。
(2)存在:氯在自然界中均以化合态存在,主要以氯盐形式存在于海水以及陆地盐湖和盐矿中。
10.为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是_______;
(2)盛有氯水的试管中的有色布条褪色,说明氯水中含有的粒子是_______;
11.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色 沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D的分子式分别为:A_______、B_______、C_______、D_______。
(2)写出下列各反应的化学方程式:A与B____;B与水____;B与NaOH溶液____
12.化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)实验室制Cl2的反应中,浓盐酸所起的作用有_______(填序号)。
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为_______(用离子方程式表示,)。
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
A.上述仪器的正确顺序(用序号表示):_______;
B.②装置中,浓硫酸的作用是_______;
C.⑤装置中发生反应的离子方程式为:_______。
【参考答案】
一、选择题
1.D
解析:A.稀盐酸与二氧化锰不反应,应选用浓盐酸、二氧化锰加热制备氯气,A错误;
B.导管应长进短出,B错误;
C.四氯化碳密度大于水,水在上层,应从上口倒出,C错误;
D.加热碘易升华,冷却变为固体碘,则图中装置可分离碘,D正确。
答案选D。
2.D
解析:A.MgCl2(熔融)电解得到镁单质和Cl2,Cl2和Fe反应生成FeCl3,故A错误;
B.S和O2反应生成SO2,故B错误;
C.CuSO4溶液和Na反应时,Na先和水反应,最终得到Cu(OH)2沉淀,不能得到单质Cu,故C错误;
D.Na和O2在加热的条件下反应生成Na2O2,Na2O2和H2O反应生成NaOH,故D正确;
故选D。
3.C
解析:A.亚铁离子还原性大于溴离子,故会先被氧化成黄色的铁离子,不能证明非金属性Cl>Br,A错误;
B.某溶液能与盐酸反应生成使石灰水变浑浊的气体,该溶液中可能含有碳酸根离子也可能含有碳酸氢根离子,B错误;
C.氯气通入水中生成盐酸和次氯酸,变红是因为盐酸电离出氢离子,褪色是因为次氯酸的漂白性,C正确;
D. 如果原溶液中本来就有铁离子,则遇到硫氰化钾溶液也会变红,故不能证明一定有亚铁离子,D错误;
故选C。
4.A
解析:A.碳酸钙为沉淀,不能拆成离子,正确离子方程式为CaCO3+2CH3COOH=2CH3COO-+H2O+CO2↑+Ca2+,A错误;
B.84消毒液主要成分为NaClO,洁厕灵主要成分为盐酸,二者混合后发生归中反应生成氯气,离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,B正确;
C.小苏打为NaHCO3,可以和胃酸即HCl反应生成二氧化碳和水,离子方程式为HCO+H+=CO2↑+H2O,C正确;
D.硫化钠可以和汞离子生成硫化汞沉淀,离子方程式为Hg2++S2-=HgS↓,D正确;
综上所述答案为A。
5.B
解析:A.因Cl-无毒,而Cl2有毒,故A错误;
B.氯气是由氯元素组成的单质,Cl-是氯原子得到一个电子形成的离子,都属于同一元素氯元素,故B正确;
C.Cl-为无色,而Cl2为黄绿色,故C错误;
D.Cl-不能与金属单质反应,而Cl2能与金属单质反应,化学性质不同,故D错误;
故选B。
6.D
解析:A.盐酸是HCl的水溶液,是混合物,A不选;
B.陈醋含醋酸的水溶液,是混合物,B不选;
C.氯水是氯气溶液水中得到的溶液,是混合物,C不选;
D.小苏打是NaHCO3,是纯净物,D选;
故选D。
7.B
解析:A. 氯水中的HClO具有强氧化性,能将有色物质氧化为无色物质而具有漂白性,故能使湿润的有色布条褪色,故A不符合题意;
B. 氯化钙无漂白作用,不能使湿润的有色布条褪色,故B符合题意;
C. 次氯酸钙溶于水与空气中的二氧化碳和水反应生成HClO,HClO具有强氧化性,能漂白有色物质,因此能使湿润的有色布条褪色,故C不符合题意;
D. 次氯酸钠溶于水与空气中的二氧化碳和水反应生成HClO,HClO具有强氧化性,能漂白有色物质,因此能使湿润的有色布条褪色,故D不符合题意;
故选B。
8.B
解析:A.氯化钠具有咸味,做调味品,A正确;
B.碳酸钠受热稳定,碳酸氢钠受热生成二氧化碳使糕点疏松,做膨松剂,B错误;
C.过氧化钠和二氧化碳生成氧气,做供氧剂,C正确;
D.次氯酸钠具有氧化性,能杀菌消毒,做消毒剂,D正确;
故选B。
二、非选择题
9. 得到 Cl- 氧化性
解析:氯为17号元素,核外电子数为17,原子结构示意图为: ,最外层7个电子,非常容易得到1个电子达稳定结构,而形成阴离子,Cl得电子能力强,表现很强的氧化性。
10. Cl2 HClO
解析:(1)氯水中含有氯气分子,所以氯水呈浅黄绿色;
(2)次氯酸具有漂白性,能盛有色布条褪色。
11. H2 Cl2 CO2 HCl H2+ Cl22HCl Cl2+ H2O = HCl + HClO Cl2+ 2NaOH =NaCl + NaClO+ H2O
【分析】A是密度最小的气体,应为H2,B在通常情况下呈黄绿色,应为Cl2,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D,生成HCl,则D为HCl,把无色无刺激气味气体C通入澄清石灰水时变浑浊,应为CO2,结合对应物质的性质解答该题。
解析:(1)由以上分析可以知道A为H2,B为Cl2,C为CO2,D为HCl,因此,本题正确答案是:H2;Cl2;CO2;HCl;
(2)H2在点燃条件下与氯气反应生成氯化氢,化学方程式为:H2+ Cl22HCl,
Cl2与水反应生成盐酸和次氯酸,反应方程式为:Cl2+ H2O = HCl + HClO,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的方程式为:Cl2+ 2NaOH =NaCl + NaClO+ H2O,因此,本题正确答案是:H2+ Cl22HCl;Cl2+ H2O = HCl + HClO;Cl2+ 2NaOH =NaCl + NaClO+ H2O。
12.(1)②④
(2)2OH-+Cl2=Cl-+ClO-+H2O
(3) ⑤④②①③ 吸收混在Cl2中的H2O 或 干燥氯气 MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
【分析】二氧化锰和浓盐酸在加热条件下生成氯气,通过饱和食盐水除去挥发的氯化氢气体,通过浓硫酸干燥后,使用向上排空气发生收集,尾气使用碱液吸收处理;
解析:(1)实验室制Cl2的反应中,浓盐酸和金属氧化物反应体现酸性,HCl中部分氯元素化合价升高,体现还原性;故选②④;
(2)Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,2OH-+Cl2=Cl-+ClO-+H2O;
(3)A.由分析可知,上述仪器的正确顺序(用序号表示):⑤④②①③;
B.浓硫酸具有吸水性,②装置中,浓硫酸的作用是吸收混在Cl2中的H2O 或 干燥氯气;
C.⑤装置中二氧化锰和浓盐酸在加热条件下生成氯气、氯化锰、水:
