6.1化学反应速率与反应限度分层练习(含解析)2023-2024学年苏教版(2019)高中化学必修第二册
文档属性
| 名称 | 6.1化学反应速率与反应限度分层练习(含解析)2023-2024学年苏教版(2019)高中化学必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 569.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-15 15:37:03 | ||
图片预览



文档简介
6.1化学反应速率与反应限度
学校:___________姓名:___________班级:___________考号:___________
一、单选题
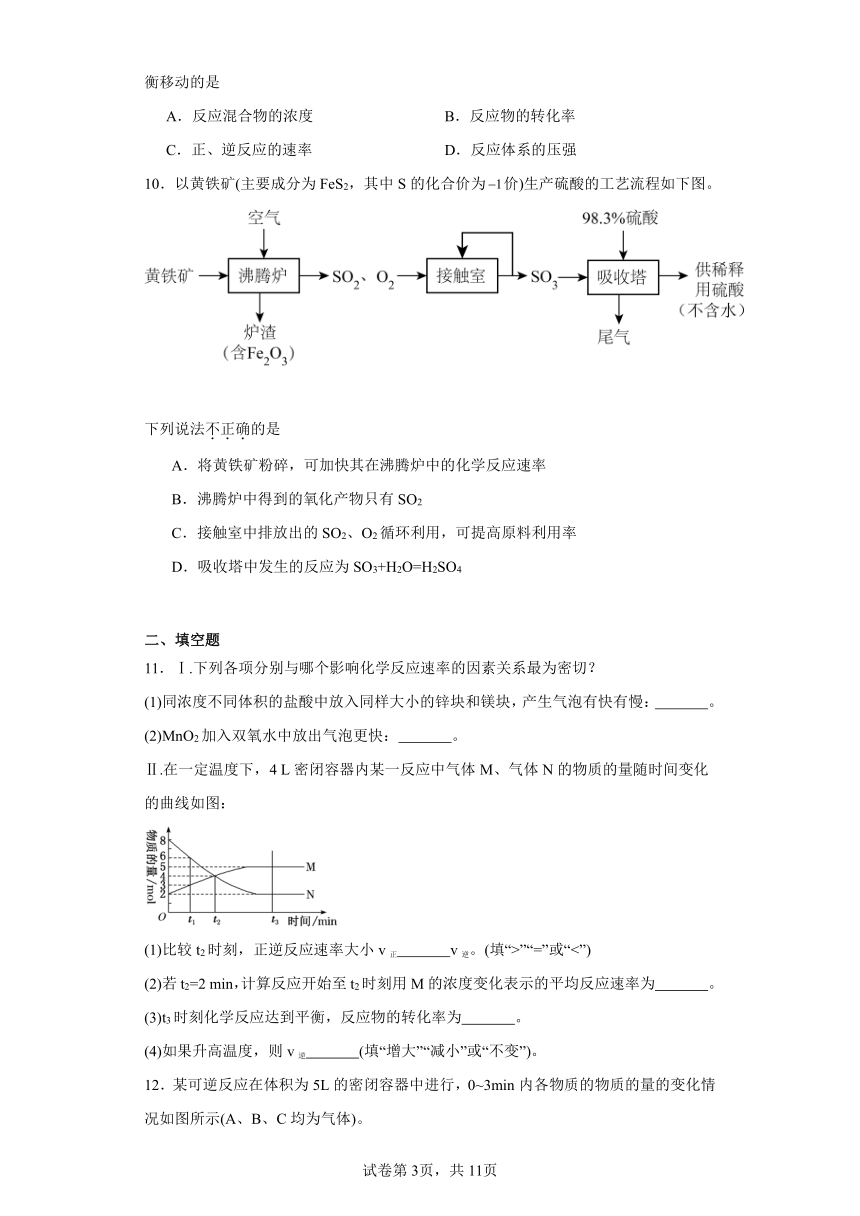
1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
A.4s时,反应达到平衡状态
B.10s时,Y的转化率为21%
C.反应的化学方程式为:
D.0~10s内Z的平均反应速率为:
2.下列措施对改变反应速率的影响正确的是
A.在工业合成氨反应中,温度和容器容积一定时,增加氮气的量,能增大反应速率
B.与稀盐酸反应,加入溶液,不会改变反应速率
C.溶液与溶液反应,加入固体,将加快反应速率
D.与稀硫酸反应制取,改用的浓硫酸将加快的生成速率
3.氨是一种重要的化工原料,在工农业生产中有广泛的应用。一定温度下,在固定容积的密闭容器中进行可逆反应N2(g)+H2(g) NH3(g)。该可逆反应达到平衡状态的标志是( )
A.3v正(H2)=2v逆(NH3)
B.单位时间内生成1mol N2的同时生成3mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间而变化
4.恒温恒容条件下,某密闭容器中发生如下反应:H2(g)+I2(g)2HI(g),说明该反应已达到平衡状态的是 ( )
A.容器内总压强不随时间改变 B.气体的密度不随时间改变
C.单位时间内生成2 mol HI同时消耗1 mol H2 D.H2的体积分数不随时间改变
5.已知,分解速率受温度、浓度、催化剂以及溶液酸碱性等多种因素影响。和等均可作为分解的催化剂。含有少量的溶液中,的分解机理为:①(慢),②(快)。对于含有少量的溶液中发生的反应,下列说法正确的是
A.增大溶液中,可提高的分解速率
B.也是该反应的催化剂
C.反应①和反应②的活化能之和等于
D.升高温度和使用催化剂均能提高分解的转化率
6.在恒容密闭容器中充入一定量CO和H2合成CH3OH,其化学方程式为2H2(g)+CO(g)CH3OH(g) △H<0。下列说法错误的是
A.升高温度,正反应速率减小,逆反应速率增大
B.向容器中充入惰性气体,反应速率不变
C.H2、CO、CH3OH的反应速率之比为2:1:1
D.加入高效催化剂,正、逆反应速率都会增大
7.在某恒容密闭容器中发生反应:。若反应速率分别用表示,则下列关系式正确的是
A. B.
C. D.
8.把3molX气体和1moY气体混合于容积为1 L的容器中,使其发生如下反应:3X(g)+Y(g)nZ(g)+2W(g)。2 min末生成0.2 molW,若测知以Z浓度变化表示的平均反应速率为0.1 mol·L-1·min-1, 则n的值为( )
A.1 B.2 C.3 D.4
9.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A.反应混合物的浓度 B.反应物的转化率
C.正、逆反应的速率 D.反应体系的压强
10.以黄铁矿(主要成分为FeS2,其中S的化合价为价)生产硫酸的工艺流程如下图。
下列说法不正确的是
A.将黄铁矿粉碎,可加快其在沸腾炉中的化学反应速率
B.沸腾炉中得到的氧化产物只有SO2
C.接触室中排放出的SO2、O2循环利用,可提高原料利用率
D.吸收塔中发生的反应为SO3+H2O=H2SO4
二、填空题
11.Ⅰ.下列各项分别与哪个影响化学反应速率的因素关系最为密切?
(1)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气泡有快有慢: 。
(2)MnO2加入双氧水中放出气泡更快: 。
Ⅱ.在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)比较t2时刻,正逆反应速率大小v正 v逆。(填“>”“=”或“<”)
(2)若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为 。
(3)t3时刻化学反应达到平衡,反应物的转化率为 。
(4)如果升高温度,则v逆 (填“增大”“减小”或“不变”)。
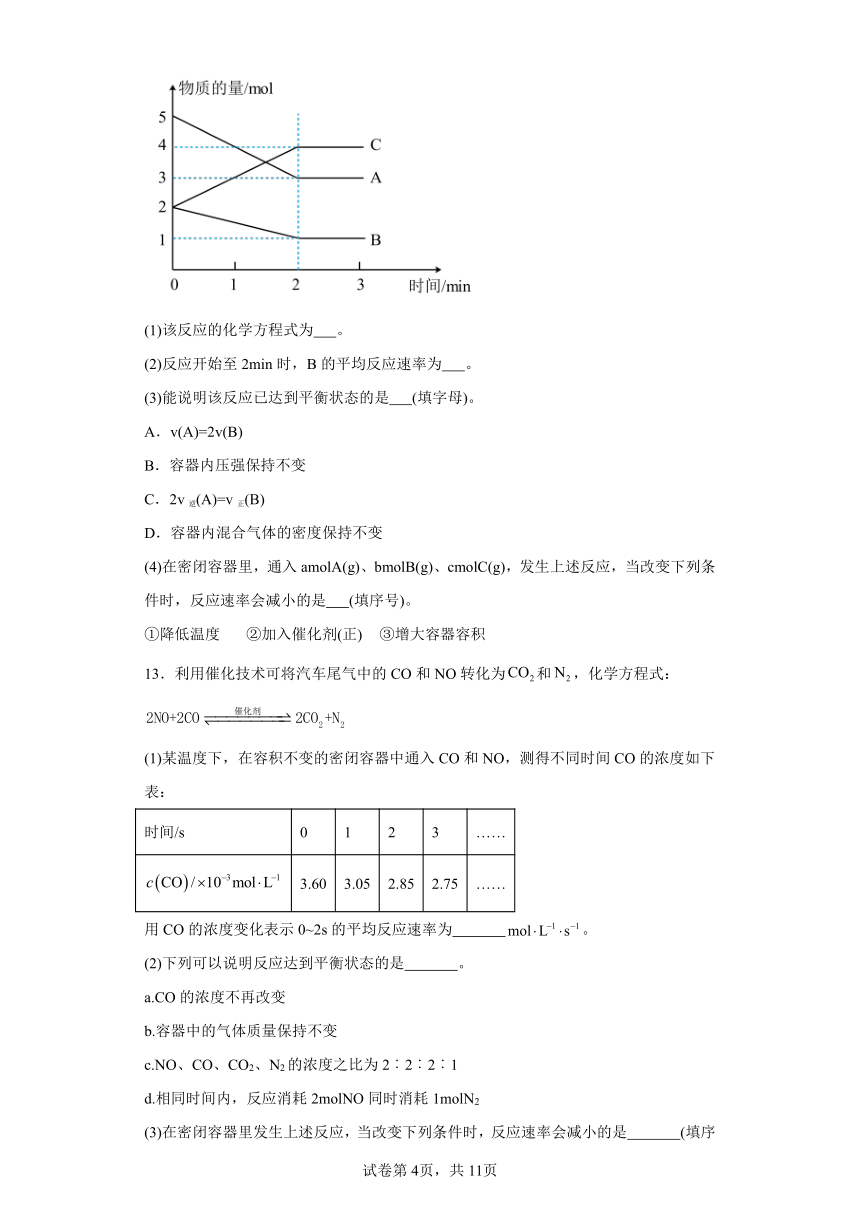
12.某可逆反应在体积为5L的密闭容器中进行,0~3min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。
(1)该反应的化学方程式为 。
(2)反应开始至2min时,B的平均反应速率为 。
(3)能说明该反应已达到平衡状态的是 (填字母)。
A.v(A)=2v(B)
B.容器内压强保持不变
C.2v逆(A)=v正(B)
D.容器内混合气体的密度保持不变
(4)在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变下列条件时,反应速率会减小的是 (填序号)。
①降低温度 ②加入催化剂(正) ③增大容器容积
13.利用催化技术可将汽车尾气中的CO和NO转化为和,化学方程式:
(1)某温度下,在容积不变的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
时间/s 0 1 2 3 ……
3.60 3.05 2.85 2.75 ……
用CO的浓度变化表示0~2s的平均反应速率为 。
(2)下列可以说明反应达到平衡状态的是 。
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、CO2、N2的浓度之比为2︰2︰2︰1
d.相同时间内,反应消耗2molNO同时消耗1molN2
(3)在密闭容器里发生上述反应,当改变下列条件时,反应速率会减小的是 (填序号)。
①降低温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④再通入a mol NO(g)
(4)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
实验编号 实验目的 T/℃ 同种催化剂的比表面积/g 达平衡时所用的时间/s
I 对照实验 280 80
II a 280 120
III 研究温度对尾气转化速率的影响 b c
【实验分析与结论】
①补全表格a. ,b. ,c. 。
②测得,对比实验I、III,可得结论:催化剂的比表面积相同时, 。
③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验I、II, (填“>”、“<”或“=”)。
14.在一定温度下,向体积为 1L 的密闭容器中通入 1molX 气体和 0.5molY 气体,各物质的物质的量随时间变化如图所示:
(1)该反应是 (填“可逆反应”或“非可逆反应”),化学反应方程式为 。
(2)在 2min 内 X 平均反应速率vX = 。
(3)若在 2min 末时,放出 18.16kJ 热量,则每消耗 1mol 的 Y 放出的热量为 kJ。
15.如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。利用H2和CO2生产甲醇燃料,为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
(1)该反应的化学方程式为: 。
(2)从反应开始到3min时,氢气的平均反应速率v(H2)= ;达到平衡时氢气的浓度为 。
(3)下列措施中不能使该反应速率增大的是 。
A 在原容器中再充入1 molCO2 B 在原容器中充入1 mol He使体系压强增大
C 缩小容器的容积 D 将水蒸气从体系中分离出
(4)当下列物理量不变时,能说明反应已经达到平衡状态的是 。
A 混合气体的压强
B CH3OH(g)和H2O(g)的体积分数比
C 混合气体的密度
D 混合气体的平均摩尔质量
16.将等物质的量A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g)xC(g)+2D(g),经5min后测得D的浓度为0.5mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1mol·L-1·min-1。
(1)经5min后A的浓度为 。
(2)反应开始前充入容器中B的物质的量为 。
(3)B的平均反应速率为 。
(4)x的值为 。
(5)对于反应A(g)+3B(g)=2C(g)+2D(g),下列分别表示不同条件下的反应速率,则反应速率大小关系是 。
①v(A)=0.01mol·L-1·s-1
②v(B)=1.20mol·L-1·min-1
③v(C)=2.40mol·L-1·min-1
④v(D)=0.02mol·L-1·s-1
17.一定条件下铁可以和CO2发生反应Fe2O3+3CO2Fe+3CO2。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
(1)t1min时,正、逆反应速率的大小关系为v正 v逆(填“>”“<”或“=”)。
(2)0~4min内,CO2的转化率为 ,CO的平均反应速率,v(CO)= 。
(3)下列条件的改变能减慢上述反应的反应速率的是 (填序号,下同)。
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是 。
①v正(CO2)=v逆(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
18.氨的合成是目前普遍使用的人工固氮方法。
(1) 根据图提供的信息,写出该反应的热化学方程 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2) 在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
19.某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
(1)计算反应开始2min内的v(x)= ,v(y)= ,v(z)= 。
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
20.在一定温度下,4L密闭容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。
(1)比较t2时刻,正、逆反应速率大小: v(正) (填“”“”或“”) v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率 。
(3) t1、t2、t3三个时刻中处于平衡状态的时刻为 (填“t1”“ t2”或“t3”)。
(4)如果升高温度,则v(逆) (填“增大”“减小”或“不变”)。
(5)该反应的化学方程式为
三、实验探究题
21.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 室温下,试管中所加试剂及其用量/mL 室温下溶液 颜色褪至无色 所需时间/min
0.6 mol · L-1 H2C2O4溶液 H2O 0.2 mol · L-1 KMnO4溶液 3 mol · L-1 稀硫酸
1 3.0 2.0 3.0 2.0 4.0
2 3.0 3.0 2.0 2.0 5.2
3 3.0 4.0 1.0 2.0 6.4
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 室温下,试管中所加试剂及其用量/mL 再向试管中加入少量固体 室温下溶液颜色褪至无色所需时间/min
0.6mol/LH2C2O4溶液 H2O 0.2mol/LKMnO4溶液 3mol/L稀硫酸
4 3.0 2.0 3.0 2.0 t
③若该小组同学提出的假设成立,应观察到的现象是 。
22.某研究性学习小组提纯粗金(主要含Au,还含少量Ag)的实验流程如下:
已知:① 浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水。
② 利用H2C2O4还原H[AuCl4]可得到Au。
(1)“溶解”前,先将粗金块切割成细条状,其目的是 。“溶解”时Au转化为H[AuCl4],该反应的化学方程式为 。
(2)“滤渣”的主要成分为 (填化学式)。
(3)“操作Ⅰ”的名称为 。
(4)“操作Ⅱ”需控制在40~70℃时进行,适宜的加热方式为 。
(5)请设计从“操作Ⅱ”后的水溶液中获取单质Au的实验方案: 。(实验中须使用的试剂有:H2C2O4溶液,蒸馏水;除常用仪器外须使用的仪器有:布氏漏斗)。
23.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的外界因素,离子方程式为2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。设计实验方案如下(KMnO4溶液已酸化):
实验编号 室温下,试管中所加试剂及其用量/mL 溶液褪色至无色所需时间/min
0.6mol/LH2C2O4溶液 H2O 0.1mol/LKMnO4溶液 3mol/LH2SO4溶液
1 3.0 13.0 2.0 2.0 8.0
2 2.0 14.0 2.0 2.0 10.4
3 1.0 V1 V2 2.0 12.8
请回答:
(1)该实验探究的是 因素对化学反应速率的影响。
(2)请完成上述实验设计表:V1= ,V2= 。
(3)利用实验1中数据计算,平均反应速率:v(KMnO4)= 。
(4)小组同学发现反应速率总是如图1,其中t1~t2时间内速率变快的主要原因可能是:
①、产物Mn2+是该反应的催化剂;②、 。
(5)该小组同学查阅已有的实验资料发现,该实验过程中Mn2+对反应有催化作用,并继续进行实验探究。请你帮助该小组同学完成实验方案。
实验编号 室温下,试管中所加试剂及其用量 室温下溶液褪色至无色所需时间/min
0.6mol/LH2C2O4溶液 H2O 0.1mol/LKMnO4溶液 3mol/LH2SO4溶液 少量
4 3.0mL 13.0mL 2.0mL 2.0mL X t
①所加试剂X最好选用
A、0.1mol/LMnCl2B、0.1mol/LMnSO4C、MnSO4粉末D、MnCl2粉末
②如果查阅资料正确,预计应观察到的现象是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.4s后,反应物和生成物的量还在变化,因此4s时,反应未达到平衡状态,故A错误;
B.10s时,Y的转化率==79%,故B错误;
C.由图可知,反应过程中X、Y的量逐渐减小,Z的物质的量逐渐增大,因此X、Y为反应物,Z为生成物,反应物最终不能完全转化为生成物,因此反应为可逆反应,Δn(X):Δn(Y):Δn(Z)=(1.2-0.41)mol:(1-0.21)mol:(1.58-0)mol=1:1:2,因此该反应化学方程式为,故C正确;
D.0~10s内Z的平均反应速率,故D错误;
综上所述,正确的是C项,故答案为C。
2.A
【详解】A.在工业合成氨反应中,温度和容器容积一定时,增加氮气的量,活化分子数目增多,有效碰撞几率增大,化学反应速率增大,A正确;
B.与稀盐酸反应,加入溶液,相当于加水稀释,溶液中H+浓度降低,化学反应速率减小,B错误;
C.溶液与溶液反应,实质为Ba2++=BaSO4↓,加入KCl固体,不影响离子浓度,化学反应速率不变,C错误;
D.与稀硫酸反应制取,改用的浓硫酸,将生成SO2气体,不会生成H2,D错误;
答案选A。
3.C
【详解】A.若2v正(H2)=3v逆(NH3),可判断v正(H2)=v逆(H2),则反应达到平衡状态,A错误;
B.单位时间内生成1molN2的同时消耗3molH2,可判断v正(N2)=v逆(N2),则反应达到平衡状态,B错误。
C.该反应体系为气体减小的反应,在固定容积的密闭容器中,压强不变时说明气体的总物质的量不再改变,可判断反应达到平衡状态,C正确。
D.体系中三种物质均为气体且容积固定,则密度恒定,D错误;
答案为C。
4.D
【分析】反应达到平衡状态时,正逆反应速率相等,各物理量不再发生变化,根据“当变化物理量不再变化时,可说明反应达到平衡状态”进行分析解答。
【详解】A.该反应为气体等体积反应,反应过程中气体总物质的量不变,恒温条件下,气体总物质的量之比等于其压强之比,因此反应过程中压强不会发生变化,因此不能根据压强判断反应是否达到平衡状态,故A项不选;
B.反应过程中,气体总质量不变,容器体积不变,因此气体密度始终不变,因此不能根据气体密度判断反应是否达到平衡状态,故B项不选;
C.生成HI与消耗H2均表示正反应速率,任意时刻均满足生成2 mol HI同时消耗1 mol H2,不能说明正逆反应速率相等,因此无法判断反应是否达到平衡,故C项不选;
D.反应进行过程中,气体总物质的量不变,反应未达到平衡时,H2(g)的物质的量会发生变化,因此H2的体积分数会发生变化,若H2的体积分数不随时间改变,说明正逆反应速率相等,可说明反应达到平衡状态,故D项选;
综上所述,说明该反应已达到平衡状态的是D项,故答案为D。
5.A
【详解】A.①(慢),②(快)。增大溶液中,可加快①的速率,①的速率决定总反应速率,所以增大溶液中,可提高的分解速率,故A正确;
B.I-是该反应的催化剂,是中间产物,故B错误;
C.焓变=正反应活化能-逆反应活化能,正反应活化能、逆反应活化能共同决定反应热,故C错误;
D.,正反应放热,升高温度,平衡逆向移动,分解的转化率减小,催化剂不能使平衡移动,使用催化剂不能改变分解的转化率,故D错误;
选A。
6.A
【详解】A. 升高温度,正反应速率和逆反应速率都增大,故A错误;
B. 向恒容密闭容器中充入惰性气体,容器体积不变,反应物气体和生成物气体的浓度都不变,反应速率不变,故B正确;
C. 由方程式2H2(g)+CO(g)CH3OH(g)可知,H2、CO、CH3OH的反应速率之比和系数成正比,为2:1:1,故C正确;
D. 加入高效催化剂,正、逆反应速率都会同等程度地增大,故D正确;
故选A。
7.D
【详解】A.化学反应速率比等于方程式中计量数比,HCl、N2化学计量数之比为6:1,则,A错误;
B.HCl、NH3化学计量数之比为6:2=3:1,则 ,B错误;
C.Cl2、N2化学计量数之比为3:1,则,C错误;
D.NH3、Cl2化学计量数之比为2:3,则,D正确;
故选D。
8.B
【详解】由题意,用W浓度变化表示的反应速率为,同一反应中,用不同物质表示的反应速率之比等于其化学计量数之比,故n=2,故选B。
9.B
【详解】A.如果混合物中各组分的浓度变化而保持各组分的含量不变时,平衡不移动,A错误;
B.只有平衡移动才能改变反应物的转化率,所以反应物的转化率改变时,化学平衡一定发生了移动,B正确;
C.如果向反应体系中加入催化剂,可以改变正、逆反应的反应速率,但是平衡并不会发生移动,C错误;
D.如果反应前后气体总物质的量不变,则压强对平衡无影响,D错误。
故选B。
10.B
【分析】黄铁矿与空气在沸腾炉中发生反应产生Fe2O3、SO2,反应方程式为:4FeS2+11O22Fe2O3+8SO2,反应产生的SO2与未反应的O2经净化后再接触室中发生可逆反应产生SO3,未反应的SO2、O2再加入接触室中进一步反应,反应产生的SO3在吸收塔中被98.3%的浓硫酸中的水吸收,反应可以得到更浓的硫酸。
【详解】A.黄铁矿是固体物质,在进行生产时将黄铁矿粉碎,可增大固体物质与空气的接触面积,从而能够加快其在沸腾炉中的化学反应速率,A正确;
B.在沸腾炉中,FeS2被O2氧化产生Fe2O3、SO2,因此得到的氧化产物不是只有SO2,还有Fe2O3,B错误;
C.在接触室中,SO2、O2在催化剂表面接触发生可逆反应产生SO3,经过热交换器,SO3被分离出来,排放出的SO2、O2可再重新加入接触室发生反应,故可以被循环利用,从而可提高原料利用率,C正确;
D.在吸收塔中,SO3被98.3%的浓硫酸中少量H2O吸收,发生的反应:SO3+H2O=H2SO4,故反应得到更浓的浓硫酸,D正确;
故合理选项是B。
11. 反应物本身性质 催化剂 > 0.25 mol·L-1·min-1 75% 增大
【详解】I.(1) 镁比锌活泼,应是反应物本身的性质决定;
(2) MnO2作催化剂,加速H2O2的分解;
II.(1)t2时刻没有达到化学平衡,此时反应物还在不断减小生成物还在不断增加,即v正v逆;
(2)根据反应速率的表达式:v(M)= ;
(3)反应物是N,转化率为 ;
(4)升高温度,正逆反应速率都增大。
12. 2A(g)+B(g)2C(g) 0.1mol·L-1·min-1 B ①③
【详解】(1)据图可知反应平衡前A、B的物质的量减小,C的物质的量增大,则A、B为反应物,C为生成物,最终三种物质共存说明为可逆反应,2min内Δn(A):Δn(B):Δn(C)=2mol:1mol:2mol=2:1:2,则反应方程式三种物质的计量数之比为2:1:2,则反应的化学方程式为2A(g)+B(g)2C(g);
(2)据图可知反应开始至2min时,Δn(B)=1mol,容器体积为5L,所以B的平均反应速率为=0.1mol·L-1·min-1;
(3)A.选项未注明是正反应速率还是逆反应速率,不能说明反应平衡,故A不符合题意;
B.该反应前后气体系数之和不相等,所以未平衡时气体总物质的量会发生变化,容器恒容,则压强会变,当压强不变时说明反应平衡,故B符合题意;
C.虽然注明了正逆反应速率,但是数值比不等于计量数之比,正反应速率与逆反应速率不相等,反应未平衡,故C不符合题意;
d.反应物和生成物均为气体,则气体的总质量不变,容器恒容,所以密度一直为定值,密度不变不能说明反应平衡,故D不符合题意;
答案为B;
(4)①降低温度,活化分子百分数减小,反应速率减小,故①符合题意;
②正催化剂可以降低反应的活化能,活化分子百分数增大,反应速率增大,故②不符合题意;
③增大容器体积,各物质的浓度减小,反应速率减小,故③符合题意;
答案为①③。
13.(1)3.75×10-4
(2)ad
(3)①③
(4) 研究同种催化剂的比表面积对尾气转化速率的影响 360 80 升高温度,可增大尾气转化速率 <
【详解】(1)
(2)a.CO浓度不再改变,说明CO正反应消耗速率和逆反应生成速率相等,说明反应达到平衡状态;b.根据质量守恒定律可知反应容器中气体总质量始终不变,因此不可作为判断平衡的依据;c.NO、CO、CO2、N2的浓度之比为2︰2︰2︰1,不一定是平衡状态时浓度关系比,不能说明反应达到平衡状态;d.相同时间内,反应消耗2molNO同时消耗1mol,即v正(NO):v逆(N2)=2:1,不同物质正逆反应速率比等于计量系数比,反应达到平衡状态;答案选ad;
(3)①降低温度,反应速率减慢;②容器体积不变,充入惰性气体Ar,由于体积不变,所以反应式中各物质的物质的量浓度不变,速率不变;③容器压强不变,充入惰性气体Ar,为保持原来压强,容器体积增大,各物质的物质的量浓度减小,速率减慢;④再通入a mol NO(g),反应物浓度增大,速率加快;由此可得当改变上述条件时,反应速率会减小的是①③;
(4)对比I、II组实验,温度相同,同种催化剂的比表面积不同,a为研究同种催化剂的比表面积对尾气转化速率的影响;对比I、III组实验,为研究温度对尾气转化速率的影响,根据控制变量可知温度不同,同种催化剂的比表面积相同,则b为360,c为80; 测得,说明III组反应速率比I组快,对比实验I、III,可得结论:催化剂的比表面积相同时,升高温度,可以加快尾气转化速率;通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验I、II,II的催化剂比表面积大,反应速率快,达到平衡所用时间短,<。
14.(1) 可逆反应 2X+YZ
(2)0.2mol/(L min)
(3)90.8
【详解】(1)根据图象可知,X、Y为反应物,Z为生成物,反应未进行到底,存在反应限度,因此该反应是可逆反应,达到平衡时,X、Y、Z转化的物质的量分别为0.4mol、0.2mol、0.2mol,因此反应的化学计量数之比为2:1:1,则反应的化学方程式为2X+Y Z;
(2)根据图示,2min内X转化的物质的量为1.0mol-0.6mol=0.4mol,容器体积为1L,则平均反应速率v(X)= 0.4mol/L÷2min=0.2mol L-1 min-1 ;
(3)2min末,Y转化的物质的量为0.2mol,放出18.16kJ的热量,则消耗1molY会放出18.16kJ÷0.2=90.8kJ的热量。
15. CO2(g)+3H2(g) CH3OH(g)+H2O(g) 0.25mol/(L·min) 0.5mol/L BD AD
【分析】(1)根据图示可以看出,随着反应的进行二氧化碳逐渐减少至不变,甲醇与水逐渐增大至不变,据此分析出反应物与产物,再结合转化量之比等于化学计量数之比书写化学方程式;
(2)根据题目内容可知,该工业方法制取甲醇为二氧化碳与氢气反应生成甲醇和水;根据三段式计算出反应混合物各组分的浓度变化量、平衡时的浓度,根据计算出v(H2);
(3)根据影响平衡化学反应速率的外界因素作判断;
(4)化学反应达到平衡状态时,各物质的浓度保持不变,正反应速率等于逆反应速率,据此分析判断。
【详解】(1)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,根据图示可以看出,△n(CO2)=1.00mol-0.25mol=0.75 mol,△n(CH3OH)= △n(H2O)=0.75mol-0mol=0.75 mol,则对应物质的化学计量数之比为1:1:1,其反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g);
(2)根据图示可以看出,3min时,图示中的三种物质的物质的量均为0.5mol,则
,
则从反应开始到3min,氢气的平均反应速率v(H2)= ;平衡时生成甲醇是0.75mol,消耗氢气是2.25mol,剩余氢气是1mol,因此浓度是0.5mol/L;
(3)A. 在原容器中再充入1mol CO2,CO2的总物质的量浓度在增加,化学反应速率增大,A项错误;
B. 在原容器中充入1mol He,体积没有变化,各成分浓度不变,化学反应速率不变,B项正确;
C. 缩小容器的容积,相当于加压,化学反应速率增大,C项错误;
D. 将水蒸气从体系中分离出,减小生成物浓度,化学反应速率减小,D项正确;
故答案选:BD;
(4)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)是气体分子数减小的反应,则
A 混合气体的压强保持不变,则说明各物质的浓度保持不变,可说明反应已经达到平衡状态,A项正确;
B CH3OH(g)和H2O(g)的体积分数比始终是1:1,则CH3OH(g)和H2O(g)的体积分数比保持不变,不能说明反应已经达到平衡状态,B项错误;
C 混合气体的质量不变,该反应体系为恒容密闭容器,则混合气体的密度始终保持不变,因此密度不变不能说明反应已经达到平衡状态,C项错误;
D 混合气体的质量不变,平均摩尔质量不变则说明混合气体的总物质的量不变,即各物质的物质的量保持不变,可以说明反应已经达到平衡状态,D项正确;故答案选AD;
【点睛】有关达到化学平衡状态的标志是常考题型,通常有直接判断法和间接判断法两大类。
一、直接判断法:
①ν(正)=ν(逆)0,即正反应速率 = 逆反应速率
注意反应速率的方向必须有正逆之分,每个物质都可以表示出参与的化学反应速率,而其速率之比应符合方程式中的化学计量数的比值,这一点学生做题容易出错。
②各组分的浓度保持不变,包括各组分的质量分数、物质的量分数、体积分数、百分含量不变。
二、间接判断法
①对于气体体积前后改变的反应,压强不变是平衡的标志,而对于气体体积前后不改变的反应,压强不能做标志。
②对于恒温恒压条件下的反应,气体体积前后改变的反应密度不变是平衡标志。
③对于恒温恒容下的反应,有非气体物质的反应,密度不变是平衡标志。
④有颜色的物质参与或生成的可逆反应,体系的颜色不再随时间而变化。
⑤任何化学反应都伴随着能量变化,当体系温度一定时,达到平衡。
16.(1)0.75mol·L-1
(2)3mol
(3)0.05mol·L-1·min-1
(4)2
(5)③>①=④>②
【分析】由方程式可知Δc(A)=1.5Δc(D)=1.5×0.5mol/L=0.75mol/L,Δc(B)=0.5Δc(D)=0.25mol/L,A、B起始浓度相等设为cmol/L,则(c-0.75):(c-0.25)=3:5,解得c=1.5。开始时容器中A、B的物质的量为n=1.5mol/L×2L=3mol。
【详解】(1)由分析可知,开始A的浓度为1.5mol/L,Δc(A)=1.5Δc(D)=1.5×0.5mol/L=0.75mol/L,则5min后A的浓度为1.5mol/L。
(2)根据分析可知,反应开始前充入容器中的B的物质的量为3mol。
(3)浓度变化量之比等于化学计量数之比,则x:2=0.1mol/(L min)×5min:0.5mol/L,解得x=2,速率之比等于化学计量数之比,则v(B)=0.5v(C)=0.05mol/(L min)。
(4)浓度变化量之比等于化学计量数之比,则x:2=0.1mol/(L min)×5min:0.5mol/L,解得x=2。
(5)①v(A)=0.01mol·L-1·s-1时,v(A)=v(A)×60=0.6mol·L-1·min-1;
②v(B)=1.20mol·L-1·min-1时,v(A)=v(B)=0.4mol·L-1·min-1;;
③v(C)=2.40mol·L-1·min-1时,v(A)=v(C)=1.20mol·L-1·min-1;
④v(D)=0.02mol·L-1·s-1,v(A)=v(D)×60=0.6mol·L-1·min-1;
故速率大小关系为③>①=④>②。
17.(1))>
(2) 71.4% 0.125mol/(L·min)
(3)①③
(4)①②④
【详解】(1)t1min后,产物CO继续增加,反应正向进行,正、逆反应速率的大小关系为v正>v逆。
(2)0~4min内,CO2的浓度降低0.5mol/L,CO2的转化率为;0~4min内,CO的浓度增大0.5mol/L,CO的平均反应速率,v(CO)=0.125mol/(L·min)。
(3)①降低温度,反应速率减慢,选①;
②铁是固体,减少铁粉的质量,反应速率几乎不变,故不选②;
③保持压强不变,充入He使容器的体积增大,CO2、CO浓度减小,反应速率减慢,故选③;
④保持体积不变,充入He使体系压强增大,CO2、CO浓度不变,反应速率不变,故不选④;
选①③;
(4)①v正(CO2)=v逆(CO),正逆反应速率相等,反应一定达到平衡状态,故选①;
②单位时间内生成nmolCO2的同时生成nmolCO,正逆反应速率相等,反应一定达到平衡状态,故选②;
③反应前后气体系数和相等,压强是恒量,容器中气体压强不随时间的变化而变化,反应不一定平衡,故不选③;
④反应后气体质量增大、气体物质的量不变,平均相对分子质量是变量,容器中气体的平均相对分子质量不随时间的变化而变化,反应一定达到平衡状态,故选④;
选①②④。
18. N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol b BD
【详解】(1) 根据图象分析,热化学方程式为: N2(g)+3H2(g) 2NH3(g) △H=508-600=-92kJ/mol;加入铁触媒做催化剂,反应速率加快,故b曲线为加入铁触媒的能量变化曲线;
(2) A.3v(H2)正=2v(NH3)逆 速率之比等于系数比;错误;B.单位时间内生成n mol N2的同时生成2n molNH3,B正确;C.反应前后气体的总质量不变,容器的体积不变,密度任何时候容器内气体的密度不随时间的变化而变化。无法判断是否平衡;D.反应前后气体的总量不相等,容器内压强不随时间的变化而变化,D正确;故选BD。
考点:热化学方程式的书写,平衡状态的判定;
19. 0.025mol/(L·min) 0.075mol/(L·min) 0.05mol//(L·min) X、Y 3X+Y 2Z
【详解】(1)由图可知2min内,X的物质的量变化为(1.0-0.9)mol=0.1mol,故x==0.025mol/(L·min);Y的物质的量变化为(1.0-0.7)mol=0.3mol,故vY==0.075mol/(L·min);Z的物质的量变化为(0.2-0)mol=0.2mol,故vZ==0.05mol/(L·min);
(2)根据图中曲线可知,随着反应的进行X、Y的物质的量减少,为反应物,Z的物质的量增多,为生成物;
(3)根据化学反应速率之比等于化学反应议程式中计量数之比,Vx:Vy:Vz=0.025mol/(L·min):0.075mol/(L·min):0.05mol//(L·min)=3:1:2,且反应物没有反应完全,该反应为可逆反应,则该反应的化学方程式为:3X+Y 2Z。
20.(1)>
(2)0.25
(3)t3
(4)增大
(5)2N(g) M(g)
【详解】(1)t2时刻,N的物质的量继续减小中,M的物质的量继续增大中,故处于建立平衡的过程中,则t2时刻正、逆反应速率大小:v(正)>v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率。
(3)达到平衡时,各成分M、N的物质的量不再改变。则处于平衡状态的时刻为t3。
(4)温度升高反应速率加快,正逆反应速率都增大,则升高温度,v(逆)增大。
(5)从反应开始至平衡时刻,,,物质的量的变化量之比等于化学计量数之比,故该反应的化学方程式为2N(g) M(g)。
21. 其他条件相同时,增大KMnO4浓度反应速率增大 mol/(L min) 生成物中的MnSO4(或Mn2+)为该反应的催化剂 MnSO4 与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min)
【详解】(1)从表中数据可知改变的条件是KMnO4浓度;其他条件相同时,增大KMnO4浓度,反应速率增大;
(2)草酸的物质的量为:0.6mol L 1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol L 1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,而由实验1可知混合溶液的中体积为10ml,所以混合后溶液中高锰酸钾的浓度为:
=0.06mol/L,
这段时间内平均反应速率为:v(KMnO4)= = mol/(L min);
(3)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂;
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min)。
22. 增大接触面积,加快溶解速率,使其充分反应 Au+HNO3+4HCl= H[AuCl4]+NO↑+2H2O AgCl 萃取、分液 水浴加热 向“操作Ⅱ”后的水溶液中加入足量H2C2O4溶液,充分反应后,用布氏漏斗抽滤(过滤),滤渣用蒸馏水充分洗涤、干燥
【分析】(1)粗金块切割成细条状,增大了接触面积,可加快反应速率;“溶解”时Au转化为H[AuCl4],同时生成NO,配平即可;
(2)加入王水后剩余的固体为AgCl沉淀;
(3)由图中可知操作Ⅰ为萃取分液;
(4)可以选用水浴加热;
(5)结合题干和流程图进行分析;
【详解】(1)将粗金块切合成细条,可增大反应接触面积,加快溶解反应速率;根据信息可写出Au+HNO3+HCl→ H[AuCl4]+NO↑,根据得失电子守恒和原子守恒,配平得Au+HNO3+4HCl= H[AuCl4]+NO↑+2H2O;
(2)粗金中Au、Ag都被王水溶解,稀释后生成AgCl沉淀;
(3)从流程中“水相”和“有机相”可判断出操作Ⅰ为萃取分液,操作Ⅱ也是萃取分液(反萃取);
(4) 100℃以内的加热都可以选用水浴加热;
(5)操作Ⅱ后的溶液主要含H[AuCl4],根据已知②,应加入草酸,将其还原成Au单质,再抽滤、洗涤、干燥即可,具体操作为:向“操作Ⅱ”后的水溶液中加入足量H2C2O4溶液,充分反应后,用布氏漏斗抽滤(过滤),滤渣用蒸馏水充分洗涤、干燥。
23. 浓度 15.0 2.0 0.00125mol/(L·min) 该反应放热,温度升高,速率加快 C 与实验1相比,溶液褪色所需时间短(或所用时间小于8min)
【分析】该实验的目的是探究浓度对化学反应速率的影响,三组实验中的混合溶液除了草酸的浓度不同,其他条件都要保持一致,通过比较溶液褪色的时间判断反应速率的快慢,探究锰离子的催化作用要注意不能改变溶液总体积,也不能进入和酸性高锰酸钾反应的其他物质。
【详解】(1)由表格可知,三组实验高锰酸钾和硫酸的浓度相同,草酸的浓度不同,故该实验在探究浓度对化学反应速率的影响;
(2)由1、2两组实验可知,混合溶液的总体积是20mL,三组实验应该保持一致,高锰酸钾和草酸的浓度也应该保持一致,故V1=16mL-1mL=15mL,V2=2.0mL;
(3)草酸的物质的量为:0.6mol L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.1mol L-1×0.002L=0.0002mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0002mol=9:1,显然草酸过量,高锰酸钾完全反应,溶液消耗的高锰酸钾的浓度为:=0.01mol/L,这段时间内平均反应速率v(KMnO4)==0.00125 mol/(L·min);
(5)除了催化剂可以加快反应速率,温度升高也可以加快反应速率,故t1~t2时间内速率变快的原因也可能是:该反应放热,温度升高,速率加快;
(4)第4组实验要证明锰离子对该反应有催化作用,所以需要向体系中加入Mn2+,但又不能改变混合溶液的体积,所以要加固体,Cl-具有还原性会和酸性高锰酸钾反应,不能加氯化锰,所以要加MnSO4,故选C。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
A.4s时,反应达到平衡状态
B.10s时,Y的转化率为21%
C.反应的化学方程式为:
D.0~10s内Z的平均反应速率为:
2.下列措施对改变反应速率的影响正确的是
A.在工业合成氨反应中,温度和容器容积一定时,增加氮气的量,能增大反应速率
B.与稀盐酸反应,加入溶液,不会改变反应速率
C.溶液与溶液反应,加入固体,将加快反应速率
D.与稀硫酸反应制取,改用的浓硫酸将加快的生成速率
3.氨是一种重要的化工原料,在工农业生产中有广泛的应用。一定温度下,在固定容积的密闭容器中进行可逆反应N2(g)+H2(g) NH3(g)。该可逆反应达到平衡状态的标志是( )
A.3v正(H2)=2v逆(NH3)
B.单位时间内生成1mol N2的同时生成3mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间而变化
4.恒温恒容条件下,某密闭容器中发生如下反应:H2(g)+I2(g)2HI(g),说明该反应已达到平衡状态的是 ( )
A.容器内总压强不随时间改变 B.气体的密度不随时间改变
C.单位时间内生成2 mol HI同时消耗1 mol H2 D.H2的体积分数不随时间改变
5.已知,分解速率受温度、浓度、催化剂以及溶液酸碱性等多种因素影响。和等均可作为分解的催化剂。含有少量的溶液中,的分解机理为:①(慢),②(快)。对于含有少量的溶液中发生的反应,下列说法正确的是
A.增大溶液中,可提高的分解速率
B.也是该反应的催化剂
C.反应①和反应②的活化能之和等于
D.升高温度和使用催化剂均能提高分解的转化率
6.在恒容密闭容器中充入一定量CO和H2合成CH3OH,其化学方程式为2H2(g)+CO(g)CH3OH(g) △H<0。下列说法错误的是
A.升高温度,正反应速率减小,逆反应速率增大
B.向容器中充入惰性气体,反应速率不变
C.H2、CO、CH3OH的反应速率之比为2:1:1
D.加入高效催化剂,正、逆反应速率都会增大
7.在某恒容密闭容器中发生反应:。若反应速率分别用表示,则下列关系式正确的是
A. B.
C. D.
8.把3molX气体和1moY气体混合于容积为1 L的容器中,使其发生如下反应:3X(g)+Y(g)nZ(g)+2W(g)。2 min末生成0.2 molW,若测知以Z浓度变化表示的平均反应速率为0.1 mol·L-1·min-1, 则n的值为( )
A.1 B.2 C.3 D.4
9.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A.反应混合物的浓度 B.反应物的转化率
C.正、逆反应的速率 D.反应体系的压强
10.以黄铁矿(主要成分为FeS2,其中S的化合价为价)生产硫酸的工艺流程如下图。
下列说法不正确的是
A.将黄铁矿粉碎,可加快其在沸腾炉中的化学反应速率
B.沸腾炉中得到的氧化产物只有SO2
C.接触室中排放出的SO2、O2循环利用,可提高原料利用率
D.吸收塔中发生的反应为SO3+H2O=H2SO4
二、填空题
11.Ⅰ.下列各项分别与哪个影响化学反应速率的因素关系最为密切?
(1)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气泡有快有慢: 。
(2)MnO2加入双氧水中放出气泡更快: 。
Ⅱ.在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)比较t2时刻,正逆反应速率大小v正 v逆。(填“>”“=”或“<”)
(2)若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为 。
(3)t3时刻化学反应达到平衡,反应物的转化率为 。
(4)如果升高温度,则v逆 (填“增大”“减小”或“不变”)。
12.某可逆反应在体积为5L的密闭容器中进行,0~3min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。
(1)该反应的化学方程式为 。
(2)反应开始至2min时,B的平均反应速率为 。
(3)能说明该反应已达到平衡状态的是 (填字母)。
A.v(A)=2v(B)
B.容器内压强保持不变
C.2v逆(A)=v正(B)
D.容器内混合气体的密度保持不变
(4)在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变下列条件时,反应速率会减小的是 (填序号)。
①降低温度 ②加入催化剂(正) ③增大容器容积
13.利用催化技术可将汽车尾气中的CO和NO转化为和,化学方程式:
(1)某温度下,在容积不变的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
时间/s 0 1 2 3 ……
3.60 3.05 2.85 2.75 ……
用CO的浓度变化表示0~2s的平均反应速率为 。
(2)下列可以说明反应达到平衡状态的是 。
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、CO2、N2的浓度之比为2︰2︰2︰1
d.相同时间内,反应消耗2molNO同时消耗1molN2
(3)在密闭容器里发生上述反应,当改变下列条件时,反应速率会减小的是 (填序号)。
①降低温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④再通入a mol NO(g)
(4)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
实验编号 实验目的 T/℃ 同种催化剂的比表面积/g 达平衡时所用的时间/s
I 对照实验 280 80
II a 280 120
III 研究温度对尾气转化速率的影响 b c
【实验分析与结论】
①补全表格a. ,b. ,c. 。
②测得,对比实验I、III,可得结论:催化剂的比表面积相同时, 。
③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验I、II, (填“>”、“<”或“=”)。
14.在一定温度下,向体积为 1L 的密闭容器中通入 1molX 气体和 0.5molY 气体,各物质的物质的量随时间变化如图所示:
(1)该反应是 (填“可逆反应”或“非可逆反应”),化学反应方程式为 。
(2)在 2min 内 X 平均反应速率vX = 。
(3)若在 2min 末时,放出 18.16kJ 热量,则每消耗 1mol 的 Y 放出的热量为 kJ。
15.如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。利用H2和CO2生产甲醇燃料,为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
(1)该反应的化学方程式为: 。
(2)从反应开始到3min时,氢气的平均反应速率v(H2)= ;达到平衡时氢气的浓度为 。
(3)下列措施中不能使该反应速率增大的是 。
A 在原容器中再充入1 molCO2 B 在原容器中充入1 mol He使体系压强增大
C 缩小容器的容积 D 将水蒸气从体系中分离出
(4)当下列物理量不变时,能说明反应已经达到平衡状态的是 。
A 混合气体的压强
B CH3OH(g)和H2O(g)的体积分数比
C 混合气体的密度
D 混合气体的平均摩尔质量
16.将等物质的量A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g)xC(g)+2D(g),经5min后测得D的浓度为0.5mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1mol·L-1·min-1。
(1)经5min后A的浓度为 。
(2)反应开始前充入容器中B的物质的量为 。
(3)B的平均反应速率为 。
(4)x的值为 。
(5)对于反应A(g)+3B(g)=2C(g)+2D(g),下列分别表示不同条件下的反应速率,则反应速率大小关系是 。
①v(A)=0.01mol·L-1·s-1
②v(B)=1.20mol·L-1·min-1
③v(C)=2.40mol·L-1·min-1
④v(D)=0.02mol·L-1·s-1
17.一定条件下铁可以和CO2发生反应Fe2O3+3CO2Fe+3CO2。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
(1)t1min时,正、逆反应速率的大小关系为v正 v逆(填“>”“<”或“=”)。
(2)0~4min内,CO2的转化率为 ,CO的平均反应速率,v(CO)= 。
(3)下列条件的改变能减慢上述反应的反应速率的是 (填序号,下同)。
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是 。
①v正(CO2)=v逆(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
18.氨的合成是目前普遍使用的人工固氮方法。
(1) 根据图提供的信息,写出该反应的热化学方程 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2) 在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
19.某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
(1)计算反应开始2min内的v(x)= ,v(y)= ,v(z)= 。
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
20.在一定温度下,4L密闭容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。
(1)比较t2时刻,正、逆反应速率大小: v(正) (填“”“”或“”) v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率 。
(3) t1、t2、t3三个时刻中处于平衡状态的时刻为 (填“t1”“ t2”或“t3”)。
(4)如果升高温度,则v(逆) (填“增大”“减小”或“不变”)。
(5)该反应的化学方程式为
三、实验探究题
21.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 室温下,试管中所加试剂及其用量/mL 室温下溶液 颜色褪至无色 所需时间/min
0.6 mol · L-1 H2C2O4溶液 H2O 0.2 mol · L-1 KMnO4溶液 3 mol · L-1 稀硫酸
1 3.0 2.0 3.0 2.0 4.0
2 3.0 3.0 2.0 2.0 5.2
3 3.0 4.0 1.0 2.0 6.4
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 室温下,试管中所加试剂及其用量/mL 再向试管中加入少量固体 室温下溶液颜色褪至无色所需时间/min
0.6mol/LH2C2O4溶液 H2O 0.2mol/LKMnO4溶液 3mol/L稀硫酸
4 3.0 2.0 3.0 2.0 t
③若该小组同学提出的假设成立,应观察到的现象是 。
22.某研究性学习小组提纯粗金(主要含Au,还含少量Ag)的实验流程如下:
已知:① 浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水。
② 利用H2C2O4还原H[AuCl4]可得到Au。
(1)“溶解”前,先将粗金块切割成细条状,其目的是 。“溶解”时Au转化为H[AuCl4],该反应的化学方程式为 。
(2)“滤渣”的主要成分为 (填化学式)。
(3)“操作Ⅰ”的名称为 。
(4)“操作Ⅱ”需控制在40~70℃时进行,适宜的加热方式为 。
(5)请设计从“操作Ⅱ”后的水溶液中获取单质Au的实验方案: 。(实验中须使用的试剂有:H2C2O4溶液,蒸馏水;除常用仪器外须使用的仪器有:布氏漏斗)。
23.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的外界因素,离子方程式为2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。设计实验方案如下(KMnO4溶液已酸化):
实验编号 室温下,试管中所加试剂及其用量/mL 溶液褪色至无色所需时间/min
0.6mol/LH2C2O4溶液 H2O 0.1mol/LKMnO4溶液 3mol/LH2SO4溶液
1 3.0 13.0 2.0 2.0 8.0
2 2.0 14.0 2.0 2.0 10.4
3 1.0 V1 V2 2.0 12.8
请回答:
(1)该实验探究的是 因素对化学反应速率的影响。
(2)请完成上述实验设计表:V1= ,V2= 。
(3)利用实验1中数据计算,平均反应速率:v(KMnO4)= 。
(4)小组同学发现反应速率总是如图1,其中t1~t2时间内速率变快的主要原因可能是:
①、产物Mn2+是该反应的催化剂;②、 。
(5)该小组同学查阅已有的实验资料发现,该实验过程中Mn2+对反应有催化作用,并继续进行实验探究。请你帮助该小组同学完成实验方案。
实验编号 室温下,试管中所加试剂及其用量 室温下溶液褪色至无色所需时间/min
0.6mol/LH2C2O4溶液 H2O 0.1mol/LKMnO4溶液 3mol/LH2SO4溶液 少量
4 3.0mL 13.0mL 2.0mL 2.0mL X t
①所加试剂X最好选用
A、0.1mol/LMnCl2B、0.1mol/LMnSO4C、MnSO4粉末D、MnCl2粉末
②如果查阅资料正确,预计应观察到的现象是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.4s后,反应物和生成物的量还在变化,因此4s时,反应未达到平衡状态,故A错误;
B.10s时,Y的转化率==79%,故B错误;
C.由图可知,反应过程中X、Y的量逐渐减小,Z的物质的量逐渐增大,因此X、Y为反应物,Z为生成物,反应物最终不能完全转化为生成物,因此反应为可逆反应,Δn(X):Δn(Y):Δn(Z)=(1.2-0.41)mol:(1-0.21)mol:(1.58-0)mol=1:1:2,因此该反应化学方程式为,故C正确;
D.0~10s内Z的平均反应速率,故D错误;
综上所述,正确的是C项,故答案为C。
2.A
【详解】A.在工业合成氨反应中,温度和容器容积一定时,增加氮气的量,活化分子数目增多,有效碰撞几率增大,化学反应速率增大,A正确;
B.与稀盐酸反应,加入溶液,相当于加水稀释,溶液中H+浓度降低,化学反应速率减小,B错误;
C.溶液与溶液反应,实质为Ba2++=BaSO4↓,加入KCl固体,不影响离子浓度,化学反应速率不变,C错误;
D.与稀硫酸反应制取,改用的浓硫酸,将生成SO2气体,不会生成H2,D错误;
答案选A。
3.C
【详解】A.若2v正(H2)=3v逆(NH3),可判断v正(H2)=v逆(H2),则反应达到平衡状态,A错误;
B.单位时间内生成1molN2的同时消耗3molH2,可判断v正(N2)=v逆(N2),则反应达到平衡状态,B错误。
C.该反应体系为气体减小的反应,在固定容积的密闭容器中,压强不变时说明气体的总物质的量不再改变,可判断反应达到平衡状态,C正确。
D.体系中三种物质均为气体且容积固定,则密度恒定,D错误;
答案为C。
4.D
【分析】反应达到平衡状态时,正逆反应速率相等,各物理量不再发生变化,根据“当变化物理量不再变化时,可说明反应达到平衡状态”进行分析解答。
【详解】A.该反应为气体等体积反应,反应过程中气体总物质的量不变,恒温条件下,气体总物质的量之比等于其压强之比,因此反应过程中压强不会发生变化,因此不能根据压强判断反应是否达到平衡状态,故A项不选;
B.反应过程中,气体总质量不变,容器体积不变,因此气体密度始终不变,因此不能根据气体密度判断反应是否达到平衡状态,故B项不选;
C.生成HI与消耗H2均表示正反应速率,任意时刻均满足生成2 mol HI同时消耗1 mol H2,不能说明正逆反应速率相等,因此无法判断反应是否达到平衡,故C项不选;
D.反应进行过程中,气体总物质的量不变,反应未达到平衡时,H2(g)的物质的量会发生变化,因此H2的体积分数会发生变化,若H2的体积分数不随时间改变,说明正逆反应速率相等,可说明反应达到平衡状态,故D项选;
综上所述,说明该反应已达到平衡状态的是D项,故答案为D。
5.A
【详解】A.①(慢),②(快)。增大溶液中,可加快①的速率,①的速率决定总反应速率,所以增大溶液中,可提高的分解速率,故A正确;
B.I-是该反应的催化剂,是中间产物,故B错误;
C.焓变=正反应活化能-逆反应活化能,正反应活化能、逆反应活化能共同决定反应热,故C错误;
D.,正反应放热,升高温度,平衡逆向移动,分解的转化率减小,催化剂不能使平衡移动,使用催化剂不能改变分解的转化率,故D错误;
选A。
6.A
【详解】A. 升高温度,正反应速率和逆反应速率都增大,故A错误;
B. 向恒容密闭容器中充入惰性气体,容器体积不变,反应物气体和生成物气体的浓度都不变,反应速率不变,故B正确;
C. 由方程式2H2(g)+CO(g)CH3OH(g)可知,H2、CO、CH3OH的反应速率之比和系数成正比,为2:1:1,故C正确;
D. 加入高效催化剂,正、逆反应速率都会同等程度地增大,故D正确;
故选A。
7.D
【详解】A.化学反应速率比等于方程式中计量数比,HCl、N2化学计量数之比为6:1,则,A错误;
B.HCl、NH3化学计量数之比为6:2=3:1,则 ,B错误;
C.Cl2、N2化学计量数之比为3:1,则,C错误;
D.NH3、Cl2化学计量数之比为2:3,则,D正确;
故选D。
8.B
【详解】由题意,用W浓度变化表示的反应速率为,同一反应中,用不同物质表示的反应速率之比等于其化学计量数之比,故n=2,故选B。
9.B
【详解】A.如果混合物中各组分的浓度变化而保持各组分的含量不变时,平衡不移动,A错误;
B.只有平衡移动才能改变反应物的转化率,所以反应物的转化率改变时,化学平衡一定发生了移动,B正确;
C.如果向反应体系中加入催化剂,可以改变正、逆反应的反应速率,但是平衡并不会发生移动,C错误;
D.如果反应前后气体总物质的量不变,则压强对平衡无影响,D错误。
故选B。
10.B
【分析】黄铁矿与空气在沸腾炉中发生反应产生Fe2O3、SO2,反应方程式为:4FeS2+11O22Fe2O3+8SO2,反应产生的SO2与未反应的O2经净化后再接触室中发生可逆反应产生SO3,未反应的SO2、O2再加入接触室中进一步反应,反应产生的SO3在吸收塔中被98.3%的浓硫酸中的水吸收,反应可以得到更浓的硫酸。
【详解】A.黄铁矿是固体物质,在进行生产时将黄铁矿粉碎,可增大固体物质与空气的接触面积,从而能够加快其在沸腾炉中的化学反应速率,A正确;
B.在沸腾炉中,FeS2被O2氧化产生Fe2O3、SO2,因此得到的氧化产物不是只有SO2,还有Fe2O3,B错误;
C.在接触室中,SO2、O2在催化剂表面接触发生可逆反应产生SO3,经过热交换器,SO3被分离出来,排放出的SO2、O2可再重新加入接触室发生反应,故可以被循环利用,从而可提高原料利用率,C正确;
D.在吸收塔中,SO3被98.3%的浓硫酸中少量H2O吸收,发生的反应:SO3+H2O=H2SO4,故反应得到更浓的浓硫酸,D正确;
故合理选项是B。
11. 反应物本身性质 催化剂 > 0.25 mol·L-1·min-1 75% 增大
【详解】I.(1) 镁比锌活泼,应是反应物本身的性质决定;
(2) MnO2作催化剂,加速H2O2的分解;
II.(1)t2时刻没有达到化学平衡,此时反应物还在不断减小生成物还在不断增加,即v正v逆;
(2)根据反应速率的表达式:v(M)= ;
(3)反应物是N,转化率为 ;
(4)升高温度,正逆反应速率都增大。
12. 2A(g)+B(g)2C(g) 0.1mol·L-1·min-1 B ①③
【详解】(1)据图可知反应平衡前A、B的物质的量减小,C的物质的量增大,则A、B为反应物,C为生成物,最终三种物质共存说明为可逆反应,2min内Δn(A):Δn(B):Δn(C)=2mol:1mol:2mol=2:1:2,则反应方程式三种物质的计量数之比为2:1:2,则反应的化学方程式为2A(g)+B(g)2C(g);
(2)据图可知反应开始至2min时,Δn(B)=1mol,容器体积为5L,所以B的平均反应速率为=0.1mol·L-1·min-1;
(3)A.选项未注明是正反应速率还是逆反应速率,不能说明反应平衡,故A不符合题意;
B.该反应前后气体系数之和不相等,所以未平衡时气体总物质的量会发生变化,容器恒容,则压强会变,当压强不变时说明反应平衡,故B符合题意;
C.虽然注明了正逆反应速率,但是数值比不等于计量数之比,正反应速率与逆反应速率不相等,反应未平衡,故C不符合题意;
d.反应物和生成物均为气体,则气体的总质量不变,容器恒容,所以密度一直为定值,密度不变不能说明反应平衡,故D不符合题意;
答案为B;
(4)①降低温度,活化分子百分数减小,反应速率减小,故①符合题意;
②正催化剂可以降低反应的活化能,活化分子百分数增大,反应速率增大,故②不符合题意;
③增大容器体积,各物质的浓度减小,反应速率减小,故③符合题意;
答案为①③。
13.(1)3.75×10-4
(2)ad
(3)①③
(4) 研究同种催化剂的比表面积对尾气转化速率的影响 360 80 升高温度,可增大尾气转化速率 <
【详解】(1)
(2)a.CO浓度不再改变,说明CO正反应消耗速率和逆反应生成速率相等,说明反应达到平衡状态;b.根据质量守恒定律可知反应容器中气体总质量始终不变,因此不可作为判断平衡的依据;c.NO、CO、CO2、N2的浓度之比为2︰2︰2︰1,不一定是平衡状态时浓度关系比,不能说明反应达到平衡状态;d.相同时间内,反应消耗2molNO同时消耗1mol,即v正(NO):v逆(N2)=2:1,不同物质正逆反应速率比等于计量系数比,反应达到平衡状态;答案选ad;
(3)①降低温度,反应速率减慢;②容器体积不变,充入惰性气体Ar,由于体积不变,所以反应式中各物质的物质的量浓度不变,速率不变;③容器压强不变,充入惰性气体Ar,为保持原来压强,容器体积增大,各物质的物质的量浓度减小,速率减慢;④再通入a mol NO(g),反应物浓度增大,速率加快;由此可得当改变上述条件时,反应速率会减小的是①③;
(4)对比I、II组实验,温度相同,同种催化剂的比表面积不同,a为研究同种催化剂的比表面积对尾气转化速率的影响;对比I、III组实验,为研究温度对尾气转化速率的影响,根据控制变量可知温度不同,同种催化剂的比表面积相同,则b为360,c为80; 测得,说明III组反应速率比I组快,对比实验I、III,可得结论:催化剂的比表面积相同时,升高温度,可以加快尾气转化速率;通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验I、II,II的催化剂比表面积大,反应速率快,达到平衡所用时间短,<。
14.(1) 可逆反应 2X+YZ
(2)0.2mol/(L min)
(3)90.8
【详解】(1)根据图象可知,X、Y为反应物,Z为生成物,反应未进行到底,存在反应限度,因此该反应是可逆反应,达到平衡时,X、Y、Z转化的物质的量分别为0.4mol、0.2mol、0.2mol,因此反应的化学计量数之比为2:1:1,则反应的化学方程式为2X+Y Z;
(2)根据图示,2min内X转化的物质的量为1.0mol-0.6mol=0.4mol,容器体积为1L,则平均反应速率v(X)= 0.4mol/L÷2min=0.2mol L-1 min-1 ;
(3)2min末,Y转化的物质的量为0.2mol,放出18.16kJ的热量,则消耗1molY会放出18.16kJ÷0.2=90.8kJ的热量。
15. CO2(g)+3H2(g) CH3OH(g)+H2O(g) 0.25mol/(L·min) 0.5mol/L BD AD
【分析】(1)根据图示可以看出,随着反应的进行二氧化碳逐渐减少至不变,甲醇与水逐渐增大至不变,据此分析出反应物与产物,再结合转化量之比等于化学计量数之比书写化学方程式;
(2)根据题目内容可知,该工业方法制取甲醇为二氧化碳与氢气反应生成甲醇和水;根据三段式计算出反应混合物各组分的浓度变化量、平衡时的浓度,根据计算出v(H2);
(3)根据影响平衡化学反应速率的外界因素作判断;
(4)化学反应达到平衡状态时,各物质的浓度保持不变,正反应速率等于逆反应速率,据此分析判断。
【详解】(1)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,根据图示可以看出,△n(CO2)=1.00mol-0.25mol=0.75 mol,△n(CH3OH)= △n(H2O)=0.75mol-0mol=0.75 mol,则对应物质的化学计量数之比为1:1:1,其反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g);
(2)根据图示可以看出,3min时,图示中的三种物质的物质的量均为0.5mol,则
,
则从反应开始到3min,氢气的平均反应速率v(H2)= ;平衡时生成甲醇是0.75mol,消耗氢气是2.25mol,剩余氢气是1mol,因此浓度是0.5mol/L;
(3)A. 在原容器中再充入1mol CO2,CO2的总物质的量浓度在增加,化学反应速率增大,A项错误;
B. 在原容器中充入1mol He,体积没有变化,各成分浓度不变,化学反应速率不变,B项正确;
C. 缩小容器的容积,相当于加压,化学反应速率增大,C项错误;
D. 将水蒸气从体系中分离出,减小生成物浓度,化学反应速率减小,D项正确;
故答案选:BD;
(4)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)是气体分子数减小的反应,则
A 混合气体的压强保持不变,则说明各物质的浓度保持不变,可说明反应已经达到平衡状态,A项正确;
B CH3OH(g)和H2O(g)的体积分数比始终是1:1,则CH3OH(g)和H2O(g)的体积分数比保持不变,不能说明反应已经达到平衡状态,B项错误;
C 混合气体的质量不变,该反应体系为恒容密闭容器,则混合气体的密度始终保持不变,因此密度不变不能说明反应已经达到平衡状态,C项错误;
D 混合气体的质量不变,平均摩尔质量不变则说明混合气体的总物质的量不变,即各物质的物质的量保持不变,可以说明反应已经达到平衡状态,D项正确;故答案选AD;
【点睛】有关达到化学平衡状态的标志是常考题型,通常有直接判断法和间接判断法两大类。
一、直接判断法:
①ν(正)=ν(逆)0,即正反应速率 = 逆反应速率
注意反应速率的方向必须有正逆之分,每个物质都可以表示出参与的化学反应速率,而其速率之比应符合方程式中的化学计量数的比值,这一点学生做题容易出错。
②各组分的浓度保持不变,包括各组分的质量分数、物质的量分数、体积分数、百分含量不变。
二、间接判断法
①对于气体体积前后改变的反应,压强不变是平衡的标志,而对于气体体积前后不改变的反应,压强不能做标志。
②对于恒温恒压条件下的反应,气体体积前后改变的反应密度不变是平衡标志。
③对于恒温恒容下的反应,有非气体物质的反应,密度不变是平衡标志。
④有颜色的物质参与或生成的可逆反应,体系的颜色不再随时间而变化。
⑤任何化学反应都伴随着能量变化,当体系温度一定时,达到平衡。
16.(1)0.75mol·L-1
(2)3mol
(3)0.05mol·L-1·min-1
(4)2
(5)③>①=④>②
【分析】由方程式可知Δc(A)=1.5Δc(D)=1.5×0.5mol/L=0.75mol/L,Δc(B)=0.5Δc(D)=0.25mol/L,A、B起始浓度相等设为cmol/L,则(c-0.75):(c-0.25)=3:5,解得c=1.5。开始时容器中A、B的物质的量为n=1.5mol/L×2L=3mol。
【详解】(1)由分析可知,开始A的浓度为1.5mol/L,Δc(A)=1.5Δc(D)=1.5×0.5mol/L=0.75mol/L,则5min后A的浓度为1.5mol/L。
(2)根据分析可知,反应开始前充入容器中的B的物质的量为3mol。
(3)浓度变化量之比等于化学计量数之比,则x:2=0.1mol/(L min)×5min:0.5mol/L,解得x=2,速率之比等于化学计量数之比,则v(B)=0.5v(C)=0.05mol/(L min)。
(4)浓度变化量之比等于化学计量数之比,则x:2=0.1mol/(L min)×5min:0.5mol/L,解得x=2。
(5)①v(A)=0.01mol·L-1·s-1时,v(A)=v(A)×60=0.6mol·L-1·min-1;
②v(B)=1.20mol·L-1·min-1时,v(A)=v(B)=0.4mol·L-1·min-1;;
③v(C)=2.40mol·L-1·min-1时,v(A)=v(C)=1.20mol·L-1·min-1;
④v(D)=0.02mol·L-1·s-1,v(A)=v(D)×60=0.6mol·L-1·min-1;
故速率大小关系为③>①=④>②。
17.(1))>
(2) 71.4% 0.125mol/(L·min)
(3)①③
(4)①②④
【详解】(1)t1min后,产物CO继续增加,反应正向进行,正、逆反应速率的大小关系为v正>v逆。
(2)0~4min内,CO2的浓度降低0.5mol/L,CO2的转化率为;0~4min内,CO的浓度增大0.5mol/L,CO的平均反应速率,v(CO)=0.125mol/(L·min)。
(3)①降低温度,反应速率减慢,选①;
②铁是固体,减少铁粉的质量,反应速率几乎不变,故不选②;
③保持压强不变,充入He使容器的体积增大,CO2、CO浓度减小,反应速率减慢,故选③;
④保持体积不变,充入He使体系压强增大,CO2、CO浓度不变,反应速率不变,故不选④;
选①③;
(4)①v正(CO2)=v逆(CO),正逆反应速率相等,反应一定达到平衡状态,故选①;
②单位时间内生成nmolCO2的同时生成nmolCO,正逆反应速率相等,反应一定达到平衡状态,故选②;
③反应前后气体系数和相等,压强是恒量,容器中气体压强不随时间的变化而变化,反应不一定平衡,故不选③;
④反应后气体质量增大、气体物质的量不变,平均相对分子质量是变量,容器中气体的平均相对分子质量不随时间的变化而变化,反应一定达到平衡状态,故选④;
选①②④。
18. N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol b BD
【详解】(1) 根据图象分析,热化学方程式为: N2(g)+3H2(g) 2NH3(g) △H=508-600=-92kJ/mol;加入铁触媒做催化剂,反应速率加快,故b曲线为加入铁触媒的能量变化曲线;
(2) A.3v(H2)正=2v(NH3)逆 速率之比等于系数比;错误;B.单位时间内生成n mol N2的同时生成2n molNH3,B正确;C.反应前后气体的总质量不变,容器的体积不变,密度任何时候容器内气体的密度不随时间的变化而变化。无法判断是否平衡;D.反应前后气体的总量不相等,容器内压强不随时间的变化而变化,D正确;故选BD。
考点:热化学方程式的书写,平衡状态的判定;
19. 0.025mol/(L·min) 0.075mol/(L·min) 0.05mol//(L·min) X、Y 3X+Y 2Z
【详解】(1)由图可知2min内,X的物质的量变化为(1.0-0.9)mol=0.1mol,故x==0.025mol/(L·min);Y的物质的量变化为(1.0-0.7)mol=0.3mol,故vY==0.075mol/(L·min);Z的物质的量变化为(0.2-0)mol=0.2mol,故vZ==0.05mol/(L·min);
(2)根据图中曲线可知,随着反应的进行X、Y的物质的量减少,为反应物,Z的物质的量增多,为生成物;
(3)根据化学反应速率之比等于化学反应议程式中计量数之比,Vx:Vy:Vz=0.025mol/(L·min):0.075mol/(L·min):0.05mol//(L·min)=3:1:2,且反应物没有反应完全,该反应为可逆反应,则该反应的化学方程式为:3X+Y 2Z。
20.(1)>
(2)0.25
(3)t3
(4)增大
(5)2N(g) M(g)
【详解】(1)t2时刻,N的物质的量继续减小中,M的物质的量继续增大中,故处于建立平衡的过程中,则t2时刻正、逆反应速率大小:v(正)>v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率。
(3)达到平衡时,各成分M、N的物质的量不再改变。则处于平衡状态的时刻为t3。
(4)温度升高反应速率加快,正逆反应速率都增大,则升高温度,v(逆)增大。
(5)从反应开始至平衡时刻,,,物质的量的变化量之比等于化学计量数之比,故该反应的化学方程式为2N(g) M(g)。
21. 其他条件相同时,增大KMnO4浓度反应速率增大 mol/(L min) 生成物中的MnSO4(或Mn2+)为该反应的催化剂 MnSO4 与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min)
【详解】(1)从表中数据可知改变的条件是KMnO4浓度;其他条件相同时,增大KMnO4浓度,反应速率增大;
(2)草酸的物质的量为:0.6mol L 1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol L 1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,而由实验1可知混合溶液的中体积为10ml,所以混合后溶液中高锰酸钾的浓度为:
=0.06mol/L,
这段时间内平均反应速率为:v(KMnO4)= = mol/(L min);
(3)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂;
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min)。
22. 增大接触面积,加快溶解速率,使其充分反应 Au+HNO3+4HCl= H[AuCl4]+NO↑+2H2O AgCl 萃取、分液 水浴加热 向“操作Ⅱ”后的水溶液中加入足量H2C2O4溶液,充分反应后,用布氏漏斗抽滤(过滤),滤渣用蒸馏水充分洗涤、干燥
【分析】(1)粗金块切割成细条状,增大了接触面积,可加快反应速率;“溶解”时Au转化为H[AuCl4],同时生成NO,配平即可;
(2)加入王水后剩余的固体为AgCl沉淀;
(3)由图中可知操作Ⅰ为萃取分液;
(4)可以选用水浴加热;
(5)结合题干和流程图进行分析;
【详解】(1)将粗金块切合成细条,可增大反应接触面积,加快溶解反应速率;根据信息可写出Au+HNO3+HCl→ H[AuCl4]+NO↑,根据得失电子守恒和原子守恒,配平得Au+HNO3+4HCl= H[AuCl4]+NO↑+2H2O;
(2)粗金中Au、Ag都被王水溶解,稀释后生成AgCl沉淀;
(3)从流程中“水相”和“有机相”可判断出操作Ⅰ为萃取分液,操作Ⅱ也是萃取分液(反萃取);
(4) 100℃以内的加热都可以选用水浴加热;
(5)操作Ⅱ后的溶液主要含H[AuCl4],根据已知②,应加入草酸,将其还原成Au单质,再抽滤、洗涤、干燥即可,具体操作为:向“操作Ⅱ”后的水溶液中加入足量H2C2O4溶液,充分反应后,用布氏漏斗抽滤(过滤),滤渣用蒸馏水充分洗涤、干燥。
23. 浓度 15.0 2.0 0.00125mol/(L·min) 该反应放热,温度升高,速率加快 C 与实验1相比,溶液褪色所需时间短(或所用时间小于8min)
【分析】该实验的目的是探究浓度对化学反应速率的影响,三组实验中的混合溶液除了草酸的浓度不同,其他条件都要保持一致,通过比较溶液褪色的时间判断反应速率的快慢,探究锰离子的催化作用要注意不能改变溶液总体积,也不能进入和酸性高锰酸钾反应的其他物质。
【详解】(1)由表格可知,三组实验高锰酸钾和硫酸的浓度相同,草酸的浓度不同,故该实验在探究浓度对化学反应速率的影响;
(2)由1、2两组实验可知,混合溶液的总体积是20mL,三组实验应该保持一致,高锰酸钾和草酸的浓度也应该保持一致,故V1=16mL-1mL=15mL,V2=2.0mL;
(3)草酸的物质的量为:0.6mol L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.1mol L-1×0.002L=0.0002mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0002mol=9:1,显然草酸过量,高锰酸钾完全反应,溶液消耗的高锰酸钾的浓度为:=0.01mol/L,这段时间内平均反应速率v(KMnO4)==0.00125 mol/(L·min);
(5)除了催化剂可以加快反应速率,温度升高也可以加快反应速率,故t1~t2时间内速率变快的原因也可能是:该反应放热,温度升高,速率加快;
(4)第4组实验要证明锰离子对该反应有催化作用,所以需要向体系中加入Mn2+,但又不能改变混合溶液的体积,所以要加固体,Cl-具有还原性会和酸性高锰酸钾反应,不能加氯化锰,所以要加MnSO4,故选C。
答案第1页,共2页
答案第1页,共2页
