6.1.1化学反应速率分层练习(含解析)2023-2024学年苏教版(2019)高中化学必修第二册
文档属性
| 名称 | 6.1.1化学反应速率分层练习(含解析)2023-2024学年苏教版(2019)高中化学必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 617.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-15 15:39:42 | ||
图片预览



文档简介
6.1.1化学反应速率
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.中华传统文化蕴含着丰富的化学知识。下列诗句中主要涉及吸热反应的是
A.千里冰封,万里雪飘 B.野火烧不尽,春风吹又生
C.投泥泼水愈光明,烁玉流金见精悍 D.爆竹声中一岁除,春风送暖入屠苏
2.石墨转化为金刚石反应过程中的能量变化如图所示。下列说法正确的是
A.该反应为放热反应 B.石墨比金刚石稳定
C.该反应在常温下即可发生 D.相同质量的金刚石与石墨完全燃烧放出的热量相同
3.下列反应中是放热反应的是
A.石灰石在高温下的分解反应 B.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
C.C与H2O(g)高温条件下反应 D.Zn与稀H2SO4反应
4.下列有关化学反应与能量变化的说法正确的是
A.如图所示的化学反应,反应物的键能之和大于生成物的键能之和
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C.金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可表示为:C(s,金刚石)=C(s,石墨) ΔH=(E1-E3)kJ/mol
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)能量变化如图所示,在光照和点燃条件下的ΔH相同
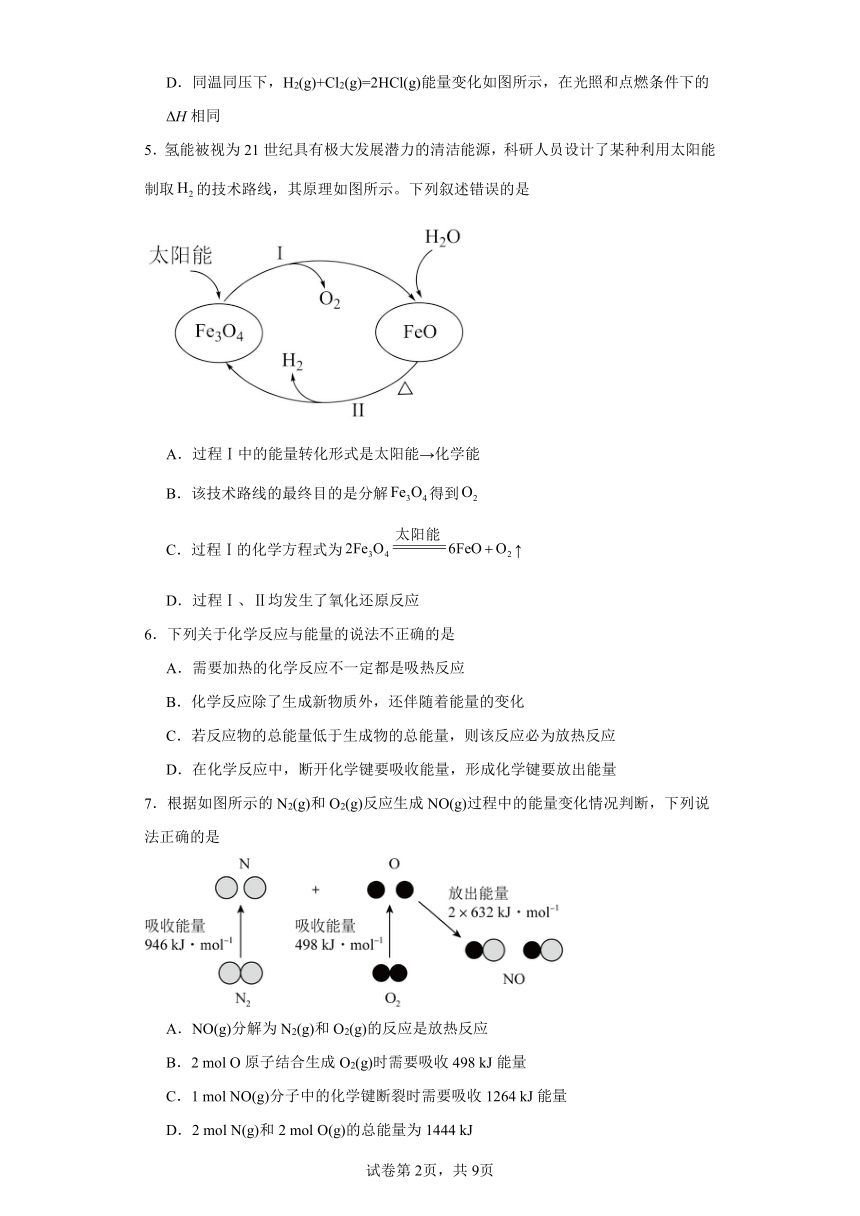
5.氢能被视为21世纪具有极大发展潜力的清洁能源,科研人员设计了某种利用太阳能制取的技术路线,其原理如图所示。下列叙述错误的是
A.过程Ⅰ中的能量转化形式是太阳能→化学能
B.该技术路线的最终目的是分解得到
C.过程Ⅰ的化学方程式为↑
D.过程Ⅰ、Ⅱ均发生了氧化还原反应
6.下列关于化学反应与能量的说法不正确的是
A.需要加热的化学反应不一定都是吸热反应
B.化学反应除了生成新物质外,还伴随着能量的变化
C.若反应物的总能量低于生成物的总能量,则该反应必为放热反应
D.在化学反应中,断开化学键要吸收能量,形成化学键要放出能量
7.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况判断,下列说法正确的是
A.NO(g)分解为N2(g)和O2(g)的反应是放热反应
B.2 mol O原子结合生成O2(g)时需要吸收498 kJ能量
C.1 mol NO(g)分子中的化学键断裂时需要吸收1264 kJ能量
D.2 mol N(g)和2 mol O(g)的总能量为1444 kJ
8.下列反应属于吸热反应的是
A.铝与稀硫酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.甲烷在O2中的燃烧反应 D.盐酸与氢氧化钠的反应
9.某学生用如图所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲下降、乙上升。下列关于该反应的叙述中错误的是
A.该反应为放热反应
B.生成物的总能量比反应物的总能量高
C.该反应过程可以看成是“贮存”于X、Y内部的部分能量转化为热能而释放出来
D.反应中化学键断裂吸收的总能量小于化学键形成释放的总能量
10.按照反应Br+H2HBr+H的能量变化示意图,下列叙述正确的是
A.该反应的ΔH=+(E1-E2)kJ·mol-1
B.加入催化剂,该化学反应的反应热变大
C.反应物的总能量高于生成物的总能量
D.该反应为放热反应
二、填空题
11.热化学方程式既表示化学反应的 变化,也表示化学反应的 变化,如表示在条件下, 。
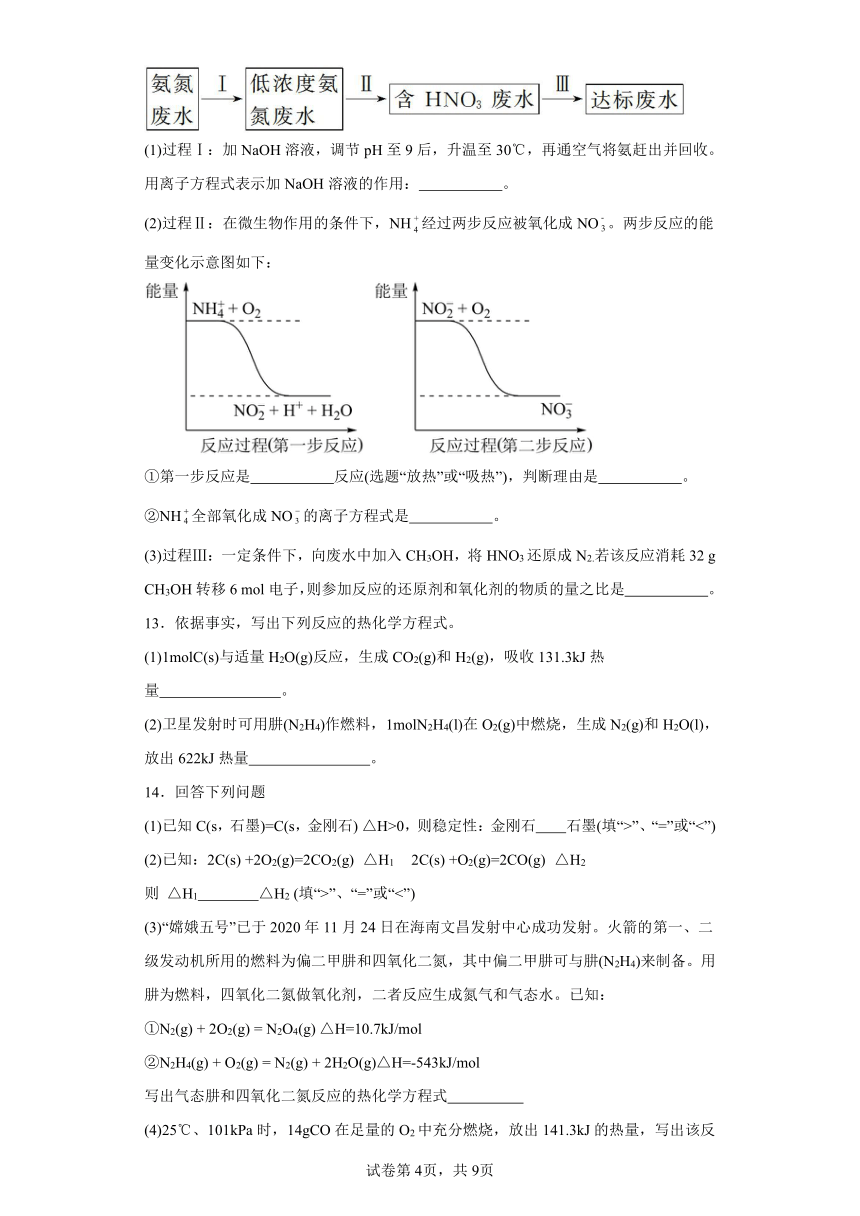
12.某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,再通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
①第一步反应是 反应(选题“放热”或“吸热”),判断理由是 。
②NH全部氧化成NO的离子方程式是 。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
13.依据事实,写出下列反应的热化学方程式。
(1)1molC(s)与适量H2O(g)反应,生成CO2(g)和H2(g),吸收131.3kJ热量 。
(2)卫星发射时可用肼(N2H4)作燃料,1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量 。
14.回答下列问题
(1)已知C(s,石墨)=C(s,金刚石) △H>0,则稳定性:金刚石 石墨(填“>”、“=”或“<”)
(2)已知:2C(s) +2O2(g)=2CO2(g) △H1 2C(s) +O2(g)=2CO(g) △H2
则 △H1 △H2 (填“>”、“=”或“<”)
(3)“嫦娥五号”已于2020年11月24日在海南文昌发射中心成功发射。火箭的第一、二级发动机所用的燃料为偏二甲肼和四氧化二氮,其中偏二甲肼可与肼(N2H4)来制备。用肼为燃料,四氧化二氮做氧化剂,二者反应生成氮气和气态水。已知:
①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol
②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol
写出气态肼和四氧化二氮反应的热化学方程式
(4)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热量,写出该反应的热化学方程式
(5)0.50L 2.00mol/LH2SO4溶液与2.0L 1.00mol/LKOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H=
15.研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有 (填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式 ,
用该反应合成1 mol液态甲醇吸收热量131.9 kJ。又知2H2(g)+CO(g)+O2(g)=CO2(g)+2H2O(g) ΔH=-594.1 kJ/mol。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
16.按要求完成下列各小题
(1)用双线桥法分析:2KMnO4K2MnO4+MnO2+O2↑,并指明还原产物是
(2)用热化学方程式表示:1g甲烷在氧气中完全燃烧,生成液态水,放出热量akJ;
(3)写出二氧化碳和足量氢氧化钠溶液反应的离子方程式
17.按要求答题
(1)氯化铵受热分解的化学方程式
(2)铜与浓硝酸反应的化学方程式
(3)请用化学方程式表示硝酸贮存棕色试剂瓶并避光保存的原因 。
(4)检验氯化铵中有的离子方程式
(5)在一定条件下,1mol氢气与1mol氯气反应生成2mol氯化氢气体,放出184.5kJ的能量。则该反应的热化学方程式为 。
18.根据所给信息,书写对应的热化学方程式。
(1)11.2L(标准状况)在足量中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式: 。
(2)发生催化氧化反应生成气态产物,放出22.67kJ的热量,其热化学方程式: 。
(3)已知: ,请写出分解对应的热化学方程式: 。若和在一定条件下发生反应,放出的热量 92kJ(填“大于”“小于”或“等于”)。
19.按照要求完成反应方程式
(1)下表是某些物质的标准生成热(△Hf,在298.15K、101kPa,由元素最稳定的单质生成1mol纯化合物时的反应焓变)数据
物质 H2 CO CH3OH(g)
△Hf (kJ·mol-1) 0 -110.5 -201
则工业上用CO和H2合成CH3OH(g)的热化学反应方程式为:
(2)置换反应的通式可以表示为:单质(1)+化合物(1)=化合物(2)+单质(2)
请写出同时满足以下要求的3个置换反应的化学方程式:
①所涉及的元素的原子序数都小于20;
②6种单质分属6个不同的主族。
、 、
(3)向饱和碳酸氢钠溶液加入少量浓CaCl2溶液,有浑浊和气泡产生,写出反应的离子方程式:
(4)两种酸性溶液混合,溶液的酸性增强。写出一个可能的化学方程式:
20.填空。
(1)乙炔的电子式为 ;芒硝的化学式为 。
(2)在日常生活中我们常使用冷敷袋有两种,第一种所盛装的物质为NH4NO3和水,第二种为过量NH4NO3和Na2CO3·10H2O,使用方法均为将两种原本隔开的物质混合即可降温,第二种还同时产生两种气体,请根据所学知识写出第二种冰袋中发生的化学方程式 ,解释其实现降温的原因 。
三、实验探究题
21.回答下列问题
(1)为了探究化学能与热能的转化,某实验小组设计了如图所示三套实验装置:
①装置Ⅲ中甲装置的名称是 ;
②上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是 (填序号)。
③某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是 。
(2)太阳能的开发利用是21世纪的一个重要课题。
①人类利用太阳能有两种常见的转化方式是 、 。
②利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知表中数据:
盐 熔点/℃ 熔化吸热/() 参考价格/(元/kg)
29.0 37.3 780~750
32.4 77.0 800~900
36.1 100.1 1600~2000
48.5 49.7 1400~1800
其中最适宜作储能介质的是 (填字母)。
A. B.
C. D.
22.实验室利用下列装置模拟工业生产中氨气和氧气反应制备少量硝酸。
(1)NaOH溶液的作用是 。
(2) B中反应的化学方程式为 。
(3)下列试剂可用于干燥氨气是 。(填字母)
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D. P2O5
(4)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持温度可达到700℃以上,下列图示中, 能够正确表示该反应过程能量变化的是 (填字母)。
(5)控制氨气和氧气的比例是制备硝酸的关键,当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是 。
23.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是 。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 ,说明该反应属于 (填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是 。
②若观察到烧杯里产生气泡,则说明M溶于水 (填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是 。
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是 。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。方法①:选择上述装置 (填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验。方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是 反应。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.“千里冰封,万里雪飘”所描述的是水的不同状态之间的物理变化,A错误;
B.“野火烧不尽,春风吹又生”涉及燃烧过程,燃烧属于放热反应,B错误;
C.“投泥泼水愈光明,烁玉流金见精悍”涉及碳与水蒸气的反应,该反应为吸热反应,C正确;
D.“爆竹声中一岁除,春风送暖入屠苏”涉及剧烈燃烧过程,燃烧属于放热反应,D错误;
故选C。
2.B
【详解】A.由图可知反应物总能量低于生成物总能量,该反应为吸热反应,A项错误;
B.由能量可知石墨能量低,能量越低越稳定,石墨较稳定,B项正确;
C.该反应在高温高压下才能进行,C项错误;
D.金刚石相对能量较高,相同质量的金刚石与石墨完全燃烧,金刚石放出热量较多,D项错误。
答案选B。
3.D
【详解】A.石灰石在高温下的分解生成氧化钙和二氧化碳,属于吸热反应,选项A错误;
B.Ba(OH)2·8H2O晶体与NH4Cl晶体反应是吸热反应,选项B错误;
C.C与H2O(g) 高温条件下反应生成氢气和CO,属于吸热反应,选项C错误;
D.金属与稀酸反应是放热反应,选项D正确。
答案选D。
4.D
【分析】如图所示,生成物相对于反应物的能量较低,故该反应为放热反应,反应热,为该反应的活化能,即反应物断键所吸收的能量;为成键所放出的能量。
【详解】A.该反应为放热反应,反应物的键能之和小于生成物的键能之和,故A错误;
B.相同条件下,水蒸气液化成液态水时放热,故氢气和氧气反应生成液态水比生成等量的气态水放出的热量要多,故B错误;
C.从图中可以看出,石墨比金刚石稳定,金刚石转化成石墨时放热,热化学方程式为,故C错误;
D.反应热与反应条件无关,与物质的状态、性质、键能大小、系数有关,故D正确;
故选D。
5.B
【详解】A.过程Ⅰ利用太阳能将四氧化三铁转化为氧气和氧化亚铁,实现了太阳能→化学能的能量转化,故A正确;
B.根据题中反应路线可知总反应为↑+2H2↑,最终目的是利用太阳能分解水制取,故B错误;
C.根据图示可知过程Ⅰ的化学方程式为↑,故C正确;
D.过程Ⅰ、Ⅱ均有化合价的升降,故发生了氧化还原反应,故D正确;
故答案为B。
6.C
【详解】A.有的放热反应需要高温条件发生,如铝热反应是放热反应,但需要加热,选项A正确;
B.化学反应的特征:一是新物质生成,二是伴随着能量的变化,选项B正确;
C.若某反应的反应物总能量低于生成物总能量,则该反应为吸热反应,选项C不正确;
D.断键吸收能量,成键放出能量,化学变化中的能量变化主要是由化学键变化引起的是对的,选项D正确;
答案选C。
7.A
【详解】A.N2(g)+O2(g)=2NO(g)的焓变为,该反应为吸热反应,则NO(g)分解为N2(g)和O2(g)的反应是放热反应,A正确;
B.成键放出能量,2 mol O原子结合生成O2(g)时需要放出498 kJ能量,B错误;
C.1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量,C错误;
D.946 kJ和498 kJ分别是1 mol N2(g)和1 mol O2(g)分子中化学键断裂吸收的能量,2 mol N(g)和2 mol O(g)的总能量不能确定,D错误;
答案选A。
8.B
【详解】A.金属与酸置换出氢气的反应为放热反应,则Al与盐酸的反应为放热反应,故A不符合题意;
B.Ba(OH)2·8H2O与NH4Cl的反应属于复分解反应,属于吸热反应,故B符合题意;
C.燃烧反应均为放热反应,故C不符合题意;
D.中和反应均为放热反应,故盐酸与氢氧化钠的反应为放热反应,故D不符合题意;
故答案为B。
9.B
【分析】当往试管中加入试剂Y时,看到U形管中液面甲下降、乙上升,可以根据大气压强原理以及气体热胀冷缩的性质来回答。
【详解】A.试管中甲处液面下降,乙处液面上升,因为左边试剂瓶中温度升高,则该反应为放热反应,故A正确;
B.放热反应中,反应物的总能量比生成物的总能量高,故B错误;
C.由于反应物的总能量比生成物的总能量高,反应的结果是向体系外放出热量,则该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来,故C正确;
D.反应为放热反应,反应中化学键断裂吸收的总能量小于化学键形成释放的总能量,故D正确;
故选B。
10.A
【详解】根据图象,反应物的总能量小于生成物的总能量,说明正反应是吸热反应,即△H=+(E1-E2)kJ·mol-1,催化剂只降低活化能,对反应热无影响,故选项A正确。
11. 物质 能量 与反应生成液态水时放出的热量为
【详解】热化学方程式既表示化学反应的物质变化,也表示化学反应的能量变化,如热化学方程式表示在25℃、101kPa条件下2mol氢气与1mol氧气反应生成2mol液态水时放出的热量为571.6kJ,故答案为:物质;能量;与反应生成液态水时放出的热量为。
12. NH + OH- = NH3 H2O 放热 反应物总能量大于生成物总能量 NH + 2O2 NO+ H2O + 2H+ 5:6
【详解】(1)铵盐能和强碱反应,实质是NH + OH- = NH3 H2O,故答案为:NH + OH- = NH3 H2O;
(2)①由第一步反应的能量变化图分析看出,该反应为放热反应,判断理由是反应物总能量大于生成物总能量,故答案为:放热;反应物总能量大于生成物总能量;
②NH全部氧化成NO的反应分两步进行:NH + O2 = NO+ 2H++H2O,NO+ O2 = NO,上述两式相加,移项抵消NO,即得到符合题意的离子方程式是NH + 2O2 NO+ H2O + 2H+,故答案为:NH + 2O2 NO+ H2O + 2H+;
(3) 32 g CH3OH的物质的量为1mol,完全反应后转移6 mol电子,CH3OH中的C元素显-2价,被氧化后生成物中C元素显+4价,氧化产物是CO2;HNO3中N元素显+5价,还原成N2后,N元素是0价。根据得失电子相等(即化合价升降相等)有:16=n(HNO3)(5-0),n(HNO3)=1.2mol,所以n(CH3OH) :n(HNO3)=1:1.2=5:6,故答案为:5:6。
13.(1)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ/mol
(2)N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-622 kJ/mol
【详解】(1)1molC(s)与适量H2O(g)反应,生成CO2(g)和H2(g),吸收131.3kJ热量,则热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ/mol。
(2)1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量,则热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-622 kJ/mol。
14.(1)<
(2)<
(3)2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol
(4)CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1
(5)-57.3kJ /mol
【详解】(1)物质的能量越高,该物质越不稳定,C(s,石墨)=C(s,金刚石) △H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H < 0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:< ;
(3)①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol;②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol,由盖斯定律②×2 -①得到2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol,故答案为:2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3kJ 的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H =-282.6kJ·mol-1,该反应的热化学方程式为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1,故答案为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1;
(5)0.50L 2.00mol/ L H2SO4溶液与2.00L 1.00mol/ L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为- 11.46kJ/mol,中和热为- 57.3kJ/mol,故答案为:-57.3kJ /mol。
15.(1)acd
(2) CO+2H2 CH3OH 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1 452 kJ/mol
【详解】(1)a、化石原料燃烧产生SO2、NO2等有污染的气体,因此减少化石燃料的使用,减少污染物产生,开发新能源,能减少污染的发生,故正确;b、使用无氟冰箱,减少氟利昂的排放,但对CO2、SO2、NO2的排放不产生影响,故错误;c、减少私家车的使用,减少NO2、CO2等的排放,故正确;d、CO2、SO2属于酸性氧化物,和碱反应,NO2能和碱反应生成硝酸盐和亚硝酸盐,故正确;
(2)根据题目中信息,反应方程式为CO+2H2CH3OH,
①CO(g)+2H2(g)CH3OH(l) △H=+131.9kJ·mol-1,
②2H2(g)+CO(g)+O2(g)=CO2(g)+2H2O(g) ΔH=-594.1 kJ·mol-1,
甲醇燃烧的反应方程式为CH3OH+O2→CO2+2H2O,
②-2×①得出:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-726 kJ/mol。
16.(1);K2MnO4+MnO2
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-16akJ/mol
(3)CO2+2OH-=CO+H2O
【分析】(1)
KMnO4中的Mn元素化合价降低,生成K2MnO4和MnO2,氧化剂为KMnO4,还原产物是K2MnO4+MnO2,O元素化合价升高,生成O2,双线桥法表示为:;
(2)
1g甲烷完全燃烧放出热量akJ,1mol甲烷的质量为m=nM=16g,则1mol甲烷完全反应放出热量为16akJ,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-16akJ/mol;
(3)
二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,离子方程式为:CO2+2OH-=CO+H2O。
17.(1)
(2)
(3)
(4)
(5)
【详解】(1)氯化铵受热分解生成氨气和氯化氢,其反应的化学方程式为,故填;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,其反应的化学方程式为,故填;
(3)硝酸见光或受热易分解,所以应避光保存,其见光分解的化学方程式为,故填;
(4)实验室检验铵根离子用氢氧化钠溶液,在加热条件下放出的气体若能使湿润的红色石蕊试纸变蓝,则含有铵根离子,其反应为,故填;
(5)在一定条件下,1mol氢气与1mol氯气反应生成2mol氯化氢气体,放出184.5kJ的能量。则该反应的热化学方程式为,故填。
18.(1)H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-906.8 kJ/mol
(3) NH3(g)N2(g)+H2(g) △H=+46 kJ/mol 小于
【详解】(1)由题意知,0.5 mol H2在Cl2中完全燃烧放热91.5 kJ,则1 mol H2在Cl2中完全燃烧放热91.5 kJ×2=183 kJ,对应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol;
(2)n(NH3)=,由题意知,0.1 mol NH3催化氧化生成NO和H2O(g)放热22.67 kJ,故4 mol NH3催化氧化放热906.8 kJ,对应热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-906.8 kJ/mol;
(3)由题意得2 mol NH3完全分解吸热92 kJ,则1 mol NH3完全分解吸热46 kJ,对应热化学方程式为:NH3(g)N2(g)+H2(g) △H=+46 kJ/mol;由于该反应为可逆反应,故1 mol N2不可能完全转化为NH3,故放出的热量小于92 kJ。
19.(1)CO(g)+2H2(g)CH3OH(g) △H=-90.5kJ/mol
(2) 2Al+6HCl=AlCl3+3H2↑ 2F2+2H2O=4HF+O2 (Cl2+H2S=2HCl+S) 2Mg+CO22MgO+C
(3)2HCO+Ca2+=CaCO3↓+CO2↑+H2O
(4)HClO+H2SO3=HCl+H2SO4或H2S+CuSO4=CuS↓+H2SO4(其它合理答案也行)
【详解】(1)工业上用CO和H2合成CH3OH(g)的化学方程式是,=生成物的标准生成热总和-反应物的标准生成热总和=[-201-(-110.5)]kJ/mol=-90.5 kJ/mol;
(2)常见的置换反应类型有金属置换非金属,金属置换金属,非金属置换非金属,非金属置换金属等类型,可以根据元素和化合物的知识并归纳中学阶段所有情况的置换反应来回答。得出符合条件的反应可以是:2Mg+CO22MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2;
(3)向饱和碳酸氢钠溶液加入少量浓CaCl2溶液,有浑浊和气泡产生,故离子方程式为2HCO+Ca2+=CaCO3↓+CO2↑+H2O;
(4)复分解反应中较强酸可以制较弱酸,但有特例,比如硫化氢与硫酸铜反应生成难溶物硫化铜沉淀,高沸点难挥发性酸磷酸可以制低沸点易挥发性酸HBr和HI,氧化还原反应中也存在较弱酸制出较强酸的离子。HClO+H2SO3=HCl+H2SO4或H2S+CuSO4=CuS↓+H2SO4皆满足两种酸性溶液混合,溶液的酸性增强。
20.(1) Na2SO4·10H2O
(2) Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O 该反应为吸热反应;过量NH4NO3溶于水也吸热
【详解】(1)乙炔的结构简式为CH≡CH,电子式为;芒硝是十水硫酸钠的俗称,化学式为Na2SO4·10H2O,故答案为:;Na2SO4·10H2O;
(2)由题意可知,第二种冰袋中发生的反应为十水碳酸钠与硝酸铵反应生成硝酸钠、氨气、二氧化碳和水,反应的化学方程式为Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O,该反应为吸热反应,反应中吸收热量,且过量的硝酸铵溶于反应生成的水也会吸收热量,使周围环境温度降低,达到降温的目的,故答案为:Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O;该反应为吸热反应;过量NH4NO3溶于水也吸热。
21.(1) 长颈漏斗 III U形管中红墨水左面高
(2) 光-热转换 光-电转换 B
【详解】(1)①装置Ⅲ中甲装置的名称是长颈漏斗;
②反应放热,使气体膨胀,Ⅰ中U形管中红墨水左面下降,Ⅱ中烧杯中有气泡冒出,均可说明反应使放热的;
③氢氧化钡晶体与氯化铵固体搅拌反应,反应吸热,Ⅰ中锥形瓶中气体压强减小,U形管中红墨水左面高;
(2)①人类直接利用太阳能,有两种常见的方式:光—热转换和光—电转换;
②作为储能介质应综合考虑下列因素才有应用价值;熔点比常温略高;熔化时吸热值较大,应考虑单位质量的固体盐在熔化时吸热越多越好;价格低廉,因此选择。
22. 吸收氮的氧化物,防止污染空气 3NO2+H2O=2HNO3+NO B A NH4NO3
【分析】试管中发生氨的催化氧化生成NO,在装置A中NO进一-步被氧气氧化生成二氧化氮,装置B中二氧化氮与水反应生成硝酸,用氢氧化钠溶液吸收氮的氧化物,防止污染空气,结合氨气的制备及氮的氧化物的性质解答该题。
【详解】(1)氮的氧化物均有毒,NaOH溶液可吸收氮的氧化物,防止污染空气,故答案为:吸收氮的氧化物,防止污染空气;
(2) 装置B中二氧化氮与水反应生成硝酸,反应的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(3)氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气,故答案为:B;
(4)反应为放热反应,放出大量的热,反应物的总能量比生成物的总能量高,700°C时水是气体,故答案为:A;
(5)一氧化氮与氧气反应生成红棕色气体二氧化氮,二氧化氮与水反应生成硝酸,氨气和硝酸能反应生成白烟硝酸铵,化学式为NH4NO3,故答案为:NH4NO3。
【点睛】本题考查实验模拟工业生产制备少量硝酸、反应热的计算、氧化还原反应等,明确结合反应原理明确各装置的作用是解答该题的关键。
23.(1)Ⅲ
(2) 左端液柱降低,右端液柱升高 放热
(3) 产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱 可能是放热反应 某些物质(如浓硫酸)溶于水放热,但不是放热反应 硝酸铵(或其他合理答案)
(4) Ⅰ(或Ⅱ) 放热
【详解】(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应,故答案为Ⅲ;
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高,故答案为左端液柱降低,右端液柱升高;放热;
(3)①若M为钠,钠与水反应生成氢氧化钠和氢气,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱,故答案为产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱;
②若观察到烧杯里产生气泡,说明M溶于水可能放出热量,由于放热反应一定属于化学变化,而有热量放出的反应不一定为化学变化,所以不一定属于放热反应,某些物质(如氢氧化钠)溶于水放热,但不是化学反应,故答案为可能是放热反应;
③若观察到烧杯里的玻璃管内形成一段水柱,说明装置中气体的压强减小,则M可能是硝酸铵,硝酸铵溶于水,吸收热量,温度降低,气体压强减小,故答案为硝酸铵;
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O═4KOH+3O2↑)是放热反应还是吸热反应:方法①:选择上述装置Ⅰ(或Ⅱ)进行实验,Ⅰ装置右边U形管中左端液柱降低,右端液柱升高(或烧杯中导管中有气泡放出),证明该反应为放热反应;故答案为Ⅰ(或Ⅱ);
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应放出大量热,使棉花燃烧,证明该反应是放热反应,故答案为放热。
点睛:本题考查化学反应中的热效应,注意掌握探究反应热效应的常用方法,试题有利于培养学生实验综合分析能力,特别是实验的评价和根据实验现象推理的能力。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.中华传统文化蕴含着丰富的化学知识。下列诗句中主要涉及吸热反应的是
A.千里冰封,万里雪飘 B.野火烧不尽,春风吹又生
C.投泥泼水愈光明,烁玉流金见精悍 D.爆竹声中一岁除,春风送暖入屠苏
2.石墨转化为金刚石反应过程中的能量变化如图所示。下列说法正确的是
A.该反应为放热反应 B.石墨比金刚石稳定
C.该反应在常温下即可发生 D.相同质量的金刚石与石墨完全燃烧放出的热量相同
3.下列反应中是放热反应的是
A.石灰石在高温下的分解反应 B.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
C.C与H2O(g)高温条件下反应 D.Zn与稀H2SO4反应
4.下列有关化学反应与能量变化的说法正确的是
A.如图所示的化学反应,反应物的键能之和大于生成物的键能之和
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C.金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可表示为:C(s,金刚石)=C(s,石墨) ΔH=(E1-E3)kJ/mol
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)能量变化如图所示,在光照和点燃条件下的ΔH相同
5.氢能被视为21世纪具有极大发展潜力的清洁能源,科研人员设计了某种利用太阳能制取的技术路线,其原理如图所示。下列叙述错误的是
A.过程Ⅰ中的能量转化形式是太阳能→化学能
B.该技术路线的最终目的是分解得到
C.过程Ⅰ的化学方程式为↑
D.过程Ⅰ、Ⅱ均发生了氧化还原反应
6.下列关于化学反应与能量的说法不正确的是
A.需要加热的化学反应不一定都是吸热反应
B.化学反应除了生成新物质外,还伴随着能量的变化
C.若反应物的总能量低于生成物的总能量,则该反应必为放热反应
D.在化学反应中,断开化学键要吸收能量,形成化学键要放出能量
7.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况判断,下列说法正确的是
A.NO(g)分解为N2(g)和O2(g)的反应是放热反应
B.2 mol O原子结合生成O2(g)时需要吸收498 kJ能量
C.1 mol NO(g)分子中的化学键断裂时需要吸收1264 kJ能量
D.2 mol N(g)和2 mol O(g)的总能量为1444 kJ
8.下列反应属于吸热反应的是
A.铝与稀硫酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.甲烷在O2中的燃烧反应 D.盐酸与氢氧化钠的反应
9.某学生用如图所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲下降、乙上升。下列关于该反应的叙述中错误的是
A.该反应为放热反应
B.生成物的总能量比反应物的总能量高
C.该反应过程可以看成是“贮存”于X、Y内部的部分能量转化为热能而释放出来
D.反应中化学键断裂吸收的总能量小于化学键形成释放的总能量
10.按照反应Br+H2HBr+H的能量变化示意图,下列叙述正确的是
A.该反应的ΔH=+(E1-E2)kJ·mol-1
B.加入催化剂,该化学反应的反应热变大
C.反应物的总能量高于生成物的总能量
D.该反应为放热反应
二、填空题
11.热化学方程式既表示化学反应的 变化,也表示化学反应的 变化,如表示在条件下, 。
12.某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,再通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
①第一步反应是 反应(选题“放热”或“吸热”),判断理由是 。
②NH全部氧化成NO的离子方程式是 。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
13.依据事实,写出下列反应的热化学方程式。
(1)1molC(s)与适量H2O(g)反应,生成CO2(g)和H2(g),吸收131.3kJ热量 。
(2)卫星发射时可用肼(N2H4)作燃料,1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量 。
14.回答下列问题
(1)已知C(s,石墨)=C(s,金刚石) △H>0,则稳定性:金刚石 石墨(填“>”、“=”或“<”)
(2)已知:2C(s) +2O2(g)=2CO2(g) △H1 2C(s) +O2(g)=2CO(g) △H2
则 △H1 △H2 (填“>”、“=”或“<”)
(3)“嫦娥五号”已于2020年11月24日在海南文昌发射中心成功发射。火箭的第一、二级发动机所用的燃料为偏二甲肼和四氧化二氮,其中偏二甲肼可与肼(N2H4)来制备。用肼为燃料,四氧化二氮做氧化剂,二者反应生成氮气和气态水。已知:
①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol
②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol
写出气态肼和四氧化二氮反应的热化学方程式
(4)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热量,写出该反应的热化学方程式
(5)0.50L 2.00mol/LH2SO4溶液与2.0L 1.00mol/LKOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H=
15.研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有 (填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式 ,
用该反应合成1 mol液态甲醇吸收热量131.9 kJ。又知2H2(g)+CO(g)+O2(g)=CO2(g)+2H2O(g) ΔH=-594.1 kJ/mol。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
16.按要求完成下列各小题
(1)用双线桥法分析:2KMnO4K2MnO4+MnO2+O2↑,并指明还原产物是
(2)用热化学方程式表示:1g甲烷在氧气中完全燃烧,生成液态水,放出热量akJ;
(3)写出二氧化碳和足量氢氧化钠溶液反应的离子方程式
17.按要求答题
(1)氯化铵受热分解的化学方程式
(2)铜与浓硝酸反应的化学方程式
(3)请用化学方程式表示硝酸贮存棕色试剂瓶并避光保存的原因 。
(4)检验氯化铵中有的离子方程式
(5)在一定条件下,1mol氢气与1mol氯气反应生成2mol氯化氢气体,放出184.5kJ的能量。则该反应的热化学方程式为 。
18.根据所给信息,书写对应的热化学方程式。
(1)11.2L(标准状况)在足量中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式: 。
(2)发生催化氧化反应生成气态产物,放出22.67kJ的热量,其热化学方程式: 。
(3)已知: ,请写出分解对应的热化学方程式: 。若和在一定条件下发生反应,放出的热量 92kJ(填“大于”“小于”或“等于”)。
19.按照要求完成反应方程式
(1)下表是某些物质的标准生成热(△Hf,在298.15K、101kPa,由元素最稳定的单质生成1mol纯化合物时的反应焓变)数据
物质 H2 CO CH3OH(g)
△Hf (kJ·mol-1) 0 -110.5 -201
则工业上用CO和H2合成CH3OH(g)的热化学反应方程式为:
(2)置换反应的通式可以表示为:单质(1)+化合物(1)=化合物(2)+单质(2)
请写出同时满足以下要求的3个置换反应的化学方程式:
①所涉及的元素的原子序数都小于20;
②6种单质分属6个不同的主族。
、 、
(3)向饱和碳酸氢钠溶液加入少量浓CaCl2溶液,有浑浊和气泡产生,写出反应的离子方程式:
(4)两种酸性溶液混合,溶液的酸性增强。写出一个可能的化学方程式:
20.填空。
(1)乙炔的电子式为 ;芒硝的化学式为 。
(2)在日常生活中我们常使用冷敷袋有两种,第一种所盛装的物质为NH4NO3和水,第二种为过量NH4NO3和Na2CO3·10H2O,使用方法均为将两种原本隔开的物质混合即可降温,第二种还同时产生两种气体,请根据所学知识写出第二种冰袋中发生的化学方程式 ,解释其实现降温的原因 。
三、实验探究题
21.回答下列问题
(1)为了探究化学能与热能的转化,某实验小组设计了如图所示三套实验装置:
①装置Ⅲ中甲装置的名称是 ;
②上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是 (填序号)。
③某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是 。
(2)太阳能的开发利用是21世纪的一个重要课题。
①人类利用太阳能有两种常见的转化方式是 、 。
②利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知表中数据:
盐 熔点/℃ 熔化吸热/() 参考价格/(元/kg)
29.0 37.3 780~750
32.4 77.0 800~900
36.1 100.1 1600~2000
48.5 49.7 1400~1800
其中最适宜作储能介质的是 (填字母)。
A. B.
C. D.
22.实验室利用下列装置模拟工业生产中氨气和氧气反应制备少量硝酸。
(1)NaOH溶液的作用是 。
(2) B中反应的化学方程式为 。
(3)下列试剂可用于干燥氨气是 。(填字母)
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D. P2O5
(4)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持温度可达到700℃以上,下列图示中, 能够正确表示该反应过程能量变化的是 (填字母)。
(5)控制氨气和氧气的比例是制备硝酸的关键,当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是 。
23.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是 。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 ,说明该反应属于 (填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是 。
②若观察到烧杯里产生气泡,则说明M溶于水 (填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是 。
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是 。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。方法①:选择上述装置 (填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验。方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是 反应。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.“千里冰封,万里雪飘”所描述的是水的不同状态之间的物理变化,A错误;
B.“野火烧不尽,春风吹又生”涉及燃烧过程,燃烧属于放热反应,B错误;
C.“投泥泼水愈光明,烁玉流金见精悍”涉及碳与水蒸气的反应,该反应为吸热反应,C正确;
D.“爆竹声中一岁除,春风送暖入屠苏”涉及剧烈燃烧过程,燃烧属于放热反应,D错误;
故选C。
2.B
【详解】A.由图可知反应物总能量低于生成物总能量,该反应为吸热反应,A项错误;
B.由能量可知石墨能量低,能量越低越稳定,石墨较稳定,B项正确;
C.该反应在高温高压下才能进行,C项错误;
D.金刚石相对能量较高,相同质量的金刚石与石墨完全燃烧,金刚石放出热量较多,D项错误。
答案选B。
3.D
【详解】A.石灰石在高温下的分解生成氧化钙和二氧化碳,属于吸热反应,选项A错误;
B.Ba(OH)2·8H2O晶体与NH4Cl晶体反应是吸热反应,选项B错误;
C.C与H2O(g) 高温条件下反应生成氢气和CO,属于吸热反应,选项C错误;
D.金属与稀酸反应是放热反应,选项D正确。
答案选D。
4.D
【分析】如图所示,生成物相对于反应物的能量较低,故该反应为放热反应,反应热,为该反应的活化能,即反应物断键所吸收的能量;为成键所放出的能量。
【详解】A.该反应为放热反应,反应物的键能之和小于生成物的键能之和,故A错误;
B.相同条件下,水蒸气液化成液态水时放热,故氢气和氧气反应生成液态水比生成等量的气态水放出的热量要多,故B错误;
C.从图中可以看出,石墨比金刚石稳定,金刚石转化成石墨时放热,热化学方程式为,故C错误;
D.反应热与反应条件无关,与物质的状态、性质、键能大小、系数有关,故D正确;
故选D。
5.B
【详解】A.过程Ⅰ利用太阳能将四氧化三铁转化为氧气和氧化亚铁,实现了太阳能→化学能的能量转化,故A正确;
B.根据题中反应路线可知总反应为↑+2H2↑,最终目的是利用太阳能分解水制取,故B错误;
C.根据图示可知过程Ⅰ的化学方程式为↑,故C正确;
D.过程Ⅰ、Ⅱ均有化合价的升降,故发生了氧化还原反应,故D正确;
故答案为B。
6.C
【详解】A.有的放热反应需要高温条件发生,如铝热反应是放热反应,但需要加热,选项A正确;
B.化学反应的特征:一是新物质生成,二是伴随着能量的变化,选项B正确;
C.若某反应的反应物总能量低于生成物总能量,则该反应为吸热反应,选项C不正确;
D.断键吸收能量,成键放出能量,化学变化中的能量变化主要是由化学键变化引起的是对的,选项D正确;
答案选C。
7.A
【详解】A.N2(g)+O2(g)=2NO(g)的焓变为,该反应为吸热反应,则NO(g)分解为N2(g)和O2(g)的反应是放热反应,A正确;
B.成键放出能量,2 mol O原子结合生成O2(g)时需要放出498 kJ能量,B错误;
C.1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量,C错误;
D.946 kJ和498 kJ分别是1 mol N2(g)和1 mol O2(g)分子中化学键断裂吸收的能量,2 mol N(g)和2 mol O(g)的总能量不能确定,D错误;
答案选A。
8.B
【详解】A.金属与酸置换出氢气的反应为放热反应,则Al与盐酸的反应为放热反应,故A不符合题意;
B.Ba(OH)2·8H2O与NH4Cl的反应属于复分解反应,属于吸热反应,故B符合题意;
C.燃烧反应均为放热反应,故C不符合题意;
D.中和反应均为放热反应,故盐酸与氢氧化钠的反应为放热反应,故D不符合题意;
故答案为B。
9.B
【分析】当往试管中加入试剂Y时,看到U形管中液面甲下降、乙上升,可以根据大气压强原理以及气体热胀冷缩的性质来回答。
【详解】A.试管中甲处液面下降,乙处液面上升,因为左边试剂瓶中温度升高,则该反应为放热反应,故A正确;
B.放热反应中,反应物的总能量比生成物的总能量高,故B错误;
C.由于反应物的总能量比生成物的总能量高,反应的结果是向体系外放出热量,则该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来,故C正确;
D.反应为放热反应,反应中化学键断裂吸收的总能量小于化学键形成释放的总能量,故D正确;
故选B。
10.A
【详解】根据图象,反应物的总能量小于生成物的总能量,说明正反应是吸热反应,即△H=+(E1-E2)kJ·mol-1,催化剂只降低活化能,对反应热无影响,故选项A正确。
11. 物质 能量 与反应生成液态水时放出的热量为
【详解】热化学方程式既表示化学反应的物质变化,也表示化学反应的能量变化,如热化学方程式表示在25℃、101kPa条件下2mol氢气与1mol氧气反应生成2mol液态水时放出的热量为571.6kJ,故答案为:物质;能量;与反应生成液态水时放出的热量为。
12. NH + OH- = NH3 H2O 放热 反应物总能量大于生成物总能量 NH + 2O2 NO+ H2O + 2H+ 5:6
【详解】(1)铵盐能和强碱反应,实质是NH + OH- = NH3 H2O,故答案为:NH + OH- = NH3 H2O;
(2)①由第一步反应的能量变化图分析看出,该反应为放热反应,判断理由是反应物总能量大于生成物总能量,故答案为:放热;反应物总能量大于生成物总能量;
②NH全部氧化成NO的反应分两步进行:NH + O2 = NO+ 2H++H2O,NO+ O2 = NO,上述两式相加,移项抵消NO,即得到符合题意的离子方程式是NH + 2O2 NO+ H2O + 2H+,故答案为:NH + 2O2 NO+ H2O + 2H+;
(3) 32 g CH3OH的物质的量为1mol,完全反应后转移6 mol电子,CH3OH中的C元素显-2价,被氧化后生成物中C元素显+4价,氧化产物是CO2;HNO3中N元素显+5价,还原成N2后,N元素是0价。根据得失电子相等(即化合价升降相等)有:16=n(HNO3)(5-0),n(HNO3)=1.2mol,所以n(CH3OH) :n(HNO3)=1:1.2=5:6,故答案为:5:6。
13.(1)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ/mol
(2)N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-622 kJ/mol
【详解】(1)1molC(s)与适量H2O(g)反应,生成CO2(g)和H2(g),吸收131.3kJ热量,则热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ/mol。
(2)1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量,则热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-622 kJ/mol。
14.(1)<
(2)<
(3)2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol
(4)CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1
(5)-57.3kJ /mol
【详解】(1)物质的能量越高,该物质越不稳定,C(s,石墨)=C(s,金刚石) △H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H < 0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:< ;
(3)①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol;②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol,由盖斯定律②×2 -①得到2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol,故答案为:2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3kJ 的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H =-282.6kJ·mol-1,该反应的热化学方程式为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1,故答案为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1;
(5)0.50L 2.00mol/ L H2SO4溶液与2.00L 1.00mol/ L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为- 11.46kJ/mol,中和热为- 57.3kJ/mol,故答案为:-57.3kJ /mol。
15.(1)acd
(2) CO+2H2 CH3OH 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1 452 kJ/mol
【详解】(1)a、化石原料燃烧产生SO2、NO2等有污染的气体,因此减少化石燃料的使用,减少污染物产生,开发新能源,能减少污染的发生,故正确;b、使用无氟冰箱,减少氟利昂的排放,但对CO2、SO2、NO2的排放不产生影响,故错误;c、减少私家车的使用,减少NO2、CO2等的排放,故正确;d、CO2、SO2属于酸性氧化物,和碱反应,NO2能和碱反应生成硝酸盐和亚硝酸盐,故正确;
(2)根据题目中信息,反应方程式为CO+2H2CH3OH,
①CO(g)+2H2(g)CH3OH(l) △H=+131.9kJ·mol-1,
②2H2(g)+CO(g)+O2(g)=CO2(g)+2H2O(g) ΔH=-594.1 kJ·mol-1,
甲醇燃烧的反应方程式为CH3OH+O2→CO2+2H2O,
②-2×①得出:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-726 kJ/mol。
16.(1);K2MnO4+MnO2
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-16akJ/mol
(3)CO2+2OH-=CO+H2O
【分析】(1)
KMnO4中的Mn元素化合价降低,生成K2MnO4和MnO2,氧化剂为KMnO4,还原产物是K2MnO4+MnO2,O元素化合价升高,生成O2,双线桥法表示为:;
(2)
1g甲烷完全燃烧放出热量akJ,1mol甲烷的质量为m=nM=16g,则1mol甲烷完全反应放出热量为16akJ,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-16akJ/mol;
(3)
二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,离子方程式为:CO2+2OH-=CO+H2O。
17.(1)
(2)
(3)
(4)
(5)
【详解】(1)氯化铵受热分解生成氨气和氯化氢,其反应的化学方程式为,故填;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,其反应的化学方程式为,故填;
(3)硝酸见光或受热易分解,所以应避光保存,其见光分解的化学方程式为,故填;
(4)实验室检验铵根离子用氢氧化钠溶液,在加热条件下放出的气体若能使湿润的红色石蕊试纸变蓝,则含有铵根离子,其反应为,故填;
(5)在一定条件下,1mol氢气与1mol氯气反应生成2mol氯化氢气体,放出184.5kJ的能量。则该反应的热化学方程式为,故填。
18.(1)H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-906.8 kJ/mol
(3) NH3(g)N2(g)+H2(g) △H=+46 kJ/mol 小于
【详解】(1)由题意知,0.5 mol H2在Cl2中完全燃烧放热91.5 kJ,则1 mol H2在Cl2中完全燃烧放热91.5 kJ×2=183 kJ,对应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol;
(2)n(NH3)=,由题意知,0.1 mol NH3催化氧化生成NO和H2O(g)放热22.67 kJ,故4 mol NH3催化氧化放热906.8 kJ,对应热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-906.8 kJ/mol;
(3)由题意得2 mol NH3完全分解吸热92 kJ,则1 mol NH3完全分解吸热46 kJ,对应热化学方程式为:NH3(g)N2(g)+H2(g) △H=+46 kJ/mol;由于该反应为可逆反应,故1 mol N2不可能完全转化为NH3,故放出的热量小于92 kJ。
19.(1)CO(g)+2H2(g)CH3OH(g) △H=-90.5kJ/mol
(2) 2Al+6HCl=AlCl3+3H2↑ 2F2+2H2O=4HF+O2 (Cl2+H2S=2HCl+S) 2Mg+CO22MgO+C
(3)2HCO+Ca2+=CaCO3↓+CO2↑+H2O
(4)HClO+H2SO3=HCl+H2SO4或H2S+CuSO4=CuS↓+H2SO4(其它合理答案也行)
【详解】(1)工业上用CO和H2合成CH3OH(g)的化学方程式是,=生成物的标准生成热总和-反应物的标准生成热总和=[-201-(-110.5)]kJ/mol=-90.5 kJ/mol;
(2)常见的置换反应类型有金属置换非金属,金属置换金属,非金属置换非金属,非金属置换金属等类型,可以根据元素和化合物的知识并归纳中学阶段所有情况的置换反应来回答。得出符合条件的反应可以是:2Mg+CO22MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2;
(3)向饱和碳酸氢钠溶液加入少量浓CaCl2溶液,有浑浊和气泡产生,故离子方程式为2HCO+Ca2+=CaCO3↓+CO2↑+H2O;
(4)复分解反应中较强酸可以制较弱酸,但有特例,比如硫化氢与硫酸铜反应生成难溶物硫化铜沉淀,高沸点难挥发性酸磷酸可以制低沸点易挥发性酸HBr和HI,氧化还原反应中也存在较弱酸制出较强酸的离子。HClO+H2SO3=HCl+H2SO4或H2S+CuSO4=CuS↓+H2SO4皆满足两种酸性溶液混合,溶液的酸性增强。
20.(1) Na2SO4·10H2O
(2) Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O 该反应为吸热反应;过量NH4NO3溶于水也吸热
【详解】(1)乙炔的结构简式为CH≡CH,电子式为;芒硝是十水硫酸钠的俗称,化学式为Na2SO4·10H2O,故答案为:;Na2SO4·10H2O;
(2)由题意可知,第二种冰袋中发生的反应为十水碳酸钠与硝酸铵反应生成硝酸钠、氨气、二氧化碳和水,反应的化学方程式为Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O,该反应为吸热反应,反应中吸收热量,且过量的硝酸铵溶于反应生成的水也会吸收热量,使周围环境温度降低,达到降温的目的,故答案为:Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O;该反应为吸热反应;过量NH4NO3溶于水也吸热。
21.(1) 长颈漏斗 III U形管中红墨水左面高
(2) 光-热转换 光-电转换 B
【详解】(1)①装置Ⅲ中甲装置的名称是长颈漏斗;
②反应放热,使气体膨胀,Ⅰ中U形管中红墨水左面下降,Ⅱ中烧杯中有气泡冒出,均可说明反应使放热的;
③氢氧化钡晶体与氯化铵固体搅拌反应,反应吸热,Ⅰ中锥形瓶中气体压强减小,U形管中红墨水左面高;
(2)①人类直接利用太阳能,有两种常见的方式:光—热转换和光—电转换;
②作为储能介质应综合考虑下列因素才有应用价值;熔点比常温略高;熔化时吸热值较大,应考虑单位质量的固体盐在熔化时吸热越多越好;价格低廉,因此选择。
22. 吸收氮的氧化物,防止污染空气 3NO2+H2O=2HNO3+NO B A NH4NO3
【分析】试管中发生氨的催化氧化生成NO,在装置A中NO进一-步被氧气氧化生成二氧化氮,装置B中二氧化氮与水反应生成硝酸,用氢氧化钠溶液吸收氮的氧化物,防止污染空气,结合氨气的制备及氮的氧化物的性质解答该题。
【详解】(1)氮的氧化物均有毒,NaOH溶液可吸收氮的氧化物,防止污染空气,故答案为:吸收氮的氧化物,防止污染空气;
(2) 装置B中二氧化氮与水反应生成硝酸,反应的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(3)氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气,故答案为:B;
(4)反应为放热反应,放出大量的热,反应物的总能量比生成物的总能量高,700°C时水是气体,故答案为:A;
(5)一氧化氮与氧气反应生成红棕色气体二氧化氮,二氧化氮与水反应生成硝酸,氨气和硝酸能反应生成白烟硝酸铵,化学式为NH4NO3,故答案为:NH4NO3。
【点睛】本题考查实验模拟工业生产制备少量硝酸、反应热的计算、氧化还原反应等,明确结合反应原理明确各装置的作用是解答该题的关键。
23.(1)Ⅲ
(2) 左端液柱降低,右端液柱升高 放热
(3) 产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱 可能是放热反应 某些物质(如浓硫酸)溶于水放热,但不是放热反应 硝酸铵(或其他合理答案)
(4) Ⅰ(或Ⅱ) 放热
【详解】(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应,故答案为Ⅲ;
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高,故答案为左端液柱降低,右端液柱升高;放热;
(3)①若M为钠,钠与水反应生成氢氧化钠和氢气,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱,故答案为产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱;
②若观察到烧杯里产生气泡,说明M溶于水可能放出热量,由于放热反应一定属于化学变化,而有热量放出的反应不一定为化学变化,所以不一定属于放热反应,某些物质(如氢氧化钠)溶于水放热,但不是化学反应,故答案为可能是放热反应;
③若观察到烧杯里的玻璃管内形成一段水柱,说明装置中气体的压强减小,则M可能是硝酸铵,硝酸铵溶于水,吸收热量,温度降低,气体压强减小,故答案为硝酸铵;
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O═4KOH+3O2↑)是放热反应还是吸热反应:方法①:选择上述装置Ⅰ(或Ⅱ)进行实验,Ⅰ装置右边U形管中左端液柱降低,右端液柱升高(或烧杯中导管中有气泡放出),证明该反应为放热反应;故答案为Ⅰ(或Ⅱ);
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应放出大量热,使棉花燃烧,证明该反应是放热反应,故答案为放热。
点睛:本题考查化学反应中的热效应,注意掌握探究反应热效应的常用方法,试题有利于培养学生实验综合分析能力,特别是实验的评价和根据实验现象推理的能力。
答案第1页,共2页
答案第1页,共2页
