2.2 氯及其化合物 同步检测题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2 氯及其化合物 同步检测题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 109.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-15 23:24:05 | ||
图片预览


文档简介
2.2 氯及其化合物 同步检测题
一、单选题
1.游泳池是公共场合,必须保持用水的清洁卫生,游泳池中的水常用漂白粉消毒,漂白粉的有效成分是( )
A.CaCl2 B.Ca(ClO)2 C.Ca(OH)2 D.HClO
2.下列关于氯水的说法不正确的是( )
A.向氯水中滴入溶液,产生气泡说明氯水中含有
B.氯水应用棕色试剂瓶避光保存
C.氯水放置一段时间后酸性增强
D.新制氯水具有漂白性是因为含有
3.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸
C.氯化钙溶液 D.二氧化硫水溶液
4.下列化合物不能由单质直接化合而成的是( )
A.CuCl2 B.FeCl2 C.NaCl D.HCl
5.用氯气跟单质化合不能制取的物质是( )
A.KCl B.FeCl2 C.FeCl3 D.CuCl2
6.将Cl2通入过量石灰乳[Ca(OH)2]中即可制得以Ca(ClO)2为有效成分的漂白粉。下列解释事实的方程式中,不正确的是( )
A.生成Ca(ClO)2:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
B.漂白粉溶液与盐酸混合产生Cl2:ClO﹣+Cl﹣+2H+=Cl2↑+H2O
C.漂白粉溶液吸收CO2后产生白色沉淀:Ca2++CO2+H2O=CaCO3↓+2H+
D.漂白粉溶液加入适量醋酸在短时间内能达到漂白效果:Ca(OH)2+2CH3COOH=Ca(CH3COO)2+2H2O、Ca(ClO)2+2CH3COOH=Ca(CH3COO)2+2HClO
7.在空气中久置而不易变质的物质是( )
A.过氧化钠 B.纯碱 C.漂粉精 D.氯水
8.下列既能由金属和氯气直接制取,又能由金属和盐酸直接制取的是( )
A.FeCl2 B.NaCl C.FeCl3 D.CuCl2
9.有些地方的自来水用氯气消毒,某学生用这种自来水配制下列溶液,不会使药品变质的是( )
A. 溶液 B. 溶液 C. 溶液 D.盐酸
10.用氯气和绿矾处理水,下列说法错误的是( )
A.氯气起杀菌消毒作用 B.氯气氧化绿矾
C.绿矾具有净水作用 D.绿矾的氧化产物具有净水作用
11.氯水中存在多种分子和离子,不同的反应中表现出不同的性质。下列结论正确的是( )
A.加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B.将紫色石蕊溶液滴加到氯水中,溶液变先变红后褪色,说明有H+和HClO存在
C.先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.将氯水加入到含有酚酞的NaOH溶液中,红色褪去,说明有HClO的存在
12.已知 (浓) (未配平).如图 是浸有相关溶液的滤纸,向 晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.下列有关说法错误的是( )
A.a处变蓝、b处变棕红,说明非金属性: 、
B.d处立即褪色是因为 的漂白作用,e处变红可用于检验
C.c处先变红后褪色说明 与 反应生成 和
D.已知反应中氧化剂与还原剂的物质的量之比为
13.在给定条件下,下列选项所示物质间转化均能实现的是( )
A.Al H2 B.CuO Cu(OH)2
C.Cl2 FeCl2 D.NaCl溶液 单质Na
14.下列实验操作、现象及实验结论相对应且正确的是( )
选项 实验操作 现象 实验结论
A 将干燥的充入放有鲜花的集气瓶中 鲜花褪色 具有漂白性
B 将加入无色酚酞溶液中 酚酞变红后不褪色 生成了碱性物质
C 用铂丝蘸取某溶液置于酒精灯外焰上灼烧 火焰呈黄色 该溶液中含元素
D 某气体通入淀粉-溶液中 淀粉变蓝 该气体一定为
A.A B.B C.C D.D
15.下列有关氯气实验现象的记录正确的是( )
A.纯净的氢气在氯气中安静燃烧,发出苍白色火焰
B.钠可以在氯气中燃烧,发出黄色火焰,生成黄色固体
C.用pH试纸检验干燥的氯气,试纸先变红后褪色
D.新制的氯水是由氯气溶于水形成的无色透明溶液
16.化学与生活密切相关,下列有关物质叙述正确的是( )
A.过氧化钠是碱性氧化物,可以用来杀菌消毒
B.碳酸钠在医疗上是治疗胃酸过多的一种药剂
C.工业上通常以氯气和澄清石灰水为原料制造漂白粉
D.氯气有毒,但可用于药物的合成
二、综合题
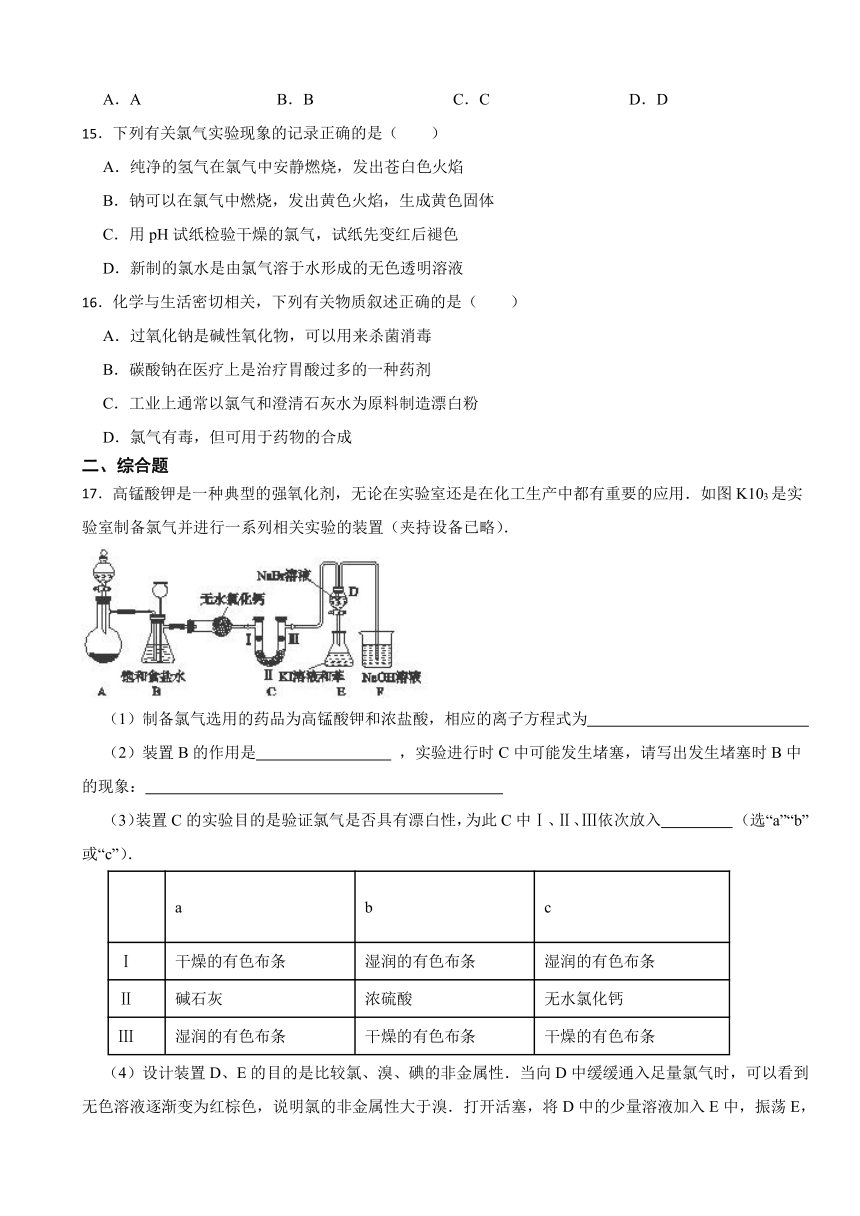
17.高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)制备氯气选用的药品为高锰酸钾和浓盐酸,相应的离子方程式为
(2)装置B的作用是 ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 (选“a”“b”或“c”).
a b c
Ⅰ 干燥的有色布条 湿润的有色布条 湿润的有色布条
Ⅱ 碱石灰 浓硫酸 无水氯化钙
Ⅲ 湿润的有色布条 干燥的有色布条 干燥的有色布条
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是 .该现象 (填“能”或“不能”)说明溴的非金属性强于碘.
18.在新制的氯水参加的反应中,有如下几种情况:
(1)向FeCl2和KSCN的混合溶液中加入氯水,现象是 ,氯水中起作用的 主要微粒是 ,反应的离子方程式是 .
(2)向AgNO3溶液中加入氯水,现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 .
(3)向氯水中滴加石蕊试液,溶液变红,起作用的微粒是 ,然后又褪色,起作用的微粒是 .
19.写出下列反应的化学方程式
(1)钠与水反应 ;
(2)Na2O2与水反应 ;
(3)Cl2与NaOH溶液反应 ;
(4)Cl2与水反应 。
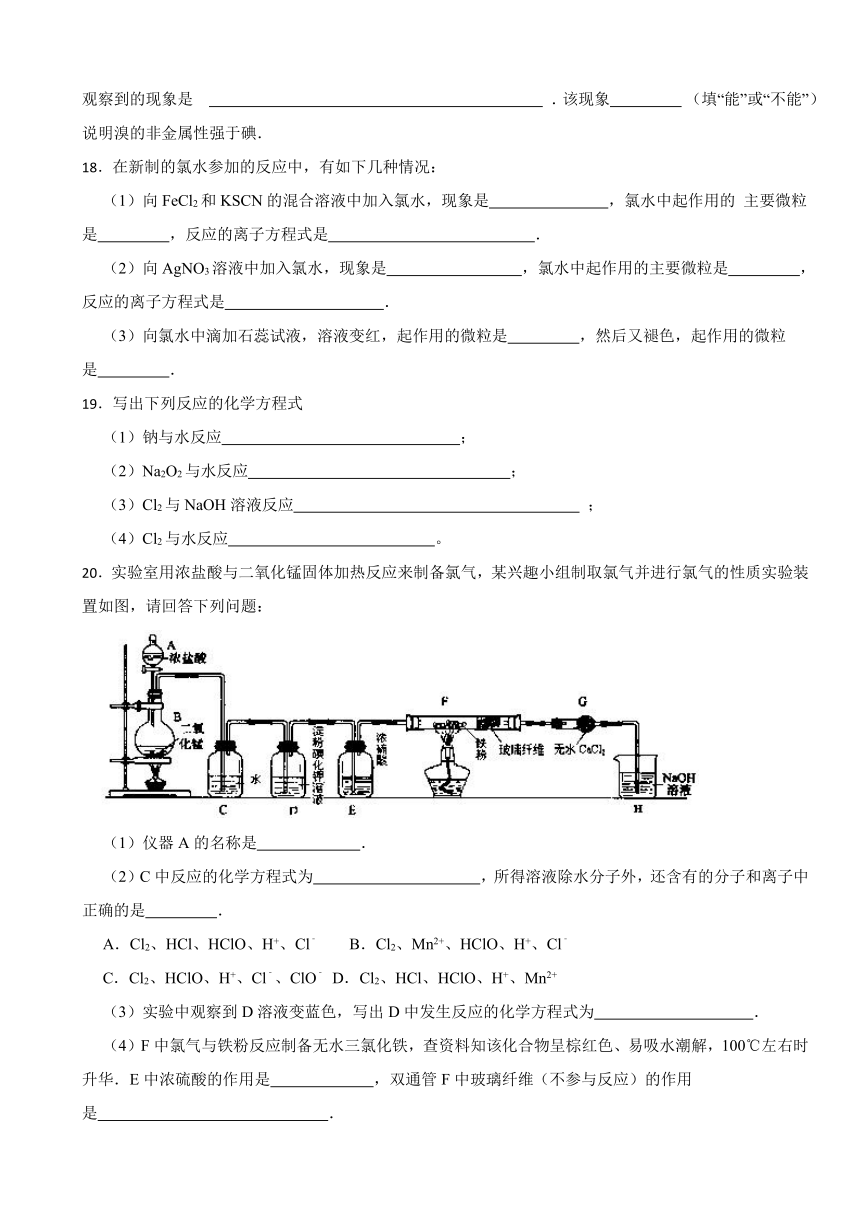
20.实验室用浓盐酸与二氧化锰固体加热反应来制备氯气,某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题:
(1)仪器A的名称是 .
(2)C中反应的化学方程式为 ,所得溶液除水分子外,还含有的分子和离子中正确的是 .
A.Cl2、HCl、HClO、H+、Cl﹣ B.Cl2、Mn2+、HClO、H+、Cl﹣
C.Cl2、HClO、H+、Cl﹣、ClO﹣ D.Cl2、HCl、HClO、H+、Mn2+
(3)实验中观察到D溶液变蓝色,写出D中发生反应的化学方程式为 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.E中浓硫酸的作用是 ,双通管F中玻璃纤维(不参与反应)的作用是 .
(5)H中盛有NaOH溶液,发生反应的化学方程式为 .
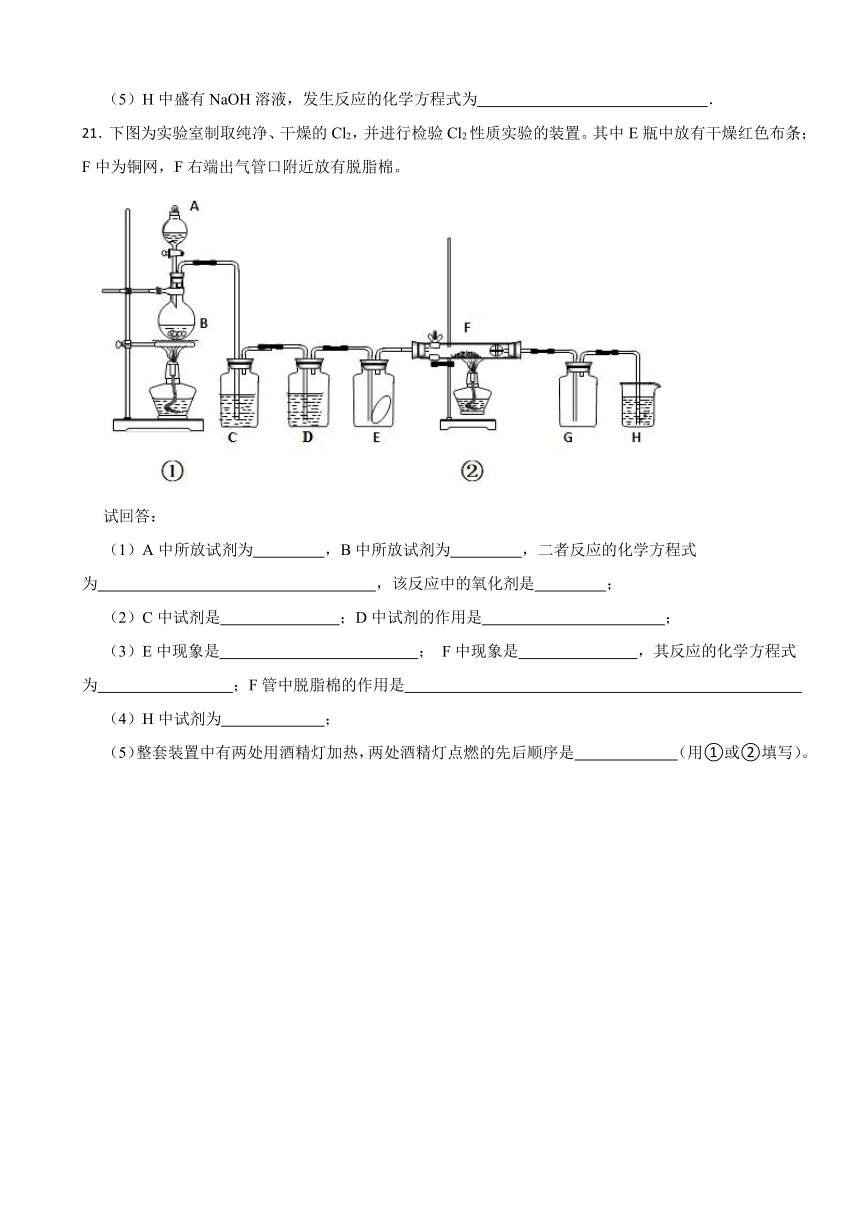
21.下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
试回答:
(1)A中所放试剂为 ,B中所放试剂为 ,二者反应的化学方程式为 ,该反应中的氧化剂是 ;
(2)C中试剂是 ;D中试剂的作用是 ;
(3)E中现象是 ; F中现象是 ,其反应的化学方程式为 ;F管中脱脂棉的作用是
(4)H中试剂为 ;
(5)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是 (用①或②填写)。
答案解析部分
1.【答案】B
【解析】【解答】漂白粉是次氯酸钙和氯化钙组成的混合物,其中有效成分是次氯酸钙,
故答案为:B。
【分析】根据漂白粉的主要成分和有效成分进行判断即可。
2.【答案】D
【解析】【解答】A.氯水中含有H+,能和
溶液反应生成CO2,A项不符合题意;
B.氯水中含有次氯酸,次氯酸见光分解生成HCl和O2,故氯水应用棕色试剂瓶避光保存,B项不符合题意;
C.氯水中含有次氯酸,次氯酸见光分解生成HCl和O2,溶液酸性增强,C项不符合题意;
D.新制氯水具有漂白性是因为含有HClO,D项符合题意;
故答案为:D。
【分析】A.氯水中含有H+,能和碳酸根反应产生气泡;
B.氯水中含有次氯酸,次氯酸见光分解,所以应该避光保存,可用棕色试剂瓶;
C.氯水放置一段时间后,氯水中的次氯酸分解为氯化氢,氯化氢溶于水后使得酸性增强;
D.新制氯水中含有次氯酸,次氯酸使其具备了漂白作用。
3.【答案】A
【解析】【解答】在氯水中存在反应Cl2+H2O H++Cl﹣+HClO,若反应使溶液中次氯酸浓度增大,则溶液漂白性会增强,
A.由于酸性HCl>H2CO3>HClO,向溶液中加入碳酸钙粉末反应反应2HCl+CaCO3=CaCl2+CO2↑+H2O,使化学平衡正向进行,导致次氯酸浓度增大,溶液漂白性增强,故A正确;
B.加入稀硫酸使溶液中氢离子浓度增大平衡逆向进行,次氯酸浓度减小,溶液漂白性减弱,故B错误;
C.加入氯化钙溶液不发生反应,溶液对氯水起到稀释作用,平衡正向进行但次氯酸浓度减小,漂白性减弱,故C错误;
D.加入二氧化硫的水溶液,二氧化硫有还原性,能被氯气氧化,平衡逆向进行,次氯酸浓度减小,漂白性减弱,故D错误;
故选A.
【分析】本题考查了氯气、次氯酸、氯水性质的分析,要求掌握化学平衡影响因素,掌握基础是解题关键,题目较简单.
4.【答案】B
【解析】【解答】A.CuCl2可由铜与氯气反应生成氯化铜,A与题意不符;
B.铁与氯气反应只能生成FeCl3,B符合题意;
C.NaCl可由钠与氯气反应生成氯化钠,C与题意不符;
D.HCl可由氢气与氯气反应生成氯化氢,D与题意不符;
答案为B。
【分析】
A.可由铜与氯气燃烧得到;
B.不可由铁单质化合生成,只能生成三价铁;
C.钠和氯气燃烧得到;
D.氢气和氯气燃烧得到。
5.【答案】B
【解析】【解答】解:A.K与氯气化合生成KCl,故A不选;
B.Fe与氯气化合生成FeCl3,故B选;
C.Fe与氯气化合生成FeCl3,故C不选;
D.Cu与氯气化合生成CuCl2,故D不选;
故选B.
【分析】氯气具有强氧化性,与变价金属反应生成高价金属氯化物,以此来解答.
6.【答案】C
【解析】【解答】A.将Cl2通入过量石灰乳[Ca(OH)2]中,发生氧化还原反应,生成Ca(ClO)2、CaCl2和H2O,其化学方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,故A不符合题意;
B.漂白粉溶液与盐酸混合,氯离子和次氯酸根离子在酸性溶液中发生氧化还原反应生成氯气和H2O,其离子方程式为ClO﹣+Cl﹣+2H+=Cl2↑+H2O,故B不符合题意;
C.漂白粉溶液中吸收二氧化碳反应生成碳酸钙和次氯酸,HClO是弱酸,在离子方程式中不能拆开,其反应的离子方程式为Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO,故C符合题意;
D.漂白粉溶液加入适量醋酸,会发生Ca(OH)2+2CH3COOH=Ca(CH3COO)2+2H2O、Ca(ClO)2+2CH3COOH=Ca(CH3COO)2+2HClO,在短时间内HClO的浓度增大,能提高其漂白效率,故D不符合题意;
故答案为C。
【分析】A.氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
B.漂白粉溶液与盐酸混合,发生氯元素的归中反应,产生Cl2;
C.漂白粉溶液吸收CO2后产生白色沉淀和次氯酸,次氯酸是弱酸;
D.将Cl2通入过量石灰乳[Ca(OH)2]中即可制得以Ca(ClO)2为有效成分的漂白粉,加入醋酸和氢氧化钙、次氯酸钙反应。
7.【答案】B
【解析】【解答】解:A.过氧化钠能与空气中的二氧化碳生成碳酸钠,和水反应氢氧化钠,所以在空气中久置会变质,故A错误;
B.碳酸钠在空气中基本无变化,即纯碱久置不易变质,故B正确;
C.次氯酸的酸性小于碳酸,所以漂白粉中次氯酸钠易和二氧化碳、水反应生成次氯酸而变质,故C错误;
D.氯水中的次氯酸能分解产生盐酸和氧气,在空气中易变质,故D错误;
故选B.
【分析】A.过氧化钠能与空气中的二氧化碳生成碳酸钠,和水反应氢氧化钠;
B.碳酸钠在空气中基本无变化;
C.次氯酸的酸性小于碳酸,所以漂白粉中次氯酸钠易和二氧化碳、水反应生成次氯酸而变质;
D.氯水中的次氯酸能分解产生盐酸和氧气.
8.【答案】B
【解析】【解答】A. Fe与Cl2反应生成FeCl3,Fe与盐酸反应生成FeCl2和H2,与题意不符,故A不选;
B. Na与Cl2反应生成NaCl,Na与盐酸反应生成NaCl和H2,与题意相符,故B选;
C. Fe与Cl2反应生成FeCl3,Fe与盐酸反应生成FeCl2和H2,与题意不符,故C不选;
D. Cu与Cl2反应生成CuCl2,Cu与盐酸不反应,与题意不符,故D不选;
故答案为:B。
【分析】A、Fe与Cl2在点燃条件下反应生成FeCl3;
B、Na与Cl2在点燃条件下反应生成NaCl;
C、Fe与Cl2在点燃条件下反应生成FeCl3;
D、Cu与Cl2在点燃条件下反应生成CuCl2;
9.【答案】D
【解析】【解答】氯气消毒过的自来水中含有Cl-、H+、 Cl2 、 HClO 等微粒,
A.NaOH和自来水中溶解的氯气产生次氯酸钠,能发生如下反应:Cl2+2NaOH=NaCl+NaClO+H2O,使相应的药品变质,故A不符合题意;
B.硝酸银和氯离子反应产生氯化银白色沉淀,使相应的药品变质,故B不符合题意;
C.Na2CO3能与氯水中的H+反应,产生无色无味气体(CO2)或生成碳酸氢钠,使相应的药品变质,故C不符合题意;
D.盐酸与氯水不反应,自来水中少量的 HClO 见光会分解为HCl,配制的溶液不会变质,故D符合题意;
故答案为:D。
【分析】A、根据自来水中含有H+、HClO能够与氢氧化钠反应解答;
B、根据自来水中含有Cl-能够与硝酸银溶液反应生成氯化银白色沉淀解答;
C、根据自来水中含有H+,能够与碳酸钠反应生成碳酸氢钠解答;
D、根据根据自来水中含有Cl-、H+、HClO,次氯酸见光分解生成盐酸解答;
10.【答案】C
【解析】【解答】A.氯气与水反应生成次氯酸,次氯酸具有杀菌消毒作用,所以可以用适量氯气杀菌消毒,故A正确;
B.绿矾中二价铁离子具有还原性,氯气能够氧化二价铁离子生成三价铁,故B正确;
C.绿矾水解生成氢氧化亚铁不稳定,极易被氧化生成氢氧化铁,所以明绿不具有净水作用,故C错误;
D.绿矾的氧化产物为硫酸铁,硫酸铁中三价铁水解生成氢氧化铁胶体,具有吸附性,能够净水,故D正确;
故选:C.
【分析】A.氯气与水反应生成次氯酸,次氯酸具有杀菌消毒作用;
B.绿矾中二价铁离子具有还原性,氯气能够氧化二价铁离子生成三价铁;
C.绿矾水解生成氢氧化亚铁不稳定,极易被氧化生成氢氧化铁;
D.氢氧化铁胶体具有吸附性,能够净水.
11.【答案】B
【解析】【解答】氯气与水反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
A.氯水中的HClO具有漂白性,向氯水中加入有色布条,片刻后有色布条褪色,可说明有HClO存在,故A不符合题意;
B.向氯水中加入紫色石蕊试液,因溶液中存在H+,会使溶液变红,而HClO具有漂白性,能够使红色褪色,因此溶液先变红后褪色,说明有H+和HClO存在,故B符合题意;
C.先加入盐酸酸化,引入Cl-,不可说明原溶液中有Cl-存在,故C不符合题意;
D.加入NaOH溶液,氯水的浅黄绿色消失的原因是氯气与氢氧化钠发生反应生成无色的氯化钠和次氯酸钠,并不能说明有HClO存在,故D不符合题意;
故答案为:B。
【分析】氯气溶于水生成氯化氢和次氯酸,次氯酸具有漂白性;
A、布条褪色时因为含有次氯酸;
B、次氯酸和氯化氢具有酸性,次氯酸还具有漂白性;
C、鉴别Cl-:滴加稀硝酸和硝酸银溶液;
D、次氯酸和氯化氢都是酸。
12.【答案】B
【解析】【解答】A.Cl2和碘化钾反应:Cl2+2NaI=2NaCl+I2,碘遇淀粉变蓝,该反应说明Cl2的氧化性强于I2,非金属性:Cl>I;Cl2和NaBr反应:Cl2+2NaBr=2NaCl+Br2,说明Cl2的氧化性强于Br2,非金属性:Cl>Br,故A不符合题意;
B.e处变红是氯气把Fe2+氧化为Fe3+,Fe3+遇KSCN变红,可以检验Fe2+;氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性,d处立即褪色可能的原因是次氯酸氧化了酚酞,也可能是氯气和NaOH溶液反应,需要通过实验验证,故B符合题意;
C.Cl2 与 H2O 反应生成 HCl 和 HClO,所以c处先变红后褪色,故C不符合题意;
D.根据电子守恒配平反应:K2Cr2O7+14HCl (浓) = 3Cl2↑+2CrCl3+2KCl+7H2O,反应中氧化剂为K2Cr2O7,还原剂为HCl,参加反应的14molHCl中只有6mol发生了化合价的变化,故氧化剂和还原剂的物质的量之比为 1:6 ,故D不符合题意;
故答案为:B。
【分析】A.a处变蓝色,说明有碘单质生成,b处变棕红,说明有溴单质生成
B.氯气可以与氢氧化钠反应,可能造成褪色,也有可能是氯气和水反应生成次氯酸具有氧化性,e处变红可以说明有铁离子,因为具有氯气,说明可以用来检验亚铁离子
C.氯气和水反应生成盐酸和次氯酸,盐酸显酸性,变红,次氯酸具有氧化性,褪色
D.将方程式配平K2Cr2O7+14HCl (浓) = 3Cl2↑+2CrCl3+2KCl+7H2O,扽出氧化剂与还原剂物质的量比为1:6
13.【答案】A
【解析】【解答】A.Al能够与NaOH溶液反应生成H2,物质间转化能实现,故A选;
B.CuO难溶于水,与水不反应,所以CuO与水不能反应生成Cu(OH)2,故B不选;
C.铁在氯气中燃烧生成FeCl3,不生成FeCl2,故C不选;
D.电解氯化钠溶液生成氢氧化钠、氢气和氯气,得不到Na,电解熔融的氯化钠可以生成Na,故D不选;
故答案为:A。
【分析】A.Al是一种两性金属,能与NaOH溶液反应生成H2;
B.CuO与H2O不反应;
C.Cl2与Fe点燃条件下反应生成FeCl3;
D.电解NaCl溶液,得到NaOH、Cl2和H2;
14.【答案】C
【解析】【解答】A.氯气和水反应能生成具有漂白性的次氯酸,鲜花中有水分,将干燥的 Cl2 充入放有鲜花的集气瓶中,鲜花褪色,能说明HClO有漂白性,Cl2不具有漂白性,故A不符合题意;
B.将 Na2O2 加入无色酚酞溶液中,Na2O2和水反应生成NaOH和H2O2,NaOH溶液能使酚酞变红,H2O2有漂白性,能使溶液褪色,故B不符合题意;
C.钠的焰色是黄色,用铂丝蘸取某溶液置于酒精灯外焰上灼烧,火焰呈黄色,该溶液中含 Na 元素,故C符合题意;
D.某气体通入淀粉- KI 溶液中,淀粉变蓝,说明该气体有氧化性,该气体将KI氧化为I2,I2遇淀粉变蓝,具有氧化性的气体不一定为 Cl2,还可以是NO2等,故D不符合题意;
故答案为:C。
【分析】A.氯气不具有漂白性;
B.过氧化钠和水的反应分为两步,第一步为过氧化钠和水生成氢氧化钠和过氧化氢,过氧化氢不稳定,又分解生成水和氧气;
C.钠的焰色反应为黄色;
D.淀粉变蓝说明该气体具有氧化性,但不一定为氯气。
15.【答案】A
【解析】【解答】A.纯净的H2可以在黄绿色的Cl2中安静燃烧,发出苍白色火焰,生成氯化氢(HCl)气体,即H2+Cl2 2HCl,故A符合题意;
B.钠可以在氯气中燃烧,生成氯化钠,氯化钠是白色固体,即2Na+Cl2 2NaCl,故B不符合题意;
C.干燥氯气不能使pH试纸先变红后褪色,含水蒸气的氯气,氯气和水反应生成盐酸和次氯酸,使pH试纸先变红后褪色,故C不符合题意;
D.新制的氯水是由氯气溶于水形成的,新制的氯水中含氯气分子,溶液呈浅黄绿色,故D不符合题意;
答案为A。
【分析】A.氢气在氯气中燃烧,产生苍白色火焰;
B.钠在氯气中燃烧,生成白色固体;
C.干燥的氯气不能使pH试纸变色;
D.新制氯水由于溶解有氯气,呈现浅黄绿色;
16.【答案】D
【解析】【解答】A.过氧化钠不是碱性氧化物,但其具有强氧化性,可用来杀菌消毒,A不符合题意;
B.碳酸氢钠是医疗上疗胃酸过多的一种药剂,B不符合题意;
C.工业上通常以氯气和石灰乳为原料制造漂白粉,C不符合题意;
D.氯气有毒,但可用于药物的合成,D符合题意;
故答案为:D。
【分析】A.过氧化钠具有强氧化性,能使蛋白质变性,过氧化钠不是碱性氧化物;
B.碳酸钠碱性较强,不能用于治疗胃酸过多;
D.工业上将氯气通入石灰乳中制造漂白粉。
17.【答案】(1)2MnO4﹣+16H++10Cl﹣═2Mn2++5Cl2↑+8H2O
(2)除杂和安全瓶;锥形瓶中的液面下降,长颈漏斗中的液面上升
(3)c
(4)E中溶液分为两层,上层(苯层)为紫红色;不能
【解析】【解答】(1)高锰酸钾与浓盐酸反应的离子方程式为:2MnO4﹣+16H++10Cl﹣═2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4﹣+16H++10Cl﹣═2Mn2++5Cl2↑+8H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,锥形瓶中液面下降,长颈漏斗中液面上升;
故答案为:除杂和安全瓶;锥形瓶中的液面下降,长颈漏斗中的液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中ab的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,故选c;
(4)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡;观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,所以该现象不能说明溴的非金属性强于碘;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;不能.
【分析】(1)高锰酸钾具有强的氧化性,与浓盐酸反应生成氯化锰、氯化钾、氯气和水;
(2)反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,振荡分层,苯层在上层;氯气具有强氧化性;由于过量的氯气也能够氧化碘离子,无法说明溴单质氧化性强于碘单质.
18.【答案】(1)溶液变红色;Cl2;Cl2+2Fe2+=2Fe2++2Cl﹣
(2)生成白色沉淀;Cl﹣;Cl﹣+Ag+=AgCl↓
(3)H+;HClO
【解析】【解答】解:氯水含有H2O、Cl2、HClO、Cl﹣、H+、OH﹣,(1)向FeCl2和KSCN的混合溶液中加入氯水,氯气把亚铁离子氧化为三价铁离子,所以溶液变红色,
故答案为:溶液变红色;Cl2;Cl2+2Fe2+=2Fe2++2Cl﹣;(2)向AgNO3溶液中加入氯水,银离子与氯离子结合生成白色沉淀,发生Cl﹣+Ag+=AgCl↓,
故答案为:生成白色沉淀;Cl﹣;Cl﹣+Ag+=AgCl↓;(3)氯气与水发生Cl2+H2O HCl+HClO,具有酸性,向氯水中滴加石蕊试液,溶液变红,由于次氯酸具有漂白性,则加入试纸最终变为无色,
故答案为:H+;HClO.
【分析】将氯气溶于水得到氯水(浅黄绿色),氯气与水发生Cl2+H2O HCl+HClO,氯水含多种微粒,有H2O、Cl2、HClO、Cl﹣、H+、OH﹣(极少量,水微弱电离出来的),结合对应的粒子的性质解答该题.
19.【答案】(1)2Na + 2H2O = 2NaOH + H2↑
(2)2Na2O2 + 2H2O = 4NaOH + O2↑
(3)2NaOH + Cl2 = H2O+ NaCl + NaClO
(4)H2O + Cl2 =HCl + HClO
【解析】【解答】(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na + 2H2O = 2NaOH + H2↑,故答案为:2Na + 2H2O = 2NaOH + H2↑;
(2)Na2O2与水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2 + 2H2O = 4NaOH + O2↑,故答案为:2Na2O2 + 2H2O = 4NaOH + O2↑;
(3)Cl2与NaOH溶液反应生成氯化钠和次氯酸钠、以及水,反应的化学方程式为2NaOH + Cl2 = H2O+ NaCl + NaClO,故答案为:2NaOH + Cl2 = H2O+ NaCl + NaClO;
(4)Cl2与水反应生成盐酸和次氯酸,反应的化学方程式为H2O + Cl2 =HCl + HClO,故答案为:H2O + Cl2 =HCl + HClO。
【分析】(1)钠与水反应生成NaOH和H2,据此写出反应的化学方程式;
(2)Na2O2与H2O反应生成NaOH和O2,据此写出反应的化学方程式;
(3)Cl2与NaOH溶液反应生成NaCl、NaClO和H2O,据此写出反应的化学方程式;
(4)Cl2与H2O反应生成HCl和HClO,据此写出反应的化学方程式;
20.【答案】(1)分液漏斗
(2)Cl2+H2O=HCl+HClO;C
(3)Cl2+2KI=I2+2KCl
(4)干燥氯气;防止氯化铁堵塞后面的导管
(5)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】【解答】解:(1)依据仪器形状可知:装置A盛放浓盐酸的为分液漏斗;
故答案为:分液漏斗;(2)氯气通入C水中生成HCl和HClO,其反应的方程式为:Cl2+H2O=HCl+HClO;HCl在溶液中完全电离出H+、Cl﹣,HClO在溶液中部分电离出H+、ClO﹣,所以氯水中含有的微粒为Cl2、HClO、H+、Cl﹣、ClO﹣;
故答案为:Cl2+H2O=HCl+HClO;C;(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,反应方程式:Cl2+2KI=I2+2KCl,碘遇到淀粉变蓝;
故答案为:Cl2+2KI=I2+2KCl;(3)制取的氯气中含有水蒸气,Fe与干燥的氯气反应,要得到干燥氯气,应除去氯气中的水蒸气,浓硫酸具有吸水性,能够干燥氯气;生成的氯化铁易堵塞导管,双通管F中加玻璃纤维可以防止氯化铁进入后面的导管,引起导管堵塞;
故答案为:干燥氯气;防止氯化铁堵塞后面的导管;(4)氯气有毒,要进行尾气处理,用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:吸收尾气中的氯气;Cl2+2NaOH=NaCl+NaClO+H2O.
【分析】A中的浓盐酸与B中的二氧化锰在加热条件下反应生成氯气,氯气通入C水中生成HCl和HClO,氯气进入D中与KI反应生成单质碘,再进入E通过浓硫酸干燥,在F中与Fe反应生成氯化铁,G中干燥剂可以防止H中的水蒸气进入F中,最后H中NaOH溶液用于吸收多余的氯气;(1)依据仪器形状说出其名称;(2)氯气通入C水中生成HCl和HClO,根据HCl和HClO的电离分析;(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘;生成的氯化铁易堵塞导管;(4)制取的氯气中含有水蒸气,要得到干燥氯气,应除去氯气中的水蒸气;(5)氯气有毒,要进行尾气处理;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水
21.【答案】(1)浓盐酸;MnO2;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;MnO2
(2)饱和食盐水;吸水氯气中的水蒸气
(3)干燥的红色布条不褪色;棕黄色的烟;Cu+Cl2 CuCl2;防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管
(4)NaOH溶液
(5)先①后②
【解析】【解答】(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,A中是浓盐酸,B中是二氧化锰固体,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;反应中Mn元素化合价降低,得到电子,二氧化锰是氧化剂;
(2)生成的氯气中含有氯化氢和水蒸气,可以用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;
(3)E是收集氯气并检验氯气是否具有漂白性的实验装置,氯气无漂白性,干燥的有色布条不褪色;F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,反应的化学方程式为Cu+Cl2 CuCl2;脱脂棉的主要作用是防止固体氯化铜小颗粒进入导气管堵塞导管;
(4)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(5)铜在加热的条件下易与空气反应,因此酒精灯需要先点燃①处生成氯气充满装置②后,再点燃②处酒精灯,以防止铜和空气中的氧气反应。
【分析】根据实验室中制取氯气的反应原理、氯气的除杂和干燥以及尾气处理,结合氯气的化学性质和反映的现象等进行回答即可.
一、单选题
1.游泳池是公共场合,必须保持用水的清洁卫生,游泳池中的水常用漂白粉消毒,漂白粉的有效成分是( )
A.CaCl2 B.Ca(ClO)2 C.Ca(OH)2 D.HClO
2.下列关于氯水的说法不正确的是( )
A.向氯水中滴入溶液,产生气泡说明氯水中含有
B.氯水应用棕色试剂瓶避光保存
C.氯水放置一段时间后酸性增强
D.新制氯水具有漂白性是因为含有
3.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸
C.氯化钙溶液 D.二氧化硫水溶液
4.下列化合物不能由单质直接化合而成的是( )
A.CuCl2 B.FeCl2 C.NaCl D.HCl
5.用氯气跟单质化合不能制取的物质是( )
A.KCl B.FeCl2 C.FeCl3 D.CuCl2
6.将Cl2通入过量石灰乳[Ca(OH)2]中即可制得以Ca(ClO)2为有效成分的漂白粉。下列解释事实的方程式中,不正确的是( )
A.生成Ca(ClO)2:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
B.漂白粉溶液与盐酸混合产生Cl2:ClO﹣+Cl﹣+2H+=Cl2↑+H2O
C.漂白粉溶液吸收CO2后产生白色沉淀:Ca2++CO2+H2O=CaCO3↓+2H+
D.漂白粉溶液加入适量醋酸在短时间内能达到漂白效果:Ca(OH)2+2CH3COOH=Ca(CH3COO)2+2H2O、Ca(ClO)2+2CH3COOH=Ca(CH3COO)2+2HClO
7.在空气中久置而不易变质的物质是( )
A.过氧化钠 B.纯碱 C.漂粉精 D.氯水
8.下列既能由金属和氯气直接制取,又能由金属和盐酸直接制取的是( )
A.FeCl2 B.NaCl C.FeCl3 D.CuCl2
9.有些地方的自来水用氯气消毒,某学生用这种自来水配制下列溶液,不会使药品变质的是( )
A. 溶液 B. 溶液 C. 溶液 D.盐酸
10.用氯气和绿矾处理水,下列说法错误的是( )
A.氯气起杀菌消毒作用 B.氯气氧化绿矾
C.绿矾具有净水作用 D.绿矾的氧化产物具有净水作用
11.氯水中存在多种分子和离子,不同的反应中表现出不同的性质。下列结论正确的是( )
A.加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B.将紫色石蕊溶液滴加到氯水中,溶液变先变红后褪色,说明有H+和HClO存在
C.先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.将氯水加入到含有酚酞的NaOH溶液中,红色褪去,说明有HClO的存在
12.已知 (浓) (未配平).如图 是浸有相关溶液的滤纸,向 晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.下列有关说法错误的是( )
A.a处变蓝、b处变棕红,说明非金属性: 、
B.d处立即褪色是因为 的漂白作用,e处变红可用于检验
C.c处先变红后褪色说明 与 反应生成 和
D.已知反应中氧化剂与还原剂的物质的量之比为
13.在给定条件下,下列选项所示物质间转化均能实现的是( )
A.Al H2 B.CuO Cu(OH)2
C.Cl2 FeCl2 D.NaCl溶液 单质Na
14.下列实验操作、现象及实验结论相对应且正确的是( )
选项 实验操作 现象 实验结论
A 将干燥的充入放有鲜花的集气瓶中 鲜花褪色 具有漂白性
B 将加入无色酚酞溶液中 酚酞变红后不褪色 生成了碱性物质
C 用铂丝蘸取某溶液置于酒精灯外焰上灼烧 火焰呈黄色 该溶液中含元素
D 某气体通入淀粉-溶液中 淀粉变蓝 该气体一定为
A.A B.B C.C D.D
15.下列有关氯气实验现象的记录正确的是( )
A.纯净的氢气在氯气中安静燃烧,发出苍白色火焰
B.钠可以在氯气中燃烧,发出黄色火焰,生成黄色固体
C.用pH试纸检验干燥的氯气,试纸先变红后褪色
D.新制的氯水是由氯气溶于水形成的无色透明溶液
16.化学与生活密切相关,下列有关物质叙述正确的是( )
A.过氧化钠是碱性氧化物,可以用来杀菌消毒
B.碳酸钠在医疗上是治疗胃酸过多的一种药剂
C.工业上通常以氯气和澄清石灰水为原料制造漂白粉
D.氯气有毒,但可用于药物的合成
二、综合题
17.高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)制备氯气选用的药品为高锰酸钾和浓盐酸,相应的离子方程式为
(2)装置B的作用是 ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 (选“a”“b”或“c”).
a b c
Ⅰ 干燥的有色布条 湿润的有色布条 湿润的有色布条
Ⅱ 碱石灰 浓硫酸 无水氯化钙
Ⅲ 湿润的有色布条 干燥的有色布条 干燥的有色布条
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是 .该现象 (填“能”或“不能”)说明溴的非金属性强于碘.
18.在新制的氯水参加的反应中,有如下几种情况:
(1)向FeCl2和KSCN的混合溶液中加入氯水,现象是 ,氯水中起作用的 主要微粒是 ,反应的离子方程式是 .
(2)向AgNO3溶液中加入氯水,现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 .
(3)向氯水中滴加石蕊试液,溶液变红,起作用的微粒是 ,然后又褪色,起作用的微粒是 .
19.写出下列反应的化学方程式
(1)钠与水反应 ;
(2)Na2O2与水反应 ;
(3)Cl2与NaOH溶液反应 ;
(4)Cl2与水反应 。
20.实验室用浓盐酸与二氧化锰固体加热反应来制备氯气,某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题:
(1)仪器A的名称是 .
(2)C中反应的化学方程式为 ,所得溶液除水分子外,还含有的分子和离子中正确的是 .
A.Cl2、HCl、HClO、H+、Cl﹣ B.Cl2、Mn2+、HClO、H+、Cl﹣
C.Cl2、HClO、H+、Cl﹣、ClO﹣ D.Cl2、HCl、HClO、H+、Mn2+
(3)实验中观察到D溶液变蓝色,写出D中发生反应的化学方程式为 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.E中浓硫酸的作用是 ,双通管F中玻璃纤维(不参与反应)的作用是 .
(5)H中盛有NaOH溶液,发生反应的化学方程式为 .
21.下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
试回答:
(1)A中所放试剂为 ,B中所放试剂为 ,二者反应的化学方程式为 ,该反应中的氧化剂是 ;
(2)C中试剂是 ;D中试剂的作用是 ;
(3)E中现象是 ; F中现象是 ,其反应的化学方程式为 ;F管中脱脂棉的作用是
(4)H中试剂为 ;
(5)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是 (用①或②填写)。
答案解析部分
1.【答案】B
【解析】【解答】漂白粉是次氯酸钙和氯化钙组成的混合物,其中有效成分是次氯酸钙,
故答案为:B。
【分析】根据漂白粉的主要成分和有效成分进行判断即可。
2.【答案】D
【解析】【解答】A.氯水中含有H+,能和
溶液反应生成CO2,A项不符合题意;
B.氯水中含有次氯酸,次氯酸见光分解生成HCl和O2,故氯水应用棕色试剂瓶避光保存,B项不符合题意;
C.氯水中含有次氯酸,次氯酸见光分解生成HCl和O2,溶液酸性增强,C项不符合题意;
D.新制氯水具有漂白性是因为含有HClO,D项符合题意;
故答案为:D。
【分析】A.氯水中含有H+,能和碳酸根反应产生气泡;
B.氯水中含有次氯酸,次氯酸见光分解,所以应该避光保存,可用棕色试剂瓶;
C.氯水放置一段时间后,氯水中的次氯酸分解为氯化氢,氯化氢溶于水后使得酸性增强;
D.新制氯水中含有次氯酸,次氯酸使其具备了漂白作用。
3.【答案】A
【解析】【解答】在氯水中存在反应Cl2+H2O H++Cl﹣+HClO,若反应使溶液中次氯酸浓度增大,则溶液漂白性会增强,
A.由于酸性HCl>H2CO3>HClO,向溶液中加入碳酸钙粉末反应反应2HCl+CaCO3=CaCl2+CO2↑+H2O,使化学平衡正向进行,导致次氯酸浓度增大,溶液漂白性增强,故A正确;
B.加入稀硫酸使溶液中氢离子浓度增大平衡逆向进行,次氯酸浓度减小,溶液漂白性减弱,故B错误;
C.加入氯化钙溶液不发生反应,溶液对氯水起到稀释作用,平衡正向进行但次氯酸浓度减小,漂白性减弱,故C错误;
D.加入二氧化硫的水溶液,二氧化硫有还原性,能被氯气氧化,平衡逆向进行,次氯酸浓度减小,漂白性减弱,故D错误;
故选A.
【分析】本题考查了氯气、次氯酸、氯水性质的分析,要求掌握化学平衡影响因素,掌握基础是解题关键,题目较简单.
4.【答案】B
【解析】【解答】A.CuCl2可由铜与氯气反应生成氯化铜,A与题意不符;
B.铁与氯气反应只能生成FeCl3,B符合题意;
C.NaCl可由钠与氯气反应生成氯化钠,C与题意不符;
D.HCl可由氢气与氯气反应生成氯化氢,D与题意不符;
答案为B。
【分析】
A.可由铜与氯气燃烧得到;
B.不可由铁单质化合生成,只能生成三价铁;
C.钠和氯气燃烧得到;
D.氢气和氯气燃烧得到。
5.【答案】B
【解析】【解答】解:A.K与氯气化合生成KCl,故A不选;
B.Fe与氯气化合生成FeCl3,故B选;
C.Fe与氯气化合生成FeCl3,故C不选;
D.Cu与氯气化合生成CuCl2,故D不选;
故选B.
【分析】氯气具有强氧化性,与变价金属反应生成高价金属氯化物,以此来解答.
6.【答案】C
【解析】【解答】A.将Cl2通入过量石灰乳[Ca(OH)2]中,发生氧化还原反应,生成Ca(ClO)2、CaCl2和H2O,其化学方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,故A不符合题意;
B.漂白粉溶液与盐酸混合,氯离子和次氯酸根离子在酸性溶液中发生氧化还原反应生成氯气和H2O,其离子方程式为ClO﹣+Cl﹣+2H+=Cl2↑+H2O,故B不符合题意;
C.漂白粉溶液中吸收二氧化碳反应生成碳酸钙和次氯酸,HClO是弱酸,在离子方程式中不能拆开,其反应的离子方程式为Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO,故C符合题意;
D.漂白粉溶液加入适量醋酸,会发生Ca(OH)2+2CH3COOH=Ca(CH3COO)2+2H2O、Ca(ClO)2+2CH3COOH=Ca(CH3COO)2+2HClO,在短时间内HClO的浓度增大,能提高其漂白效率,故D不符合题意;
故答案为C。
【分析】A.氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
B.漂白粉溶液与盐酸混合,发生氯元素的归中反应,产生Cl2;
C.漂白粉溶液吸收CO2后产生白色沉淀和次氯酸,次氯酸是弱酸;
D.将Cl2通入过量石灰乳[Ca(OH)2]中即可制得以Ca(ClO)2为有效成分的漂白粉,加入醋酸和氢氧化钙、次氯酸钙反应。
7.【答案】B
【解析】【解答】解:A.过氧化钠能与空气中的二氧化碳生成碳酸钠,和水反应氢氧化钠,所以在空气中久置会变质,故A错误;
B.碳酸钠在空气中基本无变化,即纯碱久置不易变质,故B正确;
C.次氯酸的酸性小于碳酸,所以漂白粉中次氯酸钠易和二氧化碳、水反应生成次氯酸而变质,故C错误;
D.氯水中的次氯酸能分解产生盐酸和氧气,在空气中易变质,故D错误;
故选B.
【分析】A.过氧化钠能与空气中的二氧化碳生成碳酸钠,和水反应氢氧化钠;
B.碳酸钠在空气中基本无变化;
C.次氯酸的酸性小于碳酸,所以漂白粉中次氯酸钠易和二氧化碳、水反应生成次氯酸而变质;
D.氯水中的次氯酸能分解产生盐酸和氧气.
8.【答案】B
【解析】【解答】A. Fe与Cl2反应生成FeCl3,Fe与盐酸反应生成FeCl2和H2,与题意不符,故A不选;
B. Na与Cl2反应生成NaCl,Na与盐酸反应生成NaCl和H2,与题意相符,故B选;
C. Fe与Cl2反应生成FeCl3,Fe与盐酸反应生成FeCl2和H2,与题意不符,故C不选;
D. Cu与Cl2反应生成CuCl2,Cu与盐酸不反应,与题意不符,故D不选;
故答案为:B。
【分析】A、Fe与Cl2在点燃条件下反应生成FeCl3;
B、Na与Cl2在点燃条件下反应生成NaCl;
C、Fe与Cl2在点燃条件下反应生成FeCl3;
D、Cu与Cl2在点燃条件下反应生成CuCl2;
9.【答案】D
【解析】【解答】氯气消毒过的自来水中含有Cl-、H+、 Cl2 、 HClO 等微粒,
A.NaOH和自来水中溶解的氯气产生次氯酸钠,能发生如下反应:Cl2+2NaOH=NaCl+NaClO+H2O,使相应的药品变质,故A不符合题意;
B.硝酸银和氯离子反应产生氯化银白色沉淀,使相应的药品变质,故B不符合题意;
C.Na2CO3能与氯水中的H+反应,产生无色无味气体(CO2)或生成碳酸氢钠,使相应的药品变质,故C不符合题意;
D.盐酸与氯水不反应,自来水中少量的 HClO 见光会分解为HCl,配制的溶液不会变质,故D符合题意;
故答案为:D。
【分析】A、根据自来水中含有H+、HClO能够与氢氧化钠反应解答;
B、根据自来水中含有Cl-能够与硝酸银溶液反应生成氯化银白色沉淀解答;
C、根据自来水中含有H+,能够与碳酸钠反应生成碳酸氢钠解答;
D、根据根据自来水中含有Cl-、H+、HClO,次氯酸见光分解生成盐酸解答;
10.【答案】C
【解析】【解答】A.氯气与水反应生成次氯酸,次氯酸具有杀菌消毒作用,所以可以用适量氯气杀菌消毒,故A正确;
B.绿矾中二价铁离子具有还原性,氯气能够氧化二价铁离子生成三价铁,故B正确;
C.绿矾水解生成氢氧化亚铁不稳定,极易被氧化生成氢氧化铁,所以明绿不具有净水作用,故C错误;
D.绿矾的氧化产物为硫酸铁,硫酸铁中三价铁水解生成氢氧化铁胶体,具有吸附性,能够净水,故D正确;
故选:C.
【分析】A.氯气与水反应生成次氯酸,次氯酸具有杀菌消毒作用;
B.绿矾中二价铁离子具有还原性,氯气能够氧化二价铁离子生成三价铁;
C.绿矾水解生成氢氧化亚铁不稳定,极易被氧化生成氢氧化铁;
D.氢氧化铁胶体具有吸附性,能够净水.
11.【答案】B
【解析】【解答】氯气与水反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
A.氯水中的HClO具有漂白性,向氯水中加入有色布条,片刻后有色布条褪色,可说明有HClO存在,故A不符合题意;
B.向氯水中加入紫色石蕊试液,因溶液中存在H+,会使溶液变红,而HClO具有漂白性,能够使红色褪色,因此溶液先变红后褪色,说明有H+和HClO存在,故B符合题意;
C.先加入盐酸酸化,引入Cl-,不可说明原溶液中有Cl-存在,故C不符合题意;
D.加入NaOH溶液,氯水的浅黄绿色消失的原因是氯气与氢氧化钠发生反应生成无色的氯化钠和次氯酸钠,并不能说明有HClO存在,故D不符合题意;
故答案为:B。
【分析】氯气溶于水生成氯化氢和次氯酸,次氯酸具有漂白性;
A、布条褪色时因为含有次氯酸;
B、次氯酸和氯化氢具有酸性,次氯酸还具有漂白性;
C、鉴别Cl-:滴加稀硝酸和硝酸银溶液;
D、次氯酸和氯化氢都是酸。
12.【答案】B
【解析】【解答】A.Cl2和碘化钾反应:Cl2+2NaI=2NaCl+I2,碘遇淀粉变蓝,该反应说明Cl2的氧化性强于I2,非金属性:Cl>I;Cl2和NaBr反应:Cl2+2NaBr=2NaCl+Br2,说明Cl2的氧化性强于Br2,非金属性:Cl>Br,故A不符合题意;
B.e处变红是氯气把Fe2+氧化为Fe3+,Fe3+遇KSCN变红,可以检验Fe2+;氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性,d处立即褪色可能的原因是次氯酸氧化了酚酞,也可能是氯气和NaOH溶液反应,需要通过实验验证,故B符合题意;
C.Cl2 与 H2O 反应生成 HCl 和 HClO,所以c处先变红后褪色,故C不符合题意;
D.根据电子守恒配平反应:K2Cr2O7+14HCl (浓) = 3Cl2↑+2CrCl3+2KCl+7H2O,反应中氧化剂为K2Cr2O7,还原剂为HCl,参加反应的14molHCl中只有6mol发生了化合价的变化,故氧化剂和还原剂的物质的量之比为 1:6 ,故D不符合题意;
故答案为:B。
【分析】A.a处变蓝色,说明有碘单质生成,b处变棕红,说明有溴单质生成
B.氯气可以与氢氧化钠反应,可能造成褪色,也有可能是氯气和水反应生成次氯酸具有氧化性,e处变红可以说明有铁离子,因为具有氯气,说明可以用来检验亚铁离子
C.氯气和水反应生成盐酸和次氯酸,盐酸显酸性,变红,次氯酸具有氧化性,褪色
D.将方程式配平K2Cr2O7+14HCl (浓) = 3Cl2↑+2CrCl3+2KCl+7H2O,扽出氧化剂与还原剂物质的量比为1:6
13.【答案】A
【解析】【解答】A.Al能够与NaOH溶液反应生成H2,物质间转化能实现,故A选;
B.CuO难溶于水,与水不反应,所以CuO与水不能反应生成Cu(OH)2,故B不选;
C.铁在氯气中燃烧生成FeCl3,不生成FeCl2,故C不选;
D.电解氯化钠溶液生成氢氧化钠、氢气和氯气,得不到Na,电解熔融的氯化钠可以生成Na,故D不选;
故答案为:A。
【分析】A.Al是一种两性金属,能与NaOH溶液反应生成H2;
B.CuO与H2O不反应;
C.Cl2与Fe点燃条件下反应生成FeCl3;
D.电解NaCl溶液,得到NaOH、Cl2和H2;
14.【答案】C
【解析】【解答】A.氯气和水反应能生成具有漂白性的次氯酸,鲜花中有水分,将干燥的 Cl2 充入放有鲜花的集气瓶中,鲜花褪色,能说明HClO有漂白性,Cl2不具有漂白性,故A不符合题意;
B.将 Na2O2 加入无色酚酞溶液中,Na2O2和水反应生成NaOH和H2O2,NaOH溶液能使酚酞变红,H2O2有漂白性,能使溶液褪色,故B不符合题意;
C.钠的焰色是黄色,用铂丝蘸取某溶液置于酒精灯外焰上灼烧,火焰呈黄色,该溶液中含 Na 元素,故C符合题意;
D.某气体通入淀粉- KI 溶液中,淀粉变蓝,说明该气体有氧化性,该气体将KI氧化为I2,I2遇淀粉变蓝,具有氧化性的气体不一定为 Cl2,还可以是NO2等,故D不符合题意;
故答案为:C。
【分析】A.氯气不具有漂白性;
B.过氧化钠和水的反应分为两步,第一步为过氧化钠和水生成氢氧化钠和过氧化氢,过氧化氢不稳定,又分解生成水和氧气;
C.钠的焰色反应为黄色;
D.淀粉变蓝说明该气体具有氧化性,但不一定为氯气。
15.【答案】A
【解析】【解答】A.纯净的H2可以在黄绿色的Cl2中安静燃烧,发出苍白色火焰,生成氯化氢(HCl)气体,即H2+Cl2 2HCl,故A符合题意;
B.钠可以在氯气中燃烧,生成氯化钠,氯化钠是白色固体,即2Na+Cl2 2NaCl,故B不符合题意;
C.干燥氯气不能使pH试纸先变红后褪色,含水蒸气的氯气,氯气和水反应生成盐酸和次氯酸,使pH试纸先变红后褪色,故C不符合题意;
D.新制的氯水是由氯气溶于水形成的,新制的氯水中含氯气分子,溶液呈浅黄绿色,故D不符合题意;
答案为A。
【分析】A.氢气在氯气中燃烧,产生苍白色火焰;
B.钠在氯气中燃烧,生成白色固体;
C.干燥的氯气不能使pH试纸变色;
D.新制氯水由于溶解有氯气,呈现浅黄绿色;
16.【答案】D
【解析】【解答】A.过氧化钠不是碱性氧化物,但其具有强氧化性,可用来杀菌消毒,A不符合题意;
B.碳酸氢钠是医疗上疗胃酸过多的一种药剂,B不符合题意;
C.工业上通常以氯气和石灰乳为原料制造漂白粉,C不符合题意;
D.氯气有毒,但可用于药物的合成,D符合题意;
故答案为:D。
【分析】A.过氧化钠具有强氧化性,能使蛋白质变性,过氧化钠不是碱性氧化物;
B.碳酸钠碱性较强,不能用于治疗胃酸过多;
D.工业上将氯气通入石灰乳中制造漂白粉。
17.【答案】(1)2MnO4﹣+16H++10Cl﹣═2Mn2++5Cl2↑+8H2O
(2)除杂和安全瓶;锥形瓶中的液面下降,长颈漏斗中的液面上升
(3)c
(4)E中溶液分为两层,上层(苯层)为紫红色;不能
【解析】【解答】(1)高锰酸钾与浓盐酸反应的离子方程式为:2MnO4﹣+16H++10Cl﹣═2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4﹣+16H++10Cl﹣═2Mn2++5Cl2↑+8H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,锥形瓶中液面下降,长颈漏斗中液面上升;
故答案为:除杂和安全瓶;锥形瓶中的液面下降,长颈漏斗中的液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中ab的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,故选c;
(4)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡;观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,所以该现象不能说明溴的非金属性强于碘;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;不能.
【分析】(1)高锰酸钾具有强的氧化性,与浓盐酸反应生成氯化锰、氯化钾、氯气和水;
(2)反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,振荡分层,苯层在上层;氯气具有强氧化性;由于过量的氯气也能够氧化碘离子,无法说明溴单质氧化性强于碘单质.
18.【答案】(1)溶液变红色;Cl2;Cl2+2Fe2+=2Fe2++2Cl﹣
(2)生成白色沉淀;Cl﹣;Cl﹣+Ag+=AgCl↓
(3)H+;HClO
【解析】【解答】解:氯水含有H2O、Cl2、HClO、Cl﹣、H+、OH﹣,(1)向FeCl2和KSCN的混合溶液中加入氯水,氯气把亚铁离子氧化为三价铁离子,所以溶液变红色,
故答案为:溶液变红色;Cl2;Cl2+2Fe2+=2Fe2++2Cl﹣;(2)向AgNO3溶液中加入氯水,银离子与氯离子结合生成白色沉淀,发生Cl﹣+Ag+=AgCl↓,
故答案为:生成白色沉淀;Cl﹣;Cl﹣+Ag+=AgCl↓;(3)氯气与水发生Cl2+H2O HCl+HClO,具有酸性,向氯水中滴加石蕊试液,溶液变红,由于次氯酸具有漂白性,则加入试纸最终变为无色,
故答案为:H+;HClO.
【分析】将氯气溶于水得到氯水(浅黄绿色),氯气与水发生Cl2+H2O HCl+HClO,氯水含多种微粒,有H2O、Cl2、HClO、Cl﹣、H+、OH﹣(极少量,水微弱电离出来的),结合对应的粒子的性质解答该题.
19.【答案】(1)2Na + 2H2O = 2NaOH + H2↑
(2)2Na2O2 + 2H2O = 4NaOH + O2↑
(3)2NaOH + Cl2 = H2O+ NaCl + NaClO
(4)H2O + Cl2 =HCl + HClO
【解析】【解答】(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na + 2H2O = 2NaOH + H2↑,故答案为:2Na + 2H2O = 2NaOH + H2↑;
(2)Na2O2与水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2 + 2H2O = 4NaOH + O2↑,故答案为:2Na2O2 + 2H2O = 4NaOH + O2↑;
(3)Cl2与NaOH溶液反应生成氯化钠和次氯酸钠、以及水,反应的化学方程式为2NaOH + Cl2 = H2O+ NaCl + NaClO,故答案为:2NaOH + Cl2 = H2O+ NaCl + NaClO;
(4)Cl2与水反应生成盐酸和次氯酸,反应的化学方程式为H2O + Cl2 =HCl + HClO,故答案为:H2O + Cl2 =HCl + HClO。
【分析】(1)钠与水反应生成NaOH和H2,据此写出反应的化学方程式;
(2)Na2O2与H2O反应生成NaOH和O2,据此写出反应的化学方程式;
(3)Cl2与NaOH溶液反应生成NaCl、NaClO和H2O,据此写出反应的化学方程式;
(4)Cl2与H2O反应生成HCl和HClO,据此写出反应的化学方程式;
20.【答案】(1)分液漏斗
(2)Cl2+H2O=HCl+HClO;C
(3)Cl2+2KI=I2+2KCl
(4)干燥氯气;防止氯化铁堵塞后面的导管
(5)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】【解答】解:(1)依据仪器形状可知:装置A盛放浓盐酸的为分液漏斗;
故答案为:分液漏斗;(2)氯气通入C水中生成HCl和HClO,其反应的方程式为:Cl2+H2O=HCl+HClO;HCl在溶液中完全电离出H+、Cl﹣,HClO在溶液中部分电离出H+、ClO﹣,所以氯水中含有的微粒为Cl2、HClO、H+、Cl﹣、ClO﹣;
故答案为:Cl2+H2O=HCl+HClO;C;(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,反应方程式:Cl2+2KI=I2+2KCl,碘遇到淀粉变蓝;
故答案为:Cl2+2KI=I2+2KCl;(3)制取的氯气中含有水蒸气,Fe与干燥的氯气反应,要得到干燥氯气,应除去氯气中的水蒸气,浓硫酸具有吸水性,能够干燥氯气;生成的氯化铁易堵塞导管,双通管F中加玻璃纤维可以防止氯化铁进入后面的导管,引起导管堵塞;
故答案为:干燥氯气;防止氯化铁堵塞后面的导管;(4)氯气有毒,要进行尾气处理,用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:吸收尾气中的氯气;Cl2+2NaOH=NaCl+NaClO+H2O.
【分析】A中的浓盐酸与B中的二氧化锰在加热条件下反应生成氯气,氯气通入C水中生成HCl和HClO,氯气进入D中与KI反应生成单质碘,再进入E通过浓硫酸干燥,在F中与Fe反应生成氯化铁,G中干燥剂可以防止H中的水蒸气进入F中,最后H中NaOH溶液用于吸收多余的氯气;(1)依据仪器形状说出其名称;(2)氯气通入C水中生成HCl和HClO,根据HCl和HClO的电离分析;(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘;生成的氯化铁易堵塞导管;(4)制取的氯气中含有水蒸气,要得到干燥氯气,应除去氯气中的水蒸气;(5)氯气有毒,要进行尾气处理;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水
21.【答案】(1)浓盐酸;MnO2;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;MnO2
(2)饱和食盐水;吸水氯气中的水蒸气
(3)干燥的红色布条不褪色;棕黄色的烟;Cu+Cl2 CuCl2;防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管
(4)NaOH溶液
(5)先①后②
【解析】【解答】(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,A中是浓盐酸,B中是二氧化锰固体,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;反应中Mn元素化合价降低,得到电子,二氧化锰是氧化剂;
(2)生成的氯气中含有氯化氢和水蒸气,可以用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;
(3)E是收集氯气并检验氯气是否具有漂白性的实验装置,氯气无漂白性,干燥的有色布条不褪色;F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,反应的化学方程式为Cu+Cl2 CuCl2;脱脂棉的主要作用是防止固体氯化铜小颗粒进入导气管堵塞导管;
(4)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(5)铜在加热的条件下易与空气反应,因此酒精灯需要先点燃①处生成氯气充满装置②后,再点燃②处酒精灯,以防止铜和空气中的氧气反应。
【分析】根据实验室中制取氯气的反应原理、氯气的除杂和干燥以及尾气处理,结合氯气的化学性质和反映的现象等进行回答即可.
