第1章 认识化学科学 测试题(含解析)2023-2024学年高一上学期鲁科版(2019)化学必修第一册
文档属性
| 名称 | 第1章 认识化学科学 测试题(含解析)2023-2024学年高一上学期鲁科版(2019)化学必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 162.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 13:23:55 | ||
图片预览



文档简介
第1章 认识化学科学 测试题
一、单选题
1.0.5L1mol·L-1的FeCl3溶液与0.2L1mol·L-1的KCl溶液中,Cl-浓度之比为( )
A.15:2 B.1:1 C.3:1 D.1:3
2.mg气体A和ng气体B的分子数相等,下列说法错误的是( )
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为n: m
C.同温同压时气体A和气体B的密度比为n:m
D.标况时,等质量的A和B气体的体积比为n:m
3.NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.12g金刚石中含有化学键的数目为4NA
B.7.2gCaO2中含有的阴离子数为0.2NA
C.标准状况下,11.2L甲烷和乙烯混合气体中所含氢原子总数为2NA
D.1mol/LMgCl2溶液中,含有Cl-的数目为2NA
4.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.pH=1的H3PO4溶液中,含有0.1NA个H+
B.14g乙烯和丙烯混合气体中氢原子数为2NA
C.标准状况下,2.24LCCl4含有的共价键为0.4 NA
D.0.1L0.5mol/LCH3COOH 溶液中含有的H数为0.05 NA
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.4℃时,18g 21H2168O中含有电子数为10NA
B.在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA
C.常温下,1L0.1mol L﹣1的NH4NO3溶液中所含氮原子数为0.2 NA
D.标准状况下,22.4 L的CCl4中C﹣Cl键数为4NA
6.下列关于配制一定物质的量浓度的溶液说法正确的是( )
A.将NaCl固体置于托盘天平右盘称量:左盘砝码(8g)和游码(0.6g)读数的和为8.6g
B.容量瓶上标有刻度线、温度和浓度,使用前要事先检查是否漏水
C.配制一定物质的量浓度的溶液用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管
D.配制1L0.2mol/L的H2SO4溶液,定容时仰视刻度线操作,则配出浓度偏高
7.下面关于金属钠的描述不正确的是( )
A.钠的化学性质很活泼,在自然界中不能以游离态存在
B.钠是电和热的良导体
C.将一块钠放置在空气中最终会变成NaOH
D.钠和钾的合金于室温下呈液态,可做原子反应堆的导热剂
8.关于Na2O和Na2O2的叙述正确的是( )
A.都是白色的固体 B.都能和水反应形成强碱溶液
C.都是碱性氧化物 D.焰色反应的颜色都是紫色
9.设为阿伏加德罗常数的值。下列说法正确的是( )
A.中所含键的数目为
B.标准状况下,中含有的中子数为
C.与少量氯气反应转移电子数一定为
D.中所含离子数为
10.下列有关物理量与其相应的单位不一致的是( )
A.摩尔质量:g /mol B.气体摩尔体积:L/mol
C.物质的量浓度:L/mol D.物质的量:mol
11.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42-)=0.8mol/L,则c(K+)为( )
A.0.15 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4 mol/L
12.NA为阿伏加德罗常数的值.下列说法中,正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.4NA
D.1 L 0.1 mol L﹣1的NaHCO3溶液中HCO3﹣和CO32﹣离子数之和为0.1NA
13.下列叙述不正确的是( )
A.12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为62 g/mol
B.同温、同压、同体积的H2和A2气体的质量分别是0.2g和3.2g,则A的相对原子质量为16
C.在标准状况下,CO和CO2混合气体共33.6 L,质量为50g,则两种气体的物质的量之比为1:1
D.浓盐酸的质量分数为36.5%,密度为1.19g cm﹣3,则物质的量浓度是11.9 mol L﹣1
14.用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1L 1mol/L的盐酸中含HCl分子的数目为NA
B.1 mol Cl2与足量的铁反应转移的电子数是3 NA
C.常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA
D.标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
15.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;
③转移溶液前容量瓶内有少量蒸馏水
④定容时,俯视容量瓶的刻度线;
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①②⑤ B.①③⑤ C.③④⑤ D.②③⑤
16.为阿伏加德罗常数的值。下列说法正确的是
A.氧气中,所含分子的数目为
B.质量相等的和,所含硫原子的数目之比为
C.含有的中子数目为
D.标准状况下,个与个分子所占的体积比为
二、综合题
17.在标准状况下,将33.6L HCl气体溶于H2O中配成0.5L溶液。(要求有解题过程,无解题过程不给分)
(1)该盐酸的物质的量浓度为多少
(2)取这种盐酸100mL,稀释到500mL,所得的稀盐酸的物质的量浓度为多少
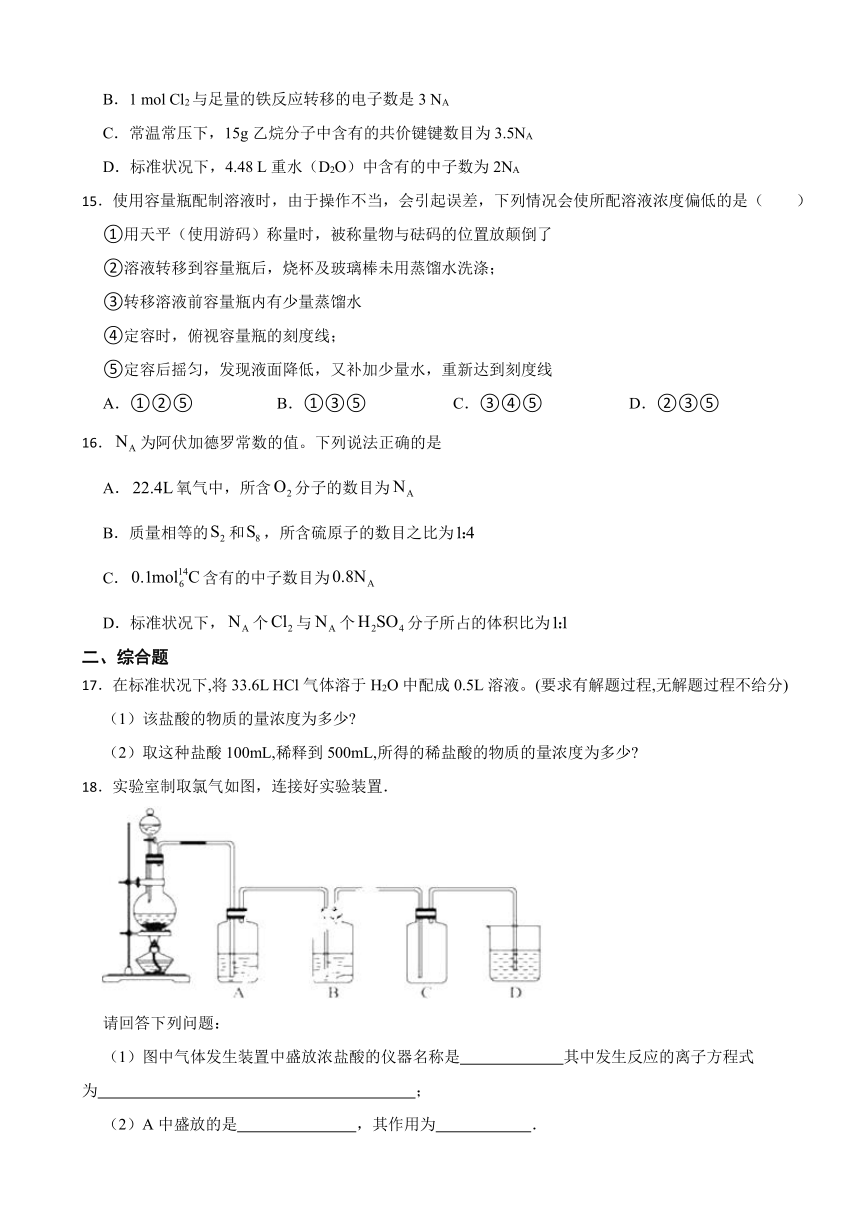
18.实验室制取氯气如图,连接好实验装置.
请回答下列问题:
(1)图中气体发生装置中盛放浓盐酸的仪器名称是 其中发生反应的离子方程式为 ;
(2)A中盛放的是 ,其作用为 .
(3)B中盛放的是 ,其作用为 .
(4)D中盛放的是 ,化学反应方程式 .
19.某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1mol L﹣1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤 (填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol L﹣1,滴定前将白醋稀释 (填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 .
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点.
重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol L﹣1).
(6)原白醋中醋酸的物质的量浓度= mol L﹣1.
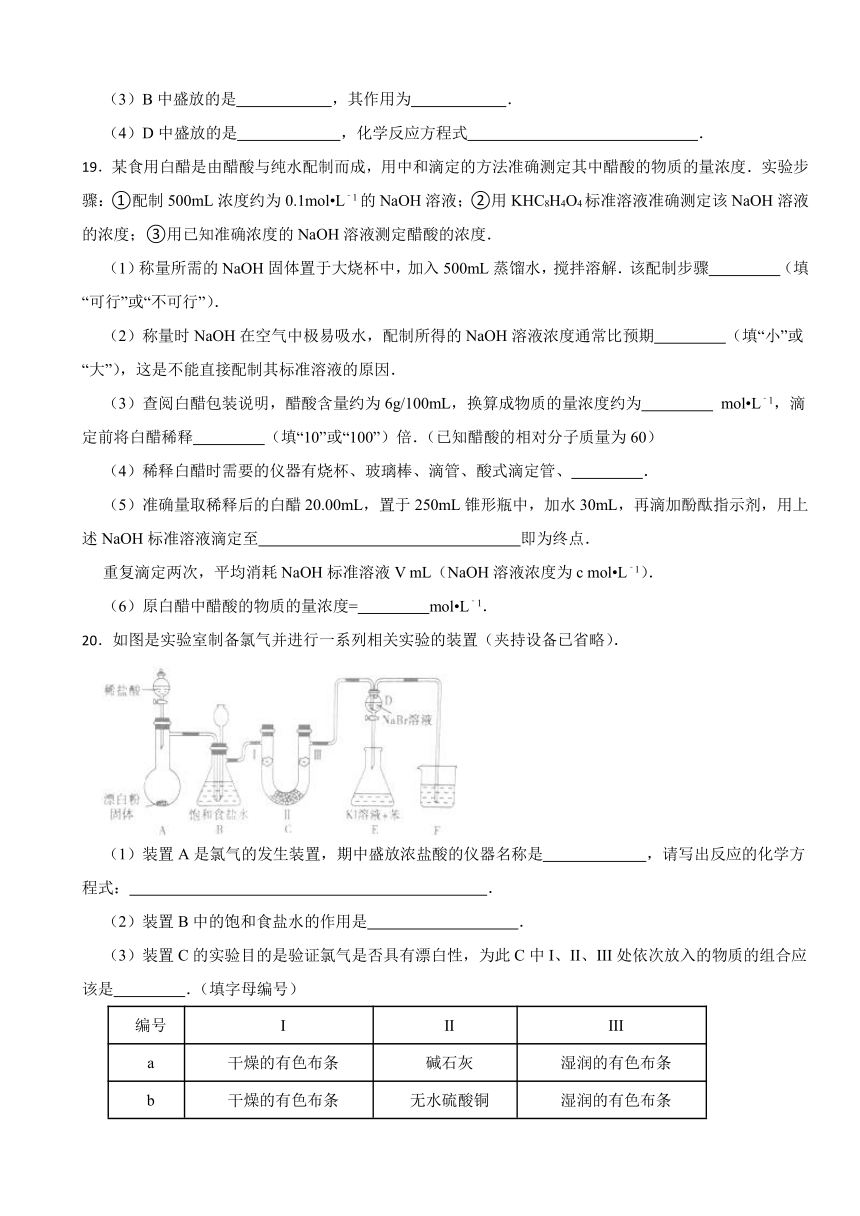
20.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略).
(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是 ,请写出反应的化学方程式: .
(2)装置B中的饱和食盐水的作用是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是 .(填字母编号)
编号 I II III
a 干燥的有色布条 碱石灰 湿润的有色布条
b 干燥的有色布条 无水硫酸铜 湿润的有色布条
c 湿润的有色布条 浓硫酸 干燥的有色布条
d 湿润的有色布条 无水氯化钙 干燥的有色布条
(4)装置F的作用是 ,其烧杯中的溶液不能选用下列中的 .
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
21.将190g MgCl2溶于水配制成1L溶液.
(1)该溶液中MgCl2的物质的量浓度为 ,溶液中Cl﹣的物质的量浓度为 .
(2)配制1mol L﹣1的MgCl2溶液500mL,需该溶液的体积为 .
(3)向(2)中500mL溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3mol L﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 ,通入HCl气体的体积(标准状况下)为 .
答案解析部分
1.【答案】C
【解析】【解答】0.5L1mol·L-1的FeCl3溶液中Cl-的物质的量浓度为1mol L-1×3=3mol L-1,0.2L1mol·L-1的KCl溶液中Cl-的物质的量浓度为1mol L-1,Cl-的物质的量浓度之比为3:1,C符合题意;
故答案为:C
【分析】结合FeCl3、KCl在水中的电离分析。
2.【答案】D
【解析】【解答】A.因气体存在的条件未知,不一定为相同条件下,则不能确定同体积的质量关系,故A不符合题意;
B.由 可知,相同质量时气体的分子数之比与摩尔质量呈反比,则相同质量的气体A和气体B的分子数之比为n:m,故B不符合题意;
C.结合 可知,同温、同压下,气体A和气体B的密度之比为m:n,故C不符合题意;
D.由 可知,相同质量的气体A和气体B的体积之比与摩尔质量呈反比,为n:m,故D符合题意
【分析】m g气体A和n g气体B所含分子数相等,则物质的量相等,二者的,摩尔质量之比为m:n
3.【答案】C
【解析】【解答】A.12g金刚石含1mol碳原子,形成共价键数目为2NA ,故A不符合题意;
B.1molCaO2含有1mol ,则7.2gCaO2中含有的阴离子数为0.1NA ,故B不符合题意;
C.0.5mol甲烷和乙烯含氢原子均为2mol,则标准状况下,11.2L甲烷和乙烯混合气体中所含氢原子总数为2NA,故C符合题意;
D.溶液体积不明确,溶液中含有的氯离子个数无法计算,故D不符合题意;
故答案为:C。
【分析】A.根据n=计算出物质的量,再根据1mol碳中含有的碳碳键即可计算
B.根据n=计算出物质的量,再根据CaO2=Ca2++O22-,即可求出阴离子的量
C.根据n=计算出物质的量,再根据分子式找出氢原子的个数即可
D.根据n=cv计算,但是体积未知,无法计算出物质的量
4.【答案】B
【解析】【解答】A.未注明溶液的体积,无法计算 pH=1的H3PO4溶液中含有的H+数目,故A错误;
B.乙烯和丙烯的最简式均为CH2,故14g混合物中含1molCH2,故含2NA个氢原子,故B正确;
C.标准状况下,四氯化碳为液体,不能使用气体摩尔体积计算,故C错误;
D.醋酸为弱电解质,部分电离,所以0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数小于0.05 NA,故D错误;
故答案为:B。
【分析】A.不能准确计算物质的量,不能确定答案;
B.现根据n=计算出物质的量,进而可得出答案;
C. CCl4 标况下不是气体,不可用公式计算;
D.现根据:n=cv计算出醋酸的物质的量,进而进行解答。
5.【答案】C
【解析】【解答】解:A、21H2168O的摩尔质量为20g/mol,故18g21H2168O的物质的量为0.9mol,故含9NA个电子,故A错误;
B、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子小于NA个,故B错误;
C、1mol硝酸铵中含2molN原子,虽然铵根离子在溶液中能水解,但根据原子守恒可知,故在1L0.1mol L﹣1的NH4NO3溶液中所含氮原子数为0.2NA,故C正确;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和C﹣Cl键个数,故D错误.
故选C.
【分析】A、21H2168O的摩尔质量为20g/mol;
B、合成氨的反应为可逆反应;
C、1mol硝酸铵中含2molN原子;
D、标况下四氯化碳为液态.
6.【答案】C
【解析】【解答】解:A.由用托盘天平称量药品时,砝码和药品放反了,已知砝码质量为8g,游码质量为0.6g,再根据左盘的质量=右盘的质量+游码的质量,即8g=药品质量+0.6g,所以药品实际质量7.4g,读出的数值比真实值大,故A错误;
B.容量瓶上标有刻度线、温度和容积,容量瓶带有活塞,使用过程中需要上下颠倒,为防止漏水,使用前要事先检查是否漏水,故B错误;
C.配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管,故C正确;
D.配制1L0.2mol/L的H2SO4溶液,定容时仰视刻度线操作,导致溶液体积偏大,依据C= 则配出浓度偏低,故D错误;
故选:C.
【分析】A.根据托盘天平称量药品时要特别注意“左物右码”,若放反时可根据左盘的质量=右盘的质量+游码的质量,得出物质质量=砝码质量﹣游码质量;
B.依据容量瓶构造及使用方法解答;
C.依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
D.定容时仰视刻度线操作,导致溶液体积偏大,依据c= 进行误差分析.
7.【答案】C
【解析】【解答】解:A.钠性质活泼,可与水、氧气等发生反应,在自然界中不能以游离态存在,故A正确;
B.钠为金属,为热和电的良导体,故B正确;
C.NaOH不稳定,最终应为碳酸钠,故C错误;
D.钠和钾的合金熔点低,常温下为液态,具有良好的导热性,可做原子反应堆的导热剂,故D正确.
故选C.
【分析】钠为活泼金属,在自然界中以化合态存在,具有良好的导热性和导电性,可用于原子反应堆的导热剂,结合氢氧化钠的性质解答该题.
8.【答案】B
【解析】【解答】解:A、Na2O是白色固体,Na2O2是淡黄色固体,颜色不同,故A错误;
B、Na2O与Na2O2与水反应都能生成氢氧化钠,氢氧化钠是强碱,故B正确;
C、因Na2O2与酸反应生成盐、水和氧气,则Na2O2不属于碱性氧化物,故C错误;
D、Na2O和Na2O2中都含有钠元素,所以焰色反应的颜色都是黄色,故D错误.
故选B.
【分析】A、Na2O是白色固体,Na2O2是淡黄色固体;
B、Na2O与水反应生成氢氧化钠,Na2O2与水反应生成氢氧化钠和氧气;
C、碱性氧化物是指能与酸反应生成盐和水的金属氧化物;
D、钠的焰色反应呈黄色.
9.【答案】A
【解析】【解答】A.单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;中含键,故中含键的数目为,A符合题意;
B.标准状况下,水不是气体,不能计算其物质的量,B不符合题意;
C.少量氯气的量未知,因此不能求转移的电子数,C不符合题意;
D.为,中含有的和的,所以所含离子数为,D不符合题意;
故答案为:A。
【分析】A.三键中含有1个σ键和2个π键;
B.标况下水不是气体,不能用气体摩尔体积计算其物质的量;
C.氯气的物质的量未知;
D.过氧化钠由钠离子和过氧根离子构成。
10.【答案】C
【解析】【解答】本题属于基础性题目,只需识记课本中的知识,选项C符合题意。物质的量浓度的单位应为“mol/L”;而“L/mol”应该是气体摩尔体积的单位。
【分析】物质的量浓度c=n/v, 单位应为“mol/L”.
11.【答案】C
【解析】【解答】氢氧根离子浓度很低,可以忽略不计,由电荷守恒可得:c(H+)+c(Al3+) 3+ c(K+)=c(SO ) 2,其中c(H+)=0.1mol/L,c(Al3+)=0.4 mol/L,c(SO )=0.8 mol/L,所以c(K+)=0.3 mol/L,C符合题意。
故答案为:C
【分析】根据整体溶液不带电,所以溶液中阴阳离子所带的电荷相等,根据电荷守恒,代入计算可得。
12.【答案】B
【解析】【解答】解:A、标况下,庚烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、NO2与N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量为n= =0.5mol,则含0.5NA个氮原子,故B正确;
C、过氧化钠与水反应时,氧元素的价态由﹣1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C错误;
D、HCO3﹣在溶液中既能水解为H2CO3又能电离为CO32﹣,根据物料守恒可知:溶液中的HCO3﹣、H2CO3、CO32﹣之和为0.1NA个,故D错误.
故选B.
【分析】A、标况下,庚烷为液态;
B、NO2与N2O4的最简式均为NO2;
C、过氧化钠与水反应时,氧元素的价态由﹣1价变为0价;
D、HCO3﹣在溶液中既能水解为H2CO3又能电离为CO32﹣;
13.【答案】C
【解析】【解答】解:A.12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,M= = =62g/mol,故A正确;
B.同温同压下,同体积的气体,质量之比等于摩尔质量之比,故0.2g:1.6g=2g/mol:M(A),解得M(A)=16g/mol,故A的相对分子质量为16,故B正确;
C.标准状况下,Vm=22.4L/mol,
n= = =1.5mol,
设CO的物质的量为x,CO2的物质的量为y,
则有:x+y=1.5 28x+44y=50
解之得:x=1mol,y=0.5mol,两种气体的物质的量之比=1:0.5=2:1,故C错误;
D.此浓盐酸的物质的量浓度为:c(HCl)= mol/L=11.9mol/L,故D正确;
故选C.
【分析】A.12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,结合M= 计算;
B.同温同压下,同体积的气体,质量之比等于摩尔质量之比,据此计算A的摩尔质量,确定A的相对分子质量;
C.根据n= 计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的物质的量分析;
D.根据溶液的物质的量浓度c= 计算出质量分数为36.5%、密度为1.20g/cm﹣3的浓盐酸的物质的量浓度
14.【答案】C
【解析】【解答】解:A、HCl溶于水后完全电离,故盐酸溶液中无HCl分子,故A错误;
B、氯气和铁反应后变为﹣1价,故1mol氯气反应后转移2NA个电子,故B错误;
C、15g乙烷的物质的量为0.5mol,而乙烷中含7条共价键,故0.5mol乙烷中含3.5NA条共价键,故C正确;
D、标况下重水为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
【分析】A、盐酸溶液中无HCl分子;
B、氯气和铁反应后变为﹣1价;
C、求出乙烷的物质的量,然后根据乙烷中含7条共价键来分析;
D、标况下重水为液体.
15.【答案】A
【解析】【解答】①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了,导致物体的实际质量偏小,浓度偏小,故符合题意;
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,因烧杯和玻璃棒上沾有溶质,溶质的质量减少,浓度偏小,故符合题意;
③转移溶液前容量瓶内有少量蒸馏水,对溶液的体积无影响,浓度不变,故不符合题意;
④定容时,俯视容量瓶的刻度线,溶液的液面比刻度线低,溶液的体积偏小,浓度偏大,故不符合题意;
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,导致加水过多溶液的体积偏大,浓度偏小,故符合题意;
故答案为:A。
【分析】配制溶液时,c=n/V,c偏小,可能是n偏小或者是v偏大
引起n偏小的原因:砝码放反,溶液在转移时未进行洗涤等等
引起v偏大的原因:定容时仰视或者加水加多了
16.【答案】C
【解析】【解答】A.没有说是标准状况,无法计算氧气物质的量,A不符合题意;
B.和的最简式是S,则等质量的和所含的硫原子数目之比为,B不符合题意;
C.1个含有8个中子,则含有的中子数目为,C符合题意;
D.标准状况下分子为液体,无法计算其体积,D不符合题意;
故答案为:C。
【分析】A、不在标准状况下无法计算;
B、结合公式n=m/M判断;
C、中子数=质量数-质子数;
D、标准状况下硫酸不是气体。
17.【答案】(1)解:该盐酸物质的量浓度为:
(2)解:稀释前后溶质物质的量不变,由稀释公式:
c(浓)·V(浓) = c(稀)·V(稀)
3 mol/L×0.1L = c(HCl)稀×0.5 L
所得稀盐酸的物质的量浓度为:c(HCl)稀=0.6mol/L
【解析】【解答】(1) 标准状况下33.6L 氯化氢气体物质的量为n =33.6L 22.4L·mol-1=1.5mol;c 0.5L= ;答案标况下, ,该盐酸物质的量浓度为: 。(2) 取这种盐酸100mL,稀释到 , 根据稀释定律,稀释前后溶质的物质的量不变,则所得的稀盐酸的物质的量浓度为c 100mL ) =0.6mol/L。
故答案为:稀释前后溶质物质的量不变,由稀释公式: c(浓)·V(浓) = c(稀)·V(稀) 3mol/L×0.1L = c(HCl)稀×0.5 L ,所得稀盐酸的物质的量浓度为:c(HCl)稀=0.6mol/L
【分析】(1)盐酸的物质的量浓度等于物质的量与体积的比值;
(2)在对浓溶液稀释的过程中,浓溶液和稀溶液的溶质的物质的量是相等的。
18.【答案】(1)圆底烧瓶;MnO2+2Cl﹣+4H+ 2H2O+Cl2↑+Mn2+
(2)饱和食盐水;除去HCl
(3)浓H2SO4;干燥Cl2
(4)NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O
【解析】【解答】解:(1)依据仪器形状可知:盛放浓盐酸的仪器为圆底烧瓶,二氧化锰、浓盐酸在加热条件下生成氯气、氯化锰和水,离子方程式为MnO2+2Cl﹣+4H+ 2H2O+Cl2↑+Mn2+故答案为:圆底烧瓶;MnO2+2Cl﹣+4H+ 2H2O+Cl2↑+Mn2+;(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气杂质,要得到纯净的氯气,需要除去氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的A除去氯气中的氯化氢;故答案为:饱和食盐水:除去HCl;(3)浓硫酸具有吸水性,能够干燥氯气;故答案为:浓H2SO4;干燥Cl2;(4)氯气有毒,直接排放到空气中能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,可以用氢氧化钠溶液吸收过量的氯气;故答案为:NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O.
【分析】实验室用加热固体二氧化锰与浓盐酸方法制取氯气,二者反应生成氯气、氯化锰和水,浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气杂质,要得到纯净的氯气,需要除去氯化氢、水蒸气,依据氯气、氯化氢在饱和食盐水溶解度不同选择合适试剂除去氯化氢,依据浓硫酸具有吸水性,选择氯气干燥剂,氯气有毒,直接排放到空气中能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气,据此解答.
19.【答案】(1)可行
(2)小
(3)1;10
(4)容量瓶
(5)溶液变成浅红色且30秒内不褪色
(6)
【解析】【解答】解:(1)由于配制的是浓度约为0.1mol L﹣1的NaOH溶液,是比较粗略的配制,故该配制步骤是可行的,故答案为:可行;(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,则配制出的溶液的浓度偏小,故答案为:小;(3)根据醋酸含量约为6g/100mL,则醋酸的物质的量n= = =0.1mol,醋酸的物质的量浓度c= = =1mol/L;酸碱中和滴定中待测液的浓度要为0.1mol/L左右,故滴定前要将醋酸溶液稀释10倍,故答案为:1;10;(4)稀释醋酸的操作需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、容量瓶,故答案为:容量瓶;(5)由于是用碱滴定酸,指示剂是酚酞,故当溶液变成浅红色且30秒内不褪色时达到滴定终点,故答案为:溶液变成浅红色且30秒内不褪色;(6)设原白醋中醋酸的物质的量浓度为Xmol/L,根据达滴定终点时,n(CH3COOH)=n(NaOH),可有 ×0.02L=c mol L﹣1×VmL×10﹣3,解得x= mol/L,
故答案为: .
【分析】(1)根据配制的是浓度约为0.1mol L﹣1的NaOH溶液来判断;(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,来分析浓度;(3)根据醋酸含量约为6g/100mL,计算出醋酸的物质的量,然后根据c= 来计算;酸碱中和滴定中待测液的浓度要为0.1mol/L左右;(4)根据稀释醋酸的操作来分析需要的仪器;(5)根据加入的指示剂是酚酞来分析滴定终点;(6)根据达滴定终点时,n(CH3COOH)=n(NaOH)来计算.
20.【答案】(1)分液漏斗;Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O
(2)除去Cl2中的HCl
(3)d
(4)吸收多余的氯气,防止污染大气;b
【解析】【解答】解:(1)依据仪图中仪器形状可知盛放浓盐酸仪器为分液漏斗;次氯酸钙与浓盐酸反应生成氯气、氯化钙和水,方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O;故答案为:分液漏斗;Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O;(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以装置B中饱和食盐水的作用是除去Cl2中的HCl;故答案为:除去Cl2中的HCl;(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,C为U型管,应盛放固体干燥剂,不能用浓硫酸干燥,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,故答案为:d;(4)氯气有毒会污染环境,所以F装置的作用是吸收多余的氯气,F中不可以盛装饱和Ca(OH)2溶液,因为Ca(OH)2溶解度太小,吸收不彻底,故答案为:吸收多余的氯气,防止污染大气;b.
【分析】(1)依据仪器形状说出其名称,次氯酸钙与浓盐酸反应生成氯气、氯化钙和水;(2)反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;(4)氯气是有毒气体,要进行尾气处理;饱和Ca(OH)2溶液中氢氧化钙较少不能完全吸收剩余的氯气.
21.【答案】(1)2mol/L;4mol/L
(2)0.25L
(3)1mol/L;11.2L
【解析】【解答】解:(1)MgCl2的物质的量为n(MgCl2) =2mol,则MgCl2物质的量浓度为c= = =2 mol/L,溶液中Cl﹣的物质的量浓度C(Cl﹣)=2C(MgCl2)=4mol/L,故答案为:2mol/L;4mol/L;(2)因溶液稀释前后溶质的物质的量不变,所以需该溶液的体积为V= =0.25L,故答案为:0.25L; (3)因(2)中Cl﹣的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl﹣的物质的量浓度为1mol/L,H+的物质的量浓度也为1mol/L,HCl的物质的量为:1mol/L×0.5L=0.5mol,体积为0.5mol×22.4L/mol=11.2L,故答案为:1mol/L;11.2L.
【分析】(1)根据MgCl2的质量求出MgCl2的物质的量,然后根据c= 求出物质的量浓度;根据MgCl2的物质的量浓度以及1个MgCl2中含有2个氯离子求出Cl﹣的物质的量浓度;(2)根据溶液稀释前后溶质的物质的量不变;(3)根据(2)可知Cl﹣的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl﹣的物质的量浓度为1mol/L,然后求出HCl的物质的量、体积以及H+的物质的量浓度.
一、单选题
1.0.5L1mol·L-1的FeCl3溶液与0.2L1mol·L-1的KCl溶液中,Cl-浓度之比为( )
A.15:2 B.1:1 C.3:1 D.1:3
2.mg气体A和ng气体B的分子数相等,下列说法错误的是( )
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为n: m
C.同温同压时气体A和气体B的密度比为n:m
D.标况时,等质量的A和B气体的体积比为n:m
3.NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.12g金刚石中含有化学键的数目为4NA
B.7.2gCaO2中含有的阴离子数为0.2NA
C.标准状况下,11.2L甲烷和乙烯混合气体中所含氢原子总数为2NA
D.1mol/LMgCl2溶液中,含有Cl-的数目为2NA
4.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.pH=1的H3PO4溶液中,含有0.1NA个H+
B.14g乙烯和丙烯混合气体中氢原子数为2NA
C.标准状况下,2.24LCCl4含有的共价键为0.4 NA
D.0.1L0.5mol/LCH3COOH 溶液中含有的H数为0.05 NA
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.4℃时,18g 21H2168O中含有电子数为10NA
B.在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA
C.常温下,1L0.1mol L﹣1的NH4NO3溶液中所含氮原子数为0.2 NA
D.标准状况下,22.4 L的CCl4中C﹣Cl键数为4NA
6.下列关于配制一定物质的量浓度的溶液说法正确的是( )
A.将NaCl固体置于托盘天平右盘称量:左盘砝码(8g)和游码(0.6g)读数的和为8.6g
B.容量瓶上标有刻度线、温度和浓度,使用前要事先检查是否漏水
C.配制一定物质的量浓度的溶液用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管
D.配制1L0.2mol/L的H2SO4溶液,定容时仰视刻度线操作,则配出浓度偏高
7.下面关于金属钠的描述不正确的是( )
A.钠的化学性质很活泼,在自然界中不能以游离态存在
B.钠是电和热的良导体
C.将一块钠放置在空气中最终会变成NaOH
D.钠和钾的合金于室温下呈液态,可做原子反应堆的导热剂
8.关于Na2O和Na2O2的叙述正确的是( )
A.都是白色的固体 B.都能和水反应形成强碱溶液
C.都是碱性氧化物 D.焰色反应的颜色都是紫色
9.设为阿伏加德罗常数的值。下列说法正确的是( )
A.中所含键的数目为
B.标准状况下,中含有的中子数为
C.与少量氯气反应转移电子数一定为
D.中所含离子数为
10.下列有关物理量与其相应的单位不一致的是( )
A.摩尔质量:g /mol B.气体摩尔体积:L/mol
C.物质的量浓度:L/mol D.物质的量:mol
11.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42-)=0.8mol/L,则c(K+)为( )
A.0.15 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4 mol/L
12.NA为阿伏加德罗常数的值.下列说法中,正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.4NA
D.1 L 0.1 mol L﹣1的NaHCO3溶液中HCO3﹣和CO32﹣离子数之和为0.1NA
13.下列叙述不正确的是( )
A.12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为62 g/mol
B.同温、同压、同体积的H2和A2气体的质量分别是0.2g和3.2g,则A的相对原子质量为16
C.在标准状况下,CO和CO2混合气体共33.6 L,质量为50g,则两种气体的物质的量之比为1:1
D.浓盐酸的质量分数为36.5%,密度为1.19g cm﹣3,则物质的量浓度是11.9 mol L﹣1
14.用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1L 1mol/L的盐酸中含HCl分子的数目为NA
B.1 mol Cl2与足量的铁反应转移的电子数是3 NA
C.常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA
D.标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
15.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;
③转移溶液前容量瓶内有少量蒸馏水
④定容时,俯视容量瓶的刻度线;
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①②⑤ B.①③⑤ C.③④⑤ D.②③⑤
16.为阿伏加德罗常数的值。下列说法正确的是
A.氧气中,所含分子的数目为
B.质量相等的和,所含硫原子的数目之比为
C.含有的中子数目为
D.标准状况下,个与个分子所占的体积比为
二、综合题
17.在标准状况下,将33.6L HCl气体溶于H2O中配成0.5L溶液。(要求有解题过程,无解题过程不给分)
(1)该盐酸的物质的量浓度为多少
(2)取这种盐酸100mL,稀释到500mL,所得的稀盐酸的物质的量浓度为多少
18.实验室制取氯气如图,连接好实验装置.
请回答下列问题:
(1)图中气体发生装置中盛放浓盐酸的仪器名称是 其中发生反应的离子方程式为 ;
(2)A中盛放的是 ,其作用为 .
(3)B中盛放的是 ,其作用为 .
(4)D中盛放的是 ,化学反应方程式 .
19.某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1mol L﹣1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤 (填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol L﹣1,滴定前将白醋稀释 (填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 .
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点.
重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol L﹣1).
(6)原白醋中醋酸的物质的量浓度= mol L﹣1.
20.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略).
(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是 ,请写出反应的化学方程式: .
(2)装置B中的饱和食盐水的作用是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是 .(填字母编号)
编号 I II III
a 干燥的有色布条 碱石灰 湿润的有色布条
b 干燥的有色布条 无水硫酸铜 湿润的有色布条
c 湿润的有色布条 浓硫酸 干燥的有色布条
d 湿润的有色布条 无水氯化钙 干燥的有色布条
(4)装置F的作用是 ,其烧杯中的溶液不能选用下列中的 .
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
21.将190g MgCl2溶于水配制成1L溶液.
(1)该溶液中MgCl2的物质的量浓度为 ,溶液中Cl﹣的物质的量浓度为 .
(2)配制1mol L﹣1的MgCl2溶液500mL,需该溶液的体积为 .
(3)向(2)中500mL溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3mol L﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 ,通入HCl气体的体积(标准状况下)为 .
答案解析部分
1.【答案】C
【解析】【解答】0.5L1mol·L-1的FeCl3溶液中Cl-的物质的量浓度为1mol L-1×3=3mol L-1,0.2L1mol·L-1的KCl溶液中Cl-的物质的量浓度为1mol L-1,Cl-的物质的量浓度之比为3:1,C符合题意;
故答案为:C
【分析】结合FeCl3、KCl在水中的电离分析。
2.【答案】D
【解析】【解答】A.因气体存在的条件未知,不一定为相同条件下,则不能确定同体积的质量关系,故A不符合题意;
B.由 可知,相同质量时气体的分子数之比与摩尔质量呈反比,则相同质量的气体A和气体B的分子数之比为n:m,故B不符合题意;
C.结合 可知,同温、同压下,气体A和气体B的密度之比为m:n,故C不符合题意;
D.由 可知,相同质量的气体A和气体B的体积之比与摩尔质量呈反比,为n:m,故D符合题意
【分析】m g气体A和n g气体B所含分子数相等,则物质的量相等,二者的,摩尔质量之比为m:n
3.【答案】C
【解析】【解答】A.12g金刚石含1mol碳原子,形成共价键数目为2NA ,故A不符合题意;
B.1molCaO2含有1mol ,则7.2gCaO2中含有的阴离子数为0.1NA ,故B不符合题意;
C.0.5mol甲烷和乙烯含氢原子均为2mol,则标准状况下,11.2L甲烷和乙烯混合气体中所含氢原子总数为2NA,故C符合题意;
D.溶液体积不明确,溶液中含有的氯离子个数无法计算,故D不符合题意;
故答案为:C。
【分析】A.根据n=计算出物质的量,再根据1mol碳中含有的碳碳键即可计算
B.根据n=计算出物质的量,再根据CaO2=Ca2++O22-,即可求出阴离子的量
C.根据n=计算出物质的量,再根据分子式找出氢原子的个数即可
D.根据n=cv计算,但是体积未知,无法计算出物质的量
4.【答案】B
【解析】【解答】A.未注明溶液的体积,无法计算 pH=1的H3PO4溶液中含有的H+数目,故A错误;
B.乙烯和丙烯的最简式均为CH2,故14g混合物中含1molCH2,故含2NA个氢原子,故B正确;
C.标准状况下,四氯化碳为液体,不能使用气体摩尔体积计算,故C错误;
D.醋酸为弱电解质,部分电离,所以0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数小于0.05 NA,故D错误;
故答案为:B。
【分析】A.不能准确计算物质的量,不能确定答案;
B.现根据n=计算出物质的量,进而可得出答案;
C. CCl4 标况下不是气体,不可用公式计算;
D.现根据:n=cv计算出醋酸的物质的量,进而进行解答。
5.【答案】C
【解析】【解答】解:A、21H2168O的摩尔质量为20g/mol,故18g21H2168O的物质的量为0.9mol,故含9NA个电子,故A错误;
B、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子小于NA个,故B错误;
C、1mol硝酸铵中含2molN原子,虽然铵根离子在溶液中能水解,但根据原子守恒可知,故在1L0.1mol L﹣1的NH4NO3溶液中所含氮原子数为0.2NA,故C正确;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和C﹣Cl键个数,故D错误.
故选C.
【分析】A、21H2168O的摩尔质量为20g/mol;
B、合成氨的反应为可逆反应;
C、1mol硝酸铵中含2molN原子;
D、标况下四氯化碳为液态.
6.【答案】C
【解析】【解答】解:A.由用托盘天平称量药品时,砝码和药品放反了,已知砝码质量为8g,游码质量为0.6g,再根据左盘的质量=右盘的质量+游码的质量,即8g=药品质量+0.6g,所以药品实际质量7.4g,读出的数值比真实值大,故A错误;
B.容量瓶上标有刻度线、温度和容积,容量瓶带有活塞,使用过程中需要上下颠倒,为防止漏水,使用前要事先检查是否漏水,故B错误;
C.配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管,故C正确;
D.配制1L0.2mol/L的H2SO4溶液,定容时仰视刻度线操作,导致溶液体积偏大,依据C= 则配出浓度偏低,故D错误;
故选:C.
【分析】A.根据托盘天平称量药品时要特别注意“左物右码”,若放反时可根据左盘的质量=右盘的质量+游码的质量,得出物质质量=砝码质量﹣游码质量;
B.依据容量瓶构造及使用方法解答;
C.依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
D.定容时仰视刻度线操作,导致溶液体积偏大,依据c= 进行误差分析.
7.【答案】C
【解析】【解答】解:A.钠性质活泼,可与水、氧气等发生反应,在自然界中不能以游离态存在,故A正确;
B.钠为金属,为热和电的良导体,故B正确;
C.NaOH不稳定,最终应为碳酸钠,故C错误;
D.钠和钾的合金熔点低,常温下为液态,具有良好的导热性,可做原子反应堆的导热剂,故D正确.
故选C.
【分析】钠为活泼金属,在自然界中以化合态存在,具有良好的导热性和导电性,可用于原子反应堆的导热剂,结合氢氧化钠的性质解答该题.
8.【答案】B
【解析】【解答】解:A、Na2O是白色固体,Na2O2是淡黄色固体,颜色不同,故A错误;
B、Na2O与Na2O2与水反应都能生成氢氧化钠,氢氧化钠是强碱,故B正确;
C、因Na2O2与酸反应生成盐、水和氧气,则Na2O2不属于碱性氧化物,故C错误;
D、Na2O和Na2O2中都含有钠元素,所以焰色反应的颜色都是黄色,故D错误.
故选B.
【分析】A、Na2O是白色固体,Na2O2是淡黄色固体;
B、Na2O与水反应生成氢氧化钠,Na2O2与水反应生成氢氧化钠和氧气;
C、碱性氧化物是指能与酸反应生成盐和水的金属氧化物;
D、钠的焰色反应呈黄色.
9.【答案】A
【解析】【解答】A.单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;中含键,故中含键的数目为,A符合题意;
B.标准状况下,水不是气体,不能计算其物质的量,B不符合题意;
C.少量氯气的量未知,因此不能求转移的电子数,C不符合题意;
D.为,中含有的和的,所以所含离子数为,D不符合题意;
故答案为:A。
【分析】A.三键中含有1个σ键和2个π键;
B.标况下水不是气体,不能用气体摩尔体积计算其物质的量;
C.氯气的物质的量未知;
D.过氧化钠由钠离子和过氧根离子构成。
10.【答案】C
【解析】【解答】本题属于基础性题目,只需识记课本中的知识,选项C符合题意。物质的量浓度的单位应为“mol/L”;而“L/mol”应该是气体摩尔体积的单位。
【分析】物质的量浓度c=n/v, 单位应为“mol/L”.
11.【答案】C
【解析】【解答】氢氧根离子浓度很低,可以忽略不计,由电荷守恒可得:c(H+)+c(Al3+) 3+ c(K+)=c(SO ) 2,其中c(H+)=0.1mol/L,c(Al3+)=0.4 mol/L,c(SO )=0.8 mol/L,所以c(K+)=0.3 mol/L,C符合题意。
故答案为:C
【分析】根据整体溶液不带电,所以溶液中阴阳离子所带的电荷相等,根据电荷守恒,代入计算可得。
12.【答案】B
【解析】【解答】解:A、标况下,庚烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、NO2与N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量为n= =0.5mol,则含0.5NA个氮原子,故B正确;
C、过氧化钠与水反应时,氧元素的价态由﹣1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C错误;
D、HCO3﹣在溶液中既能水解为H2CO3又能电离为CO32﹣,根据物料守恒可知:溶液中的HCO3﹣、H2CO3、CO32﹣之和为0.1NA个,故D错误.
故选B.
【分析】A、标况下,庚烷为液态;
B、NO2与N2O4的最简式均为NO2;
C、过氧化钠与水反应时,氧元素的价态由﹣1价变为0价;
D、HCO3﹣在溶液中既能水解为H2CO3又能电离为CO32﹣;
13.【答案】C
【解析】【解答】解:A.12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,M= = =62g/mol,故A正确;
B.同温同压下,同体积的气体,质量之比等于摩尔质量之比,故0.2g:1.6g=2g/mol:M(A),解得M(A)=16g/mol,故A的相对分子质量为16,故B正确;
C.标准状况下,Vm=22.4L/mol,
n= = =1.5mol,
设CO的物质的量为x,CO2的物质的量为y,
则有:x+y=1.5 28x+44y=50
解之得:x=1mol,y=0.5mol,两种气体的物质的量之比=1:0.5=2:1,故C错误;
D.此浓盐酸的物质的量浓度为:c(HCl)= mol/L=11.9mol/L,故D正确;
故选C.
【分析】A.12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,结合M= 计算;
B.同温同压下,同体积的气体,质量之比等于摩尔质量之比,据此计算A的摩尔质量,确定A的相对分子质量;
C.根据n= 计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的物质的量分析;
D.根据溶液的物质的量浓度c= 计算出质量分数为36.5%、密度为1.20g/cm﹣3的浓盐酸的物质的量浓度
14.【答案】C
【解析】【解答】解:A、HCl溶于水后完全电离,故盐酸溶液中无HCl分子,故A错误;
B、氯气和铁反应后变为﹣1价,故1mol氯气反应后转移2NA个电子,故B错误;
C、15g乙烷的物质的量为0.5mol,而乙烷中含7条共价键,故0.5mol乙烷中含3.5NA条共价键,故C正确;
D、标况下重水为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
【分析】A、盐酸溶液中无HCl分子;
B、氯气和铁反应后变为﹣1价;
C、求出乙烷的物质的量,然后根据乙烷中含7条共价键来分析;
D、标况下重水为液体.
15.【答案】A
【解析】【解答】①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了,导致物体的实际质量偏小,浓度偏小,故符合题意;
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,因烧杯和玻璃棒上沾有溶质,溶质的质量减少,浓度偏小,故符合题意;
③转移溶液前容量瓶内有少量蒸馏水,对溶液的体积无影响,浓度不变,故不符合题意;
④定容时,俯视容量瓶的刻度线,溶液的液面比刻度线低,溶液的体积偏小,浓度偏大,故不符合题意;
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,导致加水过多溶液的体积偏大,浓度偏小,故符合题意;
故答案为:A。
【分析】配制溶液时,c=n/V,c偏小,可能是n偏小或者是v偏大
引起n偏小的原因:砝码放反,溶液在转移时未进行洗涤等等
引起v偏大的原因:定容时仰视或者加水加多了
16.【答案】C
【解析】【解答】A.没有说是标准状况,无法计算氧气物质的量,A不符合题意;
B.和的最简式是S,则等质量的和所含的硫原子数目之比为,B不符合题意;
C.1个含有8个中子,则含有的中子数目为,C符合题意;
D.标准状况下分子为液体,无法计算其体积,D不符合题意;
故答案为:C。
【分析】A、不在标准状况下无法计算;
B、结合公式n=m/M判断;
C、中子数=质量数-质子数;
D、标准状况下硫酸不是气体。
17.【答案】(1)解:该盐酸物质的量浓度为:
(2)解:稀释前后溶质物质的量不变,由稀释公式:
c(浓)·V(浓) = c(稀)·V(稀)
3 mol/L×0.1L = c(HCl)稀×0.5 L
所得稀盐酸的物质的量浓度为:c(HCl)稀=0.6mol/L
【解析】【解答】(1) 标准状况下33.6L 氯化氢气体物质的量为n =33.6L 22.4L·mol-1=1.5mol;c 0.5L= ;答案标况下, ,该盐酸物质的量浓度为: 。(2) 取这种盐酸100mL,稀释到 , 根据稀释定律,稀释前后溶质的物质的量不变,则所得的稀盐酸的物质的量浓度为c 100mL ) =0.6mol/L。
故答案为:稀释前后溶质物质的量不变,由稀释公式: c(浓)·V(浓) = c(稀)·V(稀) 3mol/L×0.1L = c(HCl)稀×0.5 L ,所得稀盐酸的物质的量浓度为:c(HCl)稀=0.6mol/L
【分析】(1)盐酸的物质的量浓度等于物质的量与体积的比值;
(2)在对浓溶液稀释的过程中,浓溶液和稀溶液的溶质的物质的量是相等的。
18.【答案】(1)圆底烧瓶;MnO2+2Cl﹣+4H+ 2H2O+Cl2↑+Mn2+
(2)饱和食盐水;除去HCl
(3)浓H2SO4;干燥Cl2
(4)NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O
【解析】【解答】解:(1)依据仪器形状可知:盛放浓盐酸的仪器为圆底烧瓶,二氧化锰、浓盐酸在加热条件下生成氯气、氯化锰和水,离子方程式为MnO2+2Cl﹣+4H+ 2H2O+Cl2↑+Mn2+故答案为:圆底烧瓶;MnO2+2Cl﹣+4H+ 2H2O+Cl2↑+Mn2+;(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气杂质,要得到纯净的氯气,需要除去氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的A除去氯气中的氯化氢;故答案为:饱和食盐水:除去HCl;(3)浓硫酸具有吸水性,能够干燥氯气;故答案为:浓H2SO4;干燥Cl2;(4)氯气有毒,直接排放到空气中能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,可以用氢氧化钠溶液吸收过量的氯气;故答案为:NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O.
【分析】实验室用加热固体二氧化锰与浓盐酸方法制取氯气,二者反应生成氯气、氯化锰和水,浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气杂质,要得到纯净的氯气,需要除去氯化氢、水蒸气,依据氯气、氯化氢在饱和食盐水溶解度不同选择合适试剂除去氯化氢,依据浓硫酸具有吸水性,选择氯气干燥剂,氯气有毒,直接排放到空气中能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气,据此解答.
19.【答案】(1)可行
(2)小
(3)1;10
(4)容量瓶
(5)溶液变成浅红色且30秒内不褪色
(6)
【解析】【解答】解:(1)由于配制的是浓度约为0.1mol L﹣1的NaOH溶液,是比较粗略的配制,故该配制步骤是可行的,故答案为:可行;(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,则配制出的溶液的浓度偏小,故答案为:小;(3)根据醋酸含量约为6g/100mL,则醋酸的物质的量n= = =0.1mol,醋酸的物质的量浓度c= = =1mol/L;酸碱中和滴定中待测液的浓度要为0.1mol/L左右,故滴定前要将醋酸溶液稀释10倍,故答案为:1;10;(4)稀释醋酸的操作需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、容量瓶,故答案为:容量瓶;(5)由于是用碱滴定酸,指示剂是酚酞,故当溶液变成浅红色且30秒内不褪色时达到滴定终点,故答案为:溶液变成浅红色且30秒内不褪色;(6)设原白醋中醋酸的物质的量浓度为Xmol/L,根据达滴定终点时,n(CH3COOH)=n(NaOH),可有 ×0.02L=c mol L﹣1×VmL×10﹣3,解得x= mol/L,
故答案为: .
【分析】(1)根据配制的是浓度约为0.1mol L﹣1的NaOH溶液来判断;(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,来分析浓度;(3)根据醋酸含量约为6g/100mL,计算出醋酸的物质的量,然后根据c= 来计算;酸碱中和滴定中待测液的浓度要为0.1mol/L左右;(4)根据稀释醋酸的操作来分析需要的仪器;(5)根据加入的指示剂是酚酞来分析滴定终点;(6)根据达滴定终点时,n(CH3COOH)=n(NaOH)来计算.
20.【答案】(1)分液漏斗;Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O
(2)除去Cl2中的HCl
(3)d
(4)吸收多余的氯气,防止污染大气;b
【解析】【解答】解:(1)依据仪图中仪器形状可知盛放浓盐酸仪器为分液漏斗;次氯酸钙与浓盐酸反应生成氯气、氯化钙和水,方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O;故答案为:分液漏斗;Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O;(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以装置B中饱和食盐水的作用是除去Cl2中的HCl;故答案为:除去Cl2中的HCl;(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,C为U型管,应盛放固体干燥剂,不能用浓硫酸干燥,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,故答案为:d;(4)氯气有毒会污染环境,所以F装置的作用是吸收多余的氯气,F中不可以盛装饱和Ca(OH)2溶液,因为Ca(OH)2溶解度太小,吸收不彻底,故答案为:吸收多余的氯气,防止污染大气;b.
【分析】(1)依据仪器形状说出其名称,次氯酸钙与浓盐酸反应生成氯气、氯化钙和水;(2)反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;(4)氯气是有毒气体,要进行尾气处理;饱和Ca(OH)2溶液中氢氧化钙较少不能完全吸收剩余的氯气.
21.【答案】(1)2mol/L;4mol/L
(2)0.25L
(3)1mol/L;11.2L
【解析】【解答】解:(1)MgCl2的物质的量为n(MgCl2) =2mol,则MgCl2物质的量浓度为c= = =2 mol/L,溶液中Cl﹣的物质的量浓度C(Cl﹣)=2C(MgCl2)=4mol/L,故答案为:2mol/L;4mol/L;(2)因溶液稀释前后溶质的物质的量不变,所以需该溶液的体积为V= =0.25L,故答案为:0.25L; (3)因(2)中Cl﹣的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl﹣的物质的量浓度为1mol/L,H+的物质的量浓度也为1mol/L,HCl的物质的量为:1mol/L×0.5L=0.5mol,体积为0.5mol×22.4L/mol=11.2L,故答案为:1mol/L;11.2L.
【分析】(1)根据MgCl2的质量求出MgCl2的物质的量,然后根据c= 求出物质的量浓度;根据MgCl2的物质的量浓度以及1个MgCl2中含有2个氯离子求出Cl﹣的物质的量浓度;(2)根据溶液稀释前后溶质的物质的量不变;(3)根据(2)可知Cl﹣的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl﹣的物质的量浓度为1mol/L,然后求出HCl的物质的量、体积以及H+的物质的量浓度.
