2022-2023学年高二化学上学期期末试题汇编【苏教版化学期末】-03金属的腐蚀与防护、化学反应(含解析)
文档属性
| 名称 | 2022-2023学年高二化学上学期期末试题汇编【苏教版化学期末】-03金属的腐蚀与防护、化学反应(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 802.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 13:13:25 | ||
图片预览




文档简介
2022-2023学年高二化学上学期期末试题汇编【苏教版化学期末】-03 金属的腐蚀与防护、 化学反应速率
一、单选题
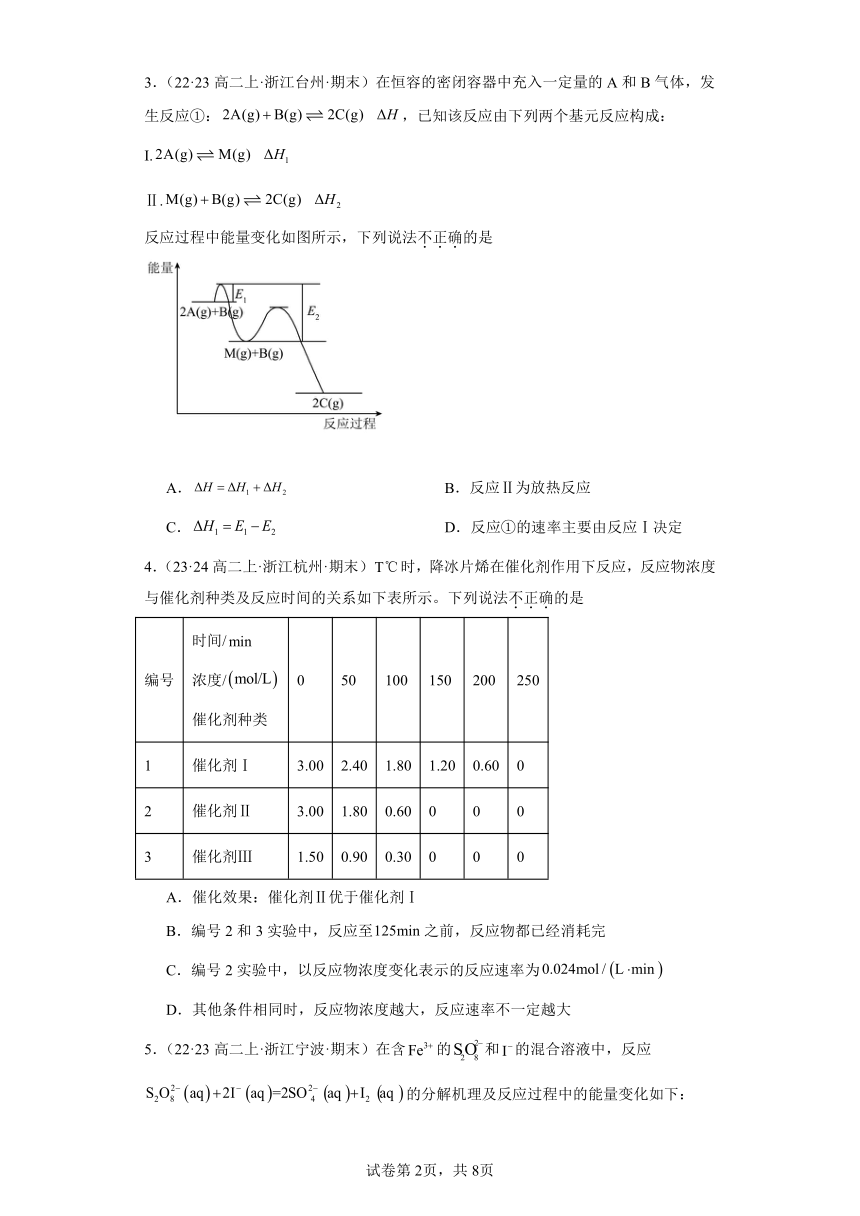
1.(22·23高二上·浙江丽水·期末)自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点,HNO自由基与O2反应过程的能量变化如图所示,下列说法不正确的是
A.反应物的总能量小于生成物的总能量
B.该历程中正反应最大的活化能为186.19 kJ·mol 1
C.两种产物中P2更稳定
D.相同条件下Z转化为产物的速率: v (P1)﹥v (P2)
2.(22·23高二上·浙江丽水·期末)已知反应:2NO(g) + Br2(g)2NOBr(g) ΔH = -a kJ·mol-1(a﹥0),其反应机理如下:
① NO(g) + Br2(g)NOBr2(g) 快
② NO(g) + NOBr2(g)2NOBr(g) 慢
下列有关该反应的说法不正确的是
A.该反应的速率主要取决于②的快慢
B.NOBr2是该反应的中间产物
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2(g)的浓度能增大活化分子百分数,加快反应速率
3.(22·23高二上·浙江台州·期末)在恒容的密闭容器中充入一定量的A和B气体,发生反应①:,已知该反应由下列两个基元反应构成:
I.
Ⅱ.
反应过程中能量变化如图所示,下列说法不正确的是
A. B.反应Ⅱ为放热反应
C. D.反应①的速率主要由反应Ⅰ决定
4.(23·24高二上·浙江杭州·期末)时,降冰片烯在催化剂作用下反应,反应物浓度与催化剂种类及反应时间的关系如下表所示。下列说法不正确的是
编号 时间/ 浓度/ 催化剂种类 0 50 100 150 200 250
1 催化剂Ⅰ 3.00 2.40 1.80 1.20 0.60 0
2 催化剂Ⅱ 3.00 1.80 0.60 0 0 0
3 催化剂Ⅲ 1.50 0.90 0.30 0 0 0
A.催化效果:催化剂Ⅱ优于催化剂Ⅰ
B.编号2和3实验中,反应至之前,反应物都已经消耗完
C.编号2实验中,以反应物浓度变化表示的反应速率为
D.其他条件相同时,反应物浓度越大,反应速率不一定越大
5.(22·23高二上·浙江宁波·期末)在含的和的混合溶液中,反应的分解机理及反应过程中的能量变化如下:
步骤①:
步骤②:
下列有关该反应的说法不正确的是
A.化学反应速率与浓度的大小有关
B.该反应为放热反应
C.是该反应的催化剂
D.若不加,则图中只出现一个能量峰
6.(22·23高二上·浙江宁波·期末)下列有关碰撞理论的说法正确的是
A.活化分子的每一次碰撞都能发生化学反应
B.能发生有效碰撞的分子一定是活化分子
C.其它条件不变,增大压强,能增大活化分子百分数,从而增大有效碰撞次数
D.催化剂能增大反应的活化能,从而加快反应速率
7.(22·23高二上·浙江宁波·期末)已知反应:,经过2min时间,B浓度减少了0.6mol/L。有关该反应速率的说法正确的是
A.0-2min用A表示的反应速率是0.4mol/(L·min)
B.0-2min用B表示的反应速率是0.3mol/(L·min)
C.2min末时用C表示的反应速率是0.2mol/(L·min)
D.分别用B、C、D表示的反应速率比值为2:3:6
8.(22·23高二上·浙江嘉兴·期末)采取下列措施对增大化学反应速率有明显效果的是
A.Fe与稀硫酸反应制取时,用浓硫酸代替稀硫酸
B.NaOH溶液和稀硝酸反应时,增大反应体系的压强
C.Na与水反应时,增加水的用量
D.工业上合成氨时,使用铁触媒作催化剂
9.(22·23高二上·浙江台州·期末)对于反应:,下列说法不正确的是
A.升高温度,化学反应速率增大 B.活化分子之间发生的碰撞一定是有效碰撞
C.升高温度能增加活化分子百分数 D.加入铂铑合金催化剂,化学反应速率增大
10.(22·23上·绍兴·期末)近似测定氧化KI的瞬时速率公式与速率常数k的实验流程如下:
加入KI后反应如下:①;②
在耗尽时溶液变蓝色瞬间记录用时,测得不同起始浓度下反应时间、反应速率与反应速率常数如表所示:
实验编号 1 2 3 4 5
溶液用量/mL 2.0 1.0 0.50 2.0 2.0
溶液用量/mL 2.0 2.0 2.0 1.0 0.50
溶液用量/mL 0 1.5 1 1.5
反应时间/s 37 68 133 72 139
反应速率 2.0 1.1 0.5 1.0
反应速率常数 3.4 3.8 3.4 3.4 4.0
下列说法正确的是
A.上表中的速率为完全消耗后测得的平均速率
B.由实验可知反应的速率公式为
C.表中数据,约为0.5
D.实验测得的5组反应速率常数不完全相等,说明浓度对k有影响
11.(22·23上·绍兴·期末)下列关于化学反应速率和化学平衡的说法正确的是
A.用少量的Zn与硫酸反应制备,则硫酸浓度越大,反应速率越快,产生的越多
B.恒温恒压条件下,反应达到平衡后,再充入一定量的稀有气体Ar,反应速率保持不变
C.某温度下,恒容容器中加入一定量的X,发生反应,达到平衡后,再加入一定量的X,达到新平衡后,X的浓度和体积分数均保持不变
D.对于反应达到平衡后,缩小容器体积,的浓度增大
12.(22·23上·湖州·期末)已知:。某化学小组欲探究溶液和酸性溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略溶液体积变化):
编号 0.01 mol·L酸性溶液体积/mL 0.1 mol·L 溶液体积/mL 水的体积/mL 反应温度/℃ 反应时间/min
Ⅰ 2 2 0 20 2.1
Ⅱ 2 1 20 5.5
Ⅲ 2 0 50 0.5
下列说法不正确的是
A.
B.设计实验Ⅰ、Ⅱ的目的是探究浓度对反应速率的影响
C.实验计时是从溶液混合开始,溶液紫红色褪去时结束
D.实验Ⅲ中用溶液的浓度变化表示的反应速率 mol·L·min
13.(22·23上·湖州·期末)下列说法正确的是
A.化学反应的反应热等于反应的焓变
B.决定化学反应速率的主要因素是体系的温度
C.对于需经过多个步骤的化学反应而言,活化能最小的那个步骤是决速步骤
D.有气体参加的反应,压缩容器体积,单位体积内活化分子数增多
14.(22·23上·舟山·期末)氮及其化合物的转化过程如图所示。下列分析合理的是
A.可逆反应的原子利用率不可能为100%
B.催化剂a表面发生了极性共价键的断裂和形成
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.使用催化剂可以降低反应的活化能,加快反应速率,从而提高单位时间的产率
15.(22·23上·衢州·期末)工厂的氨氯废水可用电化学催化氧化法加以处理,其中NH3在电极表面的氧化过程的微观示意图如图:
下列说法中,不正确的是
A.过程①②均有 N-H 键断裂
B.过程③的电极反应式为:_ e-+OH-=N+H2O
C.过程④中有非极性键形成
D.催化剂可以降低该反应的活化能
16.(22·23上·衢州·期末)以和为原料制备高纯度次氯酸的机理如图,V为元素钒,其最高化合价为价,、分别为两种不同氨基酸,下列说法不正确的是
A.该催化循环过程中有氢氧键的断裂和形成
B.反应过程中,中心原子钒的化合价和成键数目均发生改变
C.该机理中化合物a是催化剂,B、C、D、E是中间产物
D.该过程的总反应为:
17.(22·23高二上·浙江丽水·期末)下列有关电化学腐蚀和电化学保护的说法,不正确的是
A.图甲是钢铁的吸氧腐蚀示意图
B.图乙中的电解质溶液呈酸性
C.图丙中的电子被强制流向钢闸门
D.图丁是牺牲阳极示意图,利用了电解原理
18.(22·23高二上·浙江金华·期末)下列与金属腐蚀有关的说法正确的是
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,往烧杯中铁棒附近滴加几滴溶液,生成蓝色沉淀
C.图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大
D.图4中,采用外加电流法防止地下钢铁管道的腐蚀
19.(22·23高二上·浙江嘉兴·期末)下列有关金属的腐蚀与防护叙述正确的是
A.铁管上镶嵌锌块,采用的是牺牲阳极法使铁不易被腐蚀
B.用锡焊接的铁质品,焊接处不易腐蚀
C.用铁电极电解饱和食盐水:
D.用外加电流法保护钢铁设备时,将设备连接电源正极
20.(22·23高二上·浙江衢州·期末)下列说法不正确的是
A.电解精炼铜的阴极反应:Cu2++2e-=Cu
B.纯银器表面在空气中因电化学腐蚀渐渐变暗
C.稀土元素可以用来制造合金
D.储氢材料-镧镍合金(LaNi5)贮存氢气时发生了化学变化
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.根据反应历程图可知,产物相对能量低于反应物相对能量,故A错误;
B.根据反应历程图可知,中间产物Z变为过渡态IV,需要活化能最大,为186.19 kJ·mol 1,故B正确;
C.P2能量更低,更稳定,故C正确;
D.相同条件下反应需要活化能越小,则越需要效率更快,故D正确;
答案选A。
2.D
【详解】A.反应速率主要取决于慢的一步,所以反应速率主要取决于②的快慢,A正确;
B.由反应机理可知NOBr2是中间生成中间消耗,NOBr2是中间产物,B正确;
C.正反应放热,断裂化学键吸收的能量小于形成化学键放出的能量,则正反应的活化能比逆反应的活化能小akJ·mol-1,C正确;
D.增大浓度,活化分子百分数不变,D错误;
故选D。
3.D
【详解】A.根据盖斯定律可知,ΔH=ΔH1+ΔH2,A正确;
B.从图中可知,M(g)+B(g)的总能量大于2C(g),故反应Ⅱ为放热反应,B正确;
C.反应ⅠΔH1=生成物总能量-反应物总能量,反应Ⅰ为放热反应,则ΔH1=E1-E2,C正确;
D.从图中可知,反应Ⅱ的活化能较大,则反应①的速率由反应Ⅱ决定,D错误;
故答案选D。
4.B
【详解】A.由表中数据可知, 50min内反应物浓度变化:催化剂I作用时为0.60mol/L,催化剂I作用时为1.20mol/L,则反应速率:催化剂Ⅱ>催化剂Ⅰ,所以催化效果:催化剂Ⅱ优于催化剂I, A正确;
B.编号2和3实验的反应速率始终不变,分别为=0.024mol/L,,则编号2实验反应物恰好都消耗完所需时间,编号3实验反应物恰好都消耗完所需时间,B错误;
C.编号2的反应速率始终不变,为=0.024mol/L, C正确;
D.分析反应物浓度对反应速率的影响,应该对比编号2实验、3实验或编号l实验、3实验, 根据控制变量法可知,编号2实验和3实验或编号l实验和3实验均有两个变量不同,则不能据此判断反应物浓度与反应速率的关系,D正确;
故选B。
5.C
【详解】A.可以看作该反应的催化剂,根据反应的机理,化学反应速率与Fe3+浓度的大小有关,A正确;
B.反应物的总能量高于生成物的总能量,为放热反应,B正确;
C.Fe3+是该反应的催化剂,C错误;
D.加催化剂后会出现两个峰,不加,图中只出现一个能量峰,D正确;
故选C。
6.B
【详解】A.活化分子的碰撞不一定都能发生化学反应,只有活化分子碰撞时取向合适时才能发生化学反应,故A错误;
B.有效碰撞是能发生化学反应的碰撞,所以能发生有效碰撞的分子一定是活化分子,故B正确;
C.其它条件不变,增大压强,能增大单位体积内的活化分子数,从而增大有效碰撞次数,不能增大活化分子百分数,故C错误;
D.催化剂能降低反应的活化能,从而加快反应速率,故D错误;
故选B。
7.B
【详解】A.A物质是固态,不能表示反应速率,A错误;
B.经2 min后,B的浓度减少了0.6mol/L,则用B物质表示的反应速率是=0.3 mol/(L·min),B正确;
C.反应速率是一段时间内的平均值,而不是瞬时反应速率,C错误;
D.反应速率之比等于化学方程式中的化学计量数之比,故B、C、D表示的反应速率比值为3:2:1,D错误;
故选B。
8.D
【详解】A.浓硫酸和Fe发生钝化现象,且不生成氢气,加热时生成二氧化硫,故A不选;
B.NaOH溶液和稀硝酸反应中没有气体参与,增大反应体系的压强不影响反应速率,故B不选;
C.水为纯液体,所以Na与水反应时增大水的用量不影响反应速率,故C不选;
D.工业上合成氨时,使用铁触媒作催化剂,反应速率加快,故D选;
故选D。
9.B
【详解】A.升高温度,反应物能量升高,活化分子百分数增大,化学反应速率增大,A正确;
B.当活化分子有合适取向时的碰撞才是有效碰撞,所以活化分子之间发生的碰撞不一定是有效碰撞,B错误;
C.升高温度,反应物能量升高,活化分子百分数增大,C正确;
D.催化剂能降低反应所需活化能,增大活化分子百分数,化学反应速率增大,D正确;
故选B。
10.C
【详解】A.根据题目中的第一句话,表格中的速率应该为瞬时速率,A错误;
B.根据瞬时速率计算公式,分别选取1、3、4三组数据,带入相关量得到
联合①②,解得n=1;联系②③,解得m=1,B错误;
C.将v5带入速率公式得到
解之v5=0.5,C正确;
D. 速率常数与反应温度、反应介质(溶剂)、催化剂等有关,甚至会随反应器的形状、性质而异。与浓度无关,D错误;
故选C。
11.D
【详解】A.应用Zn与稀硫酸反应制备H2,若是浓硫酸反应没有氢气生成,A错误;
B.恒温恒压条件下,再充入稀有气体Ar,容器体积增大,各组分浓度减小,反应速率减小,B错误;
C.该反应属于气体体积不变的反应,恒温恒容条件下,再加入一定量的X,等效于加压,达到新平衡后,各组分的浓度增大,但平衡不移动,X体积分数保持不变,C错误;
D.达到平衡后,缩小容器体积,各组分浓度增大,D正确;
故选D。
12.D
【详解】A.根据单一变量原则,实验Ⅰ是对照实验,溶液总体积为4mL,则V1=4-2-1=1,V2=4-2=2,故A正确;
B.实验目的是探究反应过程中浓度、温度对化学反应速率的影响,实验Ⅰ和Ⅱ的温度相同但其浓度不同,则设计实验Ⅰ、Ⅱ的目的是探究浓度对反应速率的影响,故B正确;
C.该定性实验是根据酸性KMnO4溶液褪色时间来判断反应快慢的,所以实验计时是从溶液混合开始,溶液紫红色褪去时结束,故C正确;
D.实验Ⅲ中草酸过量,两种溶液混合瞬间c(KMnO4)=0.01mol/L×=0.005mol/L,反应完全时△c=0.005mol/L,v(KMnO4)==0.01mol/(L·min),故D错误;
答案为D。
13.D
【详解】A.等压条件下的化学反应的反应热等于反应的焓变,故A错误;
B.决定化学反应速率的主要因素是物质本身的性质,故B错误;
C.对于需经过多个步骤的化学反应而言,活化能最大的那个步骤是决速步骤,故C错误;
D.有气体参加的反应,压缩容器体积,单位体积内分子数增多,活化分子数增加,活化分子百分数不变,故D正确。
综上所述,答案为D。
14.D
【详解】A.N2与 H2反应生成NH3,反应物参加反应过程中原子利用率为 100%,A错误;
B.催化剂a表面是氢气和氮气反应生成氨气,催化剂a表面发生了非极性共价键的断裂和极性键的形成,B错误;
C.催化剂b表面是氨气催化氧化生成 NO的反应,发生的是氧化还原反应,C错误;
D.催化剂a、b改变反应速率,不改变化学平衡,不能提高反应的平衡转化率,可以提高单位时间内的产率,D正确;
故选D。
15.B
【详解】A.由图可知,NH3在过程①中变为NH2,NH2在过程②中变为NH,则过程①②均有N-H键断裂,故A正确;
B.由图可知,NH失去电子结合OH-,转变为N和H2O,则过程③的电极反应式为:NH-e-+OH-=N+H2O,故B错误;
C.过程④中形成N≡N键,则过程④中有非极性键形成,故C正确;
D.使用催化剂该反应的焓变不变,可以降低活化能加快反应的速率,故D正确;
故选B。
16.B
【详解】A.b→c过程中有氧氢键断裂,c→d过程中有氧氢键形成,选项A正确;
B.反应过程中,从 a→b钒的成键数目增多,但化合价均为+5价,选项B不正确;
C.该机理中化合物a在整个反应过程中质量和化学性质没有发生变化,是催化剂,b、c、d、e是中间产物,选项C正确;
D.该过程的总反应为:,选项D正确;
答案选B。
17.D
【详解】A.图甲中氧气得到电子转化为氢氧根离子,属于钢铁的吸氧腐蚀示意图,A正确;
B.图乙中氢离子得到电子转化为氢气,属于钢铁的析氢腐蚀,说明电解质溶液呈酸性,B正确;
C.图丙中钢铁和电源的负极相连,作阴极被保护,这说明电子被强制流向钢闸门,C正确;
D.图丁中负极是锌,属于牺牲阳极的阴极保护法,利用了原电池原理,D错误;
答案选D。
18.B
【详解】A.插入海水中的铁棒,越靠近底端,海水中氧气的浓度越小,越不易腐蚀,故A错误;
B.由图可知,铁和铜在酸化的氯化钠溶液中构成原电池,金属铁是负极,失电子发生氧化反应生成亚铁离子,亚铁离子与滴入的铁氰化钾溶液反应生成蓝色沉淀,故B正确;
C.由图可知,开关由M改置于N时,锌为原电池的负极,铜锌合金为正极被保护,则合金的腐蚀速率减慢,故C错误;
D.由图可知,保护钢铁管道的方法为牺牲阳极的阴极保护法,不是外加直流电源的阴极保护法,故D错误;
故选B。
19.A
【详解】A.铁块上镶嵌锌块,锌金属活动性强于铁,作负极起到保护铁管的作用,采用的是牺牲阳极的阴极保护法,A正确;
B.铁的金属活动性强于锡,用锡焊接的铁制品,焊接处铁作负极较易被腐蚀,B错误;
C.用铁作电极电解饱和食盐水,阳极上铁失电子而不是氯离子失电子,C错误;
D.用外加电流法保护钢铁设备,设备连接电源负极,D错误;
故答案选A。
20.B
【详解】A.电解精炼铜时,溶液中的Cu2+在阴极得电子生成Cu,电极反应为Cu2++2e-═Cu,故A正确;
B.发生电化学腐蚀时,金属应不纯,纯银Ag在空气中和硫化氢反应生成Ag2S而渐渐变暗,属于化学腐蚀,故B错误;
C.在合金中加入适量稀土金属,能大大改善合金的性能,所以稀土元素被誉为新材料的宝库,又被称为“冶金工业的维生素”,故C正确;
D.贮氢金属在一定的温度和压强下能够大量吸收氢气,一个金属原子可以与两三个乃至更多个氢原子结合,形成金属氢化物,属于化学变化,故D正确;
故选:B。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(22·23高二上·浙江丽水·期末)自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点,HNO自由基与O2反应过程的能量变化如图所示,下列说法不正确的是
A.反应物的总能量小于生成物的总能量
B.该历程中正反应最大的活化能为186.19 kJ·mol 1
C.两种产物中P2更稳定
D.相同条件下Z转化为产物的速率: v (P1)﹥v (P2)
2.(22·23高二上·浙江丽水·期末)已知反应:2NO(g) + Br2(g)2NOBr(g) ΔH = -a kJ·mol-1(a﹥0),其反应机理如下:
① NO(g) + Br2(g)NOBr2(g) 快
② NO(g) + NOBr2(g)2NOBr(g) 慢
下列有关该反应的说法不正确的是
A.该反应的速率主要取决于②的快慢
B.NOBr2是该反应的中间产物
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2(g)的浓度能增大活化分子百分数,加快反应速率
3.(22·23高二上·浙江台州·期末)在恒容的密闭容器中充入一定量的A和B气体,发生反应①:,已知该反应由下列两个基元反应构成:
I.
Ⅱ.
反应过程中能量变化如图所示,下列说法不正确的是
A. B.反应Ⅱ为放热反应
C. D.反应①的速率主要由反应Ⅰ决定
4.(23·24高二上·浙江杭州·期末)时,降冰片烯在催化剂作用下反应,反应物浓度与催化剂种类及反应时间的关系如下表所示。下列说法不正确的是
编号 时间/ 浓度/ 催化剂种类 0 50 100 150 200 250
1 催化剂Ⅰ 3.00 2.40 1.80 1.20 0.60 0
2 催化剂Ⅱ 3.00 1.80 0.60 0 0 0
3 催化剂Ⅲ 1.50 0.90 0.30 0 0 0
A.催化效果:催化剂Ⅱ优于催化剂Ⅰ
B.编号2和3实验中,反应至之前,反应物都已经消耗完
C.编号2实验中,以反应物浓度变化表示的反应速率为
D.其他条件相同时,反应物浓度越大,反应速率不一定越大
5.(22·23高二上·浙江宁波·期末)在含的和的混合溶液中,反应的分解机理及反应过程中的能量变化如下:
步骤①:
步骤②:
下列有关该反应的说法不正确的是
A.化学反应速率与浓度的大小有关
B.该反应为放热反应
C.是该反应的催化剂
D.若不加,则图中只出现一个能量峰
6.(22·23高二上·浙江宁波·期末)下列有关碰撞理论的说法正确的是
A.活化分子的每一次碰撞都能发生化学反应
B.能发生有效碰撞的分子一定是活化分子
C.其它条件不变,增大压强,能增大活化分子百分数,从而增大有效碰撞次数
D.催化剂能增大反应的活化能,从而加快反应速率
7.(22·23高二上·浙江宁波·期末)已知反应:,经过2min时间,B浓度减少了0.6mol/L。有关该反应速率的说法正确的是
A.0-2min用A表示的反应速率是0.4mol/(L·min)
B.0-2min用B表示的反应速率是0.3mol/(L·min)
C.2min末时用C表示的反应速率是0.2mol/(L·min)
D.分别用B、C、D表示的反应速率比值为2:3:6
8.(22·23高二上·浙江嘉兴·期末)采取下列措施对增大化学反应速率有明显效果的是
A.Fe与稀硫酸反应制取时,用浓硫酸代替稀硫酸
B.NaOH溶液和稀硝酸反应时,增大反应体系的压强
C.Na与水反应时,增加水的用量
D.工业上合成氨时,使用铁触媒作催化剂
9.(22·23高二上·浙江台州·期末)对于反应:,下列说法不正确的是
A.升高温度,化学反应速率增大 B.活化分子之间发生的碰撞一定是有效碰撞
C.升高温度能增加活化分子百分数 D.加入铂铑合金催化剂,化学反应速率增大
10.(22·23上·绍兴·期末)近似测定氧化KI的瞬时速率公式与速率常数k的实验流程如下:
加入KI后反应如下:①;②
在耗尽时溶液变蓝色瞬间记录用时,测得不同起始浓度下反应时间、反应速率与反应速率常数如表所示:
实验编号 1 2 3 4 5
溶液用量/mL 2.0 1.0 0.50 2.0 2.0
溶液用量/mL 2.0 2.0 2.0 1.0 0.50
溶液用量/mL 0 1.5 1 1.5
反应时间/s 37 68 133 72 139
反应速率 2.0 1.1 0.5 1.0
反应速率常数 3.4 3.8 3.4 3.4 4.0
下列说法正确的是
A.上表中的速率为完全消耗后测得的平均速率
B.由实验可知反应的速率公式为
C.表中数据,约为0.5
D.实验测得的5组反应速率常数不完全相等,说明浓度对k有影响
11.(22·23上·绍兴·期末)下列关于化学反应速率和化学平衡的说法正确的是
A.用少量的Zn与硫酸反应制备,则硫酸浓度越大,反应速率越快,产生的越多
B.恒温恒压条件下,反应达到平衡后,再充入一定量的稀有气体Ar,反应速率保持不变
C.某温度下,恒容容器中加入一定量的X,发生反应,达到平衡后,再加入一定量的X,达到新平衡后,X的浓度和体积分数均保持不变
D.对于反应达到平衡后,缩小容器体积,的浓度增大
12.(22·23上·湖州·期末)已知:。某化学小组欲探究溶液和酸性溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略溶液体积变化):
编号 0.01 mol·L酸性溶液体积/mL 0.1 mol·L 溶液体积/mL 水的体积/mL 反应温度/℃ 反应时间/min
Ⅰ 2 2 0 20 2.1
Ⅱ 2 1 20 5.5
Ⅲ 2 0 50 0.5
下列说法不正确的是
A.
B.设计实验Ⅰ、Ⅱ的目的是探究浓度对反应速率的影响
C.实验计时是从溶液混合开始,溶液紫红色褪去时结束
D.实验Ⅲ中用溶液的浓度变化表示的反应速率 mol·L·min
13.(22·23上·湖州·期末)下列说法正确的是
A.化学反应的反应热等于反应的焓变
B.决定化学反应速率的主要因素是体系的温度
C.对于需经过多个步骤的化学反应而言,活化能最小的那个步骤是决速步骤
D.有气体参加的反应,压缩容器体积,单位体积内活化分子数增多
14.(22·23上·舟山·期末)氮及其化合物的转化过程如图所示。下列分析合理的是
A.可逆反应的原子利用率不可能为100%
B.催化剂a表面发生了极性共价键的断裂和形成
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.使用催化剂可以降低反应的活化能,加快反应速率,从而提高单位时间的产率
15.(22·23上·衢州·期末)工厂的氨氯废水可用电化学催化氧化法加以处理,其中NH3在电极表面的氧化过程的微观示意图如图:
下列说法中,不正确的是
A.过程①②均有 N-H 键断裂
B.过程③的电极反应式为:_ e-+OH-=N+H2O
C.过程④中有非极性键形成
D.催化剂可以降低该反应的活化能
16.(22·23上·衢州·期末)以和为原料制备高纯度次氯酸的机理如图,V为元素钒,其最高化合价为价,、分别为两种不同氨基酸,下列说法不正确的是
A.该催化循环过程中有氢氧键的断裂和形成
B.反应过程中,中心原子钒的化合价和成键数目均发生改变
C.该机理中化合物a是催化剂,B、C、D、E是中间产物
D.该过程的总反应为:
17.(22·23高二上·浙江丽水·期末)下列有关电化学腐蚀和电化学保护的说法,不正确的是
A.图甲是钢铁的吸氧腐蚀示意图
B.图乙中的电解质溶液呈酸性
C.图丙中的电子被强制流向钢闸门
D.图丁是牺牲阳极示意图,利用了电解原理
18.(22·23高二上·浙江金华·期末)下列与金属腐蚀有关的说法正确的是
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,往烧杯中铁棒附近滴加几滴溶液,生成蓝色沉淀
C.图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大
D.图4中,采用外加电流法防止地下钢铁管道的腐蚀
19.(22·23高二上·浙江嘉兴·期末)下列有关金属的腐蚀与防护叙述正确的是
A.铁管上镶嵌锌块,采用的是牺牲阳极法使铁不易被腐蚀
B.用锡焊接的铁质品,焊接处不易腐蚀
C.用铁电极电解饱和食盐水:
D.用外加电流法保护钢铁设备时,将设备连接电源正极
20.(22·23高二上·浙江衢州·期末)下列说法不正确的是
A.电解精炼铜的阴极反应:Cu2++2e-=Cu
B.纯银器表面在空气中因电化学腐蚀渐渐变暗
C.稀土元素可以用来制造合金
D.储氢材料-镧镍合金(LaNi5)贮存氢气时发生了化学变化
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.根据反应历程图可知,产物相对能量低于反应物相对能量,故A错误;
B.根据反应历程图可知,中间产物Z变为过渡态IV,需要活化能最大,为186.19 kJ·mol 1,故B正确;
C.P2能量更低,更稳定,故C正确;
D.相同条件下反应需要活化能越小,则越需要效率更快,故D正确;
答案选A。
2.D
【详解】A.反应速率主要取决于慢的一步,所以反应速率主要取决于②的快慢,A正确;
B.由反应机理可知NOBr2是中间生成中间消耗,NOBr2是中间产物,B正确;
C.正反应放热,断裂化学键吸收的能量小于形成化学键放出的能量,则正反应的活化能比逆反应的活化能小akJ·mol-1,C正确;
D.增大浓度,活化分子百分数不变,D错误;
故选D。
3.D
【详解】A.根据盖斯定律可知,ΔH=ΔH1+ΔH2,A正确;
B.从图中可知,M(g)+B(g)的总能量大于2C(g),故反应Ⅱ为放热反应,B正确;
C.反应ⅠΔH1=生成物总能量-反应物总能量,反应Ⅰ为放热反应,则ΔH1=E1-E2,C正确;
D.从图中可知,反应Ⅱ的活化能较大,则反应①的速率由反应Ⅱ决定,D错误;
故答案选D。
4.B
【详解】A.由表中数据可知, 50min内反应物浓度变化:催化剂I作用时为0.60mol/L,催化剂I作用时为1.20mol/L,则反应速率:催化剂Ⅱ>催化剂Ⅰ,所以催化效果:催化剂Ⅱ优于催化剂I, A正确;
B.编号2和3实验的反应速率始终不变,分别为=0.024mol/L,,则编号2实验反应物恰好都消耗完所需时间,编号3实验反应物恰好都消耗完所需时间,B错误;
C.编号2的反应速率始终不变,为=0.024mol/L, C正确;
D.分析反应物浓度对反应速率的影响,应该对比编号2实验、3实验或编号l实验、3实验, 根据控制变量法可知,编号2实验和3实验或编号l实验和3实验均有两个变量不同,则不能据此判断反应物浓度与反应速率的关系,D正确;
故选B。
5.C
【详解】A.可以看作该反应的催化剂,根据反应的机理,化学反应速率与Fe3+浓度的大小有关,A正确;
B.反应物的总能量高于生成物的总能量,为放热反应,B正确;
C.Fe3+是该反应的催化剂,C错误;
D.加催化剂后会出现两个峰,不加,图中只出现一个能量峰,D正确;
故选C。
6.B
【详解】A.活化分子的碰撞不一定都能发生化学反应,只有活化分子碰撞时取向合适时才能发生化学反应,故A错误;
B.有效碰撞是能发生化学反应的碰撞,所以能发生有效碰撞的分子一定是活化分子,故B正确;
C.其它条件不变,增大压强,能增大单位体积内的活化分子数,从而增大有效碰撞次数,不能增大活化分子百分数,故C错误;
D.催化剂能降低反应的活化能,从而加快反应速率,故D错误;
故选B。
7.B
【详解】A.A物质是固态,不能表示反应速率,A错误;
B.经2 min后,B的浓度减少了0.6mol/L,则用B物质表示的反应速率是=0.3 mol/(L·min),B正确;
C.反应速率是一段时间内的平均值,而不是瞬时反应速率,C错误;
D.反应速率之比等于化学方程式中的化学计量数之比,故B、C、D表示的反应速率比值为3:2:1,D错误;
故选B。
8.D
【详解】A.浓硫酸和Fe发生钝化现象,且不生成氢气,加热时生成二氧化硫,故A不选;
B.NaOH溶液和稀硝酸反应中没有气体参与,增大反应体系的压强不影响反应速率,故B不选;
C.水为纯液体,所以Na与水反应时增大水的用量不影响反应速率,故C不选;
D.工业上合成氨时,使用铁触媒作催化剂,反应速率加快,故D选;
故选D。
9.B
【详解】A.升高温度,反应物能量升高,活化分子百分数增大,化学反应速率增大,A正确;
B.当活化分子有合适取向时的碰撞才是有效碰撞,所以活化分子之间发生的碰撞不一定是有效碰撞,B错误;
C.升高温度,反应物能量升高,活化分子百分数增大,C正确;
D.催化剂能降低反应所需活化能,增大活化分子百分数,化学反应速率增大,D正确;
故选B。
10.C
【详解】A.根据题目中的第一句话,表格中的速率应该为瞬时速率,A错误;
B.根据瞬时速率计算公式,分别选取1、3、4三组数据,带入相关量得到
联合①②,解得n=1;联系②③,解得m=1,B错误;
C.将v5带入速率公式得到
解之v5=0.5,C正确;
D. 速率常数与反应温度、反应介质(溶剂)、催化剂等有关,甚至会随反应器的形状、性质而异。与浓度无关,D错误;
故选C。
11.D
【详解】A.应用Zn与稀硫酸反应制备H2,若是浓硫酸反应没有氢气生成,A错误;
B.恒温恒压条件下,再充入稀有气体Ar,容器体积增大,各组分浓度减小,反应速率减小,B错误;
C.该反应属于气体体积不变的反应,恒温恒容条件下,再加入一定量的X,等效于加压,达到新平衡后,各组分的浓度增大,但平衡不移动,X体积分数保持不变,C错误;
D.达到平衡后,缩小容器体积,各组分浓度增大,D正确;
故选D。
12.D
【详解】A.根据单一变量原则,实验Ⅰ是对照实验,溶液总体积为4mL,则V1=4-2-1=1,V2=4-2=2,故A正确;
B.实验目的是探究反应过程中浓度、温度对化学反应速率的影响,实验Ⅰ和Ⅱ的温度相同但其浓度不同,则设计实验Ⅰ、Ⅱ的目的是探究浓度对反应速率的影响,故B正确;
C.该定性实验是根据酸性KMnO4溶液褪色时间来判断反应快慢的,所以实验计时是从溶液混合开始,溶液紫红色褪去时结束,故C正确;
D.实验Ⅲ中草酸过量,两种溶液混合瞬间c(KMnO4)=0.01mol/L×=0.005mol/L,反应完全时△c=0.005mol/L,v(KMnO4)==0.01mol/(L·min),故D错误;
答案为D。
13.D
【详解】A.等压条件下的化学反应的反应热等于反应的焓变,故A错误;
B.决定化学反应速率的主要因素是物质本身的性质,故B错误;
C.对于需经过多个步骤的化学反应而言,活化能最大的那个步骤是决速步骤,故C错误;
D.有气体参加的反应,压缩容器体积,单位体积内分子数增多,活化分子数增加,活化分子百分数不变,故D正确。
综上所述,答案为D。
14.D
【详解】A.N2与 H2反应生成NH3,反应物参加反应过程中原子利用率为 100%,A错误;
B.催化剂a表面是氢气和氮气反应生成氨气,催化剂a表面发生了非极性共价键的断裂和极性键的形成,B错误;
C.催化剂b表面是氨气催化氧化生成 NO的反应,发生的是氧化还原反应,C错误;
D.催化剂a、b改变反应速率,不改变化学平衡,不能提高反应的平衡转化率,可以提高单位时间内的产率,D正确;
故选D。
15.B
【详解】A.由图可知,NH3在过程①中变为NH2,NH2在过程②中变为NH,则过程①②均有N-H键断裂,故A正确;
B.由图可知,NH失去电子结合OH-,转变为N和H2O,则过程③的电极反应式为:NH-e-+OH-=N+H2O,故B错误;
C.过程④中形成N≡N键,则过程④中有非极性键形成,故C正确;
D.使用催化剂该反应的焓变不变,可以降低活化能加快反应的速率,故D正确;
故选B。
16.B
【详解】A.b→c过程中有氧氢键断裂,c→d过程中有氧氢键形成,选项A正确;
B.反应过程中,从 a→b钒的成键数目增多,但化合价均为+5价,选项B不正确;
C.该机理中化合物a在整个反应过程中质量和化学性质没有发生变化,是催化剂,b、c、d、e是中间产物,选项C正确;
D.该过程的总反应为:,选项D正确;
答案选B。
17.D
【详解】A.图甲中氧气得到电子转化为氢氧根离子,属于钢铁的吸氧腐蚀示意图,A正确;
B.图乙中氢离子得到电子转化为氢气,属于钢铁的析氢腐蚀,说明电解质溶液呈酸性,B正确;
C.图丙中钢铁和电源的负极相连,作阴极被保护,这说明电子被强制流向钢闸门,C正确;
D.图丁中负极是锌,属于牺牲阳极的阴极保护法,利用了原电池原理,D错误;
答案选D。
18.B
【详解】A.插入海水中的铁棒,越靠近底端,海水中氧气的浓度越小,越不易腐蚀,故A错误;
B.由图可知,铁和铜在酸化的氯化钠溶液中构成原电池,金属铁是负极,失电子发生氧化反应生成亚铁离子,亚铁离子与滴入的铁氰化钾溶液反应生成蓝色沉淀,故B正确;
C.由图可知,开关由M改置于N时,锌为原电池的负极,铜锌合金为正极被保护,则合金的腐蚀速率减慢,故C错误;
D.由图可知,保护钢铁管道的方法为牺牲阳极的阴极保护法,不是外加直流电源的阴极保护法,故D错误;
故选B。
19.A
【详解】A.铁块上镶嵌锌块,锌金属活动性强于铁,作负极起到保护铁管的作用,采用的是牺牲阳极的阴极保护法,A正确;
B.铁的金属活动性强于锡,用锡焊接的铁制品,焊接处铁作负极较易被腐蚀,B错误;
C.用铁作电极电解饱和食盐水,阳极上铁失电子而不是氯离子失电子,C错误;
D.用外加电流法保护钢铁设备,设备连接电源负极,D错误;
故答案选A。
20.B
【详解】A.电解精炼铜时,溶液中的Cu2+在阴极得电子生成Cu,电极反应为Cu2++2e-═Cu,故A正确;
B.发生电化学腐蚀时,金属应不纯,纯银Ag在空气中和硫化氢反应生成Ag2S而渐渐变暗,属于化学腐蚀,故B错误;
C.在合金中加入适量稀土金属,能大大改善合金的性能,所以稀土元素被誉为新材料的宝库,又被称为“冶金工业的维生素”,故C正确;
D.贮氢金属在一定的温度和压强下能够大量吸收氢气,一个金属原子可以与两三个乃至更多个氢原子结合,形成金属氢化物,属于化学变化,故D正确;
故选:B。
答案第1页,共2页
答案第1页,共2页
同课章节目录
