化学人教版(2019)选择性必修1 3.3.1盐类水解 课件(共15张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.1盐类水解 课件(共15张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 68.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 14:43:12 | ||
图片预览



文档简介
(共15张PPT)
探秘盐类水解
引用:百度图片
旧知回顾
请根据FeCl3溶液制备Fe(OH)3胶体的实验原理
推测FeCl3溶液的酸碱性。
酸溶液显酸性,碱溶液显碱性,那么盐溶液的酸碱性如何?
FeCl3+3H2O 3HCl+Fe(OH)3(胶体)
视频导入
实验探究:利用pH计测试同浓度的下列盐溶液的酸碱性,请同学们观察并记录实验现象。
主线任务一 盐类水解初探
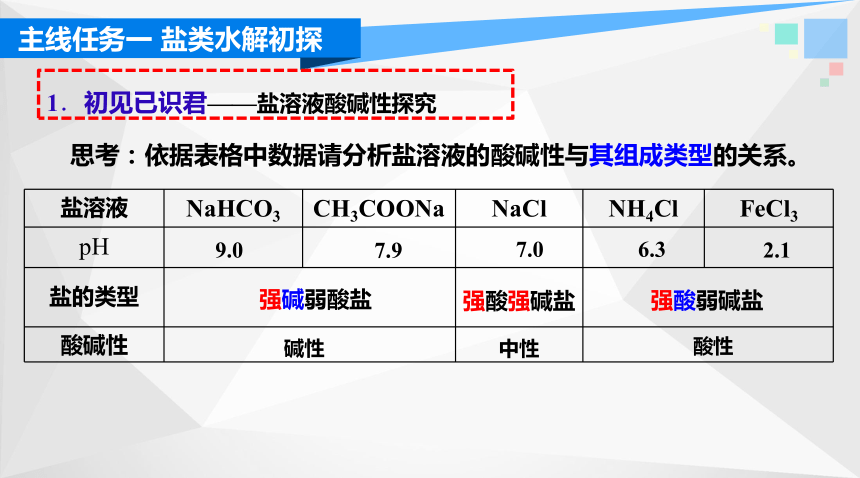
1.初见已识君——盐溶液酸碱性探究
思考:依据表格中数据请分析盐溶液的酸碱性与其组成类型的关系。
盐溶液 NaHCO3 CH3COONa NaCl NH4Cl FeCl3
pH
盐的类型 酸碱性 强酸强碱盐
强碱弱酸盐
强酸弱碱盐
7.0
9.0
6.3
2.1
7.9
中性
酸性
碱性
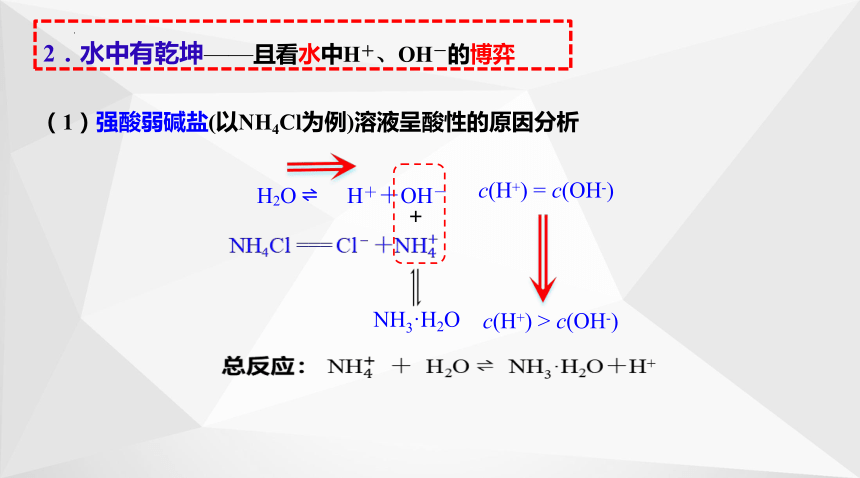
2.水中有乾坤——且看水中H+、OH-的博弈
(1)强酸弱碱盐(以NH4Cl为例)溶液呈酸性的原因分析
H2O H++OH-
NH4Cl === Cl-+
c(H+) > c(OH-)
NH3·H2O
+
总反应: + H2O NH3·H2O+H+
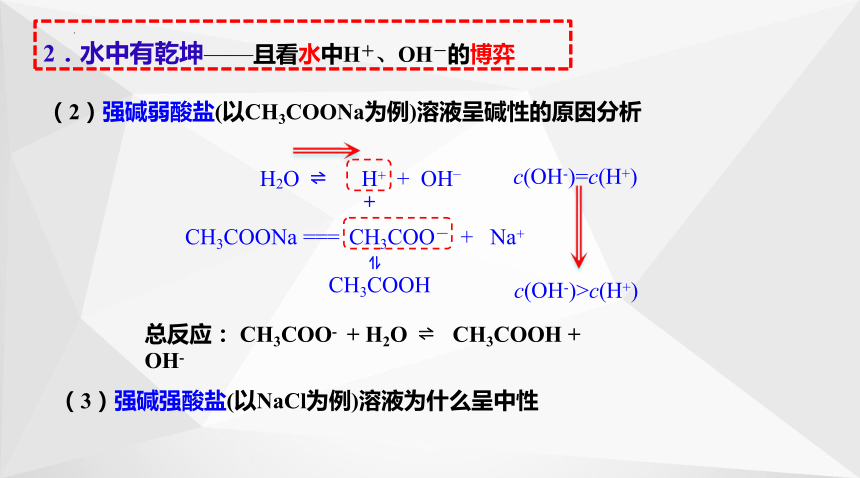
c(H+) = c(OH-)
H2O H+ + OH–
CH3COONa === CH3COO- + Na+
c(OH-)=c(H+)
总反应: CH3COO- + H2O CH3COOH + OH-
(2)强碱弱酸盐(以CH3COONa为例)溶液呈碱性的原因分析
CH3COOH
+
c(OH-)>c(H+)
2.水中有乾坤——且看水中H+、OH-的博弈
(3)强碱强酸盐(以NaCl为例)溶液为什么呈中性
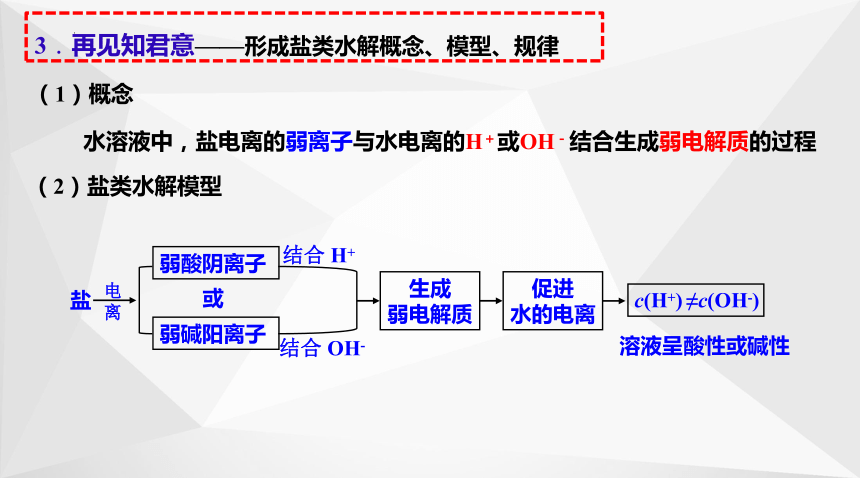
水溶液中,盐电离的弱离子与水电离的H+或OH-结合生成弱电解质的过程
盐
弱酸阴离子
或
弱碱阳离子
结合 H+
电离
结合 OH-
生成
弱电解质
促进
水的电离
溶液呈酸性或碱性
c(H+) ≠c(OH-)
(1)概念
(2)盐类水解模型
3.再见知君意——形成盐类水解概念、模型、规律
试写出以下盐水解的方程式
NaClO
(NH4)2SO4
NaHCO3
FeCl3
4.愿君解吾意——模型运用
ClO- + H2O OH- +HClO
NH4+ + H2O NH3·H2O + H+
HCO3- + H2O OH- +H2CO3
Fe3+ + 3H2O 3H+ + Fe(OH)3
主线任务二 盐类水解影响因素
探因有先手 —— 实验探究温度、浓度对盐类水解程度的影响
温度对盐类水解平衡的影响
实验操作 温度变量 pH
用pH计测试0.01mol/L FeCl3溶液在不同温度下的pH 室温
热水
结论 2.0
1.6
以Fe3++3H2O 3H++Fe(OH)3为例
温度升高,水解平衡正向移动
实验操作 浓度变量 颜色
三支试管中分别取2mL 0.01mol/L FeCl3溶液,加入下列物质,观察溶液颜色变化。 1试管中加入2滴浓盐酸
2试管加入2滴蒸馏水
3试管加入2滴浓的FeCl3溶液
结论 浓度对盐类水解平衡的影响
加入反应物,水解平衡正向移动
加入生成物,水解平衡逆向移动
小贴士:Fe3+在溶液中显黄色,Fe(OH)3在溶液中显红褐红色。
变浅
橙黄色
变深
以FeCl3+3H2O 3HCl+Fe(OH)3为例
化学与生活
绿色净水剂高铁酸钾(K FeO ),在水体净化中的独特效果是同时发挥氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭的协同作用,并不产生任何有毒、有害的物质。请分析高铁酸钾净水絮凝的原理。
(已知:高铁酸钾溶于水会产生Fe3+)
课堂小结
课堂感悟
每天的努力就像微弱的盐类水解,以跬步至千里,
以细流成江海。
愿你的每天都在奋斗中精彩。
感谢观赏
单击此处添加文本具体内容
探秘盐类水解
引用:百度图片
旧知回顾
请根据FeCl3溶液制备Fe(OH)3胶体的实验原理
推测FeCl3溶液的酸碱性。
酸溶液显酸性,碱溶液显碱性,那么盐溶液的酸碱性如何?
FeCl3+3H2O 3HCl+Fe(OH)3(胶体)
视频导入
实验探究:利用pH计测试同浓度的下列盐溶液的酸碱性,请同学们观察并记录实验现象。
主线任务一 盐类水解初探
1.初见已识君——盐溶液酸碱性探究
思考:依据表格中数据请分析盐溶液的酸碱性与其组成类型的关系。
盐溶液 NaHCO3 CH3COONa NaCl NH4Cl FeCl3
pH
盐的类型 酸碱性 强酸强碱盐
强碱弱酸盐
强酸弱碱盐
7.0
9.0
6.3
2.1
7.9
中性
酸性
碱性
2.水中有乾坤——且看水中H+、OH-的博弈
(1)强酸弱碱盐(以NH4Cl为例)溶液呈酸性的原因分析
H2O H++OH-
NH4Cl === Cl-+
c(H+) > c(OH-)
NH3·H2O
+
总反应: + H2O NH3·H2O+H+
c(H+) = c(OH-)
H2O H+ + OH–
CH3COONa === CH3COO- + Na+
c(OH-)=c(H+)
总反应: CH3COO- + H2O CH3COOH + OH-
(2)强碱弱酸盐(以CH3COONa为例)溶液呈碱性的原因分析
CH3COOH
+
c(OH-)>c(H+)
2.水中有乾坤——且看水中H+、OH-的博弈
(3)强碱强酸盐(以NaCl为例)溶液为什么呈中性
水溶液中,盐电离的弱离子与水电离的H+或OH-结合生成弱电解质的过程
盐
弱酸阴离子
或
弱碱阳离子
结合 H+
电离
结合 OH-
生成
弱电解质
促进
水的电离
溶液呈酸性或碱性
c(H+) ≠c(OH-)
(1)概念
(2)盐类水解模型
3.再见知君意——形成盐类水解概念、模型、规律
试写出以下盐水解的方程式
NaClO
(NH4)2SO4
NaHCO3
FeCl3
4.愿君解吾意——模型运用
ClO- + H2O OH- +HClO
NH4+ + H2O NH3·H2O + H+
HCO3- + H2O OH- +H2CO3
Fe3+ + 3H2O 3H+ + Fe(OH)3
主线任务二 盐类水解影响因素
探因有先手 —— 实验探究温度、浓度对盐类水解程度的影响
温度对盐类水解平衡的影响
实验操作 温度变量 pH
用pH计测试0.01mol/L FeCl3溶液在不同温度下的pH 室温
热水
结论 2.0
1.6
以Fe3++3H2O 3H++Fe(OH)3为例
温度升高,水解平衡正向移动
实验操作 浓度变量 颜色
三支试管中分别取2mL 0.01mol/L FeCl3溶液,加入下列物质,观察溶液颜色变化。 1试管中加入2滴浓盐酸
2试管加入2滴蒸馏水
3试管加入2滴浓的FeCl3溶液
结论 浓度对盐类水解平衡的影响
加入反应物,水解平衡正向移动
加入生成物,水解平衡逆向移动
小贴士:Fe3+在溶液中显黄色,Fe(OH)3在溶液中显红褐红色。
变浅
橙黄色
变深
以FeCl3+3H2O 3HCl+Fe(OH)3为例
化学与生活
绿色净水剂高铁酸钾(K FeO ),在水体净化中的独特效果是同时发挥氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭的协同作用,并不产生任何有毒、有害的物质。请分析高铁酸钾净水絮凝的原理。
(已知:高铁酸钾溶于水会产生Fe3+)
课堂小结
课堂感悟
每天的努力就像微弱的盐类水解,以跬步至千里,
以细流成江海。
愿你的每天都在奋斗中精彩。
感谢观赏
单击此处添加文本具体内容
