化学工艺流程题 二轮专题 (共27张PPT)
文档属性
| 名称 | 化学工艺流程题 二轮专题 (共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 15:46:04 | ||
图片预览








文档简介
(共27张PPT)
大题突破练(一) 化学工艺流程题
2024
1
2
3
4
5
6
1.(2023·辽宁锦州一模)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)在该流程中可循环使用的物质是Zn和H2SO4,基态S原子占据最高能级的原子轨道的形状为 , 的空间结构为 。
哑铃形
正四面体形
1
2
3
4
5
6
(2)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS发生主要反应的化学方程式: ;“含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的 = 。[已知: (H2SO3)=1.4×10-2;
(H2SO3)=6.0×10-8]
(3)浸出液“净化”过程中加入的主要物质为锌粉(过量),所得“滤渣”的成分为 (填化学式),分离“滤液”与“滤渣”的操作名称为 。
3FeS+5O2 Fe3O4+3SO2
6×10-3
Zn、Fe
过滤
1
2
3
4
5
6
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是 (填字母)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq),该反应的平衡常数K= 。[已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]
A
2.5×1011
1
2
3
4
5
6
(3)浸出液中含有铁离子和亚铁离子,加入过量Zn,铁离子和亚铁离子与Zn反应生成Fe,所得滤渣的成分为Zn、Fe。分离滤液和滤渣的操作名称为过滤。
(4)①将稀硫酸更换为98%的浓硫酸,不会加快浸取反应速率,而且浓硫酸参与的反应会生成SO2造成空气污染,A错误;将硫化锌精矿粉碎,反应物接触面积增大,反应速率增大,B正确;适当提高温度,反应速率增大,C正确。
②根据离子方程式可知,
1
2
3
4
5
6
1
2
3
4
5
6
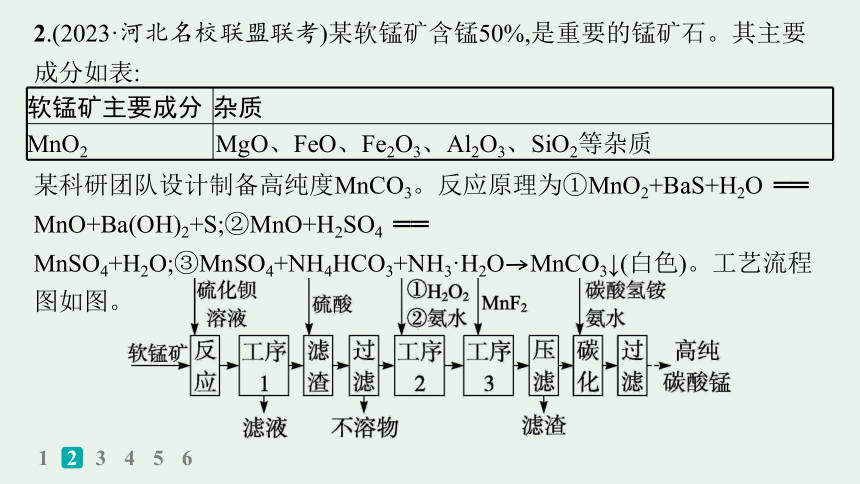
2.(2023·河北名校联盟联考)某软锰矿含锰50%,是重要的锰矿石。其主要成分如表:
软锰矿主要成分 杂质
MnO2 MgO、FeO、Fe2O3、Al2O3、SiO2等杂质
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O ══ MnO+Ba(OH)2+S;②MnO+H2SO4 ══ MnSO4+H2O;③MnSO4+NH4HCO3+NH3·H2O→MnCO3↓(白色)。工艺流程图如图。
1
2
3
4
5
6
回答下列问题:
(1)软锰矿与硫化钡反应时,适当提高反应液温度的目的是 。
(2)“不溶物”中除SiO2外,还有 (填化学式)。
(3)工序2中加入H2O2的目的是 ,使用氨水调溶液的pH,理论上pH最小值为 。(通常认为溶液中离子浓度小于10-5 mol·L-1时沉淀完全;Ksp[Fe(OH)3]=10-38.6、Ksp[Fe(OH)2]=10-16.3、Ksp[Al(OH)3]=10-32.3、Ksp[Mn(OH)2]=10-12.7)
(4)MnF2难溶于水,工序3加入MnF2的目的是除去Mg2+,其反应的离子方程式为 。
(5)碳化过程中发生反应的化学方程式 为 。
加快反应速率
S
将Fe2+氧化为Fe3+
4.9
MnF2(s)+Mg2+(aq) MgF2(s)+Mn2+(aq)
MnSO4+NH4HCO3+NH3·H2O ══ MnCO3↓+(NH4)2SO4+H2O
1
2
3
4
5
6
1
2
3
4
5
6
3.(2023·辽宁沈阳二模)重铬酸钾(K2Cr2O7)在实验室和工业上都有广泛应用。如工业中常将其用于制铬矾、火柴、电镀、有机合成等。工业上以铬铁矿[主要成分为Fe(CrO2)2,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
1
2
3
4
5
6
已知:①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,铝的氧化物转化为NaAlO2。
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示,当溶液中可溶性组分浓度c≤1.0×10-5 mol·L-1时,可认为已除尽。
1
2
3
4
5
6
请回答下列问题:
(1)写出焙烧过程中发生的主要反应的化学方程式:
。
(2)水浸滤渣的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式: 。
(3)中和步骤中理论pH的范围是 ,中和后滤渣的主要成分是
(填化学式)。
(4)酸化时加冰醋酸调节pH约等于5,写出酸化过程中反应的离子方程式: 。
4.5~9.3
H2SiO3、Al(OH)3
1
2
3
4
5
6
(5)工序Ⅰ经过过滤、洗涤后获得粗产品,则工序Ⅱ的操作方法是 。
(6)可以采用氧化还原滴定法测定产品的纯度,还可以采用分光光度法测定(K2Cr2O7溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制K2Cr2O7待测液时少加了一种试剂,该试剂可以是
(填字母)。
a.硫酸 b.氢碘酸
c.硝酸钾 d.氢氧化钾
重结晶
a
1
2
3
4
5
6
4.(2023·湖南长郡中学二模)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:该工艺中,pH>6.0时,溶液中Mo元素以 的形态存在。
1
2
3
4
5
6
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为 。
(2)“沉铝”中,生成沉淀X的离子方程式为 。
(3)“沉钼”中,pH为7.0,生成BaMoO4的离子方程式为 。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为 (填化学式)。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量 (填化学式)气体,再通入足量CO2,可析出Y。
+6价
NaHCO3
NH3
1
2
3
4
5
6
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
①该氧化物为 。
②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂的物质的量之比为 。
Al2O3
4∶1
1
2
3
4
5
6
解析 (4)①滤液Ⅰ中通入过量的二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,同时生成碳酸氢钠,过滤得到的滤液Ⅱ中含有碳酸氢钠和钼酸钠。滤液Ⅱ中加入适量的氯化钡溶液沉钼后,过滤得到的滤液Ⅲ中,主要存在的钠盐有NaCl和NaHCO3。
②根据侯氏制碱法的原理可知,往滤液Ⅲ中添加适量NaCl固体后,通入足量NH3,再通入足量CO2,可析出NaHCO3。
(5)①由题中信息可知,致密的保护膜为一种氧化物,是由H2O2与AlAs反应生成的,联想到金属铝表面容易形成致密的氧化膜可知,该氧化物为Al2O3。
②由Ga和Al同族、As和N同族可知,GaAs中Ga显+3价(其最高价)、As显-3价。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,其化合价升高8,As元素被氧化,则该反应的氧化剂为H2O2,还原剂为GaAs。根据得失电子守恒可知,该反应的氧化剂与还原剂的物质的量之比为8∶2=4∶1。
1
2
3
4
5
6
5.(2023·辽宁瓦房店一模)锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如下。回答下列问题:
1
2
3
4
5
6
已知:①MnSO4·H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
1
2
3
4
5
6
(1)请写出Mn原子基态价层电子排布式: 。
(2)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为 。
(3)“还原酸浸”过程中主要反应的离子方程式为 。
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为 。
3d54s2
1∶3
C6H12O6+24H++12MnO2 ══ 12Mn2++6CO2↑+18H2O
少量多次加入葡萄糖
1
2
3
4
5
6
(5)整个流程中可循环利用的物质是 。获得MnSO4·H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是______________________________________________________
。
(6)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为 mol·L-1(保留两位小数)。判断沉淀转化能否彻底进行并说明理由___________________________________________________
。
[已知:20 ℃时Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,1.262≈1.6]
醋酸(CH3COOH)
向漏斗中加入乙醇至浸没MnSO4·H2O晶体(或沉淀),待乙醇自然流下,重复2~3次
5.87×10-10
该沉淀转化反应能彻底进行,因为该沉淀转化反应的平衡
常数为 ≈2.16×105>1×105,所以能彻底进行
1
2
3
4
5
6
1
2
3
4
5
6
6.(2023·山西吕梁二模)钪(Sc)是一种重要且价格昂贵的稀土金属,广泛用于航空航天、超导等领域。从赤泥(含有Sc2O3、Al2O3、Fe2O3、TiO2等)中回收钪,同时生产聚合硫酸铁铝的工艺流程如图所示:
1
2
3
4
5
6
回答下列问题:
(1)写出基态Sc原子的简化电子排布式: 。
(2)在酸浸赤泥的后续萃取分离过程中,Fe3+与Sc3+会发生共萃而进入有机相,从而使后续分离难度加大,经探究温度、硫酸浓度与铁、钪的浸出率及分离系数(钪的浸出率和铁的浸出率比值)关系如下图所示,则酸浸的最佳浸出温度为 ℃,最佳硫酸浓度为 mol·L-1。
[Ar]3d14s2
70
10
1
2
3
4
5
6
(3)该工艺条件下,溶液中有关离子开始沉淀和完全沉淀的pH如表所示:
离子 Fe2+ Fe3+ Al3+ TiO2+
开始沉淀的pH 7.0 1.9 3.0 0.3
完全沉淀的pH 9.0 3.2 4.7 2.0
①已知TiO2和硫酸反应生成水溶性的TiO2+,则流程中TiO2+水解生成TiO2·xH2O的离子方程式为 。
②试剂A常选用H2O2,写出其在生产、生活中可能的用途:
(填一条即可)。
TiO2++(x+1)H2O ══ TiO2·xH2O+2H+
在生产中作绿色氧化剂,除去一些具有还原性的微粒或检验一些还原性的微粒;在生活中可以用稀释的H2O2水溶液作耳道清洗剂
③该工艺流程中引入“还原”与“氧化”这两个步骤的原因是
。
引入“还原”是为了防止Fe3+在水解步骤消耗;氧化步骤目的是将Fe2+转化为Fe3+,便于制备聚合硫酸铁铝
1
2
3
4
5
6
(4)含钪元素的微粒与lg c(F-)、pH的关系如下图所示,“沉钪”时,溶液的pH=3,c(F-)=10-4 mol·L-1,则此时钪的存在形式为 (填化学式)。
(5)“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,该步骤的离子方程式为 。
ScF3
1
2
3
4
5
6
解析 (2)根据图示可知Fe3+、Sc3+浸出率在70 ℃时比较高,故酸浸的最佳浸出温度为70 ℃;Fe3+、Sc3+浸出率在硫酸浓度为10 mol·L-1时较高,故硫酸合适浓度是10 mol·L-1。
(4)c(F-)=10-4 mol·L-1,则lg c(F-)=-4,在溶液pH=3时,根据图示可知Sc元素的存在形式主要是ScF3。
(5)在“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,根据元素守恒可知该气体为CO2,发生反应的离子方程式为
大题突破练(一) 化学工艺流程题
2024
1
2
3
4
5
6
1.(2023·辽宁锦州一模)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)在该流程中可循环使用的物质是Zn和H2SO4,基态S原子占据最高能级的原子轨道的形状为 , 的空间结构为 。
哑铃形
正四面体形
1
2
3
4
5
6
(2)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS发生主要反应的化学方程式: ;“含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的 = 。[已知: (H2SO3)=1.4×10-2;
(H2SO3)=6.0×10-8]
(3)浸出液“净化”过程中加入的主要物质为锌粉(过量),所得“滤渣”的成分为 (填化学式),分离“滤液”与“滤渣”的操作名称为 。
3FeS+5O2 Fe3O4+3SO2
6×10-3
Zn、Fe
过滤
1
2
3
4
5
6
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是 (填字母)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq),该反应的平衡常数K= 。[已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]
A
2.5×1011
1
2
3
4
5
6
(3)浸出液中含有铁离子和亚铁离子,加入过量Zn,铁离子和亚铁离子与Zn反应生成Fe,所得滤渣的成分为Zn、Fe。分离滤液和滤渣的操作名称为过滤。
(4)①将稀硫酸更换为98%的浓硫酸,不会加快浸取反应速率,而且浓硫酸参与的反应会生成SO2造成空气污染,A错误;将硫化锌精矿粉碎,反应物接触面积增大,反应速率增大,B正确;适当提高温度,反应速率增大,C正确。
②根据离子方程式可知,
1
2
3
4
5
6
1
2
3
4
5
6
2.(2023·河北名校联盟联考)某软锰矿含锰50%,是重要的锰矿石。其主要成分如表:
软锰矿主要成分 杂质
MnO2 MgO、FeO、Fe2O3、Al2O3、SiO2等杂质
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O ══ MnO+Ba(OH)2+S;②MnO+H2SO4 ══ MnSO4+H2O;③MnSO4+NH4HCO3+NH3·H2O→MnCO3↓(白色)。工艺流程图如图。
1
2
3
4
5
6
回答下列问题:
(1)软锰矿与硫化钡反应时,适当提高反应液温度的目的是 。
(2)“不溶物”中除SiO2外,还有 (填化学式)。
(3)工序2中加入H2O2的目的是 ,使用氨水调溶液的pH,理论上pH最小值为 。(通常认为溶液中离子浓度小于10-5 mol·L-1时沉淀完全;Ksp[Fe(OH)3]=10-38.6、Ksp[Fe(OH)2]=10-16.3、Ksp[Al(OH)3]=10-32.3、Ksp[Mn(OH)2]=10-12.7)
(4)MnF2难溶于水,工序3加入MnF2的目的是除去Mg2+,其反应的离子方程式为 。
(5)碳化过程中发生反应的化学方程式 为 。
加快反应速率
S
将Fe2+氧化为Fe3+
4.9
MnF2(s)+Mg2+(aq) MgF2(s)+Mn2+(aq)
MnSO4+NH4HCO3+NH3·H2O ══ MnCO3↓+(NH4)2SO4+H2O
1
2
3
4
5
6
1
2
3
4
5
6
3.(2023·辽宁沈阳二模)重铬酸钾(K2Cr2O7)在实验室和工业上都有广泛应用。如工业中常将其用于制铬矾、火柴、电镀、有机合成等。工业上以铬铁矿[主要成分为Fe(CrO2)2,杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
1
2
3
4
5
6
已知:①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,铝的氧化物转化为NaAlO2。
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示,当溶液中可溶性组分浓度c≤1.0×10-5 mol·L-1时,可认为已除尽。
1
2
3
4
5
6
请回答下列问题:
(1)写出焙烧过程中发生的主要反应的化学方程式:
。
(2)水浸滤渣的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式: 。
(3)中和步骤中理论pH的范围是 ,中和后滤渣的主要成分是
(填化学式)。
(4)酸化时加冰醋酸调节pH约等于5,写出酸化过程中反应的离子方程式: 。
4.5~9.3
H2SiO3、Al(OH)3
1
2
3
4
5
6
(5)工序Ⅰ经过过滤、洗涤后获得粗产品,则工序Ⅱ的操作方法是 。
(6)可以采用氧化还原滴定法测定产品的纯度,还可以采用分光光度法测定(K2Cr2O7溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制K2Cr2O7待测液时少加了一种试剂,该试剂可以是
(填字母)。
a.硫酸 b.氢碘酸
c.硝酸钾 d.氢氧化钾
重结晶
a
1
2
3
4
5
6
4.(2023·湖南长郡中学二模)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:该工艺中,pH>6.0时,溶液中Mo元素以 的形态存在。
1
2
3
4
5
6
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为 。
(2)“沉铝”中,生成沉淀X的离子方程式为 。
(3)“沉钼”中,pH为7.0,生成BaMoO4的离子方程式为 。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为 (填化学式)。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量 (填化学式)气体,再通入足量CO2,可析出Y。
+6价
NaHCO3
NH3
1
2
3
4
5
6
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
①该氧化物为 。
②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂的物质的量之比为 。
Al2O3
4∶1
1
2
3
4
5
6
解析 (4)①滤液Ⅰ中通入过量的二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,同时生成碳酸氢钠,过滤得到的滤液Ⅱ中含有碳酸氢钠和钼酸钠。滤液Ⅱ中加入适量的氯化钡溶液沉钼后,过滤得到的滤液Ⅲ中,主要存在的钠盐有NaCl和NaHCO3。
②根据侯氏制碱法的原理可知,往滤液Ⅲ中添加适量NaCl固体后,通入足量NH3,再通入足量CO2,可析出NaHCO3。
(5)①由题中信息可知,致密的保护膜为一种氧化物,是由H2O2与AlAs反应生成的,联想到金属铝表面容易形成致密的氧化膜可知,该氧化物为Al2O3。
②由Ga和Al同族、As和N同族可知,GaAs中Ga显+3价(其最高价)、As显-3价。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,其化合价升高8,As元素被氧化,则该反应的氧化剂为H2O2,还原剂为GaAs。根据得失电子守恒可知,该反应的氧化剂与还原剂的物质的量之比为8∶2=4∶1。
1
2
3
4
5
6
5.(2023·辽宁瓦房店一模)锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如下。回答下列问题:
1
2
3
4
5
6
已知:①MnSO4·H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
1
2
3
4
5
6
(1)请写出Mn原子基态价层电子排布式: 。
(2)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为 。
(3)“还原酸浸”过程中主要反应的离子方程式为 。
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为 。
3d54s2
1∶3
C6H12O6+24H++12MnO2 ══ 12Mn2++6CO2↑+18H2O
少量多次加入葡萄糖
1
2
3
4
5
6
(5)整个流程中可循环利用的物质是 。获得MnSO4·H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是______________________________________________________
。
(6)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为 mol·L-1(保留两位小数)。判断沉淀转化能否彻底进行并说明理由___________________________________________________
。
[已知:20 ℃时Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,1.262≈1.6]
醋酸(CH3COOH)
向漏斗中加入乙醇至浸没MnSO4·H2O晶体(或沉淀),待乙醇自然流下,重复2~3次
5.87×10-10
该沉淀转化反应能彻底进行,因为该沉淀转化反应的平衡
常数为 ≈2.16×105>1×105,所以能彻底进行
1
2
3
4
5
6
1
2
3
4
5
6
6.(2023·山西吕梁二模)钪(Sc)是一种重要且价格昂贵的稀土金属,广泛用于航空航天、超导等领域。从赤泥(含有Sc2O3、Al2O3、Fe2O3、TiO2等)中回收钪,同时生产聚合硫酸铁铝的工艺流程如图所示:
1
2
3
4
5
6
回答下列问题:
(1)写出基态Sc原子的简化电子排布式: 。
(2)在酸浸赤泥的后续萃取分离过程中,Fe3+与Sc3+会发生共萃而进入有机相,从而使后续分离难度加大,经探究温度、硫酸浓度与铁、钪的浸出率及分离系数(钪的浸出率和铁的浸出率比值)关系如下图所示,则酸浸的最佳浸出温度为 ℃,最佳硫酸浓度为 mol·L-1。
[Ar]3d14s2
70
10
1
2
3
4
5
6
(3)该工艺条件下,溶液中有关离子开始沉淀和完全沉淀的pH如表所示:
离子 Fe2+ Fe3+ Al3+ TiO2+
开始沉淀的pH 7.0 1.9 3.0 0.3
完全沉淀的pH 9.0 3.2 4.7 2.0
①已知TiO2和硫酸反应生成水溶性的TiO2+,则流程中TiO2+水解生成TiO2·xH2O的离子方程式为 。
②试剂A常选用H2O2,写出其在生产、生活中可能的用途:
(填一条即可)。
TiO2++(x+1)H2O ══ TiO2·xH2O+2H+
在生产中作绿色氧化剂,除去一些具有还原性的微粒或检验一些还原性的微粒;在生活中可以用稀释的H2O2水溶液作耳道清洗剂
③该工艺流程中引入“还原”与“氧化”这两个步骤的原因是
。
引入“还原”是为了防止Fe3+在水解步骤消耗;氧化步骤目的是将Fe2+转化为Fe3+,便于制备聚合硫酸铁铝
1
2
3
4
5
6
(4)含钪元素的微粒与lg c(F-)、pH的关系如下图所示,“沉钪”时,溶液的pH=3,c(F-)=10-4 mol·L-1,则此时钪的存在形式为 (填化学式)。
(5)“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,该步骤的离子方程式为 。
ScF3
1
2
3
4
5
6
解析 (2)根据图示可知Fe3+、Sc3+浸出率在70 ℃时比较高,故酸浸的最佳浸出温度为70 ℃;Fe3+、Sc3+浸出率在硫酸浓度为10 mol·L-1时较高,故硫酸合适浓度是10 mol·L-1。
(4)c(F-)=10-4 mol·L-1,则lg c(F-)=-4,在溶液pH=3时,根据图示可知Sc元素的存在形式主要是ScF3。
(5)在“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,根据元素守恒可知该气体为CO2,发生反应的离子方程式为
同课章节目录
