人教版 高中化学 选择性必修1 1.1反应热(共32张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修1 1.1反应热(共32张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-16 18:16:24 | ||
图片预览











文档简介
(共32张PPT)
汇报人:XXX
XX月XX日
第一节 反应热
人教版高中化学选择必修一
第一节 反应热内容要求1、认识化学能可以与热能、电能等其他形式能量之间相互转化,能量的转化遵循能量守恒定律2、知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响3、认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示4、知道中和反应热的测定方法5、了解不同燃料的燃烧热学业要求能辩识化学反应中的能量转化形式能解释化学反应中能量变化的本质能进行反应焓变的简单计算能用热化学方程式表示反应中的能量变化能运反应焓变合理选择和利用化学反应知识回顾1、常见的吸热反应和放热反应有哪些?2、化学反应中能量变化的主要原因是什么?3、从宏观上看,化学反应中的能量变化的原因是什么?常见的吸热反应和放热反应放热反应吸热反应反应类型①大多数化合反应②所有的燃烧及缓慢氧化反应③酸碱中和反应④活泼金属与酸的反应和水的反应⑤铝热反应⑥少数分解反应①大多数分解反应②少数化合反应③Ba(OH)2·8H2O与NH4Cl的反应④C和CO2、C和H2O(g)的反应化学反应中能量变化的主要原因2、化学键的断裂和化学键的形成是化学反应中能量变化的主要原因3、一个化学反应释放热量还是吸收热量与反应物总能量和生成物总能量的相对大小有关。如果反应物的总能量高于生成物的总能量,发生反应时会向环境释放能量;如果反应物的总能量低于生成物的总能量,发生反应时会从环境吸收能量知识点1反应热 焓变1、反应热及其测定在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。注意:1、等温条件2、体系和环境反应前后体系的温度相等知识点1反应热 焓变 体系和环境体系(系统)反应物:盐酸和氢氧化钠溶液生成物:氯化钠和水发生反应:NaOH+HCl=NaCl+H2O盛溶液的试管和溶液之外的空气如图,氢氧化钠与盐酸反应为例环境知识点1反应热 焓变——反应热的测定方法2、反应热的测定(1)测定方法用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热(2)中和反应反应热的测定知识点1 反应热 焓变——探究(实验目的)
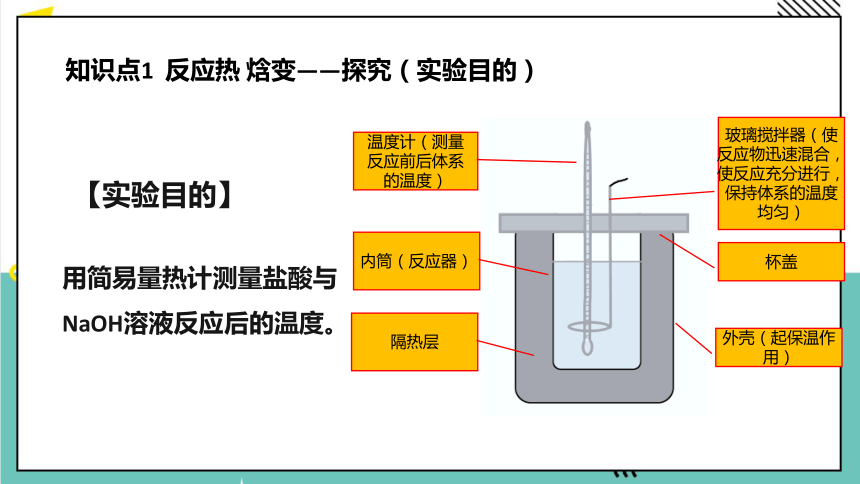
中和热的测定
【实验目的】
用简易量热计测量盐酸与NaOH溶液反应后的温度。
温度计(测量反应前后体系的温度)
内筒(反应器)
隔热层
玻璃搅拌器(使反应物迅速混合,使反应充分进行,保持体系的温度均匀)
杯盖
外壳(起保温作用)
知识点1反应热 焓变——探究【实验测量】【实验测量】(1)反应物温度的测量①用量筒量取50mL 0.50mol/L盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取50mL 0.55mol/LNaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。保证盐酸完全被中和知识点1反应热 焓变——探究【实验测量】(2)反应后体系温度的测量打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。(3)重复上述步骤(1)至步骤(2)两次。新人教版化学选择性必修1知识点1 反应热 焓变——探究【数据处理】
【数据处理】
(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系温度(t1),计算温度差(t2-t1),将数据填入下表。
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
知识点1反应热 焓变——探究【数据处理】(2)取三次测量所得温度差的平均值作为计算依据。(3)根据温度差和比热容等计算反应热为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:①50mL 0.50mol/L盐酸的质量m1=50g, 50mL 0.55mol/LNaOH溶液的质量m2=50g。新人教版化学选择性必修1知识点1 反应热 焓变——探究【问题与讨论】
【问题与讨论】
(1)导致中和反应热测定存在误差的原因有哪些?
(2)在上述过程中,提高测定反应热准确度的措施有哪些?
结论1
结论2
知识点1 反应热 焓变——反应热与焓变(内能)
2、反应热与焓变 【学生阅读教材P6,回答下列问题】
(1)内能:
(2)焓:
内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。符号为U
物质所具有的能量,是与内能有关的物理量,符号是H
化学反应为什么会产生反应热?
反应体系的内能发生了变化
知识点1 反应热 焓变——反应热与焓变(焓变)
2、反应热与焓变 【学生阅读教材P6,回答下列问题】
(3)焓变:
在等压条件下进行的化学反应,其反应热等于反应的焓变
对于一个化学反应,生成物的总焓与反应物的总焓之差称为焓变,符号是△H
数学表达式: △H=H生成物-H反应物
常用单位: KJ/mol 或 KJ mol-1
知识点1 反应热 焓变——反应热与焓变(与吸放热关系)
2、反应热与焓变 【学生阅读教材P6,回答下列问题】
(4)焓、焓变与放热反应、吸热反应的关系
当反应体系放热时其焓变减小,△H为负值, 即△H<0
当反应体系吸热时其焓变增大,△H为正值, 即△H>0
反应热和焓变的比较
反应热 焓变
不同点 概念 在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热 在等压条件下进行的化学反应,其反应热等于反应的焓变
相同点 单位 KJ/mol “+”“-”的意义 “+”表示反应吸热,“-”表示反应放热 数据来源 可以通过实验直接测得,也可以利用已知数据计算求得 联系 在等压条件下进行的化学反应,其反应热等于焓变,如敝口容器中进行的化学反应 注意 ①焓、焓变、反应热代表的意义不同 ②焓(H)只有正值,而焓变( H)有正负之分 ③可以通过焓变来判断一个反应是吸热反应还是放热反应 ④任何化学反应都有反应热 ⑤物质三态之间变化的焓变不能叫反应热,反应热是化学反应的焓变 知识点1 反应热 焓变——能量变化的微观解析
H
H
断开1molH2中化学键要吸收436kJ的能量
Cl
Cl
断开1molCl2中化学键要吸收243kJ的能量
断开1molH2 和1molCl2中化学键共吸收679kJ的能量
+
2HCl
形成1molHCl中化学键要放出431kJ的能量
形成2molHCl中化学键要放出862kJ的能量
1molH2与1molCl2反应生成2molHCl时的反应热,应等于生成物分子的化学键形成时所释放的总能量(862kJ)与反应物分子的化学键断裂时所吸收的总能量(679kJ)的差即放出183KJ的能量
H2(g) +Cl2(g) = 2HCl(g)
△H=-184.6KJ/mol
△H=-183KJ/mol
结论:化学键的断裂和形成时的能量变化是化学反 应中能量变化的主要原因
(5)能量变化的原因微观解析:
知识点1 反应热 焓变——能量变化的宏观解析
宏观解析:从物质内能角度分析,若化学反应中的总能量大于生成物的总能量,反应物转化为生成物时放出热量,则为放热反应(反之为吸热反应)。
知识点1 反应热 焓变——放热反应和吸热反应
知识点1反应热 焓变—— H的计算(6) H的计算① H =生成物的总能量-反应物的总能量②反应物分子的化学键断裂时吸收的总能量-生成物分子化学键形成时释放的总能量中和反应热测定存在误差的原因
1、隔热层隔热效果不好,盖板盖不严,实验过程中有热量损失。
2、酸碱浓度不准确;量取酸碱溶液的体积不准确。
3、温度计计数有误(如未读取到混合溶液的最高温度,就记为终止温度)。
4、实验过程中有液体溅出。
5、混合酸、碱溶液时,动作缓慢。
6、测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。
提高测定反应热准确度的措施
(1)实验中用同一支温度计,且测量完一种溶液后温度计必须用水冲洗干净并用滤纸擦干。
(2)温度计的水银球要完全浸入溶液中,且要稳定一段时间后再记录下计数。
(3)酸、碱溶液混合时要一次性迅速加入,避免有液体没出,且迅速盖上盖板,及时搅拌均匀(实验操作要快,尽量减少热量的损失)。
(4)重复实验3次,取3次实验数据的平均值。
课堂检测1.(2019·德州高二月考)下列过程需要吸热的是( )A.O2―→O+O B.H+Cl―→HClC.CaO+H2O===Ca(OH)2D.浓硫酸稀释解析:选A。化学键的断裂是吸热过程,化学键的形成是放热过程,故O2―→O+O需要吸热,H+Cl―→HCl放热;CaO溶于水、浓硫酸稀释均放热,故A正确。A课堂检测
2.CO(g)与H2O(g)反应的能量变化如图所示,下列有关两者反应的说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量
大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
B
解析:选B。从图示可知,反应物能量高,生成物能量低,所以该反应为放热反应,故A错误,B正确;该反应需要加热才能进行,故C错误;正反应放热,则逆反应吸热,应吸收41 kJ热量,故D错误。
课堂检测
3.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,则该反应的反应热为( )
A.-180 kJ·mol-1 B.+180 kJ·mol-1
C.+812 kJ·mol-1 D.-812 kJ·mol-1
解析:选B。反应化学方程式为N2(g)+O2(g)===2NO(g),则ΔH=(946+498-2×632) kJ·mol-1=+180 kJ·mol-1。
B
课堂检测
4.下列说法中正确的是( )
A.中和热的测定实验中需要用到的主要玻璃仪器有两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒
B.可以用保温杯代替烧杯做有关中和热测定的实验
C.在测定中和热的实验中,只需要测定并记录3次温度
D.在测定中和热的实验中,若所使用的NaOH的物质的量稍大于HCl,则会导致所测得的中和热数值偏高
B
4、解析:选B。为了防止散热,在中和热测定的实验中应选用一大一小两个烧杯,小烧杯和大烧杯之间应用碎泡沫塑料隔开,A项错误。从防止散热的效果看,保温杯完全可以代替烧杯,而且防止散热效果更好,B项正确。在测定中和热的实验中,需测定稀盐酸、稀NaOH溶液的温度以及反应后混合液的最高温度,即一次实验需要测定并记录3次温度,但对于定量实验,需进行重复实验,C项错误。在中和热测定的过程中为了提高实验的准确度,在实验中通常使一种物质稍过量,D项错误。
课堂检测
5.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法不正确的是( )
A.NH4HCO3和盐酸的反应是吸热反应
B.该反应中,热能转化为生成物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O
C
解析:选C。醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,A项正确;该反应为吸热反应,吸收的热量转化为生成物内部的能量,故B项正确;因该反应为吸热反应,则生成物的总能量高于反应物的总能量,C项错误;NH4HCO3和盐酸的反应为NH4HCO3+HCl===NH4Cl+CO2↑+H2O,D项正确。
汇报人:XXX
XX月XX日
第一节 反应热
人教版高中化学选择必修一
第一节 反应热内容要求1、认识化学能可以与热能、电能等其他形式能量之间相互转化,能量的转化遵循能量守恒定律2、知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响3、认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示4、知道中和反应热的测定方法5、了解不同燃料的燃烧热学业要求能辩识化学反应中的能量转化形式能解释化学反应中能量变化的本质能进行反应焓变的简单计算能用热化学方程式表示反应中的能量变化能运反应焓变合理选择和利用化学反应知识回顾1、常见的吸热反应和放热反应有哪些?2、化学反应中能量变化的主要原因是什么?3、从宏观上看,化学反应中的能量变化的原因是什么?常见的吸热反应和放热反应放热反应吸热反应反应类型①大多数化合反应②所有的燃烧及缓慢氧化反应③酸碱中和反应④活泼金属与酸的反应和水的反应⑤铝热反应⑥少数分解反应①大多数分解反应②少数化合反应③Ba(OH)2·8H2O与NH4Cl的反应④C和CO2、C和H2O(g)的反应化学反应中能量变化的主要原因2、化学键的断裂和化学键的形成是化学反应中能量变化的主要原因3、一个化学反应释放热量还是吸收热量与反应物总能量和生成物总能量的相对大小有关。如果反应物的总能量高于生成物的总能量,发生反应时会向环境释放能量;如果反应物的总能量低于生成物的总能量,发生反应时会从环境吸收能量知识点1反应热 焓变1、反应热及其测定在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。注意:1、等温条件2、体系和环境反应前后体系的温度相等知识点1反应热 焓变 体系和环境体系(系统)反应物:盐酸和氢氧化钠溶液生成物:氯化钠和水发生反应:NaOH+HCl=NaCl+H2O盛溶液的试管和溶液之外的空气如图,氢氧化钠与盐酸反应为例环境知识点1反应热 焓变——反应热的测定方法2、反应热的测定(1)测定方法用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热(2)中和反应反应热的测定知识点1 反应热 焓变——探究(实验目的)
中和热的测定
【实验目的】
用简易量热计测量盐酸与NaOH溶液反应后的温度。
温度计(测量反应前后体系的温度)
内筒(反应器)
隔热层
玻璃搅拌器(使反应物迅速混合,使反应充分进行,保持体系的温度均匀)
杯盖
外壳(起保温作用)
知识点1反应热 焓变——探究【实验测量】【实验测量】(1)反应物温度的测量①用量筒量取50mL 0.50mol/L盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取50mL 0.55mol/LNaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。保证盐酸完全被中和知识点1反应热 焓变——探究【实验测量】(2)反应后体系温度的测量打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。(3)重复上述步骤(1)至步骤(2)两次。新人教版化学选择性必修1知识点1 反应热 焓变——探究【数据处理】
【数据处理】
(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系温度(t1),计算温度差(t2-t1),将数据填入下表。
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
知识点1反应热 焓变——探究【数据处理】(2)取三次测量所得温度差的平均值作为计算依据。(3)根据温度差和比热容等计算反应热为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:①50mL 0.50mol/L盐酸的质量m1=50g, 50mL 0.55mol/LNaOH溶液的质量m2=50g。新人教版化学选择性必修1知识点1 反应热 焓变——探究【问题与讨论】
【问题与讨论】
(1)导致中和反应热测定存在误差的原因有哪些?
(2)在上述过程中,提高测定反应热准确度的措施有哪些?
结论1
结论2
知识点1 反应热 焓变——反应热与焓变(内能)
2、反应热与焓变 【学生阅读教材P6,回答下列问题】
(1)内能:
(2)焓:
内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。符号为U
物质所具有的能量,是与内能有关的物理量,符号是H
化学反应为什么会产生反应热?
反应体系的内能发生了变化
知识点1 反应热 焓变——反应热与焓变(焓变)
2、反应热与焓变 【学生阅读教材P6,回答下列问题】
(3)焓变:
在等压条件下进行的化学反应,其反应热等于反应的焓变
对于一个化学反应,生成物的总焓与反应物的总焓之差称为焓变,符号是△H
数学表达式: △H=H生成物-H反应物
常用单位: KJ/mol 或 KJ mol-1
知识点1 反应热 焓变——反应热与焓变(与吸放热关系)
2、反应热与焓变 【学生阅读教材P6,回答下列问题】
(4)焓、焓变与放热反应、吸热反应的关系
当反应体系放热时其焓变减小,△H为负值, 即△H<0
当反应体系吸热时其焓变增大,△H为正值, 即△H>0
反应热和焓变的比较
反应热 焓变
不同点 概念 在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热 在等压条件下进行的化学反应,其反应热等于反应的焓变
相同点 单位 KJ/mol “+”“-”的意义 “+”表示反应吸热,“-”表示反应放热 数据来源 可以通过实验直接测得,也可以利用已知数据计算求得 联系 在等压条件下进行的化学反应,其反应热等于焓变,如敝口容器中进行的化学反应 注意 ①焓、焓变、反应热代表的意义不同 ②焓(H)只有正值,而焓变( H)有正负之分 ③可以通过焓变来判断一个反应是吸热反应还是放热反应 ④任何化学反应都有反应热 ⑤物质三态之间变化的焓变不能叫反应热,反应热是化学反应的焓变 知识点1 反应热 焓变——能量变化的微观解析
H
H
断开1molH2中化学键要吸收436kJ的能量
Cl
Cl
断开1molCl2中化学键要吸收243kJ的能量
断开1molH2 和1molCl2中化学键共吸收679kJ的能量
+
2HCl
形成1molHCl中化学键要放出431kJ的能量
形成2molHCl中化学键要放出862kJ的能量
1molH2与1molCl2反应生成2molHCl时的反应热,应等于生成物分子的化学键形成时所释放的总能量(862kJ)与反应物分子的化学键断裂时所吸收的总能量(679kJ)的差即放出183KJ的能量
H2(g) +Cl2(g) = 2HCl(g)
△H=-184.6KJ/mol
△H=-183KJ/mol
结论:化学键的断裂和形成时的能量变化是化学反 应中能量变化的主要原因
(5)能量变化的原因微观解析:
知识点1 反应热 焓变——能量变化的宏观解析
宏观解析:从物质内能角度分析,若化学反应中的总能量大于生成物的总能量,反应物转化为生成物时放出热量,则为放热反应(反之为吸热反应)。
知识点1 反应热 焓变——放热反应和吸热反应
知识点1反应热 焓变—— H的计算(6) H的计算① H =生成物的总能量-反应物的总能量②反应物分子的化学键断裂时吸收的总能量-生成物分子化学键形成时释放的总能量中和反应热测定存在误差的原因
1、隔热层隔热效果不好,盖板盖不严,实验过程中有热量损失。
2、酸碱浓度不准确;量取酸碱溶液的体积不准确。
3、温度计计数有误(如未读取到混合溶液的最高温度,就记为终止温度)。
4、实验过程中有液体溅出。
5、混合酸、碱溶液时,动作缓慢。
6、测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。
提高测定反应热准确度的措施
(1)实验中用同一支温度计,且测量完一种溶液后温度计必须用水冲洗干净并用滤纸擦干。
(2)温度计的水银球要完全浸入溶液中,且要稳定一段时间后再记录下计数。
(3)酸、碱溶液混合时要一次性迅速加入,避免有液体没出,且迅速盖上盖板,及时搅拌均匀(实验操作要快,尽量减少热量的损失)。
(4)重复实验3次,取3次实验数据的平均值。
课堂检测1.(2019·德州高二月考)下列过程需要吸热的是( )A.O2―→O+O B.H+Cl―→HClC.CaO+H2O===Ca(OH)2D.浓硫酸稀释解析:选A。化学键的断裂是吸热过程,化学键的形成是放热过程,故O2―→O+O需要吸热,H+Cl―→HCl放热;CaO溶于水、浓硫酸稀释均放热,故A正确。A课堂检测
2.CO(g)与H2O(g)反应的能量变化如图所示,下列有关两者反应的说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量
大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
B
解析:选B。从图示可知,反应物能量高,生成物能量低,所以该反应为放热反应,故A错误,B正确;该反应需要加热才能进行,故C错误;正反应放热,则逆反应吸热,应吸收41 kJ热量,故D错误。
课堂检测
3.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,则该反应的反应热为( )
A.-180 kJ·mol-1 B.+180 kJ·mol-1
C.+812 kJ·mol-1 D.-812 kJ·mol-1
解析:选B。反应化学方程式为N2(g)+O2(g)===2NO(g),则ΔH=(946+498-2×632) kJ·mol-1=+180 kJ·mol-1。
B
课堂检测
4.下列说法中正确的是( )
A.中和热的测定实验中需要用到的主要玻璃仪器有两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒
B.可以用保温杯代替烧杯做有关中和热测定的实验
C.在测定中和热的实验中,只需要测定并记录3次温度
D.在测定中和热的实验中,若所使用的NaOH的物质的量稍大于HCl,则会导致所测得的中和热数值偏高
B
4、解析:选B。为了防止散热,在中和热测定的实验中应选用一大一小两个烧杯,小烧杯和大烧杯之间应用碎泡沫塑料隔开,A项错误。从防止散热的效果看,保温杯完全可以代替烧杯,而且防止散热效果更好,B项正确。在测定中和热的实验中,需测定稀盐酸、稀NaOH溶液的温度以及反应后混合液的最高温度,即一次实验需要测定并记录3次温度,但对于定量实验,需进行重复实验,C项错误。在中和热测定的过程中为了提高实验的准确度,在实验中通常使一种物质稍过量,D项错误。
课堂检测
5.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法不正确的是( )
A.NH4HCO3和盐酸的反应是吸热反应
B.该反应中,热能转化为生成物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O
C
解析:选C。醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,A项正确;该反应为吸热反应,吸收的热量转化为生成物内部的能量,故B项正确;因该反应为吸热反应,则生成物的总能量高于反应物的总能量,C项错误;NH4HCO3和盐酸的反应为NH4HCO3+HCl===NH4Cl+CO2↑+H2O,D项正确。
