第5章 金属的冶炼与利用单元复习课件(共27张PPT)-2023-2024学年九年级化学上册同步(沪教版)
文档属性
| 名称 | 第5章 金属的冶炼与利用单元复习课件(共27张PPT)-2023-2024学年九年级化学上册同步(沪教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-17 16:37:06 | ||
图片预览








文档简介
第5章 金属的冶炼与利用
沪教版九年级化学
复 习 课
【学习目标】
考点1:金属材料;
考点2:金属的性质;
考点3:置换反应;
考点4:金属的冶炼;
考点5:钢铁的锈蚀与防护。
纯金属:铁、铝、铜等
金属材料
合
金
概念:在金属中加热熔合某些金属或非金属,制得的具有 特征的 。
特性:合金与组成它的纯金属相比,一般硬度更 、熔点更 、抗腐蚀性更 。
举例:常见的铁合金有生铁(含碳_______)和钢(含碳__________)
2%~4.3%
0.03%~2%
考点1:金属材料
金属
混合物
大
低
强
1.(2023·北京)正月十五闹花灯。下列制作花灯的材料中,属于金属材料的是( )
A.宣纸 B.铁丝 C.棉线 D.竹条
B
【考点突破】
2.(2023·青海)下列常见的生活物品中,由金属材料制成的是( )
A.纯棉毛巾 B.橡胶轮胎
C.有机玻璃 D.合金门窗
D
3.(2023·山西)中国国家博物馆珍藏着一枚“国玺”,即“中华人民共和国中央人民政府之印”,代表着熠熠生辉的共和国符号。她由铜胎铸字,不易变形。选用这种材料作为印章胎体最大的优点是( )
A.硬度较大 B.熔点较高
C.不溶于水 D.形状美观
A
【考点突破】
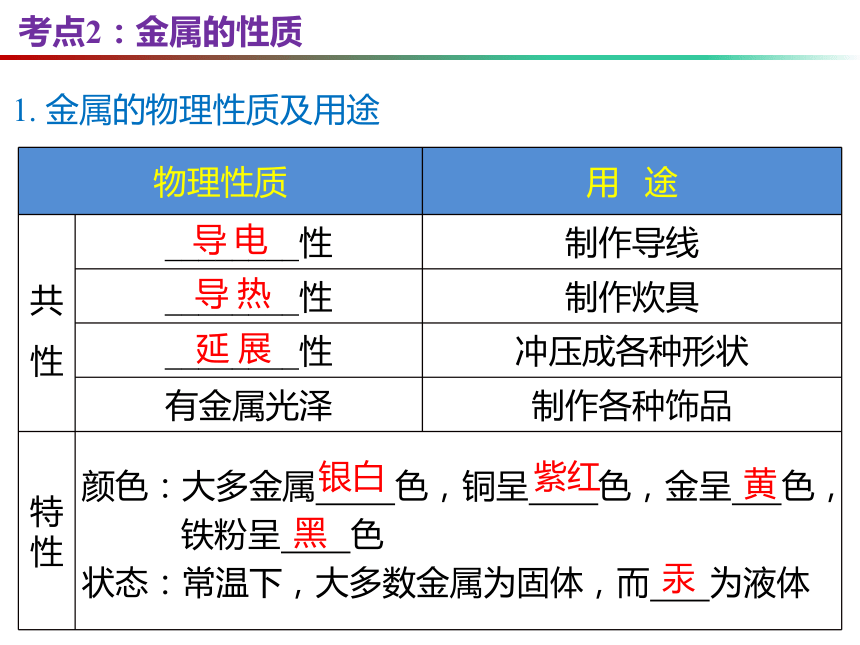
考点2:金属的性质
{5940675A-B579-460E-94D1-54222C63F5DA}物理性质
用 途
共性
________性
制作导线
________性
制作炊具
________性
冲压成各种形状
有金属光泽
制作各种饰品
特性
颜色:大多金属 色,铜呈 色,金呈 色,
铁粉呈 色
状态:常温下,大多数金属为固体,而 为液体
1. 金属的物理性质及用途
导 电
导 热
延 展
银白
紫红
黄
黑
汞
1.(2023·辽宁丹东)铁铸成铁锅是利用了铁具有良好的
性;铁锅用于烹饪食物是利用铁具有良好的 性。
【考点突破】
2.(2023·淄博)利用物理方法可以把黄金压成厚度只有1/10000mm的薄片,说明金具有良好的______(填字母)。
A.金属光泽 B.导电性 C.延展性 D.导热性
延展
导热
C
镁:在空气中点燃,剧烈燃烧,发出______________,生成白色固体,化学方程式为__________________
铝:具有很好的抗腐蚀性能,原因是______________________ _______________________________________________________________________。其与氧气反应的化学方程式为________________________
铁:在氧气中点燃,剧烈燃烧,_____________________
铜:在空气中加热,表面生成_____色物质氧气反应
金:“真金不怕火炼”说明金在高温时________与氧气反应
与氧气反应
耀眼的白光
2Mg+O2 ???点燃???? 2MgO
?
4Al+3O2 ═══ 2Al2O3
火星四射,生成黑色固体
黑
不能
2. 金属的化学性质
铝在空气中与氧气反应,表面生成一层致密的氧化铝(Al2O3)薄膜,阻止铝进一步氧化
1.(2023·营口)“真金不怕火炼”说明金即使在高温下也不与 反应。
氧气
【考点突破】
2.(2023·临沂)铝的化学性质很活泼,通常铝制品却很耐腐蚀,原因是 。
在常温下铝与氧气反应生成一层致密的氧化铝保护膜,阻止内部铝的进一步氧化
3.(2023·宿迁)铝具有很好的抗腐蚀性能,是因为铝在常温下就能与氧气发生反应,生成一层致密而坚固的保护膜,写出该反应的化学方程式: 。
4Al+3O2=2Al2O3
镁:与盐酸反应非常剧烈,化学方程式为
_____________________________
锌:与盐酸反应较剧烈,化学方程式为
_____________________________
铁:与盐酸反应慢,化学方程式为
_____________________________,溶液由
无色变为______色
铜:加入盐酸,无明显现象
Zn+2HCl ═══ ZnCl2+H2↑
与酸反应
Mg+2HCl ═══ MgCl2+H2↑
浅绿
Fe+2HCl ═══ FeCl2+H2↑
2. 金属的化学性质
1.(2023·广西)向三个烧杯中分别放入足量的Mg、A1、Fe粉末,同时加入质量分数相同的100g稀盐酸,充分反应。反应的有关图像错误的是( )
A. B.
C. D.
D
【考点突破】
2.(2023·潍坊)向两个盛有相同质量铝粉和铁粉的烧杯中,分别滴加相同浓度的稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。下列说法正确的是( )
A.a点时,两个烧杯中的酸都恰好完全反应
B.b点时,两个烧杯中产生氢气的质量相同
C.c点时,两个烧杯中都有金属剩余
D.右侧曲线不能反映铁和铝的金属活动性强弱
CD
【考点突破】
铜与硝酸银:
现象为________________________________________
化学方程式为_______________________________
铜与硫酸铝:
无明显现象,证明活动性铝_____铜(填“>”或“<”)
现象为_______________________________________
化学方程式为_____________________________
Fe+CuSO4 ══ FeSO4 +Cu
铁的表面有红色固体析出,溶液由蓝色变为浅绿色
与金属化合物溶液反应
铁与硫酸铜:
有银白色固体析出,溶液由无色变为蓝色
>
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
2. 金属的化学性质
1.(2023·吉林)《天工开物》记载“凡钟为金乐之首”,在古代的金属乐器之中,钟是最重要的乐器。铸钟的材料,铜为上等,铁为下等。
(1)古代炼铜的方法之一是用铁与硫酸铜溶液反应,该反应的化学方程式为 。
(2)此反应的发生,表现出铁与铜的金属活动性强弱关系是 。
【考点突破】
Fe+CuSO4 ══ FeSO4 +Cu
铁比铜活泼
2.(2023·青岛)向含有硝酸银和硝酸铜的废液中加入—定质量的锌粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得滤渣的质量与加入锌粉的质量相等。下列说法不正确的是( )
A.滤液可能呈蓝色
B.滤渣中至少含有两种物质
C.向滤渣中滴加稀盐酸,一定没有气泡产生
D.向滤液中滴加稀盐酸,一定没有白色沉淀生成
C
【考点突破】
{5940675A-B579-460E-94D1-54222C63F5DA}概
念
由一种 跟一种 作用生成另一种 和另一种 的反应。
特点
一换一,属于基本反应类型。
注意
有单质和化合物参加的反应不一定是置换反应,
如 。
有单质和化合物生成的反应不一定是置换反应,
如 。
单质
化合物
单质
化合物
CH4 +2O2 CO2+2H2O
点燃
Fe2O3+3CO 2Fe+3CO2
高温
考点3:置换反应
1.(2023·益阳)我国宋代《梦溪笔谈》中有“熬胆矾铁釜久之亦化为铜”的记载,其化学反应原理为
Fe+CuSO4 ══ FeSO4 +Cu,该反应属于( )
A.化合反应 B.置换反应
C.分解反应 D.复分解反应
B
【考点突破】
2.(2023·济南)下列说法中,合理的是( )
A.催化剂一定都能加快化学反应速率
B.含有氧元素的化合物一定是氧化物
C.溶液一定是均一、稳定的混合物
D.生成单质和化合物的反应一定是置换反应
C
(1)原理:___________________________
(2)现象:玻璃管中粉末___________________,试管中澄清石灰水_________,导管口尾气燃烧并产生_____色火焰
3CO+Fe2O3 ???高温???? 2Fe+3CO2
?
由红棕色逐渐变黑
变浑浊
蓝
考点4:金属的冶炼
1. 实验室炼铁
① 为什么开始要先通一段时间CO,再加热Fe2O3?
排尽装置内的空气,防止加热时发生爆炸
②为什么结束要先停止加热,待物质冷却后再停止通CO?
防止石灰水倒吸
防止铁粉再次被氧化
考点4:金属的冶炼
(3)注意顺序:
1.(2023·西宁)以实验为基础是化学学科的重要特征之一?图示实验是一氧化碳还原氧化铁的部分实验装置,实验中玻璃管内出现的现象是 ?
【考点突破】
红棕色粉末逐渐变黑
2.(2023·齐齐哈尔)化学实验是进行科学探究的重要方式之一,具备基本的化学实验技能是学习化学和进行探究活动的基础和保证。根据图示回答 : 图C中酒精灯的作用是 ?
【考点突破】
点燃一氧化碳,防止污染空气
(1)原料:铁矿石、焦炭、石灰石和空气等
(2)主要设备:炼铁高炉
(3)主要反应(以赤铁矿为原料)
C+O2 ???高温???? CO2
?
CO2+C ???高温???? 2CO
?
3CO+Fe2O3 ???高温???? 2Fe+3CO2
?
考点4:金属的冶炼
2. 工业炼铁
①________________(提供热量)
②_________________(提供还原剂)
③___________________________
1.(2023·大连)工业上用赤铁矿(主要成分为)和一氧化碳炼铁的化学方程式为 。生铁和钢都是铁的合金,从组成上看,二者的 不同。
【考点突破】
3CO+Fe2O3 ???高温???? 2Fe+3CO2
?
含碳量
【考点突破】
2.(2023·连云港)工业上冶炼钢铁的主要工艺流程如下:
①石灰石(主要成分为CaCO3)在高温下可将铁矿石中的SiO2转变为炉渣(CaSiO3),同时生成一种氧化物。该反应的化学方程式为 。
②从物质组成的角度分析,炼钢炉中通入O2的目的是 。
降低生铁中C元素的含量
CaCO3+SiO2 CaSiO3+CO2↑
高温
1. 铁生锈的条件:铁与 同时接触。
2. 铁锈属于混合物,主要成分是 ,质地 。
3. 防止金属腐蚀的措施(原理:隔绝_________ )
(1)“洁身自好”— 保持铁制品表面干燥;
(2)“穿外衣”— 覆盖保护层(喷漆、涂油、电镀);
(3)“强体质”— 改变金属结构(制成不锈钢)。
水和氧气
Fe2O3
疏松多孔
水或氧气
考点5:钢铁的锈蚀与防护
1.(2023·常德)常德滨湖公园的“金刚塔”,俗称“铁树”,始建于北宋建隆年间。
(1)铁生锈的条件为 ,铁锈主要成分为 (填化学式)。
(2)常德“金刚塔”表面局部锈蚀严重,以下合理的除锈措施是________(填序号)。
A.直接喷洒稀盐酸 B.小心打磨生锈处 C.用水清洗
(3)请你写出一种防止铁制品锈蚀的措施 。
【考点突破】
与水和氧气同时接触
Fe2O3
B
置于干燥处或刷漆或涂油等
2.(2023·安徽)某兴趣小组进行铁锈蚀的实验探究。
该小组利用如下装置对铁钉锈蚀的条件进行探究、一段时间后,在A和B中没有观察到明显现象,C和D中铁钉有锈蚀。
(1)B中将蒸馏水煮沸的目的是 。
(2)ABD对比,说明铁钉锈蚀需要的物质是 ;C中的铁钉比D中的锈蚀更严重,原因是 。
【考点突破】
除去水中溶解的氧气
氧气和水
C中的铁钉与氧气和水充分接触
沪教版九年级化学
复 习 课
【学习目标】
考点1:金属材料;
考点2:金属的性质;
考点3:置换反应;
考点4:金属的冶炼;
考点5:钢铁的锈蚀与防护。
纯金属:铁、铝、铜等
金属材料
合
金
概念:在金属中加热熔合某些金属或非金属,制得的具有 特征的 。
特性:合金与组成它的纯金属相比,一般硬度更 、熔点更 、抗腐蚀性更 。
举例:常见的铁合金有生铁(含碳_______)和钢(含碳__________)
2%~4.3%
0.03%~2%
考点1:金属材料
金属
混合物
大
低
强
1.(2023·北京)正月十五闹花灯。下列制作花灯的材料中,属于金属材料的是( )
A.宣纸 B.铁丝 C.棉线 D.竹条
B
【考点突破】
2.(2023·青海)下列常见的生活物品中,由金属材料制成的是( )
A.纯棉毛巾 B.橡胶轮胎
C.有机玻璃 D.合金门窗
D
3.(2023·山西)中国国家博物馆珍藏着一枚“国玺”,即“中华人民共和国中央人民政府之印”,代表着熠熠生辉的共和国符号。她由铜胎铸字,不易变形。选用这种材料作为印章胎体最大的优点是( )
A.硬度较大 B.熔点较高
C.不溶于水 D.形状美观
A
【考点突破】
考点2:金属的性质
{5940675A-B579-460E-94D1-54222C63F5DA}物理性质
用 途
共性
________性
制作导线
________性
制作炊具
________性
冲压成各种形状
有金属光泽
制作各种饰品
特性
颜色:大多金属 色,铜呈 色,金呈 色,
铁粉呈 色
状态:常温下,大多数金属为固体,而 为液体
1. 金属的物理性质及用途
导 电
导 热
延 展
银白
紫红
黄
黑
汞
1.(2023·辽宁丹东)铁铸成铁锅是利用了铁具有良好的
性;铁锅用于烹饪食物是利用铁具有良好的 性。
【考点突破】
2.(2023·淄博)利用物理方法可以把黄金压成厚度只有1/10000mm的薄片,说明金具有良好的______(填字母)。
A.金属光泽 B.导电性 C.延展性 D.导热性
延展
导热
C
镁:在空气中点燃,剧烈燃烧,发出______________,生成白色固体,化学方程式为__________________
铝:具有很好的抗腐蚀性能,原因是______________________ _______________________________________________________________________。其与氧气反应的化学方程式为________________________
铁:在氧气中点燃,剧烈燃烧,_____________________
铜:在空气中加热,表面生成_____色物质氧气反应
金:“真金不怕火炼”说明金在高温时________与氧气反应
与氧气反应
耀眼的白光
2Mg+O2 ???点燃???? 2MgO
?
4Al+3O2 ═══ 2Al2O3
火星四射,生成黑色固体
黑
不能
2. 金属的化学性质
铝在空气中与氧气反应,表面生成一层致密的氧化铝(Al2O3)薄膜,阻止铝进一步氧化
1.(2023·营口)“真金不怕火炼”说明金即使在高温下也不与 反应。
氧气
【考点突破】
2.(2023·临沂)铝的化学性质很活泼,通常铝制品却很耐腐蚀,原因是 。
在常温下铝与氧气反应生成一层致密的氧化铝保护膜,阻止内部铝的进一步氧化
3.(2023·宿迁)铝具有很好的抗腐蚀性能,是因为铝在常温下就能与氧气发生反应,生成一层致密而坚固的保护膜,写出该反应的化学方程式: 。
4Al+3O2=2Al2O3
镁:与盐酸反应非常剧烈,化学方程式为
_____________________________
锌:与盐酸反应较剧烈,化学方程式为
_____________________________
铁:与盐酸反应慢,化学方程式为
_____________________________,溶液由
无色变为______色
铜:加入盐酸,无明显现象
Zn+2HCl ═══ ZnCl2+H2↑
与酸反应
Mg+2HCl ═══ MgCl2+H2↑
浅绿
Fe+2HCl ═══ FeCl2+H2↑
2. 金属的化学性质
1.(2023·广西)向三个烧杯中分别放入足量的Mg、A1、Fe粉末,同时加入质量分数相同的100g稀盐酸,充分反应。反应的有关图像错误的是( )
A. B.
C. D.
D
【考点突破】
2.(2023·潍坊)向两个盛有相同质量铝粉和铁粉的烧杯中,分别滴加相同浓度的稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。下列说法正确的是( )
A.a点时,两个烧杯中的酸都恰好完全反应
B.b点时,两个烧杯中产生氢气的质量相同
C.c点时,两个烧杯中都有金属剩余
D.右侧曲线不能反映铁和铝的金属活动性强弱
CD
【考点突破】
铜与硝酸银:
现象为________________________________________
化学方程式为_______________________________
铜与硫酸铝:
无明显现象,证明活动性铝_____铜(填“>”或“<”)
现象为_______________________________________
化学方程式为_____________________________
Fe+CuSO4 ══ FeSO4 +Cu
铁的表面有红色固体析出,溶液由蓝色变为浅绿色
与金属化合物溶液反应
铁与硫酸铜:
有银白色固体析出,溶液由无色变为蓝色
>
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
2. 金属的化学性质
1.(2023·吉林)《天工开物》记载“凡钟为金乐之首”,在古代的金属乐器之中,钟是最重要的乐器。铸钟的材料,铜为上等,铁为下等。
(1)古代炼铜的方法之一是用铁与硫酸铜溶液反应,该反应的化学方程式为 。
(2)此反应的发生,表现出铁与铜的金属活动性强弱关系是 。
【考点突破】
Fe+CuSO4 ══ FeSO4 +Cu
铁比铜活泼
2.(2023·青岛)向含有硝酸银和硝酸铜的废液中加入—定质量的锌粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得滤渣的质量与加入锌粉的质量相等。下列说法不正确的是( )
A.滤液可能呈蓝色
B.滤渣中至少含有两种物质
C.向滤渣中滴加稀盐酸,一定没有气泡产生
D.向滤液中滴加稀盐酸,一定没有白色沉淀生成
C
【考点突破】
{5940675A-B579-460E-94D1-54222C63F5DA}概
念
由一种 跟一种 作用生成另一种 和另一种 的反应。
特点
一换一,属于基本反应类型。
注意
有单质和化合物参加的反应不一定是置换反应,
如 。
有单质和化合物生成的反应不一定是置换反应,
如 。
单质
化合物
单质
化合物
CH4 +2O2 CO2+2H2O
点燃
Fe2O3+3CO 2Fe+3CO2
高温
考点3:置换反应
1.(2023·益阳)我国宋代《梦溪笔谈》中有“熬胆矾铁釜久之亦化为铜”的记载,其化学反应原理为
Fe+CuSO4 ══ FeSO4 +Cu,该反应属于( )
A.化合反应 B.置换反应
C.分解反应 D.复分解反应
B
【考点突破】
2.(2023·济南)下列说法中,合理的是( )
A.催化剂一定都能加快化学反应速率
B.含有氧元素的化合物一定是氧化物
C.溶液一定是均一、稳定的混合物
D.生成单质和化合物的反应一定是置换反应
C
(1)原理:___________________________
(2)现象:玻璃管中粉末___________________,试管中澄清石灰水_________,导管口尾气燃烧并产生_____色火焰
3CO+Fe2O3 ???高温???? 2Fe+3CO2
?
由红棕色逐渐变黑
变浑浊
蓝
考点4:金属的冶炼
1. 实验室炼铁
① 为什么开始要先通一段时间CO,再加热Fe2O3?
排尽装置内的空气,防止加热时发生爆炸
②为什么结束要先停止加热,待物质冷却后再停止通CO?
防止石灰水倒吸
防止铁粉再次被氧化
考点4:金属的冶炼
(3)注意顺序:
1.(2023·西宁)以实验为基础是化学学科的重要特征之一?图示实验是一氧化碳还原氧化铁的部分实验装置,实验中玻璃管内出现的现象是 ?
【考点突破】
红棕色粉末逐渐变黑
2.(2023·齐齐哈尔)化学实验是进行科学探究的重要方式之一,具备基本的化学实验技能是学习化学和进行探究活动的基础和保证。根据图示回答 : 图C中酒精灯的作用是 ?
【考点突破】
点燃一氧化碳,防止污染空气
(1)原料:铁矿石、焦炭、石灰石和空气等
(2)主要设备:炼铁高炉
(3)主要反应(以赤铁矿为原料)
C+O2 ???高温???? CO2
?
CO2+C ???高温???? 2CO
?
3CO+Fe2O3 ???高温???? 2Fe+3CO2
?
考点4:金属的冶炼
2. 工业炼铁
①________________(提供热量)
②_________________(提供还原剂)
③___________________________
1.(2023·大连)工业上用赤铁矿(主要成分为)和一氧化碳炼铁的化学方程式为 。生铁和钢都是铁的合金,从组成上看,二者的 不同。
【考点突破】
3CO+Fe2O3 ???高温???? 2Fe+3CO2
?
含碳量
【考点突破】
2.(2023·连云港)工业上冶炼钢铁的主要工艺流程如下:
①石灰石(主要成分为CaCO3)在高温下可将铁矿石中的SiO2转变为炉渣(CaSiO3),同时生成一种氧化物。该反应的化学方程式为 。
②从物质组成的角度分析,炼钢炉中通入O2的目的是 。
降低生铁中C元素的含量
CaCO3+SiO2 CaSiO3+CO2↑
高温
1. 铁生锈的条件:铁与 同时接触。
2. 铁锈属于混合物,主要成分是 ,质地 。
3. 防止金属腐蚀的措施(原理:隔绝_________ )
(1)“洁身自好”— 保持铁制品表面干燥;
(2)“穿外衣”— 覆盖保护层(喷漆、涂油、电镀);
(3)“强体质”— 改变金属结构(制成不锈钢)。
水和氧气
Fe2O3
疏松多孔
水或氧气
考点5:钢铁的锈蚀与防护
1.(2023·常德)常德滨湖公园的“金刚塔”,俗称“铁树”,始建于北宋建隆年间。
(1)铁生锈的条件为 ,铁锈主要成分为 (填化学式)。
(2)常德“金刚塔”表面局部锈蚀严重,以下合理的除锈措施是________(填序号)。
A.直接喷洒稀盐酸 B.小心打磨生锈处 C.用水清洗
(3)请你写出一种防止铁制品锈蚀的措施 。
【考点突破】
与水和氧气同时接触
Fe2O3
B
置于干燥处或刷漆或涂油等
2.(2023·安徽)某兴趣小组进行铁锈蚀的实验探究。
该小组利用如下装置对铁钉锈蚀的条件进行探究、一段时间后,在A和B中没有观察到明显现象,C和D中铁钉有锈蚀。
(1)B中将蒸馏水煮沸的目的是 。
(2)ABD对比,说明铁钉锈蚀需要的物质是 ;C中的铁钉比D中的锈蚀更严重,原因是 。
【考点突破】
除去水中溶解的氧气
氧气和水
C中的铁钉与氧气和水充分接触
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
