2024届高三化学一轮复习 滴定曲线的规律和结论 课件(共22张PPT)
文档属性
| 名称 | 2024届高三化学一轮复习 滴定曲线的规律和结论 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-17 10:50:48 | ||
图片预览








文档简介
(共22张PPT)
第三章 物质在水溶液中的行为
水溶液中离子平衡的图像分析
基于思维模型建构的实践
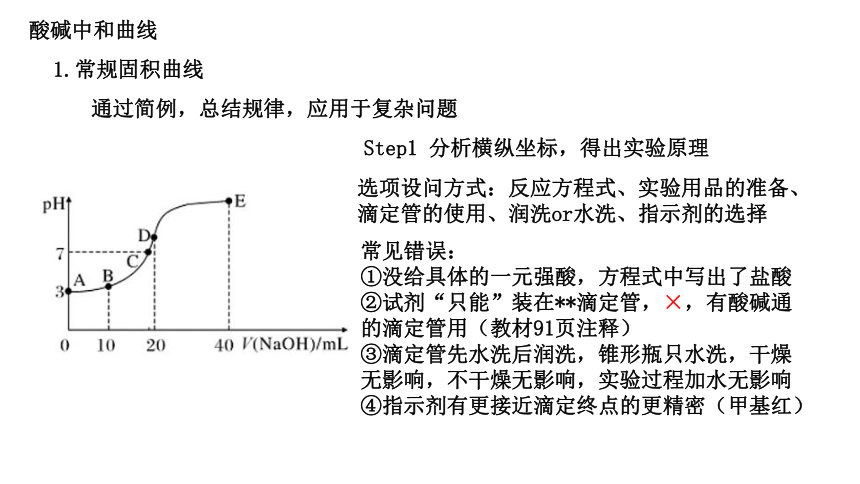
酸碱中和曲线
1.常规固积曲线
通过简例,总结规律,应用于复杂问题
Step1 分析横纵坐标,得出实验原理
选项设问方式:反应方程式、实验用品的准备、滴定管的使用、润洗or水洗、指示剂的选择
常见错误:
①没给具体的一元强酸,方程式中写出了盐酸
②试剂“只能”装在**滴定管,×,有酸碱通的滴定管用(教材91页注释)
③滴定管先水洗后润洗,锥形瓶只水洗,干燥无影响,不干燥无影响,实验过程加水无影响
④指示剂有更接近滴定终点的更精密(甲基红)
Step2 逐点突破,全面分析
1.零点:标准液没有进行滴定,溶液的pH代表锥形瓶内溶液的酸碱性,若给出数据,可做相关计算
A点未加入NaOH溶液,初始pH为3,说明HA为弱酸
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
粒子浓度大小
弱酸部分电离,剩的最多
酸电离+水电离
就酸能电离
就水电离,最弱,最少
结论1:零点酸分子浓度最大,质子浓度恒大于酸根离子
通过零点的pH,得出氢离子浓度,题中还给出了已知酸(待测液)的浓度,可以计算电离平衡常数
结论2:pH越小,酸越强,电离程度越大
2.半反应点:
反应关系 20mLHA溶液需要20mLNaOH才能被完全中和,所以滴入10mLNaOH即被反映了一半,这个点叫半反应点。
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
HA+NaOH=NaA+H2O
加入10mL
被反应10mL
得到10mL
但被反应了,溶液里没有碱
中和固积曲线中,半反应点是剩的一半酸和反应生成的等体积的强碱弱酸盐。
结论1:B点的溶质是等物质的量的HA和NaA
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
观察B点的pH,pH<7
溶质已知,利用电离理论和水解理论对pH分析
结论1:B点的溶质是等物质的量的HA和NaA
HA为弱酸,存在电离平衡 HAH++A-
NaA为强碱弱酸盐,存在一步盐的完全电离,还有一步弱酸酸根的水解
NaA=Na++A-
A-+H2O HA+OH-
由pH<7得到,HA的电离程度大于NaA的水解程度,氢离子浓度更大
粒子浓度
盐完全电离+酸部分电离
盐完全电离
酸部分电离,剩的比产物多,比完全解离的浓度小
电离程度大,pH<7的原因
水解+水微弱电离
结论2:半反应点能推粒子浓度,取决于pH(电离和水解程度的比较)
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
3.中性点
明确:中性点并不是恰好完全反应的点,滴入20mL时,酸才被完全中和
分析溶质:接近恰好完全反应,所以酸剩的少,生成的强碱弱酸盐就非常多(结论1:盐多酸少)
溶质:NaA和少量的HA
定量分析:pH=7 →
写电荷守恒
约去相等的量
结论2:中性点盐解离出的离子浓度相等
粒子浓度
结论2
中性
盐完全电离+酸部分电离
酸部分电离+水及其微弱的电离
结论3:离子浓度,酸根离子>质子
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
4.完全反应点
D点,所有的HA都被反应掉,溶质只有NaA
pH>7的原因:A-离子水解成碱性
A-+H2O HA+OH-
粒子浓度关系
阳离子不水解,最多
弱酸阴离子水解,微弱,浓度比不水解的少,比水解产物多
水解产物+水电离
仅水微弱电离
结论:水解离子浓度少于不水解离子,水解离子浓度总大于水解产物
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
5.等倍过量点
E点,NaOH过量20mL,溶质是等物质的量的NaOH和NaA,pH>7
粒子浓度关系
NaOH过量带来大量的钠离子
少于钠离子浓度的一半,水解消耗部分
NaOH过量带来大量的氢氧根离子,同时是水解产物
仅由水电离
溶质是等物质的量的NaOH和NaA常考察物料守恒的书写
同时离子已全部分析,易得电荷守恒,与物料结合,也可写出质子守恒
2.复杂曲线:多元酸碱滴定
分析滴定原理:一元碱滴定三元酸,酸分步被中和,每10mLNaOH中和1个氢离子。
少量、足量、过量的氢氧化钠分别与磷酸反应
根据反应原理和图像,每滴入10mLNaOH到达一个反应终点,总共有3个反应终点
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
1.零点
由pH值得
直接运用经验公式和结论
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
易得,Ka≈10-2.4
2.半反应点
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
5mL、15mL、25mL是三个半反应点
5mL时,溶质是被反应一半的磷酸,和等物质的量生成的磷酸二氢根离子
由
得到,此时氢离子浓度就是Ka的值
结论1:多元酸碱滴定图像中,半反应点对应pH得到的氢离子浓度,就是该步的电离平衡常数
技巧:零点和半反应点都能算电离平衡常数,给哪个用哪个,都给的情况下,用半反应点更简单,直接用结论即出
2.半反应点
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
运用结论1,15mL的氢离子浓度为Ka2,25mL的氢离子浓度为Ka3,他们的溶质都是等物质的量的酸根离子和下一步的酸根离子
结论2:已知电离平衡常数,可以用 推盐的水解常数
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
3.完全反应点
根据这个点的参量,可以判定水解和电离的相对大小
例1:a点,溶质是NaH2PO4,pH=4
溶液中的行为
电离程度>水解程度
结论1:用pH大小判定酸碱性,和电离、水解的产物比较,程度大的决定溶液的pH
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
3.完全反应点
粒子浓度关系
盐的完全电离
电离程度大,生成的多
水解程度小,生成的少
结论2:盐电离的阴离子浓度最大,程度小的行为产物浓度最小
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
例2:c点,溶质是Na2HPO4,pH=10
应用结论1:磷酸氢根,水解>电离
应用结论2得到离子浓度
盐的完全电离
电离行为弱,电离产物浓度小
结论2:盐电离的阴离子浓度最大,程度小的行为产物浓度最小
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
4.常见选项:半反应点的质子守恒
例:求25mL时溶液的质子守恒
Step1 判定25mL时溶质:
Step2 写电荷守恒和物料守恒
先分析溶质中的原子
所以
分析离子后可写出两个守恒等式
电
物
把物料守恒带入电荷守恒,消元,即得到质子守恒
质
3.创新曲线:滴定过程中水的电离变化
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
(1)分析零点
初始点,酸性,存在
已知,
则
和常规固积一样,可算
还可通过 计算电离度
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
(2)先分析最高点
最高点一定是水解程度最大的点,对应固积曲线中的最后一个反应终点(图中d点的溶质即为Na3PO4,酸根离子最弱,水解程度最大)
最高点常见考法:计算水解平衡常数
由结论 可计算
此题 题一般会给参考数据
已知
结合公式,水解平衡常熟可算
复习结论:水解平衡常数和电离平衡常数的关系
对于酸或多元酸式根离子,先从左到右写出电离过程,只写指定离子,不写质子
再从右到左写出水解过程,不写水和氢氧根离子
在可逆号上方写各步电离常数,下方写水解常数
结论:同一个可逆号上下两个常数的乘积,是该温度下水的离子积常数
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
(3)中性点的判定
通过事实直接判定,找到零点(酸性),最高点(碱性),从酸性溶液到碱性溶液的过程中,必定经历中性,因为pH突跃需要外力驱动
注意:滴定中水电离图像,氢氧根浓度为
10-7mol/L时,不一定为中性,可能是碱过量而抑制水的电离导致的
(4)过量点的判定
最高点是碱性,然后碱过量,碱中加碱,对水的电离起抑制作用,对阴离子的水解也起抑制作用,但是始终为碱性溶液
考法:给出V2的值,计算过量NaOH和Na3PO4的物质的量之比,写三大守恒
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
总结和提升
①起点能判断酸碱性,能算电离平衡常数(多元就算第一步)
②判定最高点即水解程度最大时的酸碱性
【注意】如果横坐标是pOH就是最低点
③存在酸碱性互变,中性点一定在两点其中
④注意该图像是水电离图像,不是溶液中氢氧根离子或氢离子浓度的变化量
⑤牢记各种结论和推断方法
第三章 物质在水溶液中的行为
水溶液中离子平衡的图像分析
基于思维模型建构的实践
酸碱中和曲线
1.常规固积曲线
通过简例,总结规律,应用于复杂问题
Step1 分析横纵坐标,得出实验原理
选项设问方式:反应方程式、实验用品的准备、滴定管的使用、润洗or水洗、指示剂的选择
常见错误:
①没给具体的一元强酸,方程式中写出了盐酸
②试剂“只能”装在**滴定管,×,有酸碱通的滴定管用(教材91页注释)
③滴定管先水洗后润洗,锥形瓶只水洗,干燥无影响,不干燥无影响,实验过程加水无影响
④指示剂有更接近滴定终点的更精密(甲基红)
Step2 逐点突破,全面分析
1.零点:标准液没有进行滴定,溶液的pH代表锥形瓶内溶液的酸碱性,若给出数据,可做相关计算
A点未加入NaOH溶液,初始pH为3,说明HA为弱酸
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
粒子浓度大小
弱酸部分电离,剩的最多
酸电离+水电离
就酸能电离
就水电离,最弱,最少
结论1:零点酸分子浓度最大,质子浓度恒大于酸根离子
通过零点的pH,得出氢离子浓度,题中还给出了已知酸(待测液)的浓度,可以计算电离平衡常数
结论2:pH越小,酸越强,电离程度越大
2.半反应点:
反应关系 20mLHA溶液需要20mLNaOH才能被完全中和,所以滴入10mLNaOH即被反映了一半,这个点叫半反应点。
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
HA+NaOH=NaA+H2O
加入10mL
被反应10mL
得到10mL
但被反应了,溶液里没有碱
中和固积曲线中,半反应点是剩的一半酸和反应生成的等体积的强碱弱酸盐。
结论1:B点的溶质是等物质的量的HA和NaA
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
观察B点的pH,pH<7
溶质已知,利用电离理论和水解理论对pH分析
结论1:B点的溶质是等物质的量的HA和NaA
HA为弱酸,存在电离平衡 HAH++A-
NaA为强碱弱酸盐,存在一步盐的完全电离,还有一步弱酸酸根的水解
NaA=Na++A-
A-+H2O HA+OH-
由pH<7得到,HA的电离程度大于NaA的水解程度,氢离子浓度更大
粒子浓度
盐完全电离+酸部分电离
盐完全电离
酸部分电离,剩的比产物多,比完全解离的浓度小
电离程度大,pH<7的原因
水解+水微弱电离
结论2:半反应点能推粒子浓度,取决于pH(电离和水解程度的比较)
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
3.中性点
明确:中性点并不是恰好完全反应的点,滴入20mL时,酸才被完全中和
分析溶质:接近恰好完全反应,所以酸剩的少,生成的强碱弱酸盐就非常多(结论1:盐多酸少)
溶质:NaA和少量的HA
定量分析:pH=7 →
写电荷守恒
约去相等的量
结论2:中性点盐解离出的离子浓度相等
粒子浓度
结论2
中性
盐完全电离+酸部分电离
酸部分电离+水及其微弱的电离
结论3:离子浓度,酸根离子>质子
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
4.完全反应点
D点,所有的HA都被反应掉,溶质只有NaA
pH>7的原因:A-离子水解成碱性
A-+H2O HA+OH-
粒子浓度关系
阳离子不水解,最多
弱酸阴离子水解,微弱,浓度比不水解的少,比水解产物多
水解产物+水电离
仅水微弱电离
结论:水解离子浓度少于不水解离子,水解离子浓度总大于水解产物
【情景】室温下,向20mL 0.1mol/L的HA溶液滴定0.1mol/L的NaOH溶液
5.等倍过量点
E点,NaOH过量20mL,溶质是等物质的量的NaOH和NaA,pH>7
粒子浓度关系
NaOH过量带来大量的钠离子
少于钠离子浓度的一半,水解消耗部分
NaOH过量带来大量的氢氧根离子,同时是水解产物
仅由水电离
溶质是等物质的量的NaOH和NaA常考察物料守恒的书写
同时离子已全部分析,易得电荷守恒,与物料结合,也可写出质子守恒
2.复杂曲线:多元酸碱滴定
分析滴定原理:一元碱滴定三元酸,酸分步被中和,每10mLNaOH中和1个氢离子。
少量、足量、过量的氢氧化钠分别与磷酸反应
根据反应原理和图像,每滴入10mLNaOH到达一个反应终点,总共有3个反应终点
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
1.零点
由pH值得
直接运用经验公式和结论
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
易得,Ka≈10-2.4
2.半反应点
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
5mL、15mL、25mL是三个半反应点
5mL时,溶质是被反应一半的磷酸,和等物质的量生成的磷酸二氢根离子
由
得到,此时氢离子浓度就是Ka的值
结论1:多元酸碱滴定图像中,半反应点对应pH得到的氢离子浓度,就是该步的电离平衡常数
技巧:零点和半反应点都能算电离平衡常数,给哪个用哪个,都给的情况下,用半反应点更简单,直接用结论即出
2.半反应点
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
运用结论1,15mL的氢离子浓度为Ka2,25mL的氢离子浓度为Ka3,他们的溶质都是等物质的量的酸根离子和下一步的酸根离子
结论2:已知电离平衡常数,可以用 推盐的水解常数
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
3.完全反应点
根据这个点的参量,可以判定水解和电离的相对大小
例1:a点,溶质是NaH2PO4,pH=4
溶液中的行为
电离程度>水解程度
结论1:用pH大小判定酸碱性,和电离、水解的产物比较,程度大的决定溶液的pH
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
3.完全反应点
粒子浓度关系
盐的完全电离
电离程度大,生成的多
水解程度小,生成的少
结论2:盐电离的阴离子浓度最大,程度小的行为产物浓度最小
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
例2:c点,溶质是Na2HPO4,pH=10
应用结论1:磷酸氢根,水解>电离
应用结论2得到离子浓度
盐的完全电离
电离行为弱,电离产物浓度小
结论2:盐电离的阴离子浓度最大,程度小的行为产物浓度最小
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,曲线如图
4.常见选项:半反应点的质子守恒
例:求25mL时溶液的质子守恒
Step1 判定25mL时溶质:
Step2 写电荷守恒和物料守恒
先分析溶质中的原子
所以
分析离子后可写出两个守恒等式
电
物
把物料守恒带入电荷守恒,消元,即得到质子守恒
质
3.创新曲线:滴定过程中水的电离变化
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
(1)分析零点
初始点,酸性,存在
已知,
则
和常规固积一样,可算
还可通过 计算电离度
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
(2)先分析最高点
最高点一定是水解程度最大的点,对应固积曲线中的最后一个反应终点(图中d点的溶质即为Na3PO4,酸根离子最弱,水解程度最大)
最高点常见考法:计算水解平衡常数
由结论 可计算
此题 题一般会给参考数据
已知
结合公式,水解平衡常熟可算
复习结论:水解平衡常数和电离平衡常数的关系
对于酸或多元酸式根离子,先从左到右写出电离过程,只写指定离子,不写质子
再从右到左写出水解过程,不写水和氢氧根离子
在可逆号上方写各步电离常数,下方写水解常数
结论:同一个可逆号上下两个常数的乘积,是该温度下水的离子积常数
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
(3)中性点的判定
通过事实直接判定,找到零点(酸性),最高点(碱性),从酸性溶液到碱性溶液的过程中,必定经历中性,因为pH突跃需要外力驱动
注意:滴定中水电离图像,氢氧根浓度为
10-7mol/L时,不一定为中性,可能是碱过量而抑制水的电离导致的
(4)过量点的判定
最高点是碱性,然后碱过量,碱中加碱,对水的电离起抑制作用,对阴离子的水解也起抑制作用,但是始终为碱性溶液
考法:给出V2的值,计算过量NaOH和Na3PO4的物质的量之比,写三大守恒
例:常温下用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的磷酸溶液,水中电离的氢氧根离子和标准液体积的关系曲线如图
总结和提升
①起点能判断酸碱性,能算电离平衡常数(多元就算第一步)
②判定最高点即水解程度最大时的酸碱性
【注意】如果横坐标是pOH就是最低点
③存在酸碱性互变,中性点一定在两点其中
④注意该图像是水电离图像,不是溶液中氢氧根离子或氢离子浓度的变化量
⑤牢记各种结论和推断方法
同课章节目录
