2.2化学平衡同步(含解析)练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2化学平衡同步(含解析)练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 368.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-17 10:57:31 | ||
图片预览



文档简介
2.2化学平衡同步练习题
一、选择题
1.一定温度下,对可逆反应A(s)+2B(g)C(g)+D(g)的下列叙述中,能说明该反应已达到平衡的是
A.容器内的压强不再变化
B.单位时间内消耗2molB,同时生成1molC
C.混合气体的物质的量不再变化
D.混合气体的平均相对分子质量不再变化
2.一定温度下的密闭容器中发生可逆反应2SO2(g)+O2(g) 2SO3(g),不能说明该反应一定达到平衡状态的是
A.压强保持不变
B.SO2、O2、SO3的物质的量之比为2︰1︰2
C.SO2的消耗速率和SO2的生成速率相等
D.SO2的百分含量保持不变
3.对于可逆反应2SO2+O22SO3,在一定温度下平衡常数为K,下列变化中,能使K发生变化的是
A.将SO2的浓度增大 B.增大体系的压强
C.使用合适的催化剂 D.升高体系的温度
4.在恒温下的密闭容器中,反应CO2(g)+C(s)2CO(g)已经达到平衡状态的标志是
A.容器中CO2、C和CO共存 B.CO2和CO的物质的量浓度相等
C.CO的物质的量浓度不再变化 D.容器中CO2、C、CO的物质的量比为1:1:2
5.将一定量纯净的氨基甲酸铵置于恒容真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是
①v(NH3)正=2v(CO2)逆
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器混合气体的总物质的量不变
⑥密闭容器中CO2的体积分数不变
⑦混合气体总质量不变
A.①②③⑤⑦ B.①②④⑤⑦ C.①②③④⑤ D.②③⑤⑥⑦
6.下列说法正确的是
A.升高温度,会使单位体积内分子数增多,从而加快化学反应速率
B.(蓝色)(黄色) ,稀溶液受热颜色变黄
C.达平衡后,加入少量KCl固体,溶液红色变浅
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,溶液变为黄色
7.有一处于平衡状态的反应:3A(s)+2B(g)3C(g),ΔH>0。为了使平衡向生成C的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂
A.①③ B.①③⑤ C.①④ D.②④⑤
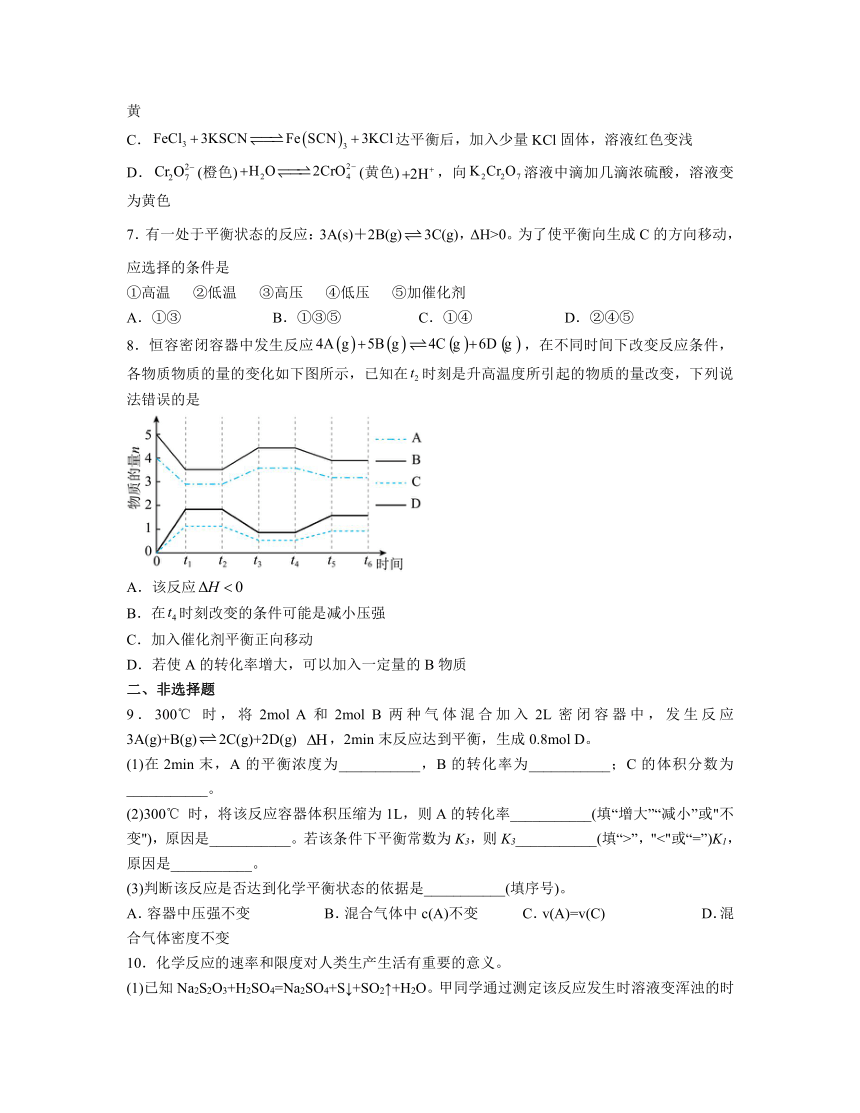
8.恒容密闭容器中发生反应,在不同时间下改变反应条件,各物质物质的量的变化如下图所示,已知在时刻是升高温度所引起的物质的量改变,下列说法错误的是
A.该反应
B.在时刻改变的条件可能是减小压强
C.加入催化剂平衡正向移动
D.若使A的转化率增大,可以加入一定量的B物质
二、非选择题
9.300℃ 时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)2C(g)+2D(g) ,2min末反应达到平衡,生成0.8mol D。
(1)在2min末,A的平衡浓度为___________,B的转化率为___________;C的体积分数为___________。
(2)300℃ 时,将该反应容器体积压缩为1L,则A的转化率___________(填“增大”“减小”或"不变"),原因是___________。若该条件下平衡常数为K3,则K3___________(填“>”,"<"或“=”)K1,原因是___________。
(3)判断该反应是否达到化学平衡状态的依据是___________(填序号)。
A.容器中压强不变 B.混合气体中c(A)不变 C.v(A)=v(C) D.混合气体密度不变
10.化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
实验编号 温度/℃ c(Na2S2O3)/mol·L-1 c(H2SO4)/mol·L-1
Ⅰ 25 0.1 0.1
Ⅱ 25 0.2 0.1
Ⅲ 50 0.2 0.1
①上述实验中溶液最先变浑浊的是___________(填实验编号,下同)。
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择___________
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
请回答:
①该反应的化学平衡常数表达式为K =___________。
②该反应为___________(填“吸热”或“放热”)反应。
③能说明该反应达到化学平衡状态的是___________(填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ___________℃。
11.碘化钾是常用的化工原料。某实验小组设计实验探究的还原性。
I.探究不同条件下空气中氧气氧化的速率。
组别 温度 溶液 溶液 蒸馏水 淀粉溶液
V V
1 3滴
2 3滴
3 3滴
(1)酸性条件下能被空气中氧气氧化,发生反应的离子方程式为_______。
(2)通过实验组别1和组别2探究温度对氧化速率的影响。其中_______,_______。
(3)设计实验组别3的目的是_______。
Ⅱ.探究反应“”为可逆反应。
试剂:溶液,溶液,淀粉溶液,溶液,溶液。实验如下:
(4)甲同学通过试管i和试管ⅱ中现象结合可证明该反应为可逆反应,则试管i中现象为:_______;乙同学认为该现象无法证明该反应为可逆反应,原因为_______。
(5)请选择上述试剂重新设计实验,证明该反应为可逆反应_______。
12.某小组同学探究盐对平衡体系的影响。
实验Ⅰ:探究KCl对和平衡体系的影响
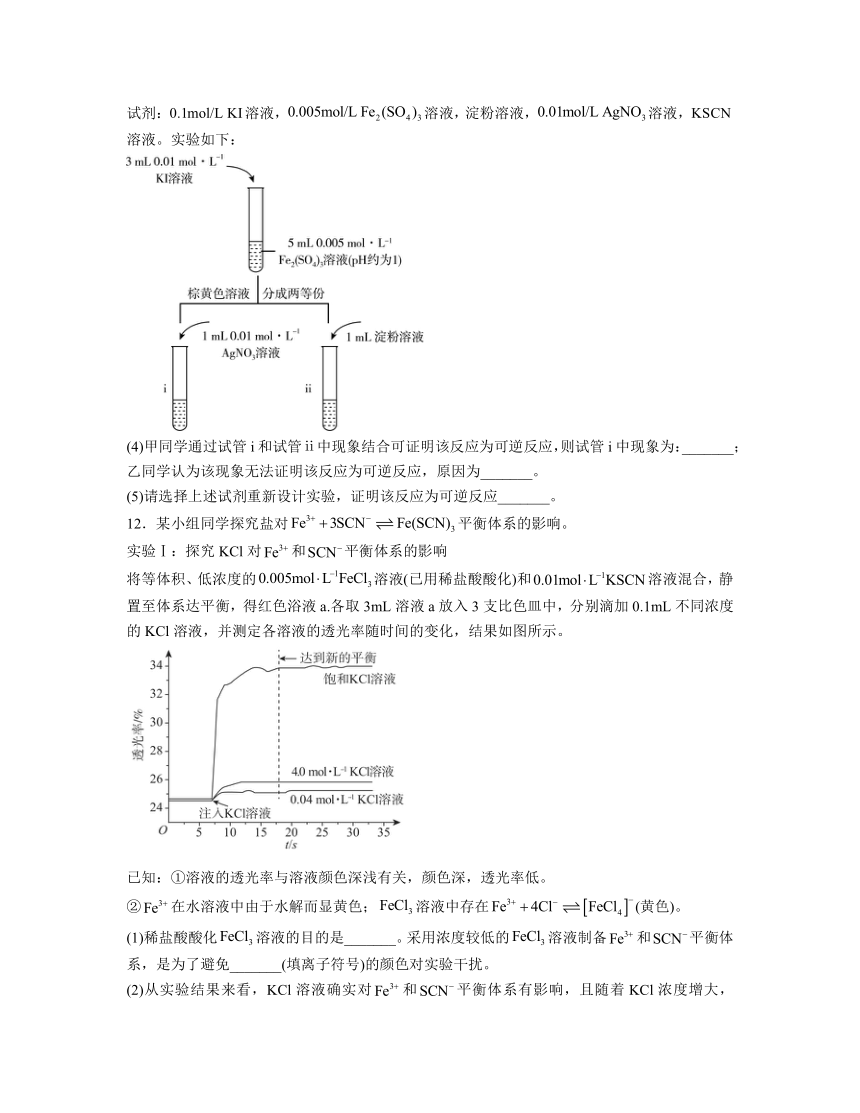
将等体积、低浓度的溶液(已用稀盐酸酸化)和溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②在水溶液中由于水解而显黄色;溶液中存在(黄色)。
(1)稀盐酸酸化溶液的目的是_______。采用浓度较低的溶液制备和平衡体系,是为了避免_______(填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对和平衡体系有影响,且随着KCl浓度增大,平衡向_______(填“正”或“逆”)反应方向移动。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使和平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应,离子浓度发生变化,导致和平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
序号 加入少量盐 溶液颜色
1 无 红色
2 KCl 变浅
3 略变浅
4 NaCl 变浅程度较大
①上述实验可证明盐效应影响了和平衡体系的是_______ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验_______(填序号)可得出结论:的盐效应弱于的盐效应。简述选择实验的理由_______。
(4)取等体积的溶液a继续进行实验,结果如下表。
序号 加入溶液 溶液颜色
5 1mL浓盐酸 明显变浅,溶液偏黄
6 1mL去离子水 略变浅
上述实验可证明副反应影响了和平衡体系,结合实验现象及化学用语分析副反应对和平衡体系有影响的原因:_______。
【参考答案】
一、选择题
1.D
解析:A.该反应前后气体分子数相等,反应过程中容器内的压强不变,不能判断是否达到平衡,故A不选;
B.单位时间内消耗2molB,同时生成1molC,均表示正反应速率,不能判断是否达到平衡,故B不选;
C.该反应前后气体分子数相等,反应过程中混合气体的物质的量不变,不能判断是否达到平衡,故C不选;
D.由于有固体A参加反应,反应过程中混合气体的质量会发生变化而物质的量不变,因此混合气体的平均相对分子质量不再变化表明反应已达到平衡,故D选。
答案选D。
2.B
解析:A.反应2SO2(g)+O2(g) 2SO3(g)是气体体积减小的反应,反应过程中压强不断减小,当压强保持不变时,说明反应达到平衡,故A不选;
B.平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故B选;
C.SO2的消耗速率和SO2的生成速率相等,证明化学反应中正逆反应速率相等,达到了平衡状态,故C不选;
D.SO2的百分含量保持不变,即SO3的质量保持不变,即浓度不变,说明反应达到化学平衡状态,故D不选;
故选B。
3.D
解析:化学平衡常数只随温度的改变而改变,则只有改变体系温度才能使K发生变化,故选:D。
4.C
解析:A.该反应是可逆反应,CO2、C不能完全反应,容器中CO2、C和CO一直存在,当容器中CO2、C和CO共存时,不能说明反应达到平衡,故A不选;
B.CO2和CO的物质的量浓度相等,不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,故B不选;
C.CO的物质的量浓度不再变化,说明正反应速率等于逆反应速率,说明反应达到平衡,故C选;
D.容器中CO2、C、CO的物质的量比为1:1:2时无法判断正逆反应速率是否相等,故也就无法判断反应是否处于平衡状态,故D不选;
故选C。
5.A
解析:①v(NH3)正=2v(CO2)逆,表明正逆反应速率相等,该反应达到平衡状态,故①正确;
②该反应为气体物质的量增大的反应,容器内压强为变量,当密闭容器中总压强不变时,表明达到平衡状态,故②正确;
③H2NCOONH4(s)为固体,混合气体的质量为变量,混合气体的体积不变,则密闭容器中混合气体的密度为变量,当容器内混合气体的密度不变时,表明达到平衡状态,故③正确;
④只有NH3(g)、CO2(g)为气体,且二者的物质的量之比始终为2:1,则混合气体的平均相对分子质量始终不变,不能判断平衡状态,故④错误;
⑤H2NCOONH4(s)为固体,混合气体的总物质的量为变量,当密闭容器混合气体的总物质的量不变时,表明达到平衡状态,故⑤正确;
⑥只有NH3(g)、CO2(g)为气体,且二者的物质的量之比始终为2:1,则密闭容器中CO2的体积分数始终不变,不能判断平衡状态,故⑥错误;
⑦H2NCOONH4(s)为固体,混合气体总质量为变量,当混合气体的总质量不变时,表明达到平衡状态,故⑦正确;
故选A。
6.B
解析:A.升高温度,分子吸收能量,单位体积内分子总数不变,活化分子总数变多,活化分子百分数变大,碰撞几率增大,从而加快化学反应速率,故A错误;
B.(蓝色)(黄色) ,稀溶液受热,平衡正向移动,因此溶液颜色变黄,故B正确;
C.达平衡后,该反应的实质是,加入少量KCl固体,离子浓度不变,平衡不移动,故C错误;
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,氢离子浓度增大,平衡逆向移动,溶液变为橙色,故D错误;
综上所述,答案为B。
7.C
解析:3A(s)+2B(g)3C(g),ΔH>0,正反应是气体体积增大的吸热反应;
①升高温度,平衡向正向(放热)反应移动;
②降低温度,平衡向逆向(吸热)反应移动;
③压强增大,平衡向逆向(气体体积减小)方向移动;
④降低压强,平衡向正向(气体体积增大)方向移动;
⑤加催化剂不会引起化学平衡的移动;
①④符合题意,故选C。
8.C
解析:A.由题可知,在时,平衡逆向移动,即升高温度,平衡逆向移动,则,A项正确;
B.由方程式可知,气体反应物的化学计量数之和小于生成物的化学计量数之和,则减小压强平衡正向移动,则在t4时刻改变的条件可能是减小压强,B项正确;
C.加入催化剂改变反应速率,不改变平衡,C项错误;
D.加入一定量的B物质,可以增大A物质的转化率,D项正确。
答案选C。
二、非选择题
9.4mol/L 20% 20% 不变 反应前后气体体积不变,压强不影响平衡移动 = 平衡常数只受温度影响,温度相同,则平衡常数相同 B
【分析】
根据题意列三段式有:
,据此分析。
解析:(1)2minΔn(D)=0.8mol,根据方程式可知Δn(A)=1.2mol,所以平衡时n(A)=2mol-1.2mol=0.8mol,容器体积为2L,则c(A)=0.4mol/L;Δn(B)=0.4mol,则=20%;n(C)=0.8mol,则C的体积分数为=20%;
(2)该反应前后气体系数之和相等,所以压强对平衡没有影响,则将该反应容器体积压缩为1L,平衡不移动,A的转化率不变;平衡常数只与温度有关,温度不变则平衡常数不变,所以K3=K1;
(3)A.该反应前后气体系数之和相等,所以无论是否平衡,压强均不发生变化,压强不变不能说明反应平衡,故A不符合题意;
B.平衡时正逆反应速率相等,各物质的浓度不再改变,所以A的浓度不变可以说明反应平衡,故B符合题意;
C.平衡时v正(A)=v逆(A),2v逆(A)=3v逆(C),选项既没有注明正逆,比例关系也不对,所以不能说明反应平衡,故C不符合题意;
D.该反应中反应物和生成物均为气体,所以气体的质量不变,容器恒容则体积不变,所以无论是否平衡密度都不变,故D不符合题意;
综上所述答案为B。
10.(1) Ⅲ Ⅰ和Ⅱ
(2) 吸热 bc 830
解析:(1)①温度越高、浓度越大反应速率越快,所以第Ⅲ组实验反应速率最快,最先变浑浊;
②为探究浓度对化学反应速率的影响,则变量应只有浓度,其他条件都相同,所以应选择第Ⅰ组和Ⅱ组进行探究;
(2)①根据平衡常数的定义可知该反应的平衡常数K=;
②根据表格数据可知温度升高,该反应平衡常数增大,说明升温平衡正向移动,该反应为吸热反应;
③a.该反应前后气体系数之和相等,所以无论是否平衡,压强都不改变,a不符合题意;
b.混合气体中 c(CO)不变,说明正逆反应速率相等,反应达到平衡,b符合题意;
c.氢气和水的系数相等,υ正(H2)=υ逆(H2O)即正反速率相等,反应达到平衡,c符合题意;
d.c(CO2)=c(CO)不能说明浓度不变,不能说明达到平衡,d不符合题意;
故答案选bc;
④若平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则K==1,根据表格数据可知此时温度为830℃。
11.(1)
(2) 5 0.1
(3)探究硫酸的浓度对氧化速率的影响
(4) 产生黄色沉淀 含的溶液中加入也能产生黄色沉淀
(5)向5mL(过量)溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应
解析:(1)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为;
(2)根据控制单一变量的原则可知a=5,b=0.1;
(3)实验3的反应温度是298K,温度相同,混合溶液总体积相同,KI溶液浓度相同,但H2SO4溶液浓度不相同,因此设计实验组别3的目的是为了与组别1对比,从而探究硫酸的浓度对氧化速率的影响;
(4)由题意可知实验i中现象为产生黄色沉淀;乙同学认为该现象无法证明该反应为可逆反应,原因为含的溶液中加入也能产生黄色沉淀;
(5)向5mL溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应[或向溶液中加入5mL(过量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应]。
12.(1) 抑制Fe3+水解,避免铁离子水解产物颜色的干扰
(2)逆
(3) b 实验2和4 阴离子均为氯离子,加入,溶液变浅程度较大
(4)加入浓盐酸,氯离子浓度增大,平衡正向移动,溶液偏黄色,Fe3+浓度减小,平衡逆向移动,溶液颜色变浅
【分析】实验Ⅰ:探究对和平衡体系的影响,随着溶液浓度增大,溶液的透光率增加,按照题中信息,可能原因有:原因1,溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。溶液的加入使和平衡状态因盐效应而发生变化。原因2,溶液中存在副反应,离子浓度发生变化,导致和平衡状态发生变化。
解析:(1)稀盐酸酸化溶液的目的是抑制Fe3+水解;有颜色,采用浓度较低的溶液制备和平衡体系,是为了避免的颜色对实验干扰;
(2)随着浓度增大,平衡正向移动,Fe3+浓度减小,平衡逆向移动;
(3)① 溶液和溶液中均存在氯离子,对平衡有影响,无法确定是盐效应使平衡移动,加入溶液,颜色略变浅,证明和平衡状态因盐效应而发生变化,故1和3可证明盐效应影响了和平衡体系,故选b;
② 选择实验2和4可得出结论:的盐效应弱于的盐效应;溶液和溶液中均存在氯离子,加入,溶液变浅程度较大;
(4)加入浓盐酸,氯离子浓度增大,平衡正向移动,溶液偏黄色,Fe3+浓度减小,平衡逆向移动,溶液颜色变浅
一、选择题
1.一定温度下,对可逆反应A(s)+2B(g)C(g)+D(g)的下列叙述中,能说明该反应已达到平衡的是
A.容器内的压强不再变化
B.单位时间内消耗2molB,同时生成1molC
C.混合气体的物质的量不再变化
D.混合气体的平均相对分子质量不再变化
2.一定温度下的密闭容器中发生可逆反应2SO2(g)+O2(g) 2SO3(g),不能说明该反应一定达到平衡状态的是
A.压强保持不变
B.SO2、O2、SO3的物质的量之比为2︰1︰2
C.SO2的消耗速率和SO2的生成速率相等
D.SO2的百分含量保持不变
3.对于可逆反应2SO2+O22SO3,在一定温度下平衡常数为K,下列变化中,能使K发生变化的是
A.将SO2的浓度增大 B.增大体系的压强
C.使用合适的催化剂 D.升高体系的温度
4.在恒温下的密闭容器中,反应CO2(g)+C(s)2CO(g)已经达到平衡状态的标志是
A.容器中CO2、C和CO共存 B.CO2和CO的物质的量浓度相等
C.CO的物质的量浓度不再变化 D.容器中CO2、C、CO的物质的量比为1:1:2
5.将一定量纯净的氨基甲酸铵置于恒容真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是
①v(NH3)正=2v(CO2)逆
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器混合气体的总物质的量不变
⑥密闭容器中CO2的体积分数不变
⑦混合气体总质量不变
A.①②③⑤⑦ B.①②④⑤⑦ C.①②③④⑤ D.②③⑤⑥⑦
6.下列说法正确的是
A.升高温度,会使单位体积内分子数增多,从而加快化学反应速率
B.(蓝色)(黄色) ,稀溶液受热颜色变黄
C.达平衡后,加入少量KCl固体,溶液红色变浅
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,溶液变为黄色
7.有一处于平衡状态的反应:3A(s)+2B(g)3C(g),ΔH>0。为了使平衡向生成C的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂
A.①③ B.①③⑤ C.①④ D.②④⑤
8.恒容密闭容器中发生反应,在不同时间下改变反应条件,各物质物质的量的变化如下图所示,已知在时刻是升高温度所引起的物质的量改变,下列说法错误的是
A.该反应
B.在时刻改变的条件可能是减小压强
C.加入催化剂平衡正向移动
D.若使A的转化率增大,可以加入一定量的B物质
二、非选择题
9.300℃ 时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)2C(g)+2D(g) ,2min末反应达到平衡,生成0.8mol D。
(1)在2min末,A的平衡浓度为___________,B的转化率为___________;C的体积分数为___________。
(2)300℃ 时,将该反应容器体积压缩为1L,则A的转化率___________(填“增大”“减小”或"不变"),原因是___________。若该条件下平衡常数为K3,则K3___________(填“>”,"<"或“=”)K1,原因是___________。
(3)判断该反应是否达到化学平衡状态的依据是___________(填序号)。
A.容器中压强不变 B.混合气体中c(A)不变 C.v(A)=v(C) D.混合气体密度不变
10.化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为2mL):
实验编号 温度/℃ c(Na2S2O3)/mol·L-1 c(H2SO4)/mol·L-1
Ⅰ 25 0.1 0.1
Ⅱ 25 0.2 0.1
Ⅲ 50 0.2 0.1
①上述实验中溶液最先变浑浊的是___________(填实验编号,下同)。
②控制变量是科学研究的重要方法,为探究浓度对化学反应速率的影响,应选择___________
(2)在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
请回答:
①该反应的化学平衡常数表达式为K =___________。
②该反应为___________(填“吸热”或“放热”)反应。
③能说明该反应达到化学平衡状态的是___________(填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ___________℃。
11.碘化钾是常用的化工原料。某实验小组设计实验探究的还原性。
I.探究不同条件下空气中氧气氧化的速率。
组别 温度 溶液 溶液 蒸馏水 淀粉溶液
V V
1 3滴
2 3滴
3 3滴
(1)酸性条件下能被空气中氧气氧化,发生反应的离子方程式为_______。
(2)通过实验组别1和组别2探究温度对氧化速率的影响。其中_______,_______。
(3)设计实验组别3的目的是_______。
Ⅱ.探究反应“”为可逆反应。
试剂:溶液,溶液,淀粉溶液,溶液,溶液。实验如下:
(4)甲同学通过试管i和试管ⅱ中现象结合可证明该反应为可逆反应,则试管i中现象为:_______;乙同学认为该现象无法证明该反应为可逆反应,原因为_______。
(5)请选择上述试剂重新设计实验,证明该反应为可逆反应_______。
12.某小组同学探究盐对平衡体系的影响。
实验Ⅰ:探究KCl对和平衡体系的影响
将等体积、低浓度的溶液(已用稀盐酸酸化)和溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②在水溶液中由于水解而显黄色;溶液中存在(黄色)。
(1)稀盐酸酸化溶液的目的是_______。采用浓度较低的溶液制备和平衡体系,是为了避免_______(填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对和平衡体系有影响,且随着KCl浓度增大,平衡向_______(填“正”或“逆”)反应方向移动。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使和平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应,离子浓度发生变化,导致和平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
序号 加入少量盐 溶液颜色
1 无 红色
2 KCl 变浅
3 略变浅
4 NaCl 变浅程度较大
①上述实验可证明盐效应影响了和平衡体系的是_______ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验_______(填序号)可得出结论:的盐效应弱于的盐效应。简述选择实验的理由_______。
(4)取等体积的溶液a继续进行实验,结果如下表。
序号 加入溶液 溶液颜色
5 1mL浓盐酸 明显变浅,溶液偏黄
6 1mL去离子水 略变浅
上述实验可证明副反应影响了和平衡体系,结合实验现象及化学用语分析副反应对和平衡体系有影响的原因:_______。
【参考答案】
一、选择题
1.D
解析:A.该反应前后气体分子数相等,反应过程中容器内的压强不变,不能判断是否达到平衡,故A不选;
B.单位时间内消耗2molB,同时生成1molC,均表示正反应速率,不能判断是否达到平衡,故B不选;
C.该反应前后气体分子数相等,反应过程中混合气体的物质的量不变,不能判断是否达到平衡,故C不选;
D.由于有固体A参加反应,反应过程中混合气体的质量会发生变化而物质的量不变,因此混合气体的平均相对分子质量不再变化表明反应已达到平衡,故D选。
答案选D。
2.B
解析:A.反应2SO2(g)+O2(g) 2SO3(g)是气体体积减小的反应,反应过程中压强不断减小,当压强保持不变时,说明反应达到平衡,故A不选;
B.平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故B选;
C.SO2的消耗速率和SO2的生成速率相等,证明化学反应中正逆反应速率相等,达到了平衡状态,故C不选;
D.SO2的百分含量保持不变,即SO3的质量保持不变,即浓度不变,说明反应达到化学平衡状态,故D不选;
故选B。
3.D
解析:化学平衡常数只随温度的改变而改变,则只有改变体系温度才能使K发生变化,故选:D。
4.C
解析:A.该反应是可逆反应,CO2、C不能完全反应,容器中CO2、C和CO一直存在,当容器中CO2、C和CO共存时,不能说明反应达到平衡,故A不选;
B.CO2和CO的物质的量浓度相等,不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,故B不选;
C.CO的物质的量浓度不再变化,说明正反应速率等于逆反应速率,说明反应达到平衡,故C选;
D.容器中CO2、C、CO的物质的量比为1:1:2时无法判断正逆反应速率是否相等,故也就无法判断反应是否处于平衡状态,故D不选;
故选C。
5.A
解析:①v(NH3)正=2v(CO2)逆,表明正逆反应速率相等,该反应达到平衡状态,故①正确;
②该反应为气体物质的量增大的反应,容器内压强为变量,当密闭容器中总压强不变时,表明达到平衡状态,故②正确;
③H2NCOONH4(s)为固体,混合气体的质量为变量,混合气体的体积不变,则密闭容器中混合气体的密度为变量,当容器内混合气体的密度不变时,表明达到平衡状态,故③正确;
④只有NH3(g)、CO2(g)为气体,且二者的物质的量之比始终为2:1,则混合气体的平均相对分子质量始终不变,不能判断平衡状态,故④错误;
⑤H2NCOONH4(s)为固体,混合气体的总物质的量为变量,当密闭容器混合气体的总物质的量不变时,表明达到平衡状态,故⑤正确;
⑥只有NH3(g)、CO2(g)为气体,且二者的物质的量之比始终为2:1,则密闭容器中CO2的体积分数始终不变,不能判断平衡状态,故⑥错误;
⑦H2NCOONH4(s)为固体,混合气体总质量为变量,当混合气体的总质量不变时,表明达到平衡状态,故⑦正确;
故选A。
6.B
解析:A.升高温度,分子吸收能量,单位体积内分子总数不变,活化分子总数变多,活化分子百分数变大,碰撞几率增大,从而加快化学反应速率,故A错误;
B.(蓝色)(黄色) ,稀溶液受热,平衡正向移动,因此溶液颜色变黄,故B正确;
C.达平衡后,该反应的实质是,加入少量KCl固体,离子浓度不变,平衡不移动,故C错误;
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,氢离子浓度增大,平衡逆向移动,溶液变为橙色,故D错误;
综上所述,答案为B。
7.C
解析:3A(s)+2B(g)3C(g),ΔH>0,正反应是气体体积增大的吸热反应;
①升高温度,平衡向正向(放热)反应移动;
②降低温度,平衡向逆向(吸热)反应移动;
③压强增大,平衡向逆向(气体体积减小)方向移动;
④降低压强,平衡向正向(气体体积增大)方向移动;
⑤加催化剂不会引起化学平衡的移动;
①④符合题意,故选C。
8.C
解析:A.由题可知,在时,平衡逆向移动,即升高温度,平衡逆向移动,则,A项正确;
B.由方程式可知,气体反应物的化学计量数之和小于生成物的化学计量数之和,则减小压强平衡正向移动,则在t4时刻改变的条件可能是减小压强,B项正确;
C.加入催化剂改变反应速率,不改变平衡,C项错误;
D.加入一定量的B物质,可以增大A物质的转化率,D项正确。
答案选C。
二、非选择题
9.4mol/L 20% 20% 不变 反应前后气体体积不变,压强不影响平衡移动 = 平衡常数只受温度影响,温度相同,则平衡常数相同 B
【分析】
根据题意列三段式有:
,据此分析。
解析:(1)2minΔn(D)=0.8mol,根据方程式可知Δn(A)=1.2mol,所以平衡时n(A)=2mol-1.2mol=0.8mol,容器体积为2L,则c(A)=0.4mol/L;Δn(B)=0.4mol,则=20%;n(C)=0.8mol,则C的体积分数为=20%;
(2)该反应前后气体系数之和相等,所以压强对平衡没有影响,则将该反应容器体积压缩为1L,平衡不移动,A的转化率不变;平衡常数只与温度有关,温度不变则平衡常数不变,所以K3=K1;
(3)A.该反应前后气体系数之和相等,所以无论是否平衡,压强均不发生变化,压强不变不能说明反应平衡,故A不符合题意;
B.平衡时正逆反应速率相等,各物质的浓度不再改变,所以A的浓度不变可以说明反应平衡,故B符合题意;
C.平衡时v正(A)=v逆(A),2v逆(A)=3v逆(C),选项既没有注明正逆,比例关系也不对,所以不能说明反应平衡,故C不符合题意;
D.该反应中反应物和生成物均为气体,所以气体的质量不变,容器恒容则体积不变,所以无论是否平衡密度都不变,故D不符合题意;
综上所述答案为B。
10.(1) Ⅲ Ⅰ和Ⅱ
(2) 吸热 bc 830
解析:(1)①温度越高、浓度越大反应速率越快,所以第Ⅲ组实验反应速率最快,最先变浑浊;
②为探究浓度对化学反应速率的影响,则变量应只有浓度,其他条件都相同,所以应选择第Ⅰ组和Ⅱ组进行探究;
(2)①根据平衡常数的定义可知该反应的平衡常数K=;
②根据表格数据可知温度升高,该反应平衡常数增大,说明升温平衡正向移动,该反应为吸热反应;
③a.该反应前后气体系数之和相等,所以无论是否平衡,压强都不改变,a不符合题意;
b.混合气体中 c(CO)不变,说明正逆反应速率相等,反应达到平衡,b符合题意;
c.氢气和水的系数相等,υ正(H2)=υ逆(H2O)即正反速率相等,反应达到平衡,c符合题意;
d.c(CO2)=c(CO)不能说明浓度不变,不能说明达到平衡,d不符合题意;
故答案选bc;
④若平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则K==1,根据表格数据可知此时温度为830℃。
11.(1)
(2) 5 0.1
(3)探究硫酸的浓度对氧化速率的影响
(4) 产生黄色沉淀 含的溶液中加入也能产生黄色沉淀
(5)向5mL(过量)溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应
解析:(1)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为;
(2)根据控制单一变量的原则可知a=5,b=0.1;
(3)实验3的反应温度是298K,温度相同,混合溶液总体积相同,KI溶液浓度相同,但H2SO4溶液浓度不相同,因此设计实验组别3的目的是为了与组别1对比,从而探究硫酸的浓度对氧化速率的影响;
(4)由题意可知实验i中现象为产生黄色沉淀;乙同学认为该现象无法证明该反应为可逆反应,原因为含的溶液中加入也能产生黄色沉淀;
(5)向5mL溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应[或向溶液中加入5mL(过量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应]。
12.(1) 抑制Fe3+水解,避免铁离子水解产物颜色的干扰
(2)逆
(3) b 实验2和4 阴离子均为氯离子,加入,溶液变浅程度较大
(4)加入浓盐酸,氯离子浓度增大,平衡正向移动,溶液偏黄色,Fe3+浓度减小,平衡逆向移动,溶液颜色变浅
【分析】实验Ⅰ:探究对和平衡体系的影响,随着溶液浓度增大,溶液的透光率增加,按照题中信息,可能原因有:原因1,溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。溶液的加入使和平衡状态因盐效应而发生变化。原因2,溶液中存在副反应,离子浓度发生变化,导致和平衡状态发生变化。
解析:(1)稀盐酸酸化溶液的目的是抑制Fe3+水解;有颜色,采用浓度较低的溶液制备和平衡体系,是为了避免的颜色对实验干扰;
(2)随着浓度增大,平衡正向移动,Fe3+浓度减小,平衡逆向移动;
(3)① 溶液和溶液中均存在氯离子,对平衡有影响,无法确定是盐效应使平衡移动,加入溶液,颜色略变浅,证明和平衡状态因盐效应而发生变化,故1和3可证明盐效应影响了和平衡体系,故选b;
② 选择实验2和4可得出结论:的盐效应弱于的盐效应;溶液和溶液中均存在氯离子,加入,溶液变浅程度较大;
(4)加入浓盐酸,氯离子浓度增大,平衡正向移动,溶液偏黄色,Fe3+浓度减小,平衡逆向移动,溶液颜色变浅
